高灵敏度检测铅离子的全细胞生物传感器的构建方法与流程
本发明属于环境生物技术领域,涉及多种用来检测水溶性样品中铅离子浓度的生物传感器的构建及使用;特别涉及高灵敏度检测铅离子的全细胞生物传感器的构建方法。
背景技术:
铅是一种普遍存在于自然界并且有剧毒的重金属元素,其多以化合物的形态稳定存在。但是由于铅广泛地应用于人类生活生产的各个领域,例如矿山开采、金属冶炼、汽油、建筑材料、燃煤、蓄电池汽车尾气等,在许多地区引发了不同程度地铅污染,给自然环境和人类身体健康带来危害。铅主要通过消化道和呼吸道等方式进入到人体内,并且与人体内的各种酶和氨基酸等相互结合,干扰人体的生化和生理活性。儿童、老人和免疫力低的人对铅比较敏感,铅中毒主要容易引发贫血症、神经失调和肾损伤等。
目前对铅的检测方法多采用分光光度法、原子吸收光谱法(AAS)和氢化物发生原子荧光光谱法(HG-AFS)等。微生物传感器是目前用于环境监测中的一种新方法,该方法是将容易检测的报告基因如荧光蛋白等转入污染物代谢基因的启动子下游,使其在污染源的诱导下表达并进行检测进而对环境中重金属及其它污染物进行监测,和上述通过仪器进行铅含量的测定方法相比,这类方法具有灵敏、直接、简便、快速等特点,并且将微生物细胞和传感器耦合的全细胞生物传感器可以把细胞感应信号转换成可测光信号,并且易于复制,有很大的潜能降低成本。在MerR家族中,PbrR蛋白对铅离子有特异性的结合能力,而这种结合将导致蛋白质/DNA复合物的构象发生变化,使DNA呈现开发的状态,从而使pbr启动子下游的表达通路得以开放,因此可以通过下游基因的表达来检测铅离子含量。
全细胞微生物传感器(Whole-cell biosensor)是一种便捷、快速、低成本的环境重金属检测工具,它采用基因工程技术对活体微生物进行改造,使其能够对重金属污染物进行定量分析。但是其特异性欠佳、灵敏度不高一直是限制其广泛应用的瓶颈问题。2000年法国南特大学的Jouanneaut教授开发的细胞金属探针,对相关金属的最低检测限达到了nmol水平。2014年南京大学赵劲课题组基于调节因子构建的Pb(Ⅱ)传感器检测最低限可达到0.001μΜ,多种金属离子选择性检测结果表明其对Pb(Ⅱ)有较好的选择性检测能力。
技术实现要素:
本发明的目的在于针对现有的化学检测方法操作复杂、价格昂贵等问题,特别提出全细胞生物传感器多种检测铅离子的构建方法。
具体技术方案如下:
高灵敏度检测铅离子的全细胞生物传感器的构建方法;利用天然菌株耐金属贪铜菌Ralstonia metallidurans CH34中的天然质粒pMOL30中的pbrR基因,质粒pGN68的带有自反馈功能的启动子PluxRI和调控蛋白LuxR,以及绿色荧光蛋白基因GFP,在工程大肠杆菌DH5α中实现了多种的对铅离子进行定量的全细胞生物传感器的构建。
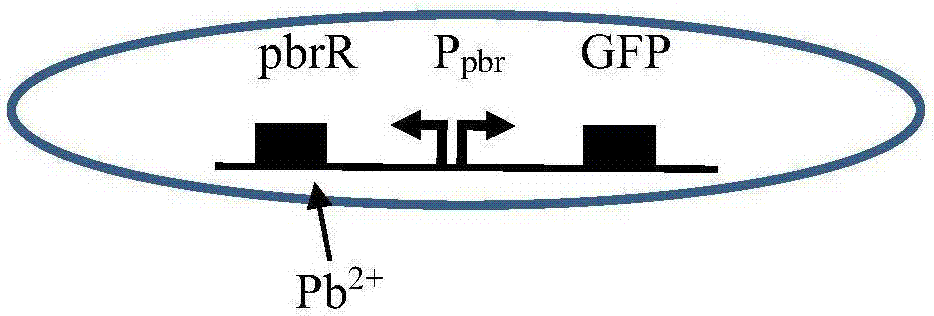
利用双向特异性启动子Ppbr、调节基因pbrR以及绿色荧光蛋白基因GFP依次组成的二价铅离子诱导控制的绿色荧光基因表达调节系统,以大肠杆菌DH5α为宿主菌,构建了能检测铅离子的生物传感器细胞Ⅰ。
将绿色荧光蛋白基因GFP置于双向特异性启动子Ppbr的下游,提高荧光蛋白基因的表达强度,同时将调节基因pbrR置于双向特异性启动子Ppbr上游,提高调节蛋白PbrR的表达量,由此构建了能检测铅离子的生物传感器细胞Ⅱ。
降低生物传感器细胞的本底表达;在绿色荧光蛋白基因GFP的上游引入了第二个双向特异性启动子Ppbr,得到含有双启动子的生物传感器细胞Ⅲ,用该细胞制得的生物传感器细胞在铅离子不存在的情况下降低细胞的荧光本底表达,从而提高生物传感器的灵敏度。
在生物传感器细胞Ⅲ内引入调节基因luxR与质粒pGN68共同组成含有基因级联放大表达系统的自反馈调节体系的生物传感器细胞Ⅳ。
具体说明如下:
利用天然菌株耐金属贪铜菌Ralstonia metallidurans CH34中的天然质粒pMOL30中的pbrR基因,质粒pGN68的带有自反馈功能的启动子PluxRI和调控蛋白LuxR,以及绿色荧光蛋白基因GFP,在工程大肠杆菌DH5α中实现了多种具有高灵敏度、低成本的可对铅离子进行定量的全细胞生物传感器的构建,并且通过构建的全细胞生物传感器检测荧光强度信号来表示水溶性样品中的铅离子浓度。
利用双向特异性启动子Ppbr、调节基因pbrR以及绿色荧光蛋白基因GFP依次组成的二价铅离子诱导控制的绿色荧光基因表达调节系统,以大肠杆菌DH5α为宿主菌,我们构建了能检测铅离子的生物传感器细胞Ⅰ(附图1)。生物传感器的灵敏度是限制其广泛应用的的瓶颈问题,也就是降低生物传感器细胞的本底表达以及提高在相同情况下荧光的表达量。从我们设计的生物传感器细胞Ⅰ(附图1)可知,有三种情况可以提高检测灵敏度。
1)提高在相同实验条件下荧光的表达量。将绿色荧光蛋白基因GFP置于双向特异性启动子Ppbr的下游,提高荧光蛋白基因的表达强度,同时将调节基因pbrR置于双向特异性启动子Ppbr上游,提高调节蛋白PbrR的表达量,由此构建了能检测铅离子的生物传感器细胞Ⅱ(附图2),通过提高基因表达量来提高生物传感器细胞的检测灵敏度。
2)降低生物传感器细胞的本底表达。在绿色荧光蛋白基因GFP的上游引入了第二个双向特异性启动子Ppbr,得到含有双启动子的生物传感器细胞Ⅲ(附图3),用该细胞制得的生物传感器细胞可以在铅离子不存在的情况下降低细胞的荧光本底表达,从而提高生物传感器的灵敏度。
3)引入基因级联放大表达系统的自反馈调节体系。通过在短时间内产生大量的调节蛋白PbrR来提高的生物传感器细胞的检测灵敏度。在生物传感器细胞Ⅲ铅离子诱导的基因表达系统中将绿色荧光蛋白基因GFP替换成调节基因luxR与质粒pGN68含有的自反馈启动子PluxRI(其核苷酸序列如SEQ ID No.4所示)、调节基因luxR在铅离子存在的情况下可以促进调节蛋白luxR的表达,同时使得自反馈启动子PluxRI启动下游绿色荧光蛋白基因GFP的在短时间内的大量表达。在生物传感器细胞Ⅲ内引入调节基因luxR与质粒pGN68共同组成含有基因级联放大表达系统的自反馈调节体系的生物传感器细胞Ⅳ(附图4)。在相同的时间内生物传感器细胞Ⅳ比生物传感器细胞Ⅰ可以产生更多的绿色荧光蛋白,检测到更高的荧光信号,同时双启动子体系可以降低细胞的荧光本底表达,从而更灵敏的检测到铅离子的存在。
本发明涉及一种铅离子敏感的具有基因级联放大表达系统的全细胞生物传感器及构建方法;将人工全合成双向启动子Ppbr以及铅离子特异性结合蛋白PbrR如SEQ ID No.1所示核苷酸序列与质粒pGN68所含自反馈调控蛋白LuxR的SEQ ID No.4的核苷酸序列通过酶切方式连接,筛选阳性克隆得到目标重组载体pET28a-pbr-lux;质粒pGN68含有自反馈启动子PluxRI、绿色荧光蛋白基因核苷酸序列、自反馈调控蛋白LuxR核苷酸序列,按照酶切方式依次连接;利用大肠杆菌E.coli DH5α作为宿主,将重组载体以及质粒pGN68共转化,得到对铅离子敏感性的全细胞生物传感器。
附图说明
图1检测铅污染的生物传感器细胞Ⅰ简图。
图2检测铅污染的生物传感器细胞Ⅱ简图。
图3检测铅污染的生物传感器细胞Ⅲ简图。
图4检测铅污染的生物传感器细胞Ⅳ简图。
图5-A为构建生物传感器细胞Ⅰ质粒pET28a-Ppbr的图谱。
图5-B为构建生物传感器细胞Ⅱ质粒pET28a-pbrR的图谱。
图5-C是构建生物传感器细胞Ⅲ质粒pET28a-Ppbr-pbrR的图谱。
图5-D为构建生物传感器细胞Ⅳ质粒pET28a-luxR的图谱。
图6-A是生物传感器细胞Ⅰ的铅离子浓度-荧光响应图。
图6-B是生物传感器细胞Ⅱ的铅离子浓度-荧光响应图。
图6-C是生物传感器细胞Ⅲ的铅离子浓度-荧光响应图。
图6-D是生物传感器细胞Ⅳ的铅离子浓度-荧光响应图。
具体实施方式
本发明所用pET28a质粒作为构建铅离子生物传感器的主要载体和pGN68质粒作为自反馈体系中荧光蛋白基因的表达载体。
原始底盘细胞为E.coli DH5α购买自北京全式金生物技术有限公司。
下面通过具体实施例子对本发明做进一步说明。
1.生物传感器的构建:
利用聚合酶链式反应(PCR),在人工全合成的双向特异性启动子Ppbr(其核苷酸序列如SEQ ID No.1所示)和调节基因pbrR(其核苷酸序列如SEQ ID No.2所示)片段的两端加入HindⅢ、BamHⅠ酶切位点,在绿色荧光蛋白基因GFP(其核苷酸序列如SEQ ID No.3所示)两端加入BamHⅠ、HindⅢ酶切位点。通过使用FastDigest内切酶对双向特异性启动子Ppbr和调节基因pbrR以及绿色荧光蛋白基因GFP上述两个片段分别进行酶切,然后以T4DNA连接酶连接,并转化至感受态细胞E.coli DH5α,菌落PCR筛选阳性克隆,得到重组质粒pET28a-Ppbr(见图5-A),经测序验证后获得具有二价铅离子诱导控制的绿色荧光基因表达调节系统的生物传感器细胞Ⅰ(见图1)。
利用聚合酶链式反应(PCR),在人工全合成的调节基因pbrR两端加入Hind Ⅲ、BglⅡ酶切位点,在双向特异性启动子Ppbr两端加入HindⅢ、BamHⅠ酶切位点以及绿色荧光蛋白基因GFP两端加入BamHⅠ、HindⅢ酶切位点(其核苷酸序列同上),通过使用FastDigest内切酶对调节基因pbrR、双向特异性启动子Ppbr以及绿色荧光蛋白基因GFP上述三个片段分别进行酶切,通过T4连接酶连接,并转化至感受态细胞E.coli DH5α,菌落PCR筛选阳性克隆,得到重组质粒pET28a-pbrR(见图5-B),经测序验证后获得将绿色荧光蛋白基因GFP以及调节基因pbrR分别置于双向特异性启动子Ppbr的上下游,通过提高荧光蛋白基因的表达强度高灵敏的检测水溶液中二价无机铅离子生物传感器细胞Ⅱ(见图2)。
利用聚合酶链式反应(PCR),在人工全合成的双向特异性启动子Ppbr(其核苷酸序列如SEQ ID No.1所示)和调节基因pbrR(其核苷酸序列如SEQ ID No.2所示)片段的两端加入HindⅢ、BamHⅠ酶切位点,在双向特异性启动子Ppbr两端加入HindⅢ、BamHⅠ酶切位点以及绿色荧光蛋白基因GFP两端加入BamH Ⅰ、HindⅢ酶切位点,通过使用FastDigest内切酶对双向特异性启动子Ppbr、调节基因pbrR、双向特异性启动子Ppbr以及绿色荧光蛋白基因GFP(其核苷酸序列同上)进行酶切,通过T4连接酶连接,并转化至感受态细胞E.coli DH5α,菌落PCR筛选阳性克隆,得到重组质粒pET28a-Ppbr-pbrR(见图5-C),经测序验证后获得在绿色荧光蛋白基因GFP的上游引入了第二个双向特异性启动子Ppbr,得到二价铅离子诱导控制的双重双向特异性启动子启动的绿色荧光基因表达调节系统生物传感器细胞Ⅲ(见图3)。
利用聚合酶链式反应(PCR),在人工全合成的双向特异性启动子Ppbr(其核苷酸序列如SEQ ID No.1所示)和调节基因pbrR(其核苷酸序列如SEQ ID No.2所示)片段的两端加入HindⅢ、BamHⅠ酶切位点,在双向特异性启动子Ppbr两端加入HindⅢ、BamH Ⅰ酶切位点以及调节基因luxR(其核苷酸序列如SEQ ID No.4所示)两端加入BamH Ⅰ、HindⅢ酶切位点。通过使用FastDigest内切酶对双向特异性启动子Ppbr、调节基因pbrR、双向特异性启动子Ppbr以及调节基因luxR进行酶切,通过T4连接酶连接,并转化至感受态细胞E.coli DH5α,菌落PCR筛选阳性克隆,经测序验证后获到重组质粒pET28a-luxR(见图5-D)。
通过聚合酶链式反应,在PluxRI的基因序列两端加入Sal Ⅰ和EcoR Ⅰ酶切位点,调节基因luxR的基因序列两端加入EcoR Ⅰ和BamH Ⅰ酶切位点。人工全合成绿色荧光蛋白基因GFP,并在序列两端加入BamH Ⅰ和Not Ⅰ酶切位点。通过使用FastDigest内切酶对上述三个片段分别进行酶切,然后以T4DNA连接酶连接并转化至感受态细胞E.coli DH5α,菌落PCR筛选阳性克隆,测序验证获得质粒pGN68。重组质粒pET28a与质粒pGN68共转化得到的具有基因级联放大表达系统的自反馈调节体系的生物传感器细胞Ⅳ(见图4)。
2.铅离子定量检测方法:
(1)用添加卡那霉素(50毫克升)的液体培养基LB在220rpm、37℃条件下培养上述五种生物传感器细胞过夜(12-14小时)。
(2)然后将取1mL上述种子菌液,测量其在600nm下的吸光度,用LB培养基稀释至OD600=1,并1%接种至100mL不含抗性的LB培养基中,220rpm、37℃摇瓶培养2.5个小时,直至OD600约为0.6,即达到生物传感器细胞的生长对数期。
(3)向锥形瓶内加入不同浓度的铅离子标准溶液,测定各溶液的荧光强度(RFU,测定的激发波长为480nm,发射波长520nm)。
结果表明生物传感器细胞Ⅰ所测得的铅离子浓度与荧光强度柱状图(见图6-A)显示不同浓度的铅离子标准溶液得到不同的荧光强度,且在铅离子浓度低于100μM时随着铅离子浓度升高,荧光强度也随之增长;生物传感器细胞Ⅱ所测得的铅离子浓度与荧光强度柱状图(见图6-B)显示在50μM时荧光强度最大;生物传感器细胞Ⅲ所测得的铅离子浓度与荧光强度柱状图(见图6-C)显示与生物传感器Ⅰ、Ⅱ相比其背景值较小,在铅离子浓度为0.001μM时即有较高的荧光响应,灵敏度增强;生物传感器细胞Ⅳ所测得的铅离子浓度与荧光强度柱状图(见图6-D)显示与传统的生物传感器Ⅰ(见图1)相比所测得荧光值增强,底盘背景值较小,灵敏度高,最低检测限可以达到0.001μM。
综上结果显示上述四种生物传感器细胞均可检测到水样品中的铅离子,检测限均小于1μM,其中生物传感器细胞Ⅴ的背景检测值最低,且灵敏度最高,最低检测限可以达到0.001μM,说明基因级联放大表达系统的自反馈调节体系可以放大荧光检测信号,提高检测灵敏度,效果最好。同时说明上述四种生物传感器细胞都可用于检测水溶液中二价铅离子,并且在一定范围内可定量确定铅离子污染的程度。
SEQ ID NO.01
TTCTGGGTTGCGCGTCGCAACGGAAGCGCAGCCACATCCCTTCGAGCCACATTCGCTCATGGCAACCCCTTGTGTGTATTCATCTCGCGTTGCCGATTTAACACCCTCTAGTTACTATAGAGTCAAGACATCTCCCATCCGACGCC
SEQ ID NO.02
ATGAATATCCAGATCGGCGAGCTTGCCAAGCGCACCGCATGCCCGGTGGTGACCATTCGCTTCTACGAACAAGAAGGGCTGTTGCCGCCGCCGGGCCGCAGCCGGGGGAATTTTCGCCTGTATGGCGAGGAGCACGTGGAGCGCTTGCAGTTCATTCGTCACTGCCGGTCTCTGGATATGCCGTTGAGCGACGTACGGACCTTATTGAGTTACCGGAAGCGGCCCGACCAGGATTGCGGTGAAGTCAATATGCTCTTGGATGAGCACATCCGTCAGGTCGAATCTCGGATCGGAGCTTTGCTCGAACTGAAGCACCATTTGGTGGAACTGCGCGAAGCCTGTTCTGGTGCCAGGCCCGCCCAATCGTGCGGGATTCTGCAGGGACTGTCGGACTGCGTGTGTGATACGCGGGGGACCACCGCCCATCCAAGCGACTAG
SEQ ID NO.03
AGTAAAGGAGAAGAACTTTTCACTGGAGTTGTGACAATTCTTGTTGAATTAGATGGTGATGTTAATGGTCACAAATTTTCTGTTAGTGGAGAGGGTGAAGGTGATGCAACATACGGAAAACTTACCCTTAAATTTATTTGTACTACTGGAAAACTACCTGTTCCCTGGCCAACACTTGTTACTACTTTGACTTATGGTGTTCAATGTTTTTCAAGATACCCAGATCACATGAAACGGCACGACTTTTTCAAGAGTGCAATGCCCGAAGGTTATGTACAAGAAAGAACTATTTTTTTCAAAGATGACGGTAACTACAAGACACGTGCTGAAGTTAAGTTTGAAGGTGATACCCTTGTTAATAGAATCGAGTTAAAAGGTATTGATTTTAAAGAAGATGGAAACATTCTTGGACACAAATTGGAATACAACTATAACTCACACAATGTATACATTATGGCAGACAAACAAAAGAATGGAATCAAAGTTAACTTCAAAATTAGACACAACATTGAAGATGGAAGTGTTCAACTAGCAGACCATTATCAACAAAATACTCCAATTGGCGATGGCCCTGTTCTTTTACCAGACAACCATTACCTGTCCACACAATCTGCTCTTTCTAAAGATCCCAACGAAAAGAGAGACCATATGGTGCTTCTTGAGTTTGTAACAGCTGCTGGTATTACACACGGTATGGATGAACTATACAAACACCATCACCATCACCATCACTAG
SEQ ID NO.04
ATGCCTTCTCTAGTTGATAATTATCGAAAAATAAATATAGCAAATAATAAATCAAACAACGATTTAACCAAAAGAGAAAAAGAATGTTTAGCGTGGGCATGCGAAGGAAAAAGCTCTTGGGATATTTCAAAAATATTAGGCTGCAGTGAGCGTACTGTCACTTTCCATTTAACCAATGTGCAAATGAAACTCAATACAACAAACCGCTGCCAAAGTATTTCTAAAGCAATTTTAACAGGAGCAATTGATTGCCCATACTTTAAAAATTAA
- 还没有人留言评论。精彩留言会获得点赞!