水解探针的制作方法
本申请要求2011年9月29日提交的美国临时专利申请序列号61/540,868的优先权。上述引用的公开内容通过引用整体并入本文。
技术领域:
本发明一般性地涉及分子生物学领域。更具体地,本发明涉及核酸的检测和定量。
背景技术:
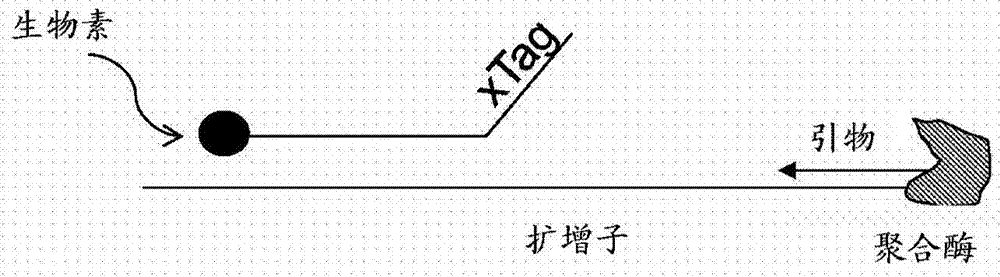
:聚合酶链反应(PCR)是一种分子生物学技术,其通常在医学和生物学研究实验室中用于多种任务,例如遗传性疾病的检测、遗传指纹的鉴定、感染性疾病的诊断、基因的克隆、亲子鉴定和DNA计算。PCR已经因其无可比拟的扩增能力和精确性而被分子生物学家公认为选择用于核酸检测的方法。DNA检测通常在PCR反应的终点或平台期进行,使得难以对起始模板进行定量。实时PCR或动力学PCR通过随着反应进行记录扩增子浓度来提高终点PCR分析能力。扩增子浓度最常通过与所扩增靶标相关的荧光信号变化来记录。实时PCR相对于终点检测来说的优势还在于污染受到限制,因为其可以在封闭的系统中进行。其他优点包括较高的灵敏度、动态范围、速度以及较少的所需程序。若干测定化学已被用于实时PCR检测方法中。这些测定化学包括使用双链DNA结合染料、双重标记寡核苷酸(例如发夹引物和发夹探针)。其他化学包括基于外切核酸酶的探针(例如水解探针)。多种PCR和实时PCR方法公开于美国专利No.5,656,493、5,994,056、6,174,670、5,716,784、6,030,787、6,174,670和7,955,802中,其通过引用并入本文。许多实时PCR技术的缺点是有限的多重(multiplexing)能力。使用游离在溶液中的报道子(reporter)荧光染料(fluorochrome)的实时PCR技术在多重反应的每个测定中需要光谱不同的荧光染料。例如,设计为检测4个靶序列的多重反应会需要能够通过光谱差异来区分4种不同的自由漂浮(freefloating)荧光染料的仪器,不包括对照。这些要求不仅限制实际多重能力,还提高成本,因为这样的仪器通常需要多个激光器和过滤器。技术实现要素:在某些实施方案中,提供了检测核酸的方法。在一个实施方案中,本发明提供了用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的靶核酸第一链上第二区互补的靶特异性探针在适于靶核酸与靶特异性引物以及靶特异性探针杂交的条件下相接触,其中所述靶特异性探针包含报道子并且与固体支持物相连接;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针,以从固体支持物释放报道子;和(c)通过检测来自固体支持物上报道子之信号的变化来检测靶核酸。可以进行该方法以检测单一靶标或者可以包括另外的引物和探针以在多重测定中检测多种不同的靶核酸。例如,在一个实施方案中,该方法还包括:(a)使样品和与第二靶核酸第一链上第一区互补的至少第二靶特异性引物以及与所述第一区下游的第二靶核酸第一链上第二区互补的至少第二靶特异性探针在适于第二靶核酸与第二靶特异性引物以及第二靶特异性探针杂交的条件下相接触,其中第二靶特异性探针包含第二报道子并且与第二固体支持物相连接;(b)用具有外切核酸酶活性的核酸聚合酶切割第二杂交的靶特异性探针,以从第二固体支持物释放第二报道子;和(c)通过检测来自第二固体支持物上第二报道子之信号的变化来检测第二靶核酸。第一固体支持物与第二固体支持物可以是同一固体支持物上的空间上离散的位置,例如平面阵列上的空间上离散的位置,或者第一固体支持物与第二固体支持物可以是物理上分离的(例如珠阵列)。在一种多重性方法中,不同的靶特异性探针相连的报道子可以是相同的,因为不同的靶特异性探针可以通过它们所连接的固体支持物来区分。但是,在一些实施方案中,使用两种或更多种不同的报道子。另一个实施方案提供了用于在样品中检测多种靶核酸之存在或不存在的多重性方法,其包括:(a)使样品与多种引物/探针对以及靶特异性探针在适于靶核酸与第一靶特异性引物以及靶特异性探针杂交的条件下相接触,每种引物/探针对包含与多种靶核酸之一的第一链上第一区互补的靶特异性引物,所述靶特异性探针与所述第一区下游的多种靶核酸之一的第一链上第二区互补,其中所述靶特异性探针包含报道子并且与固体支持物相连接;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针,以从固体支持物释放报道子;和(c)检测来自固体支持物上报道子的信号,从而信号的变化表明靶核酸的存在。在某些方面中,多种引物/探针对的每种不同的靶特异性探针与一个固体上的空间上离散的位置相连接。在另一些方面中,多种引物/探针对的每种不同的靶特异性探针与不同的固体支持物相连接。在一些实施方案中,该方法还可以包括:使样品和与多种靶核酸第二链上的区域互补的多种不同第二靶特异性引物相接触;和进行多个聚合酶链反应循环。多个聚合酶链反应循环可以在循环之间进行或不进行用于除去自由漂浮报道子的洗涤步骤的情况下进行。信号的变化可以是信号的降低或增强,这取决于所用报道子的类型。例如,如果报道子是荧光团,则将在靶核酸的存在下观察到的信号变化是荧光信号的降低。另一方面,如果报道子是荧光团-淬灭剂对(fluorphoreandquencherpair),则在存在靶核酸时,荧光团与淬灭剂的分离导致荧光信号增强。术语“上游”和“下游”在本文中与由靶特异性引物引发的新生链之合成相关地使用。因此,例如,与引物与之杂交的靶核酸区“下游”的靶核酸区杂交的靶特异性探针位于引物的3’并且将处于聚合酶以5’至3’方向延伸所述引物的路径中。在某些方面中,该方法还包括使样品和与靶核酸第二链上的区域互补的第二靶特异性引物相接触。所述第一靶特异性引物和所述第二靶特异性引物定位在靶核酸的相反链上以使得可以通过PCR来扩增靶核酸的区域。在某些方面中,该方法包括进行多个扩增循环。典型的扩增循环具有三个期:变性期、引物退火期和引物延伸期,每个期在不同的温度下进行。也可以进行2-阶段PCR,其中每个循环仅使用两个温度;例如95℃和60℃。因此,在某些方面中,该方法还包括:使靶核酸与靶特异性引物以及靶特异性探针重复杂交;用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以使第一靶特异性引物的延伸导致杂交的靶特异性探针的切割和从固体支持物释放报道子;和检测来自固体支持物上报道子之信号的变化。在某些实施方案中,重复扩增循环至少直至可以从背景噪声中区分出信号变化。但是,如果样本中不存在特定靶核酸,那么无论进行多少次循环,从背景噪声中都不应可区分出信号变化。在反应中包括适当的阳性对照和阴性对照可以有助于确定样品中不存在特定靶核酸。本领域普通技术人员会知晓如何选择适当的阳性对照和阴性对照用于特定测定。在一些实施方案中,在用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以切割杂交的靶特异性探针并且从固体支持物释放报道子之前检测来自固体支持物上报道子的信号。在一些实施方案中,来自固体支持物上的报道子的信号的变化包括在进行多个聚合酶链反应循环之前和之后检测信号。在一些实施方案中,来自固体支持物上报道子之信号的变化包括在两个或更多个扩增循环之间检测信号。在另一些实施方案中,来自固体支持物上报道子之信号的变化包括仅在进行多个聚合酶链反应循环之后检测信号。在一个实施方案中,本文中公开的方法通过将来自固体支持物上报道子之信号的变化与来自与固体支持物相连接之非杂交探针上报道子的参考信号相关联提供了靶核酸之存在或不存在的终点检测。在一个具体的实施方案中,将来自固体支持物上报道子之检测信号与以下预定比例进行比较:固体支持物上的报道子的信号与来自与固体支持物相连接的非杂交探针上报道子的参考信号的预定比例。确定该比例已变化会表明测定中存在靶核酸。该方法的一个优点是其可以无需多个图像而进行(例如,扩增之前的一个图像和扩增之后的一个图像)。在某些方面中,预定的比例存储在计算机可读介质中并且通过与来自报道子分子的信号相关的软件分析数据来访问。“非杂交探针”是具有预期在测定条件下不与存在于测定中的任意其他核酸杂交的序列的探针。在另一个实施方案中,本发明提供了用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的靶核酸第一链上第二区互补的靶特异性探针在适于靶核酸与靶特异性引物以及靶特异性探针杂交的条件下相接触,其中所述靶特异性探针包含在其5’或3’端的标签,还包含报道子;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针,以从标签释放报道子;(c)使标签与固定在固体支持物上的其互补性抗标签(anti-tag)杂交;和(d)通过检测来自固体支持物上报道子之信号的降低来检测靶核酸。在某些方面中,该方法还包括:在切割杂交的靶特异性探针和从标签释放报道子分子之前使靶特异性探针与固定在固体支持物上的抗标签杂交;和检测来自固体支持物上报道子的信号。可以进行该方法以检测单一靶标或者可以包括另外的引物和探针以在多重测定中检测多种不同的靶核酸。例如,在一个实施方案中,该方法还包括:(a)使样品和与第二靶核酸第一链上第一区互补的第二靶特异性引物以及与所述第一区下游的第二靶核酸第一链上第二区互补的第二靶特异性探针在适于第二靶核酸与第二靶特异性引物以及第二靶特异性探针杂交的条件下相接触,其中所述第二靶特异性探针包含在其5’或3’端的第二标签,还包含第二报道子;(b)用具有外切核酸酶活性的核酸聚合酶切割第二杂交的靶特异性探针,以从第二标签释放第二报道子;(c)使第二标签与固定在第二固体支持物上的互补性第二抗标签杂交;和(c)通过检测来自第二固体支持物上第二报道子之信号的降低来检测第二靶核酸。第一固体支持物与第二固体支持物可以是同一固体支持物上的空间上离散的位置,例如平面阵列上的空间上离散的位置,或者第一固体支持物与第二固体支持物可以是物理上分离的(例如珠阵列)。在一种多重性方法中,与不同的靶特异性探针相连的报道子可以是相同的,因为不同的靶特异性探针可以通过它们所连接的固体支持物来区分。但是,在一些实施方案中,使用两种或更多种不同的报道子。在一些实施方案中,该方法还包括使样品和与靶核酸第二链上的区域互补的第二靶特异性引物相接触。第一靶特异性引物和第二靶特异性引物定位在靶核酸的相反链上使得可以通过PCR来扩增靶核酸的区域。在某些方面中,该方法包括进行多个扩增循环。因此,在某些方面中,该方法还包括:使靶核酸与靶特异性引物以及靶特异性探针重复杂交;用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以使第一靶特异性引物的延伸导致杂交的靶特异性探针的切割并且释放报道子;和检测来自固体支持物上报道子之信号的降低至少直至可以从背景噪声区分出信号的变化。在某些方面中,使用在一个或更多个扩增循环之后来自固体支持物上报道子之信号的变化来对样品中靶核酸的量进行定量。标签可以包括异碱基(isobase)和/或核酸类似物。靶特异性引物和靶特异性探针可以与靶核酸上的相邻或非相邻的序列杂交。在靶特异性引物和靶特异性探针与相邻序列杂交的情况下,聚合酶可以切割靶特异性探针而不必然延伸靶特异性引物。因此,在某些方面中,该方法可以包括或者可以不包括用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物。在某些实施方案中,反应中包括一个或更多个对照。例如,在一些实施方案中,用于在样品中检测靶核酸的方法还可以包括检测来自与固体支持物相连接的非杂交(即,阴性对照)探针上报道子的信号。非杂交探针可以连接至与靶特异性探针相连接的同一固体支持物上的空间上离散的位置,连接至与靶特异性探针相连接的固体支持物不同的固体支持物,或者可以通过其他方式与靶特异性探针区分开。在某些实施方案中,不同的固体支持物是不同的编码珠。靶核酸可以是任何目的序列。在一些实施方案中,核酸是DNA。在一些实施方案中,核酸是RNA。包含靶核酸的样品可以是任何包含核酸的样品。在本发明的某些方面中,样品例如来自针对一个或更多个基因突变或多态性之存在或不存在进行筛选的对象。在本发明的另一个方面中,样品可以来自针对病原体之存在或不存在进行测试的对象。在样品获自对象的情况下,样品可以通过本领域技术人员已知的方法(例如抽吸(aspiration)、活检、擦拭(swabbing)、静脉穿刺、脊椎穿刺(spinaltap)、粪便样品或尿液样品)来获得。在本发明的一些方面中,所述样品是环境样品(例如水、土壤或空气样品)。在本发明的另一些方面中,所述样品来自植物、细菌、病毒、真菌、原生动物(protozoan)或后生动物(metazoan)。术语靶核酸包括未经扩增序列及其扩增子二者。引物是能够在依赖模板的过程中引发新生核酸合成的核酸。靶特异性引物是指设计成引发特定靶核酸合成的引物。引物对是指两个引物,通常称为正向引物和反向引物或者称为上游引物和下游引物,其设计成在模板核酸分子上扩增两个引物的结合位点之间的靶序列。在某些实施方案中,引物具有长度为10至40、15至30或18至26个核苷酸的靶特异性序列。探针是能够与互补核酸杂交的核酸。靶特异性探针是指设计成与特定靶核酸杂交的探针。存在于反应中的探针可以包含阻断的3’羟基以防止探针通过聚合酶延伸。3’羟基可以被例如磷酸基团、3’反向dT或报道子阻断。可以选择仅允许完全互补的序列之间杂交的高度严格的杂交条件。本发明的多个方面使用互补的标签与抗标签序列组。互补对中的哪条序列称为“标签”和哪条序列称为“抗标签”是任意的。标签和抗标签优选地为非交叉杂交,即,标签和抗标签分别应在同一反应中仅与其互补配偶体(complementarypartner)杂交,而不与其他标签或抗标签杂交。优选地,标签和抗标签在反应期间也不与样品中的其他核酸杂交。标签和抗标签序列还优选地设计成等温的,即,具有类似的最佳杂交温度,因此多重反应中的全部标签和抗标签序列将具有大约相同的Tm。非交叉杂交标签和抗标签序列的适当选择可用于需要严格的非交叉杂交行为的测定、特别是高度平行的杂交环境的测定。在某些实施方案中,标签和抗标签序列的长度为6至60、8至50、10至40、10至20、12至24或20至30个核苷酸。在一些实施方案中,标签和抗标签序列的长度为12、14、16或24个核苷酸。许多标签和标签互补序列(即,抗标签)在本领域中是已知的,并且可用于本发明中。例如,美国专利7,226,737(其通过引用并入本文)描述了一组210种非交叉杂交标签和抗标签。此外,美国专利7,645,868(其通过引用并入本文)公开了一个家族的1168个具有经过证实的以最小交叉杂交与其互补序列正确杂交之能力的标签序列。“通用的”标签或抗标签是指在多重反应中于所有反应中具有相同序列的标签或抗标签。报道子也可以称为标记剂,其为有助于检测与其相连的其他分子(例如,核酸)的分子。可用于标记核酸的许多报道子分子是已知的。直接报道子分子包括荧光团、生色团和放射团(radiophore)。荧光团的非限制性实例包括:红色荧光方酸菁染料(squarinedye),例如2,4-双[1,3,3-三甲基-2-二氢亚吲哚基甲基]环丁烯二-1,3-二氧代酸盐(2,4-Bis[1,3,3-trimethyl-2-indolinylidenemethyl]cyclobutenediylium-1,3-dioxolate);红外染料,例如2,4双[3,3-二甲基-2-(1H-苯并[e]二氢亚吲哚基甲基)]环丁烯二-1,3-二氧代酸盐(2,4Bis[3,3-dimethyl-2-(1H-benz[e]indolinylidenemethyl)]cyclobutenediylium-1,3-dioxolate);或橙色方酸菁染料,例如2,4双[3,5-二甲基-2-吡咯基]环丁烯二-1,3-二氧代酸盐(2,4-Bis[3,5-dimethvl-2-pvrrolvl]cvclobutenedivlium-1,3-dioxolate)。荧光团的另一些非限制性实例包括量子点(quantumdots)、Alexa染料、AMCA、630/650、650/665、CascadeCyDyeTM(包括但不限于Cy2TM、Cy3TM和Cy5TM)、DNA嵌入染料、6-FAMTM、荧光素、HEXTM、6-JOE、Oregon488、OregonOregonPacificBlueTM、REG、藻红蛋白(phycobilliprotein)(包括但不限于藻红蛋白(phycoerythrin)和别藻蓝蛋白(allophycocyanin))、罗丹明GreenTM、罗丹明RedTM、ROXTM、TAMRATM、TETTM、四甲基罗丹明或Texas信号扩增试剂例如酪胺酰胺(tyramide,PerkinElmer)可用于增强荧光信号。间接报道子分子包括生物素,其必须与其他分子(例如链酶亲和素-藻红蛋白)相结合以进行检测。也可以使用标记对,例如荧光共振能量转移对或染料-淬灭剂对。在一些实施方案中,其氢键合模式不同于天然碱基(A、T、C、G和U)的非天然碱基可以并入到本文所述的引物和探针中。一个实例是isoC和isoG碱基,其氢与彼此键合但不与天然碱基键合。在引物和/或探针中并入这些非天然碱基可用于降低非特异性杂交。使用这样的非天然碱基来测定靶核酸的方法公开于美国专利No.6,977,161中,其通过引用并入本文。在一个实施方案中,用于扩增靶核酸的两个靶特异性引物中的至少之一包括至少1、2、3或4个非天然碱基,并且在扩增反应中包括互补非天然碱基,以使非天然碱基包括在扩增产物中。在这样的一个实施方案中,互补非天然碱基并入探针中。在探针和靶序列中互补非天然碱基(例如isoC和isoG)的存在将允许这些序列之间的杂交但降低与其他序列的非特异性杂交。在本发明的某些方面中,使用了固体支持物。用于固定生物分子的多种固体支持物是已知的。例如,固体支持物可以是硝酸纤维素、尼龙膜、玻璃、活化石英、活化玻璃、聚偏二氟乙烯(PVDF)膜、聚苯乙烯基底、基于聚丙烯酰胺的基底、其他聚合物、共聚物或交联聚合物例如聚(氯乙烯)、聚(甲基丙烯酸甲酯)、聚(二甲基硅氧烷)、光聚合物(其包含能够与靶分子形成共价连接的光反应性物质例如氮烯(nitrene)、碳烯(carbene)和羰自由基(ketylradical))。固体支持物可以是例如珠(微球)、柱或芯片的形式。固定在平面固体支持物上的分子通常通过其在支持物上的空间位置来鉴定。固定在非平面固体支持物(例如颗粒或珠)上的分子经常通过如下所述的一些编码支持物的形式来鉴定。在一些实施方案中,接头放置在靶特异性探针或抗标签与其所连接的固体支持物之间。可以编码珠和颗粒使得可以将一个子群体的珠或颗粒与另一子群体区分开。可以通过多种技术来进行编码。例如,可以用具有不同发射光谱和/或不同信号强度的荧光染料来对珠进行荧光标记。在某些实施方案中,所述珠是Luminex微球或Luminex微球。子群体中珠的大小也可用于将一个子群体与另一个子群体区分开。修饰珠的另一种方法是向结构中并入磁响应物质例如Fe3O4。在不存在磁场的条件下,顺磁性和超顺磁性微球具有可忽略的磁性,但磁场的施加引起微球中的磁性结构域对齐(alignment),导致微球被吸引至场源。将荧光染料、珠大小和/或磁响应物质组合到珠中可以进一步提高可以产生的不同珠子群体的数目。可以通过多种技术来检测靶核酸。在本发明的一个方面中,使用流式细胞仪来检测扩增的靶核酸。流式细胞仪特别良好地适合捕获复合物(capturecomplex)的固体支持物为珠或其他颗粒的情况。在本发明的另一些方面中,检测扩增的靶核酸包括在静态成像系统(例如珠阵列平台或芯片阵列平台)中对与捕获复合物结合的经扩增靶核酸序列进行成像。本发明的方法可用于多重测定中。在这样的多重测定中,样品通常将包含至少第二靶核酸序列。在本发明的某些方面中,样品中有1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100、120、140、160、180、200、220、240、260、280、300、400、500、600、700、800、900、1000个或其间任意范围的靶核酸序列。如上文所提及的,靶核酸序列可以是任何目的序列。一个靶核酸序列可以在相同的基因中或者在不同的基因中作为另一个靶核酸序列,并且靶核酸序列可以重叠或者可以不重叠。当然,靶核酸序列无需在基因中而是可以在例如DNA的非编码区中。在其中样品中存在待扩增的至少第二靶核酸的多重测定中,反应中包括至少第二区分引物或引物对。检测核酸的方法可以包括沿着模板核酸重复延伸引物以扩增序列。扩增可以是定性的、半定量的或定量的。在某些实施方案中,可以实时监测扩增(例如,实时PCR)。可以重复扩增循环直至产生期望量的扩增产物。通常来说,扩增循环重复约10次至40次。就实时PCR而言,通常将在每个扩增循环之后进行扩增产物的检测。但是在本发明的某些方面中,可以在仅扩增循环亚组之后例如每两个、三个、四个或五个扩增循环之后进行扩增产物的检测。还可以进行检测使得分析或检测少至2个或更多个扩增循环。在另一个实施方案中,本发明提供了用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的靶核酸第一链上第二区互补的靶特异性探针在适于靶核酸与靶特异性引物以及靶特异性探针杂交的条件下相接触,其中靶特异性探针包含在其5’或3’端的荧光团和在所述荧光团相反端的生物素;(b)用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以切割杂交的靶特异性探针和将荧光团与生物素分离;(c)从样品中除去生物素;和(d)通过检测来自荧光团的信号来检测靶核酸。在一些实施方案中,从样品中除去生物素包括使样品与亲和素包被的磁珠接触以结合生物素,和除去与生物素结合的亲和素包被的磁珠。在某些方面中,该方法还包括使样品和与靶核酸第二链上的区域互补的第二靶特异性引物相接触。该方法还可包括在从样品中除去生物素之前进行多个聚合酶链反应循环。在某些实施方案中,提供了对核酸的量进行定量的方法。在一个实施方案中,提供了用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对以及靶特异性探针的存在下扩增靶核酸,其中所述引物对包含与靶核酸第一链上第一区互补的第一引物和与靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的靶核酸第一链上第二区互补,其中靶特异性探针包含报道子并且与固体支持物相连接,并且其中核酸聚合酶在第一靶特异性引物沿着靶核酸延伸时切割靶特异性探针并从固体支持物释放报道子;(c)在第一时间检测来自固体支持物上报道子的第一信号和在第二时间检测来自固体支持物上报道子的第二信号;和(d)将信号的变化与样品中核酸的量相关联。在一些实施方案中,该方法还包括在第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40时间检测来自固体支持物上报道子的至少第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40信号。在某些方面中,该方法包括在用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以切割杂交的靶特异性探针和从固体支持物释放报道子之前检测来自固体支持物上报道子的信号。在一些实施方案中,该方法包括对样品中的多种不同靶核酸的量进行定量。在另一个实施方案中,提供了用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、与靶核酸的第一区互补的靶特异性引物和与所述第一区下游的靶核酸第二区互补的靶特异性探针的存在下在适于靶核酸与靶特异性引物和靶特异性探针杂交的条件下扩增靶核酸,其中所述靶特异性探针包含在其5’或3’端的标签,还包含报道子,并且其中核酸聚合酶在靶特异性引物沿着靶核酸延伸时切割靶所述特异性探针并从固体支持物释放报道子;(c)在第一时间检测来自固体支持物上的报道子的第一信号和在第二时间检测来自固体支持物上报道子的第二信号;和(d)将第一信号与第二信号之间的变化与样品中核酸的量相关联。在一些实施方案中,该方法还包括在第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40时间检测来自固体支持物上报道子的至少第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40信号。在某些方面中,该方法包括在用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物以切割杂交的靶特异性探针和从固体支持物释放报道子之前检测来自固体支持物上报道子的信号。在一些实施方案中,该方法包括对样品中的多种不同靶核酸的量进行定量。在一个实施方案中,本发明提供了用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对以及靶特异性探针的存在下在适于靶核酸与靶特异性引物对以及靶特异性探针杂交的条件下扩增靶核酸,其中所述引物对包含与靶核酸第一链上第一区互补的第一引物和与靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的靶核酸第一链上第二区互补,其中靶特异性探针包含在其5’或3’端的荧光团和在所述荧光团的相反端的生物素,并且其中依赖模板的核酸聚合酶在第一引物沿着靶核酸延伸时切割杂交的靶特异性探针从而将荧光团与生物素分离;(c)从样品中除去生物素;(d)在第一时间检测来自固体支持物上荧光团的第一信号和在第二时间检测来自荧光团的第二信号;(e)将信号的变化与样品中核酸的量相关联。在一些实施方案中,该方法还包括在第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40时间检测来自固体支持物上荧光团的至少第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19、第20、第21、第22、第23、第24、第25、第26、第27、第28、第29、第30、第31、第32、第33、第34、第35、第36、第37、第38、第39或第40信号。在某些方面中,该方法包括在用具有外切核酸酶活性的核酸聚合酶延伸靶特异性引物之前检测来自荧光团的信号。在一些实施方案中,该方法包括对样品中的多种不同靶核酸的量进行定量。在另一个实施方案中,本发明提供了用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对以及靶特异性探针的存在下在适于靶核酸与靶特异性引物对以及靶特异性探针杂交的条件下扩增靶核酸,其中靶特异性引物对包含与靶核酸第一链上第一区互补的第一引物和与靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的靶核酸第一链上第二区互补,其中所述靶特异性探针包含在其5’或3’端的标签,还包含荧光团,以及在标签和荧光团相反端的生物素,并且其中核酸聚合酶在靶特异性引物沿着靶核酸延伸时切割杂交的靶特异性探针从而将荧光团与生物素分离;(b)从样品中除去生物素;(c)使标签序列与固体支持物上的互补抗标签序列杂交;(d)检测来自固体支持物上荧光团的荧光信号;(e)将荧光信号与样品中核酸的量相关联。在定量PCR中,阈值循环数(thresholdcycle,Ct)反映反应中产生的荧光超过阈值时的循环数。Ct与初始拷贝数的对数反相关。就每个反应而言,Ct值的确定与软件所设置的基线、背景和阈值相关。在一些qPCR方法中,使用被动参考染料(passivereferencedye),用来自荧光报道子的信号除以来自参考染料的信号来计算反应介质中的可变性。该计算得出归一化报道子信号(Rn)。基线是指其中存在很少的预期荧光信号变化的PCR的初始循环(通常为3至15个循环)。基线可用于确定每个反应的背景。在多孔反应板中,来自多个孔的若干基线可用于确定整个板的“基线荧光”。可以通过许多方式来使用数据分析以确定何时靶扩增高于背景信号(超过阈值)。可以用Rn减去背景信号以得出ΔRn。通常用于qPCR中的对数据分析的其他补充都可应用于本发明。也就是说,使用内源和外源对照、管家基因、标准曲线、内部阳性对照、无扩增对照、反转录对照、无处理对照、提取对照、时间零点、健康个体对照以及阴性和阳性对照。这些可用在本发明中以进行比较Ct分析(“相对定量”)或标准曲线分析(“绝对定量”)、Pfaffl法、终点定量、定性结果、等位基因辨别等。说明扩增效率或扩增速率可以通过多种方法来进行,包括但不限于:稀释法、指数期荧光增强、S形曲线或逻辑曲线拟合等。阈值可以通过多种方法来确定,包括但不限于二阶导数最大法,或者通过高于背景的标准偏差的倍数等。终点定量分析可以通过多种方法来进行,包括但不限于:相对的、绝对的、竞争的和比较的。在本文所述的方法中,孔与孔之间信号的可变性并非如常规批量(bulk)荧光测量qPCR一样高。在批量荧光PCR中,一些信号变化可能与每个孔的体积差异相关。在本发明的某些实施方案中,体积差异将不会改变连接在固体支持物上的荧光,并且不需要被动批量流体参考染料。因为对在光谱上可鉴定的颗粒拍摄了多个图像,所以成像室内或之间焦点和光强度的变化可导致信号可变性。这可以通过校准颗粒或被动参考颗粒来归一化。校准颗粒可用于在分析反应之前聚焦和优化每个成像室的光强度或检测器设置。它们还可以与每个反应混合以归一化各图像的信号。校准颗粒一般以已知量的分类染料以及报道子染料进行内部染色。被动参考颗粒可用于通过从靶特异性探针减去或除以来归一化信号。被动参考颗粒一般用设计成在反应中不与靶核酸的任何其他部分杂交或相互作用的探针来进行外部染色。其他颗粒可以包括没有报道子染料的那些,在内部或在外部可用于归一化可影响反应中每个颗粒测量信号之批量荧光的变化。不包含珠的成像室部分也可用于归一化信号。数据分析可以以许多方式进行。下述为用于进行mRNA相对定量的数据分析的一种方法的示例性实例。在用校准颗粒校准成像室之后,被动参考颗粒的一个或更多个区域和靶特异性颗粒的一个或更多个区域以及对内源对照或管家基因具有特异性的一个或更多个区域包括在能够进行热循环的成像室中。通过内部分类染料可以在光谱上鉴定每个颗粒类型,所述染料将它们分成区域。每个区域至少有30个颗粒包括在反应中。在PCR循环的退火期或延伸期期间对反应的前10个循环进行成像。通过每个区域平均取至少30个颗粒来确定中位荧光强度(MFI)值。这前10个循环代表基线。用靶特异性和内源性对照颗粒的MFI除以被动参考颗粒的MFI(Rn)。来自基线的平均Rn用于随着反应进行从后续图像中减去(ΔRn)。通过对每个区域的Rn取标准差(SD)并乘以10来确定阈值。当ΔRn超过基线的10SD时,记录颗粒每个区域的Ct。然后可以通过关于管家区域或内源对照区域对靶特异性区域进行归一化来分析这些Ct值。该归一化通常通过取靶特异性区域的Ct与内源对照区域的Ct的差(ΔCt)来进行。接下来,如果要比较两个样品(受试样品vs对照样品或者患病样品vs健康样品),则可以使用“Δ-ΔCt”方法而无需为了效率而校准(R=2-[ΔCt样品-ΔCt对照])。扩增效率可以通过本领域技术人员已知的直接或间接方法来确定,并且可用于校正定量数据。直接方法可以包括通过稀释法或者通过指数期相对荧光的测量来确定扩增效率。其他间接方法可以包括使扩增曲线拟合至数学模型,例如S形、逻辑或指数曲线拟合。在某些实施方案中,使用数字PCR(digitalPCR,dPCR)实现靶核酸的定量。在该方法中,对样品进行分份(partitioned)以使包含在样品中的各个核酸分子定位于许多分开的区域,例如在微孔板的各个孔中、在乳剂的分散相或者核酸结合表面的阵列中。每份将含有0或1个分子,分别提供阴性反应或阳性反应。不同于常规PCR,dPCR不依赖于扩增循环的数目来确定样品中靶核酸的初始量。因此,dPCR消除了对指数数据的依赖性来对靶核酸进行定量并且提供绝对定量。本发明还提供了用于任意所公开方法的组合物和试剂盒。例如,在一个实施方案中,组合物可以包含至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27,28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100、120、140、160、180、200、220、240、260、280、300、400、500、600、700、800、900、1000组或其间任意范围的不同引物-探针组(primer-probeset),其中每个引物-探针组包含:(i)与靶核酸第一链上第一区互补的第一引物,(ii)与靶核酸第二链上的区域互补的第二引物,和(iii)与可区分地编码的颗粒共价相连的经标记靶核酸探针,其中经标记靶特异性探针能够特异性地与靶核酸第一链上第二区杂交,其中第二区在第一区的下游。该组合物还可以包含具有5’外切核酸酶活性的聚合酶。在一些实施方案中,该组合物还包含一个或更多个与可区分地编码的颗粒共价相连的阴性对照(即,被动参考)探针。阴性对照探针是设计成使其不与预期存在于给定样品中的任意核酸特异性地杂交的探针。在一些实施方案中,该组合物还包含一个或更多个与可区分地编码的颗粒共价相连的阳性对照探针。阳性对照探针是设计成使其与预期存在于给定样品中的核酸特异性地杂交的探针。在另一个实施方案中,提供了一种试剂盒,该试剂盒可包含(a)至少2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、55、60、65、70、75、80、85、90、95、100、120、140、160、180、200、220、240、260、280、300、400、500、600、700、800、900、1000组或其间任意范围的不同引物-探针组,其中每个引物-探针组包含:(i)与靶核酸第一链上第一区互补的第一引物,(ii)与靶核酸第二链上的区域互补的第二引物,和(iii)与可区分地编码的颗粒共价相连的经标记靶特异性探针,其中经标记靶特异性探针能够特异性地与靶核酸第一链上第二区杂交,其中第二区在第一区的下游。该试剂盒还可以包含具有5’外切核酸酶活性的聚合酶。在一些实施方案中,该试剂盒还包含一个或更多个与可区分地编码的颗粒共价相连的阴性对照探针。在一些实施方案中,该试剂盒还包含一个或更多个与可区分地编码的颗粒共价相连的阳性对照探针。该试剂盒的组分可提供在同一容器中或者提供在包装在一起的独立容器中。在某些实施方案中,该试剂盒是感染性疾病试剂盒,并且引物-探针对设计成扩增来自病原体(例如,细菌、病毒)的靶序列。在另一些实施方案中,该试剂盒是基因表达谱试剂盒,并且引物-探针对设计成从多种表达的基因序列扩增靶序列。本文使用的“杂交”或“能够杂交”应理解为意指形成双链或三链分子或者具有部分双链或三链性质的分子。本文使用的术语“退火”与“杂交”是同义的。本文使用的“严格条件”或“高度严格”是这样的条件:允许一个或更多个包含互补序列的核酸链之间或之内的杂交,但排除非互补序列的杂交。这样的条件是本领域普通技术人员公知的,并且优选用于需要高选择性的应用。严格条件可包括低盐和/或高温条件。应理解,期望的严格度的温度和离子强度部分地是由杂交混合物中特定核酸的长度、靶序列的长度和核酸碱基含量、核酸的电荷组成以及甲酰胺、四甲基氯化铵或其他溶剂的存在或浓度决定的。预期本文所述的任意方法或组合物都可以参考本文所述的任意其他方法或组合物来实施。术语“包含”(及其语法变化形式)、“具有”(及其语法变化形式)、“含有”(及其语法变化形式)和“包括”(及其语法变化形式)是开放性的连接动词。因此,“包含”、“具有”、“含有”或“包括”一个或更多个所记载步骤或要素的方法、组合物、试剂盒或系统具有所记载的那些步骤或要素,但不限于仅具有那些步骤或要素;其可以具有(即,涵盖)未记载的要素或步骤。同样,“包含”、“具有”、“含有”或“包括”一个或更多个所记载特征的方法、组合物、试剂盒或系统的要素具有那些特征,但不限于仅具有那些特征;其可具有未记载的特征。本发明的任意方法、组合物、试剂盒和系统的任意实施方案可由所述步骤和/或特征组成或者基本上由所述步骤和/或特征组成,而不是包含/包括/含有/具有所述步骤和/或特征。因此,在任意权利要求中,术语“由...组成”或“基本上由...组成”可以替换在上文中引用的任意开放性连系动词,以改变使用开放性连系动词的给定权利要求的范围。在权利要求中术语“或”的使用用于意指“和/或”,除非明示地指明仅指替代形式或者替代形式互相排斥,但本公开内容支持仅指替代形式和“和/或”的定义。在整个本申请中,术语“约”用于表示包括用于确定该值的装置或方法之误差的标准偏差的值。遵循长久以来的专利法,在权利要求书或说明书中,无数量词修饰形式在与措辞“包含”同时使用时表示一个/种或更多个/种,另有指明除外。通过以下详细描述,本发明的其他目的、特征和优点将变得明显。但是,应理解,虽然详细描述和特定实施例示出了本发明的具体实施方案,但是其仅通过举例说明给出,因为本发明的精神和范围内的多种变化和修改对于本领域技术人员而言将通过该详细描述而变得明显。附图说明以下附图构成本说明书的一部分,并且包括附图以进一步说明本发明的某些方面。通过参照这些附图中的一个或更多个并结合本文给出的具体实施方案的详细描述可以更好地理解本发明。图1示出多个在一端与在光谱上可鉴定的珠相连并且在另一端具有荧光团的靶特异性探针。图2A~2D.图2A示出与引物和一端具有生物素而另一端具有标签序列的靶特异性探针杂交的靶核酸(扩增子)。在图2B中,聚合酶通过引物的引发正在合成一条新链。聚合酶遇到并切割靶特异性探针将生物素与标签分离(图2B)。图2C示出从已与连接至在光谱上编码之珠的互补标签杂交的靶特异性探针切割的标签。图2D示出其中标签与连接至在光谱上编码之珠的互补标签杂交的未切割靶特异性探针。图3是示出在存在或不存在模板的条件下使用靶特异性珠组和对照珠组之PCR的MFI的图。具体实施方式A.水解探针本发明的某些方面采用水解探针来检测核酸。水解探针利用一些聚合酶的5’外切核酸酶活性。在PCR反应的延伸期或延长期期间,聚合酶(例如Taq聚合酶)使用上游引物作为结合位点然后延伸。然后水解探针在聚合酶延伸期间通过聚合酶的5’-外切核酸酶的活性在其5’端切割。但是,切割探针5’端的过程不需要靶序列的扩增或延伸(参见例如美国专利5,487,972,其通过引用并入本文)。这通过以下来实现:将探针放置为非常接近靶序列上的上游引物以使核酸聚合酶与引物3’端的结合自动地使聚合酶与探针的5’端接触。因为聚合不需要使聚合酶进入切割探针的位置,所以可以将其称为“不依赖聚合的切割”。以这种方式,后续轮的退火和后续探针水解可以发生,导致在不存在聚合的条件下显著量的信号产生。测定(参见例如美国专利5,210,015,其通过引用并入本文)是基于水解探针之测定的一个实例。在测定中,水解探针通常在5’端标记有报道子并且在3’端标记有淬灭剂。当报道子和淬灭剂固定到同一探针上时,迫使它们维持非常接近。该接近有效地淬灭报道子信号,即使在探针与靶序列杂交时也是如此。水解探针在聚合酶延伸期间在其5’端通过Taq的5’-外切核酸酶活性而被切割。在这发生时,报道子荧光团从探针释放,并且随后不再非常接近淬灭剂。这致使报道因子信号永久增强,每个延伸期随着PCR反应持续循环。为了在每个循环中获得最大信号,常常将水解探针设计成Tm为比反应中的引物高出约10℃。实时水解探针反应的使用还描述于美国专利No..5,538,848和7,205,105中,二者通过引用并入本文。图1示出本发明的一个实施方案。靶特异性探针的一端与在光谱上可鉴定的珠相连,另一端与荧光团相连。当另一扩增序列与探针/氟石/珠复合物的靶链上游结合时,荧光团因聚合酶的外切酶活性而被切割。在该方法中,当反应中存在靶核酸时,会观察到信号的降低。其他设计成非杂交的珠可用于测量背景信号,背景信号可因荧光团上温度的影响而随时间改变。该特定方法对于实时定量测定而言是有利的,因为在反应开始时,荧光仅在珠上,而不在溶液中。可以通过存在于复合物(multiplex)中的扩增子的数目和置于溶液中的珠的数目来控制结束于溶液中的总荧光。该方法也是有利的,因为其不需要终点杂交步骤或珠的后续标记。此外,在获取每个数据点之前无需等待珠上的杂交事件。该方法相对于上述测定提供了若干优点。例如,不需要淬灭分子,因为不必须进行批量荧光测量。此外,在光谱上可鉴定的珠允许进行高度多重的反应,包括高度多重的实时PCR反应。虽然使用荧光团和在光谱上编码的珠对该实施方案进行描述,但是仍可以使用其他标记和固体支持物。图2A~2D示出了本发明的另一个实施方案。在图2A中,引物和一端具有生物素而另一端具有标签序列的靶特异性探针与靶核酸杂交。生物素和标签可以反过来以使得标签在探针的3’端或5’端。引物通过聚合酶引发新链的合成。当聚合酶遇到靶特异性探针时,其切割探针将生物素与标签分离(图2B)。图2C和2D示出与在光谱上编码的珠上的互补标签杂交的标签。在图2C中,通过聚合酶从靶特异性探针切割标签。但是,在图2D中,未切割靶特异性探针。因此,可以形成生物素-PE复合物,导致可检测的信号。因此,当反应中存在靶核酸时,会观察到信号的降低。在该实施方案中,生物素可以替换成任何荧光染料。在另一个实施方案中,荧光团可以连接在探针的3’端或5’端,并且生物素可以连接在相反端。在该构造中,生物素会通过聚合酶的外切核酸酶活性而从探针切割。然后,以过量的亲和素包被的磁珠应用生物素清除步骤。如果探针/氟石/生物素复合物因缺乏靶标而未被切割,则在清除步骤中整个复合物将从反应中除去。如果发生了切割,则生物素将从标签/荧光团释放,并且仅生物素将在清除步骤期间从反应中除去。因此,如果在扩增期间存在靶核酸,则会观察到杂交珠上的信号增强。B.PCR聚合酶链反应(PCR)是在分子生物学中广泛用于通过体外酶促复制扩增DNA片段的技术。通常来说,PCR应用采用热稳定的DNA聚合酶,例如Taq聚合酶。该DNA聚合酶使用作为模板的单链DNA和用于起始DNA合成DNA引物来由核苷酸(dNTP)酶促地组装新的DNA链。基本的PCR反应需要若干组分和试剂,包括:包含待扩增靶序列的DNA模板;一种或更多种引物,其与靶序列的5’端和3’端的DNA区互补;DNA聚合酶(例如,Taq聚合酶),其优选地具有最佳为约70℃的温度;三磷酸脱氧核苷酸(dNTP);提供用于最佳活性的合适化学环境和DNA聚合酶的稳定性的缓冲溶液;二价阳离子,通常为镁离子(Mg2+);以及单价阳离子钾离子。大多数PCR方法使用热循环来对PCR样品进行限定的一系列温度步骤。每个循环通常具有2或3个离散的温度步骤。通常通过在高温(>90℃)下的单一温度步骤(“起始”),接着在结束时的就终产物延伸(“最终延伸”)或简短贮存(“最终保持”)而言的一个或两个温度步骤来进行循环。在每个循环中所用温度和应用的时间长度取决于多个参数。这些包括用于DNA合成的酶、反应中二价离子和dNTP的浓度以及引物的解链温度(Tm)。通常使用的用于PCR方法之多个步骤中的温度是:起始步骤:94℃至96℃;变性步骤:94℃至98℃;退火步骤:50℃至65℃;延伸/延长步骤:70℃至74℃;最终延长:70℃至74℃;最终保持:4℃至10℃。实时聚合酶链反应也称为定量实时聚合酶链反应(qPCR)或动力学聚合酶链反应,其用于扩增和同时对靶DNA分子进行定量。其使得能够对DNA样品中的特定序列进行检测和定量二者(在归一化为DNA输入或另外的归一化基因时作为绝对拷贝数或相对量)。实时PCR可以与反转录聚合酶链反应组合以对低丰度RNA进行定量。通过以对数尺度针对荧光相对于循环数作图来确定实时PCR的指数期期间存在的DNA的相对浓度。然后可以通过将该结果与由已知量的DNA的一系列稀释物的实时PCR产生的标准曲线进行比较来确定DNA的量。数字PCR(dPCR)涉及对样品进行分份(partitioning)以使包含在样品中的各个核酸分子定位于许多不同的区域,例如在微孔板的各个孔中、在乳剂的分散相或者核酸结合表面的阵列中。每份将包含0或1个分子,分别提供阴性反应或阳性反应。不同于常规PCR,dPCR不依赖于扩增循环数来确定样品中靶核酸的初始量,因此,dPCR降低了对指数数据的依赖性来对靶核酸进行定量并且提供绝对定量。多重PCR和多重实时PCR在单个PCR反应中利用多重独特引物组来产生不同DNA序列的扩增子。通过一次靶向多个基因,从单次测试运行可获得额外的信息,否则将需要若干次试剂和更长时间来进行。应优化每个引物组的退火温度以在单一反应中应用(work)。C.互补标签本发明的一些实施方案在引物和/或探针中采用互补标签序列(即,标签和抗标签)。非杂交标签和抗标签序列的适当选择可用于需要严格的非交叉杂交行为的测定中,特别是在高度平行杂交环境中的测定。在设计标签和抗标签序列时考虑了形成核酸杂交体的某些热力学性质。寡核酸与其互补序列形成双链体的温度(称为Tm,50%的核酸双链体在该温度下解离)根据依赖于序列数目的性质而不同,所述性质包括典型A-T对和G-C对(反映在GC或碱基组成)的氢键合能、堆叠自由能以及(在较小程度上)最近邻近相互作用。这些能量在通常用于杂交测定的寡核苷酸之间广泛不同。例如,两个探针序列与其互补靶标在理论上的标准条件下杂交在解链温度上可具有10℃的差异(Mueller等,1993),所述两个探针序列由24个核苷酸构成,一个具有40%GC含量,另一个具有60%的GC含量。当在包括对于所有寡核苷酸序列组的准确杂交而言并非最佳的单一杂交温度的杂交条件下允许形成杂交体时,出现杂交问题。非互补探针的不匹配杂交可能发生,形成具有可测量不匹配稳定性的双链体(Santalucia等,1999)。特定寡核苷酸组中双链体的不匹配可发生在其中不匹配导致双链体稳定性下降的杂交条件下,双链体稳定性下降导致与该特定组的最不稳定的准确双链体相比较高的Tm。例如,如果杂交在利于富含AT的完美匹配双链体序列的条件下实施,则存在杂交包含不匹配碱基的富含GC的双链体序列(其解链温度仍高于正确形成的富含AT双链体)的可能性。因此,可用在多重杂交反应中的寡核苷酸序列家族的设计必须包括对寡核苷酸的热力学性质和双链体形成的考虑,这将降低或消除所设计寡核苷酸组内的交叉杂交行为。可通过多种不同的方法来选择用于多重杂交测定中的标签和抗标签序列。可以在可寻址阵列(addressablearray)中用作邮编(zipcode)或标签的序列的选择已作为Brenner及同事所采取的方法而描述于专利文献中(美国专利5,654,413,其通过引用并入本文)。Chetverin等(WO93/17126,美国专利No.6,103,463和6,322,971,其通过引用并入本文)公开了区段化二元寡核苷酸阵列以分选和研究核酸。这些阵列具有与相邻的可变核苷酸序列相连的连续核苷酸序列,二者均通过共价连接部分与固体支持物结合。Barany等(WO9731256,其通过引用并入本文)中讨论了用于设计基于亚单元之标签的参数。美国专利4,942,124(其通过引用并入本文)中描述了多重测序方法。该方法采用标签序列彼此不同的至少两个载体。美国专利7,226,737(其通过引用并入本文)描述了一组210种非交叉杂交标签和抗标签。美国公开的申请No.2005/0191625(其通过引用并入本文)公开了一个家族的1168个具有经过证实的以最小交叉杂交与其互补序列正确杂交之能力的标签序列。美国公开No.2009/0148849(其通过引用并入本文)描述了标签、抗标签和捕获复合物在扩增核酸序列中的用途。寡核苷酸标签或抗标签序列群体可以以若干不同的方式与引物或其他多核苷酸序列群体缀合,所述方式包括但不限于直接化学合成、化学偶联、连接、扩增等。用靶特异性引物序列合成的序列标签可例如在PCR扩增中用于靶标上引物的酶促延伸。寡核苷酸标签或抗标签序列的群体可以通过例如支持物表面上的表面化学与固体支持物缀合。D.固体支持物在某些实施方案中,探针和/或引物可以与固体支持物相连接。这样的固体支持物可以是例如微球(即,珠)或其他颗粒(例如微颗粒、金或其他金属纳米颗粒、量子点或纳米点)。在某些方面中,颗粒可以是磁性的、顺磁性的或超顺磁性的。微球、珠和颗粒的实例在以下举例说明:Fulton的美国专利No.5,736,330、Chandler等的美国专利5,981,180、Fulton的美国专利6,057,107、Chandler等的美国专利6,268,222、Chandler等的美国专利6,449,562、Chandler等的美国专利6,514,295、Chandler等的美国专利6,524,793、以及Chandler的美国专利6,528,165,其通过引用并入本文。可以用标签来编码颗粒。在某些实施方案中,本发明与和MagPlexTM技术联合使用。LuminexxMAP技术允许检测固定在荧光地编码的微球上的核酸产物。通过用两种在光谱上不同的荧光染料(分别具有10种不同的强度)对微球进行染色,产生了100种荧光不同的微球群体。这些个体群体(组)可以代表个体检测序列,并且可以单独检测每个组的杂交程度(magnitude)。使用第三报道子来测量杂交反应的程度,第三报道子通常是第三光谱上不同的荧光团。在其中经标记水解探针与微球相连的一些实施方案中,探针的杂交和水解导致来自第三报道子之信号的降低。因为微球和报道子分子二者均被标记,所以数字信号处理允许就每个反应而言将信号转化为实时定量数据。Luminex技术描述于例如美国专利5,736,330、5,981,180和6,057,107中,其全部通过引用具体地并入。MagPlexTM微球是使用上述技术荧光地编码的超顺磁性微球。该微球包含用于配体(或生物分子)之共价连接的表面羧基。或者,固体支持物可以是平面阵列例如基因芯片或微阵列(参见例如Pease等,1994;Fodor等,1991)。平面阵列上核酸的性质通常通过其在阵列上的空间位置来确定。基于微球的测定也可以在珠阵列平台上分析。一般而言,珠阵列平台对分布在基本平面阵列上的珠和分析物进行成像。以该方式,珠阵列的成像类似于上文中讨论的基因芯片。但是,与分析物通常通过其在阵列上的空间位置来鉴定的基因芯片相比,珠阵列通常通过与其结合的编码微球来鉴定分析物。直接在固体基底上合成多核苷酸探针或者将多核苷酸探针与固体基底相连的能力在本领域中是公知的。参见美国专利No.5,837,832和5,837,860,二者均通过引用并入本文。多种方法已用于将探针永久地与基底结合或者可除去地与基底结合。示例性方法包括:生物素化核酸分子固定至亲和素/链霉亲和素包被的支持物(Holmstrom,1993)、短的5’-磷酸化引物直接共价连接至化学改性的聚苯乙烯板(Rasmussen等,1991)或者用聚-L-Lys或聚L-Lys、Phe预包被聚苯乙烯或玻璃固相,接着使用双功能交联试剂共价连接氨基或巯基修饰的寡核苷酸(Running等,1990;Newton等,1993)。许多材料可用作固体支持物,包括加强的硝酸纤维素膜、活化石英、活化玻璃、聚偏二氟乙烯(PVDF)膜、聚苯乙烯基底、基于聚丙烯酰胺的基底、其他聚合物例如聚(氯乙烯)、聚(甲基丙烯酸甲酯)、聚(二甲基硅氧烷)、光聚合物(其包含能够与靶分子形成共价连接的光反应性物质例如氮烯、碳烯和羰自由基)。E.检测本发明的多个方面涉及通过检测信号的增强或降低来直接或间接检测一种或更多种靶核酸。所用检测技术将取决于报道子和平台(例如,在光谱上编码的珠、微阵列等)的类型。例如,流式细胞术在分析基于微球的测定中特别有用。流式细胞术涉及在液体样品中分离细胞或其他颗粒,例如微球。一般而言,流式细胞术的目的是针对一个或更多个特征分析分离的颗粒。流式细胞术的基本步骤涉及引导流体样品通过设备使得液体流通过传感区。一次应有一个颗粒通过传感器,并且颗粒基于大小、折射、光散射、不透明度、粗糙度、形状、荧光等来分类。在Luminex系统的上下文中,流式细胞术可同时用于序列鉴定和杂交定量。微球中的内部染料通过流式细胞术来检测并用于鉴定与微球相偶联的特定核酸序列。靶核酸分子或探针上的标记也通过流式细胞术来检测并用于确定与微球的杂交。流式细胞术的方法在本领域中是公知的并且描述于例如全部通过引用并入本文的以下美国专利中:美国专利No.5,981,180、4,284,412、4,989,977、4,498,766、5,478,722、4,857,451、4,774,189、4,767,206、4,714,682、5,160,974和4,661,913。本文所述的测量可以包括用于分析颗粒的一个或更多个图像以确定颗粒的一个或更多个特征的图像处理,所述特征例如表示颗粒在多个检测波长的荧光发射程度的数值。可以根据Fulton的美国专利No.5,736,330、Chandler等的美国专利5,981,180、Chandler等的美国专利6,449,562、Chandler等的美国专利6,524,793、Chandler的美国专利6,592,822以及Chandler等的美国专利6,939,720(其通过引用并入本文)来进行颗粒的一个或更多个特征的后续处理,例如使用一个或更多个数值来确定表示颗粒所属的多重亚组的象征ID和/或表示与颗粒表面结合的分析物的存在和/或量的报道子值。在一个实例中,Chandler等的美国专利No.5,981,180所述的技术可以在多重方案中与本文所述的荧光测量一起使用,在该多重方案中,将颗粒分为亚组以分析单个样品中的多种分析物。Chandler等的美国专利5,981,180、Chandler的美国专利6,046,807、Chandler的美国专利6,139,800、Chandler的美国专利6,366,354、Chandler美国专利6,411,904、Chandler等的美国专利6,449,562、以及Chandler等的美国专利6,524,793(其通过引用并入本文)中举例说明了可以配置为如本文所述的系统的另外实例(例如,通过包括本文所述的示例性子系统的实施方案)。还可以在阵列平台上分析微球,所述阵列平台对分布在基本平面阵列上的珠和分析物进行成像。以该方式,珠阵列的成像类似于基因芯片的成像。但是,与其中分析物通过其在阵列上的空间位置(即,x、y坐标)来鉴定的基因芯片相反,珠阵列通常通过与其结合的编码微球来鉴定分析物。市售珠阵列系统的实例包括Luminex’s和Illumina’sBeadXpressTMReader以及BeadStation500TM。一旦珠在平面层中,它们即可通过其“编码”(以包埋染料的形式,或者针对每种珠类型产生独特信号的其他方法)来鉴定。在“编码”珠的解决方案之后或者之前,可以测量信号,并且这两种测量联合以确定特定核酸与珠的杂交。F.试剂盒本发明还提供了包含用于本文所公开的扩增和检测方法的组分的试剂盒。在本文中公开的任意组分都可组合在试剂盒中。在某些实施方案中,该试剂盒包含用于引发多种靶核酸扩增的多种引物和与多种靶核酸互补的多种探针。在一些实施方案中,探针固定在固体支持物上。在一个实施方案中,多种探针与多种编码磁珠相连使得每种探针的性质得以从其所固定的编码磁珠得知。在某些实施方案中,该试剂盒还包含标记剂。在某些实施方案中,该试剂盒包含不与固体支持物相连的探针。在一些实施方案中,该试剂盒包含成像室,其可以是可弃型(disposable)成像室,用于成像系统。该试剂盒一般将包含向其中放置组分的至少一个小瓶、测试管、烧瓶、瓶子、注射器或其他容器,并且优选地适当地等分。在试剂盒中有多于一种组分的情况下,该试剂盒一般还将包含可以分别放置另外的组分的第二、第三或其他另外的容器。然而,容器中可以包含组分的多种组合。本发明的试剂盒通常还将包含符合市售的严格限制的用于包含多种容器的包装。这样的包装可以包括其中保存期望容器的硬纸板或注塑包装或吹塑包装。试剂盒还可以包含用于使用试剂盒组分的说明书。说明书可以包括可以实施的变化形式。G.实施例包括下述实施例以展示本发明的优选实施方案。本领域技术人员应理解,在下文的实施例中公开的技术表明本发明人发现的技术在本发明的实践中良好地发挥作用,因此可以认为其构成实践本发明的优选实施方式。但是,根据本公开内容,本领域技术人员应理解可以对所公开的具体实施方案作出许多变化并且仍获得相似或类似的结果而不脱离本发明的精神和范围。根据制造商的说明书将Luminex微球与胺修饰的寡核苷酸探针相偶联。微球区25与对表皮葡萄球菌具有特异性的探针相偶联:5’-/5AmMC12/CAGCTGTTCGTAATAATGGCGGTGGTC/3Cy3Sp/-3’(SEQIDNO:1)微球区54与设计为不与表皮葡萄球菌杂交的探针相偶联:5’-/5AmMC12/GATTGTAAGATTTGATAAAGTGTA/3Cy3Sp/-3’(SEQIDNO:2)接下来,为每个反应制备PCRMaster混合物,其包含:Master混合物(AppliedBiosystems).....12.5μL水.................................................5.7μL50mMMgCl2.........................................2.0μL20×引物混合物.....................................1.3μL2500个珠/μL/区.....................................1.0μL20×引物混合物包含以下比例/μL:TEpH8.0.....................0.64μL100μM正向引物...............0.18μL100μM反向引物...............0.18μL正向引物具有以下寡核苷酸序列:5’-TCAGCAGTTGAAGGGACAGAT-3’(SEQIDNO:3)反向引物具有以下寡核苷酸序列:5’-CCAGAACAATGAATGGTTAAGG-3’(SEQIDNO:4)模板购自ATCC#12228D-5(表皮葡萄球菌的经纯化DNA)。向每个“模板”PCR反应(2ng/反应)中添加水中的2.5μL模板,向“无模板”PCR反应中添加单独的2.5μL水。在ABIStepOnePlusThermalCycler上使用以下热循环方案:50℃,2分钟95℃,10分钟接着35个循环的两步PCR95℃,15秒。60℃,1分钟。在PCR之后,直接将反应混合物放入具有低PMT设置的LuminexFLEXMAP3D仪,并使用100个微球/MFI数据点分析中位荧光强度(MFI)值。获得了以下粗略MFI结果。表1:粗略MFI样品区域54区域25非特异性特异性模板42513854模板43503876模板43423804模板43753870无模板4320.54278.5无模板42684215无模板43014315无模板4301.54237这些结果在表2中平均:表2:平均MFI非特异性探针(即,非杂交探针)示出32MFI的差异,表明没有因外切核酸酶活性的显著变化。就特异性探针而言,在PCR反应期间,在模板的存在下,410MFI的差异示出特异性外切核酸酶活性。图3图示地展示了这些差异。*********************根据本公开内容,可以制备本文所公开和请求保护的全部组合物和进行本文所请求保护的全部方法。虽然就某些实施方案对本发明的组合物和方法进行了描述,但是对本领域技术人员而言明显的是许多改变可适用于本文所述的组合物和方法以及方法的步骤或步骤的顺序而不脱离本发明的概念、精神和范围。更具体地,明显的是,化学相关并且生理学相关的某些试剂可以替换成本文所述的试剂同时获得相同或类似的结果。认为所有这些对于本领域技术人员而言明显的替换和修改在如所附权利要求限定的本发明的精神、范围和概念之内。本申请还涉及以下实施方案:1.一种用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的所述靶核酸第一链上第二区互补的靶特异性探针在适于所述靶核酸与所述第一靶特异性引物以及所述靶特异性探针杂交的条件下相接触,其中所述靶特异性探针包含报道子并且与固体支持物相连接;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针以从所述固体支持物释放所述报道子;和(c)通过检测来自所述固体支持物上所述报道子之信号的变化来检测所述靶核酸。2.实施方案1所述的方法,其中所述第一靶特异性引物和所述靶特异性探针与所述靶核酸上的相邻序列杂交。3.实施方案1所述的方法,其中所述第一靶特异性引物和所述靶特异性探针与所述靶核酸上的非相邻序列杂交。4.实施方案1所述的方法,其还包括用所述具有外切核酸酶活性的核酸聚合酶延伸所述第一靶特异性引物。5.实施方案1所述的方法,其中所述固体支持物是编码的珠。6.实施方案1所述的方法,其中所述报道子是荧光团。7.实施方案6所述的方法,其中所述荧光团连接在所述靶特异性探针的5’端。8.实施方案6所述的方法,其中所述信号的变化是荧光信号的降低。9.实施方案1所述的方法,其中所述报道子是荧光团-淬灭剂对。10.实施方案9所述的方法,其中所述信号的变化是荧光信号的增强。11.实施方案1所述的方法,其还包括检测来自与固体支持物相连接的非杂交探针上报道子的参考信号。12.实施方案11所述的方法,其中所述非杂交探针连接至与所述靶特异性探针相连接的同一固体支持物上的空间上离散的位置。13.实施方案11所述的方法,其中所述非杂交探针连接至与所述靶特异性探针相连接的固体支持物不同的固体支持物。14.实施方案13所述的方法,其中所述不同的固体支持物是不同的编码的珠。15.实施方案1所述的方法,其中所述靶核酸是第一靶核酸,所述报道子是第一报道子,所述固体支持物是第一固体支持物,并且所述方法还包括:(a)使所述样品和与第二靶核酸第一链上第一区互补的第二靶特异性引物以及与所述第一区下游的所述第二靶核酸第一链上第二区互补的第二靶特异性探针在适于所述第二靶核酸与所述第二靶特异性引物以及所述第二靶特异性探针杂交的条件下相接触,其中所述第二靶特异性探针包含第二报道子并且与第二固体支持物相连接;(b)用所述具有外切核酸酶活性的核酸聚合酶切割第二杂交的靶特异性探针以从所述第二固体支持物释放所述第二报道子;和(c)通过检测来自所述第二固体支持物上所述第二报道子之信号的变化来检测所述第二靶核酸。16.实施方案15所述的方法,其中所述第一固体支持物和所述第二固体支持物是一个固体支持物上的空间上离散的位置。17.实施方案15所述的方法,其中所述第一固体支持物与所述第二固体支持物是物理上分离的。18.实施方案15所述的方法,其中所述第一报道子与所述第二报道子是相同的。19.实施方案15所述的方法,其中所述第一报道子与所述第二报道子是不同的。20.实施方案11所述的方法,其还包括对荧光的随时间变化进行归一化。21.实施方案1所述的方法,其还包括使所述样品和与所述靶核酸的第二链上的区域互补的第二靶特异性引物相接触。22.实施方案21所述的方法,其还包括进行多个聚合酶链反应循环。23.实施方案22所述的方法,其中所述多个聚合酶链反应循环在没有用于在循环之间除去自由漂浮荧光团的洗涤步骤的情况下进行。24.实施方案22所述的方法,其中检测来自所述固体支持物上所述报道子之信号的变化包括在进行所述多个聚合酶链反应循环之前和之后检测所述信号。25.实施方案22所述的方法,其中检测来自所述固体支持物上所述报道子之信号的变化包括仅在进行所述多个聚合酶链反应循环之后检测所述信号。26.实施方案25所述的方法,其还包括将所检测的来自所述固体支持物上所述报道子的信号与以下预定比例进行比较:所述固体支持物上所述报道子的信号与来自与固体支持物相连接的非杂交探针上报道子的参考信号的预定比例。27.实施方案22所述的方法,其还包括对所述样品中所述靶核酸的量进行定量。28.实施方案27所述的方法,其中对所述样品中所述核酸靶的量进行定量包括使用标准曲线。29.实施方案27所述的方法,其中对所述样品中所述核酸靶的量进行定量包括确定所述靶核酸的相对量。30.实施方案27所述的方法,其中对所述样品中所述核酸靶的量进行定量包括使用终点定量。31.实施方案27所述的方法,其中对所述样品中所述核酸靶的量进行定量包括通过将所述信号相对于背景可检测时的PCR循环数与存在的靶标的量相关联来确定所述核酸靶的量。32.实施方案1所述的方法,其还包括在切割所述杂交的靶特异性探针之前检测来自所述固体支持物上所述报道子的信号。33.实施方案1所述的方法,其还包括所述靶特异性探针与所述固体支持物之间的接头。34.一种用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的所述靶核酸第一链上第二区互补的靶特异性探针在适于所述靶核酸与所述第一靶特异性引物以及所述靶特异性探针杂交的条件下相接触,其中所述靶特异性探针包含在其5’或3’端的标签,还包含报道子;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针以从所述标签释放所述报道子;(c)使所述标签与固定在固体支持物上的互补性抗标签杂交;和(d)通过检测来自所述固体支持物上所述报道子之信号的降低来检测所述靶核酸。35.实施方案34所述的方法,其中所述第一靶特异性引物和所述靶特异性探针与所述靶核酸上的相邻序列杂交。36.实施方案34所述的方法,其中所述第一靶特异性引物和所述靶特异性探针与所述靶核酸上的非相邻序列杂交。37.实施方案34所述的方法,其还包括用所述具有外切酶活性的核酸聚合酶延伸所述第一靶特异性引物。38.实施方案34所述的方法,其还包括:在切割所述杂交的靶特异性探针以从所述标签释放所述报道子分子之前使所述靶特异性探针与固定在所述固体支持物上的抗标签杂交;和检测来自所述固体支持物上所述报道子的信号。39.实施方案34所述的方法,其中所述报道子是生物素或荧光团。40.实施方案34所述的方法,其中所述固体支持物是编码的珠。41.实施方案34所述的方法,其中所述靶核酸是第一靶核酸,所述报道子是第一报道子,所述标签是第一标签,所述固体支持物是第一固体支持物,并且所述方法还包括:(a)使所述样品和与第二靶核酸第一链上第一区互补的第二靶特异性引物以及与所述第一区下游的所述第二靶核酸第一链上第二区互补的第二靶特异性探针在适于所述第二靶核酸与所述第二靶特异性引物以及所述第二靶特异性探针杂交的条件下相接触,其中所述第二靶特异性探针包含在其5’或3’端的第二标签,还包含第二报道子;(b)用所述具有外切核酸酶活性的核酸聚合酶切割第二杂交的靶特异性探针以从所述第二标签释放所述第二报道子;(c)使所述第二标签与固定在第二固体支持物上的互补性第二抗标签杂交;和(c)通过检测来自所述第二固体支持物上所述第二报道子之信号的降低来检测所述第二靶核酸。42.实施方案41所述的方法,其中所述第一固体支持物和所述第二固体支持物是一个固体支持物上的空间上离散的位置。43.实施方案41所述的方法,其中所述第一固体支持物与所述第二固体支持物是物理上分离的。44.实施方案41所述的方法,其中所述第一报道子与所述第二报道子是相同的。45.实施方案41所述的方法,其中所述第一报道子与所述第二报道子是不同的。46.实施方案34所述的方法,其还包括使所述样品和与所述靶核酸的第二链上的区域互补的第二靶特异性引物相接触。47.实施方案46所述的方法,其还包括进行多个聚合酶链反应循环。48.实施方案47所述的方法,其中所述多个聚合酶链反应循环在没有用于在循环之间除去自由漂浮荧光团的洗涤步骤的情况下进行。49.实施方案47所述的方法,其中检测来自所述固体支持物上所述报道子之信号的降低包括在进行所述多个聚合酶链反应循环之前和之后检测所述信号。50实施方案47所述的方法,其中检测来自所述固体支持物上所述报道子之信号的降低包括仅在进行所述多个聚合酶链反应循环之后检测所述信号。51实施方案47所述的方法,其还包括对所述样品中所述靶核酸的量进行定量。52.实施方案51所述的方法,其中对所述样品中所述核酸靶的量进行定量包括使用标准曲线。53.实施方案51所述的方法,其中对所述样品中所述核酸靶的量进行定量包括使用终点定量。54.实施方案51所述的方法,其中对所述样品中所述核酸靶的量进行定量包括通过将所述信号相对于背景可检测时的PCR循环数与存在的靶标的量相关联来确定所述核酸靶的量。55.实施方案51所述的方法,其中对所述样品中所述靶核酸的量进行定量包括确定所述靶核酸的相对量。56.实施方案34所述的方法,其还包括所述抗标签与所述固体支持物之间的接头。57.一种用于在样品中检测靶核酸的方法,其包括:(a)使样品和与靶核酸第一链上第一区互补的第一靶特异性引物以及与所述第一区下游的所述靶核酸第一链上第二区互补的靶特异性探针在适于所述靶核酸与所述第一靶特异性引物以及所述靶特异性探针杂交的条件下相接触,其中所述靶特异性探针包含与在其5’或3’端的标签序列相连接的荧光团和在所述荧光团和所述标签序列相反端的生物素;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针,从而将所述荧光团与所述生物素分离;(c)从所述样品中除去所述生物素;和(d)通过检测来自所述荧光团的信号来检测所述靶核酸。58.实施方案57所述的方法,其中所述靶特异性引物和所述靶特异性探针与所述靶核酸上的相邻序列杂交。59.实施方案57所述的方法,其中所述靶特异性引物和所述靶特异性探针与所述靶核酸上的非相邻序列杂交。60.实施方案57所述的方法,其还包括用所述具有外切酶活性的核酸聚合酶延伸所述靶特异性引物。61.实施方案57所述的方法,其中从所述样品中除去生物素包括使所述样品与亲和素包被的磁珠相接触以结合生物素,并除去与生物素结合的所述亲和素包被的磁珠。62.实施方案57所述的方法,其还包括使所述样品和与所述靶核酸的第二链上的区域互补的第二靶特异性引物相接触。63.实施方案62所述的方法,其还包括在从所述样品中除去生物素之前进行多个聚合酶链反应循环。64.一种用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对、以及靶特异性探针的存在下扩增靶核酸,所述靶特异性引物对包含与所述靶核酸第一链上第一区互补的第一引物和与所述靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的所述靶核酸第一链上第二区互补,其中所述靶特异性探针包含报道子并且与固体支持物相连接,并且其中所述核酸聚合酶在所述第一引物沿着所述靶核酸的所述第一链延伸时切割所述靶特异性探针并且从所述固体支持物释放所述报道子;(c)在第一时间检测来自所述固体支持物上所述报道子的第一信号和在第二时间检测来自所述固体支持物上所述报道子的第二信号;和(d)将信号的变化与所述样品中所述靶核酸的量相关联。65.实施方案64所述的方法,其中对所述样品中所述靶核酸的量进行定量包括使用标准曲线。66.实施方案64所述的方法,其中对所述样品中所述靶核酸的量进行定量包括确定所述靶核酸的相对量。67.实施方案64所述的方法,其还包括至少在第三时间检测来自所述固体支持物上所述报道子的第三信号。68.实施方案64所述的方法,其包括在用所述具有外切核酸酶活性的核酸聚合酶延伸所述靶特异性引物以切割杂交的靶特异性探针并且从所述固体支持物释放所述报道子之前检测来自所述固体支持物上所述报道子的信号。69.实施方案64所述的方法,其中所述固体支持物是编码的珠。70.实施方案64所述的方法,其包括对所述样品中的多种不同靶核酸的量进行定量。71.实施方案64所述的方法,其中所述报道子是荧光团。72.实施方案71所述的方法,其中所述荧光团连接在所述靶特异性探针的5’端。73.实施方案71所述的方法,其中所述信号的变化是荧光信号的降低。74.实施方案64所述的方法,其中所述报道子是荧光团-淬灭剂对。75.实施方案74所述的方法,其中所述信号的变化是荧光信号的增强。76.一种用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对、以及靶特异性探针的存在下在适于靶核酸与所述靶特异性引物以及所述靶特异性探针杂交的条件下扩增所述靶核酸,所述靶特异性引物对包含与所述靶核酸第一链上第一区互补的第一引物和与所述靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的所述靶核酸第一链上第二区互补,其中所述靶特异性探针包含在其5’或3’端的标签,还包含报道子,并且其中所述核酸聚合酶在所述第一引物沿着所述靶核酸的所述第一链延伸时切割所述靶特异性探针并且从所述固体支持物释放所述报道子;(b)在第一时间检测来自所述固体支持物上所述报道子的第一信号和在第二时间检测来自所述固体支持物上所述报道子的第二信号;和(c)将信号的变化与所述样品中所述靶核酸的量相关联。77.实施方案76所述的方法,其中对所述样品中所述靶核酸的量进行定量包括使用标准曲线。78.实施方案76所述的方法,其中对所述样品中所述靶核酸的量进行定量包括确定所述靶核酸的相对量。79.实施方案76所述的方法,其还包括至少在第三时间检测来自所述固体支持物上所述报道子的第三信号。80.实施方案76所述的方法,其包括在用所述具有外切核酸酶活性的核酸聚合酶延伸所述第一引物以切割杂交的靶特异性探针并且从所述固体支持物释放所述报道子之前检测来自所述固体支持物上所述报道子的信号。81.实施方案76所述的方法,其中所述固体支持物是编码的珠。82.实施方案76所述的方法,其包括对所述样品中的多种不同靶核酸的量进行定量。83.实施方案76所述的方法,其中所述报道子是荧光团。84.实施方案83所述的方法,其中所述荧光团连接在所述靶特异性探针的5’端。85.实施方案83所述的方法,其中所述信号的变化是荧光信号的降低。86.实施方案76所述的方法,其中所述报道子是荧光团-淬灭剂对。87.实施方案86所述的方法,其中所述信号的变化是荧光信号的增强。88.一种用于对样品中靶核酸的量进行定量的方法,其包括:(a)在具有外切核酸酶活性的核酸聚合酶、靶特异性引物对、以及靶特异性探针的存在下在适于靶核酸与所述靶特异性引物对以及所述靶特异性探针杂交的条件下扩增所述靶核酸,所述靶特异性引物对包含与所述靶核酸第一链上第一区互补的第一引物和与所述靶核酸第二链上的区域互补的第二引物,所述靶特异性探针与所述第一区下游的所述靶核酸第一链上第二区互补,其中所述靶特异性探针包含在其5’或3’端的标签和荧光团,以及在所述标签和所述荧光团的相反端的生物素,并且其中所述核酸聚合酶在所述靶特异性引物沿着所述靶核酸延伸时切割杂交的靶特异性探针,从而将所述荧光团与所述生物素分离;(b)从所述样品中除去生物素;(c)使所述标签序列与固体支持物上的互补性抗标签序列杂交;(d)检测来自所述固体支持物上所述荧光团的荧光信号;和(e)将所述荧光信号与所述样品中核酸的量相关联。89.实施方案88所述的方法,其中对所述样品中所述靶核酸的量进行定量包括使用标准曲线。90.实施方案88所述的方法,其中对所述样品中所述靶核酸的量进行定量包括确定所述靶核酸的相对量。91.实施方案88所述的方法,其包括对所述样品中多种不同靶核酸的量进行定量。92.一种组合物,其包含:(a)至少两个不同的引物-探针组,其中每个引物-探针组包含:(i)与靶核酸第一链上第一区互补的第一引物;(ii)与所述靶核酸第二链上的区域互补的第二引物;和(iii)与可区分地编码的颗粒共价连接的经标记靶特异性探针,其中所述经标记靶特异性探针能够特异性地与所述靶核酸所述第一链上的第二区杂交,其中所述第二区在所述第一区的下游。93.实施方案92所述的组合物,其还包含具有5’外切核酸酶活性的聚合酶。94.实施方案92所述的组合物,其还包含与可区分地编码的颗粒共价连接的被动参考探针。95.实施方案92所述的组合物,其包含至少八个不同的引物-探针组。96.一种试剂盒,其包含:(a)至少两个不同的引物-探针组,其中每个引物-探针组包含:(i)与靶核酸第一链上第一区互补的第一引物;(ii)与所述靶核酸第二链上的区域互补的第二引物;和(iii)与可区分地编码的颗粒共价连接的经标记靶特异性探针,其中所述经标记靶特异性探针能够特异性地与所述靶核酸所述第一链上的第二区杂交,其中所述第二区在所述第一区的下游。97.实施方案96所述的试剂盒,其还包含具有外切核酸酶活性的聚合酶。98.实施方案96所述的试剂盒,其还包含与可区分地编码的颗粒共价连接的被动参考探针。99.实施方案96所述的试剂盒,其包含至少八个不同的引物-探针组。100.一种用于在样品中检测多种靶核酸之存在或不存在的多重性方法,其包括:(a)使样品与多种引物/探针对以及靶特异性探针在适于靶核酸与第一靶特异性引物以及靶特异性探针杂交的条件下相接触,每种引物/探针对包含与所述多种靶核酸之一的第一链上第一区互补的靶特异性引物,所述靶特异性探针与所述第一区下游的所述多种靶核酸之一的第一链上第二区互补,其中所述靶特异性探针包含报道子并且与固体支持物相连接;(b)用具有外切核酸酶活性的核酸聚合酶切割杂交的靶特异性探针以从所述固体支持物释放所述报道子;和(c)检测来自所述固体支持物上所述报道子的信号,从而所述信号的变化表明靶核酸的存在。101.实施方案100所述的方法,其中所述固体支持物是编码的珠。102.实施方案100所述的方法,其中所述报道子是荧光团。103.实施方案102所述的方法,其中所述信号的变化是荧光信号的降低。104.实施方案3所述的方法,其中所述报道子是荧光团-淬灭剂对。105.实施方案104所述的方法,其中所述信号的变化是荧光信号的增强。106.实施方案100所述的方法,其中所述多种引物/探针对的每种不同靶特异性探针与一个固体上的空间上离散的位置相连接。107.实施方案100所述的方法,其中所述多种引物/探针对的每种不同靶特异性探针与不同的固体支持物相连接。108.实施方案100所述的方法,其还包括检测来自与固体支持物相连接的非杂交探针上报道子的参考信号。109.实施方案108所述的方法,其中所述非杂交探针连接至与所述靶特异性探针相连接的同一固体支持物上的空间上离散的位置。110.实施方案108所述的方法,其中所述非杂交探针连接至与所述靶特异性探针相连接的固体支持物不同的固体支持物。111.实施方案100所述的方法,其中所述多种引物/探针对的每种不同靶特异性探针包含相同的报道子。112.实施方案100所述的方法,其中所述多种引物/探针对的每种不同靶特异性探针包含不同的报道子。113.实施方案100所述的方法,其还包括使所述样品和与所述多种靶核酸的第二链上的区域互补的多种不同第二靶特异性引物相接触,和进行多个聚合酶链反应循环。114.实施方案113所述的方法,其中所述多个聚合酶链反应循环在没有用于在循环之间除去自由漂浮报道子的洗涤步骤的情况下进行。115.实施方案113所述的方法,其中检测来自所述固体支持物上所述报道子之信号的变化包括在进行所述多个聚合酶链反应循环之前和之后检测所述信号。116.实施方案113所述的方法,其中检测来自所述固体支持物上所述报道子之信号的变化包括仅在进行所述多个聚合酶链反应循环之后检测所述信号。117.实施方案113所述的方法,其还包括将所检测的来自所述固体支持物上所述报道子的信号与以下预定比例进行比较:所述固体支持物上所述报道子的信号与来自与固体支持物相连接的非杂交探针上报道子的参考信号的预定比例。118.实施方案113所述的方法,其还包括对所述样品中所述靶核酸的量进行定量。参考文献以下参考文献在提供示例性方法或补充本文所给出细节的其他细节的程度上具体地通过引用并入本文。美国专利4,284,412美国专利4,498,766美国专利4,661,913美国专利4,714,682美国专利4,767,206美国专利4,774,189美国专利4,857,451美国专利4,942,124美国专利4,989,977美国专利5,160,974美国专利5,210,015美国专利5,478,722美国专利5,487,972美国专利5,538,848美国专利5,654,413美国专利5,656,493美国专利5,716,784美国专利5,736,330美国专利5,736,330美国专利5,736,330美国专利5,837,832美国专利5,837,860美国专利5,981,180美国专利5,981,180美国专利5,981,180美国专利5,981,180美国专利5,981,180美国专利5,994,056美国专利6,030,787美国专利6,046,807美国专利6,057,107美国专利6,057,107美国专利6,103,463美国专利6,139,800美国专利6,174,670美国专利6,174,670美国专利6,268,222美国专利6,322,971,美国专利6,366,354美国专利6,411,904美国专利6,449,562美国专利6,449,562美国专利6,514,295美国专利6,524,793美国专利6,524,793美国专利6,528,165美国专利6,592,822美国专利6,939,720美国专利7,205,105美国专利7,226,737美国专利7,226,737美国专利7,645,868美国专利7,955,802美国公开2005/0191625美国公开2009/0148849PCT申请WO93/17126PCT申请WO97/31256Fodor等,Science,251:767-773,1991.Holmstrom等,Anal.Biochem.209:278-283,1993.Mueller等,CurrentProtocolsinMol.Biol.;15:5,:1993.Newton等,Nucl.AcidsRes.21:1155-1162,1993.Pease等,Proc.Natl.Acad.Sci.USA,91:5022-5026,1994.Rasmussen等,Anal.Biochem,198:138-142,1991.Running等,BioTechniques8:276-277,1990.Santalucia等,Biochemistry;38:3468-3477,1999.序列表<110>SCHRADER,BRIANWHITMAN,DOUGLASF<120>水解探针<130>LUMN.P0105WO<140>未知<141>2012-09-28<150>61/540,868<151>2011-09-29<160>4<170>PatentInversion3.5<210>1<211>27<212>DNA<213>人工序列<220><223>合成的引物<220><221>5AmMC12<222>(1)..(1)<220><221>3Cy3Sp<222>(27)..(27)<400>1cagctgttcgtaataatggcggtggtc27<210>2<211>24<212>DNA<213>人工序列<220><223>合成的引物<220><221>5AmMC12<222>(1)..(1)<220><221>3Cy3Sp<222>(24)..(24)<400>2gattgtaagatttgataaagtgta24<210>3<211>21<212>DNA<213>人工序列<220><223>合成的引物<400>3tcagcagttgaagggacagat21<210>4<211>22<212>DNA<213>人工序列<220><223>合成的引物<400>4ccagaacaatgaatggttaagg22当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种鸭细小病毒Taqman探针荧光定量PCR检测试剂盒的制作方法
- 用于检测IFITM3-rs12252基因多态性的Taqman荧光定量RT-PCR引物和探针的制作方法
- 一种快速鉴别金钱白花蛇的TaqMan探针引物混合物、试剂盒和荧光定量PCR检测方法
- 利用Taqman MGB探针检测绵羊FecB基因多态性的方法
- 菲利普孢囊线虫Taqman MGB探针实时荧光定量PCR检测方法及其应用
- 采用Taqman探针法鉴定小麦黑穗菌(Tilletia controversa Kühn)的方法及试剂盒的制作方法
- 一种转基因大豆mon89788的恒温探针法检测引物组、检测试剂盒及检测方法
- 转基因苜蓿草J101品系Taqman实时荧光定量PCR检测用引物和探针及检测方法
- 一种基于位图追踪法的双探针自动测试平台的制作方法
- 一种pcr法检测人ercc1基因表达水平的试剂盒的制作方法