观察肿瘤细胞外泌体与外泌体内部miRNA在受体细胞内动态分布的方法与流程
本发明涉及生物光子学领域,具体涉及一种观察肿瘤细胞外泌与外泌体内部miRNA在受体细胞内动态分布的方法。
背景技术:
外泌体是由细胞分泌出的囊泡中的一类,其尺寸约30-100nm。这种有趣的纳米级囊泡外层为脂质膜,其上表达有特定的信号分子,而其内部包含了蛋白质、RNA等生物分子。外泌体在细胞间通讯和物质交换中扮演了十分重要的角色。已有的研究表明,外泌体与受体细胞之间的相互作用主要分为三种:1)外泌体通过受体细胞表面的外泌体粘附分子结合到受体细胞表面;2)外泌体直接与受体细胞发生融合;3)外泌体通过受体接到的胞吞作用进入受体细胞。肿瘤细胞外泌体与肿瘤的发展关系密切相关,一方面外泌体能改造肿瘤微环境,使其更加适合肿瘤的生长;另一方面,肿瘤细胞外泌体又具有“感染”受体细胞的可能。这使得外泌体成为一种重要的肿瘤标志物以及潜在的药物治疗靶点。但肿瘤细胞外泌体在癌症的发展过程中扮演的实际角色尚不清楚。因此,目前仍需要研究肿瘤细胞外泌体与受体细胞的相互作用过程,从而深入解析外泌体介导的癌症转移机制,为癌症治疗方案的确定提供有用的参考信息。
然而,外泌体30-100nm的尺寸极大地增加了对其进行观测的难度,目前用于观测外泌体的方法有纳米颗粒跟踪分析技术(NTA)、共聚焦显微术(CLSM)、电子显微术(TEM、SEM)、流式细胞术(FCM)等,其中,隶属光学显微术的CLSM由于其无损、直观、并能实时跟踪观测活细胞样品等特点而获得了较为广泛的应用,但光学显微镜的分辨率受到衍射极限的限制,通常只能达到200-300nm,这使得CLSM等光学显微镜无法对外泌体进行细致的观测。近年来,科学家们针对光学显微镜的分辨率极限,开发出了几类能够突破衍射极限的超分辨光学显微镜。例如受激发射损耗显微镜(STED)、结构光照明显微镜(SIM)、随机光学重建显微镜(STORM)以及光活化定位显微镜(PALM)等。其中,以STORM/PALM技术能达到的分辨率最为突出,它们的成像原理相似,都基于单分子定位显微技术。目前,蔡司、尼康等显微镜厂商已经推出了基于PALM/STORM技术的50-80nm分辨率的超分辨显微系统。
技术实现要素:
在上述背景下,本发明提出采用基于单分子定位法的超分辨光学成像技术观察肿瘤细胞外泌体与外泌体内部miRNA在受体细胞内的动态分布,解决了现有技术中由于衍射极限限制无法细致观测外泌体的问题,为研究外泌体介导的癌症转移机制以及癌症转移扩散治疗研究提供了新的技术手段。
为解决上述问题,本发明采用以下技术方案,一种观察肿瘤细胞外泌体与外泌体内部miRNA在受体细胞内动态分布的方法,包括如下步骤:
1)提取肿瘤细胞外泌体后,使用外泌体膜染色剂和与外泌体内部miRNA互补的分子信标分别对肿瘤细胞外泌体膜及其外泌体内部miRNA进行荧光标记,同时使用细胞膜染色剂染色受体细胞;
2)将经步骤1)荧光标记好的肿瘤细胞外泌体与染色好的受体细胞共同培养,使肿瘤细胞外泌体与受体细胞发生相互作用;
3)肿瘤细胞外泌体与受体细胞发生相互作用后,加入单分子定位成像所需的成像缓冲液,利用超分辨光学显微镜实现活细胞内外泌体及其内部miRNA的动态示踪。
其中,利用超分辨光学显微镜进行活细胞超分辨成像时,受体细胞膜通过全内反射(TIRF)显微成像,外泌体膜与外泌体内部miRNA通过超分辨光学显微技术成像,该超分辨光学显微成像方法是基于单分子定位技术,分辨率提高至50-80nm,可细致地观测到外泌体及其内部miRNA在受体细胞内的动态分布。
在进行荧光分子标记时,外泌体膜染色剂、分子信标上修饰的荧光分子和细胞膜染色剂的荧光发射光谱不能有显著重叠,即荧光发射峰之间彼此间隔30nm以上。
为了适应单分子定位超分辨光学成像,所述的分子信标上修饰的荧光分子和外泌体膜染色剂均是具有荧光闪烁(blink)效应的;优选地,所述的外泌体膜染色剂为亲脂性荧光染料,进一步优选为DiI或PKH26;所述的分子信标上修饰的荧光分子为Alexa Fluor 647或Cy5。另外,在进行肿瘤细胞外泌体荧光标记时, 所要标记的miRNA在肿瘤细胞分泌的外泌体内含量远高于正常细胞分泌的外泌体的miRNA。
优选地,所述的细胞膜染色剂为PKH67或DiO。
其中,优选地,所述的提取肿瘤细胞外泌体的具体方法是向细胞培养液上清中加入外泌体提取液,于3-4℃反应12-24h后,离心得到的外泌体沉淀分散在100-150μLPBS中配成外泌体溶液,其中所加入外泌体提取液与细胞培养液上清与体积比为1:5。
荧光标记肿瘤细胞外泌体具体包括如下步骤:
第一步:在提取出的外泌体溶液中加入与外泌体内部miRNA互补的分子信标,进行杂交反应,分子信标在外泌体溶液中浓度为5-20nM;
第二步:在提取出的外泌体溶液中加入外泌体膜染色剂标记外泌体膜,外泌体膜染色剂在外泌体溶液中浓度为1-5nM;
第三步:使用超滤管滤除多余的外泌体膜染料以及分子信标探针。
优选地,所述的成像缓冲液为加入有27mM ß-巯基乙醇,1wt%葡萄糖,0.1mg/mL的葡萄糖氧化酶和8μg/mL的过氧化氢酶的DMEM培养基,可实现外泌体及其内部miRNA的在活细胞内长达1h以上的动态观测。
有益效果:
1、本发明实现了外泌体以及外泌体内部miRNA的超分辨率光学成像,可进行更加精确的定位,更细致地观测到外泌体及其内部miRNA。
2 本发明采用低毒性的成像缓冲液,可以实现外泌体及其内部miRNA在活细胞内的动态观测。
3、本发明采用具有荧光闪烁效应的染料分子作为荧光探针,这类探针量子产率高、亮态占空比小、开关次数多、光稳定性好且标记密度高,有利于提高单分子定位成像的分辨率。
4、本发明利用分子信标标记肿瘤细胞外泌体内部的miRNA,灵敏度高,荧光背景低。
附图说明
图1为对外泌体中的miRNA进行宽场和单分子定位成像的结果。(a)普通宽场显微镜所成的单个外泌体内miRNA的图像;(b)单分子定位显微镜所成的单个外泌体内miRNA的图像;(c)该外泌体沿径向的荧光强度分布,从荧光强度分布曲线上可以看出单分子定位显微镜中观察到的外泌体尺寸明显小于普通宽场显微镜。
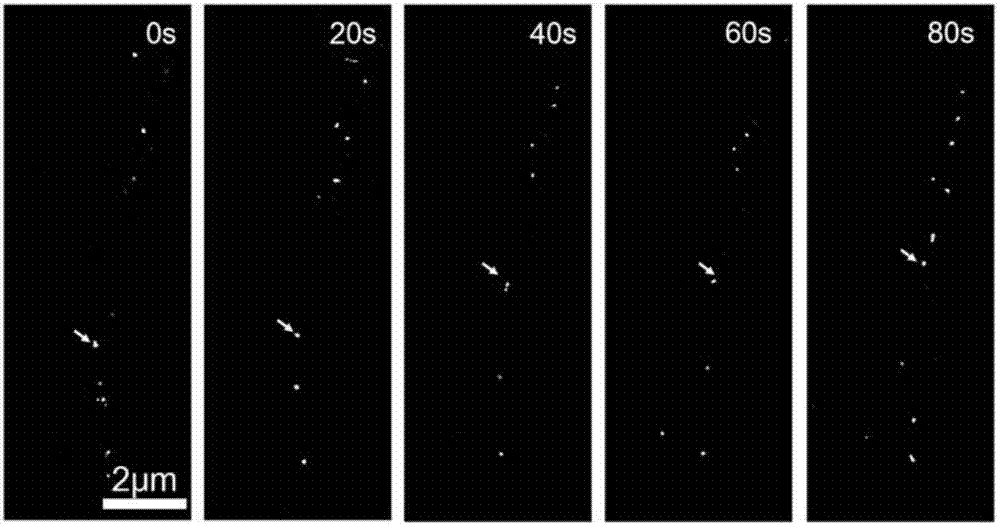
图2为对受体细胞中的外泌体进行动态超分辨光学成像跟踪图;该图中显示的白色点为不同外泌体,其中,箭头所指的外泌体为同一个外泌体,随时间运动到其他的位置。
图3为对受体细胞中外泌体内部的mir-21进行动态超分辨光学成像跟踪图,该图中显示的白色点为不同mir-21,其中,箭头所指的mir-21为同一mir-21,随时间运动到其他的位置。
具体实施方式
为了加深对本发明的理解,下面将结合实施例对本发明作进一步详述,该实施例仅用于解释本发明,并不构成对本发明保护范围的限定。
实施例1
该实施例中涉及的PBS缓冲液为pH=7.4,浓度为10mM的PBS缓冲液;涉及的受体细胞膜染料为PKH67,其反应溶液为sigma公司提供的Diluent C溶液;涉及的单分子定位超分辨光学成像技术为PALM技术,涉及的低毒性成像缓冲液为DMEM培养基,其中配有27mM的ß-巯基乙醇,1wt%葡萄糖,0.1mg/mL的葡萄糖氧化酶和8μg/mL的过氧化氢酶;涉及的肿瘤细胞外泌体为HeLa细胞外泌体,受体细胞为PC12细胞;涉及的肿瘤细胞外泌体内部miRNA为mir-21,其序列为3’AGUUGUAGUCAGACUAUUCGAU 5’,采用的分子信标MB21序列为5’Cy5-CTCTTTCAACATCAGTCTGATAAGCTAAAGAG-BHQ3 3’,其中Cy5为荧光分子,BHQ3为淬灭基团。涉及的外泌体膜染料为DiI;涉及的外泌体提取液为SBI公司的ExoQuick-TC Exosomes Preciptation Solution外泌体试剂盒中配有的泌体提取液。
步骤一、提取肿瘤细胞外泌体
取5mL的1×106个对数生长期的HeLa细胞的条件培养液,以3000×g离心15分钟,取上清去除悬浮液中的细胞。采用SBI公司提供的ExoQuick-TC Exosomes Preciptation Solution外泌体试剂盒提取,向细胞悬浮液上清中加入1mL外泌体提取液于4oC反应过夜。将混合溶液在10000×g转速下离心20分钟,取沉淀重悬在100μL的PBS缓冲液中于-75oC冻存。
步骤二、外泌体及其内部miRNA荧光标记
取5μL外泌体冻存液溶解后稀释在400μL的PBS溶液中,加入5μL的10μM的MB21,37oC摇床杂交反应2小时后,加入1μL的1μM的DiI溶液,继续反应15分钟。将反应溶液于50KDa超滤管6000rmp超滤提纯20分钟,去除多余的分子信标MB21以及DiI。沉淀稀释在400μL的PBS溶液中,于4oC保存待用。
步骤三、受体细胞染色
取0.2μL的PKH67溶液稀释在50μL的反应液中作为细胞膜染色剂,受体细胞PC12培养48小时后,吸去多余培养液,用PBS轻轻冲洗三次后,加入100μL PKH67反应缓冲液。将配好的细胞膜染色剂加入细胞皿中,轻轻摇晃使其分布均匀,将细胞皿继续放入培养箱中反应4分钟后取出,去除多余的染色剂,加入200μL的1%的BSA用于终止PKH67染色,5分钟后除去多余BSA加入新鲜培养液。
步骤四、肿瘤外泌体与正常细胞共培养并成像
向正常细胞中均匀滴入50μL标记过的外泌体溶液,随后将细胞皿继续放入细胞培养液中待其共培养30分钟后取出,吸去多余培养液,用PBS轻轻冲洗三次后,加入200μL 低毒性的PALM成像缓冲液后,通过超分辨光学显微镜(Zeiss Elyra P.1)可分别对外泌体以及外泌体内部mir-21进行PALM成像,采用50Hz的帧速率采集10000帧图片,其中每200帧重建一张超分辨图片,最终实现时间分辨率为4s的动态观测。观察外泌体时,激发波长为543nm,滤光片为560-590nm带通滤光片,观测到外泌体在受体细胞中的动态超分辨光学成像跟踪图如图2所示;观察mir-21时,激发波长为642nm,滤光片为655nm长通滤光片,观测到外泌体内部的mir-21在受体细胞中动态超分辨光学成像跟踪图如图3所示。
实施例2
该实施例中涉及的PBS缓冲液为pH=7.4,浓度为10mM的PBS缓冲液;涉及的受体细胞膜染料为DiO;涉及的单分子定位超分辨光学成像技术为PALM技术,涉及的低毒性成像缓冲液为DMEM培养基,其中配有27mM的ß-巯基乙醇,1wt%葡萄糖,0.1mg/mL的葡萄糖氧化酶和8μg/mL的过氧化氢酶;涉及的肿瘤细胞外泌体为HeLa细胞外泌体,受体细胞为PC12细胞;涉及的肿瘤细胞外泌体内部miRNA为mir-21,其序列为3’AGUUGUAGUCAGACUAUUCGAU 5’,采用的分子信标MB21序列为5’Alexa Fluor 647-CTCTTTCAACATCAGTCTGATAAGCTAAAGAG-BHQ3 3’,其中Alexa Fluor 647为荧光分子,BHQ3为淬灭基团。涉及的外泌体膜染料为PKH26;涉及的外泌体提取液为SBI公司的ExoQuick-TC Exosomes Preciptation Solution外泌体试剂盒中配有的泌体提取液。
步骤一、提取肿瘤细胞外泌体
取5mL的1×106个对数生长期的HeLa细胞的条件培养液,以3000×g离心15分钟,取上清去除悬浮液中的细胞。采用SBI公司提供的ExoQuick-TC Exosomes Preciptation Solution外泌体试剂盒提取,向细胞悬浮液上清中加入1mL外泌体提取液于4oC反应过夜。将混合溶液在10000×g转速下离心20分钟,取沉淀重悬在150μL的PBS缓冲液中于-75oC冻存。
步骤二、外泌体及其内部miRNA荧光标记
取5μL外泌体冻存液溶解后稀释在400μL的PBS溶液中,加入5μL的10μM的MB21,37oC摇床杂交反应2小时后,加入0.5μL的3μM的PKH26溶液,继续反应10分钟。将反应溶液于50KDa超滤管6000rmp超滤提纯20分钟,去除多余的分子信标MB21以及PKH26。沉淀稀释在400μL的PBS溶液中,于4oC保存待用。
步骤三、受体细胞染色
取0.2μL的DiO溶液稀释在500μL的PBS中作为细胞膜染色剂。受体细胞PC12培养48小时后,吸去多余培养液,用PBS轻轻冲洗三次后,加入100μL稀释好的 DiO,轻轻摇晃使其分布均匀。将细胞皿继续放入培养箱中反应4分钟后取出,去除多余的染色剂并加入新鲜培养液。
步骤四、肿瘤外泌体与正常细胞共培养并成像
向正常细胞中均匀滴入50μL标记过的外泌体溶液,随后将细胞皿继续放入细胞培养液中待其共培养30分钟后取出,吸去多余培养液,用PBS轻轻冲洗三次后,加入200μL 低毒性的PALM成像缓冲液后,通过超分辨光学显微镜(Zeiss Elyra P.1)可分别对外泌体以及外泌体内部mir-21进行PALM成像。采用50Hz的帧速率采集10000帧图片,其中每200帧重建一张超分辨图片,最终实现时间分辨率为4s的动态观测。观察外泌体时,激发波长为543nm,滤光片为560-590nm带通滤光片,观测到外泌体在受体细胞中的动态超分辨光学成像跟踪图如图2所示;观察mir-21时,激发波长为642nm,滤光片为655nm长通滤光片。观察mir-21时,激发波长为642nm,滤光片为655nm长通滤光片,观测到外泌体内部的mir-21在受体细胞中动态超分辨光学成像跟踪图如图3所示。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!