一种狄尔斯-阿尔德型化合物及其制备方法和应用与流程
本发明涉及药物领域,具体涉及一种狄尔斯-阿尔德型化合物及其制备方法和应用。
背景技术:
狄尔斯-阿尔德(diels–alder)型化合物,是桑属植物特有的化学成分,在结构上是由查耳酮或查耳酮衍生物的α,β双键与含有异戊二烯基的化合物发生[4+2]加成反应后形成的甲基环己烯衍生物,有些化合物还发生进一步的反应,如双键位移、氧化、环化、缩合等,因而形成结构更复杂的狄尔斯-阿尔德型化合物。这类结构活性报道很少,主要集中在抗氧化,抗炎活性。
α-葡萄糖苷酶(α-glucosidase)又叫α-d-葡萄糖苷水解酶。它可以从低聚糖类底物的非还原末端切开α-1,4糖苷键,释放出葡萄糖,或将游离出的葡萄糖残基转移到另一糖类底物形成α-1,6糖苷键,从而得到非发酵性的低聚异麦芽糖或糖酯、糖肽等。具体过程为:食物中的多糖,如淀粉经口腔唾液、胰淀粉酶消化成含少数葡萄糖分子的低聚糖,α-葡萄糖苷酶便在这些低聚糖的非还原末端切开α-1,4糖苷键,释放出葡萄糖,葡萄糖被小肠上皮吸收后进入血液循环,就成为血糖。其在食物吸收过程中起着重要的作用,必须与之结合后,食物才能消化和吸收。
目前,α-葡萄糖苷酶抑制剂已经被广泛用来降低餐后高血糖,临床上应用的该类药物主要有阿卡波糖、伏格列波糖和米格列醇,经临床应用,均取得了较好的疗效,被认为是2型糖尿病的首选药和1型糖尿病的胰岛素治疗的辅助药物,具有广阔的应用前景。这类α-葡萄糖苷酶抑制剂分子中均含有多个糖单元体,合成步骤较复杂,且服用这三类药后,经常会出现腹部不适、胀气、排气等不良反应。
因此,本领域迫切需要开发一种副作用小、高效的新型α-葡萄糖苷酶抑制剂。
技术实现要素:
本发明提供了一种不同于现有技术的狄尔斯-阿尔德型化合物及其制备方法和应用。本发明的狄尔斯-阿尔德型化合物是从多种桑属植物中均能提取得到,且呈现出对α-葡萄糖苷酶抑制活性高、来源多样化和获取方便等优点。
本发明提供了一种如式i所示的狄尔斯-阿尔德型化合物或其药学上可接受的盐或酯:
其中,r为r1或r2;
当r为r1时为化合物i-1;当r为r1时为化合物i-2。
本发明还提供了一种如式i所示的狄尔斯-阿尔德型化合物的制备方法,包括以下步骤:
步骤1:桑属植物为原料,用醇溶液提取得浸膏,将浸膏用纯水分散,用有机溶剂萃取后,即得粗提取物;
步骤2:将步骤(1)所得粗提物经柱层析进行分离,进一步纯化即得式i所示的狄尔斯-阿尔德型化合物;
其中,化合物i中,r为r1时的化合物(即化合物i-1),以及化合物i中,r为r2时的化合物(即化合物i-2)的检测参数如下:
高效液相色谱条件:c18键合硅胶柱,检测波长254nm,流速2.5ml/min,流动相为体积含量为55%的乙腈水溶液,化合物i-1保留时间为tr=20.3min;流动相体积为含量为56%的乙腈水溶液,化合物i-2保留时间为tr=18.5min。
本领域技术人员根据上述检测参数,相应的选择和调整柱层析的条件,即可得到化合物i-1和化合物i-2,如采用高效液相法制备时,可采用上述检测参数中的高效液相分离条件,也可采用其他分离条件,只要获得的产物的检测参数与上述检测参数一致即可。
其中,步骤(1)中,所述的原料本领域均知,可为桑属植物的根、茎、叶、皮和果实中的一种或多种,较佳地为奶桑的茎皮;所述的醇溶液为乙醇水溶液,所述的乙醇水溶液的浓度较佳地为95%;所述的提取的操作和条件为本领域常规的提取的操作和条件,所述的提取次数较佳地进行3次;所述的每次提取时间较佳地为1.5小时;所述的提取使用的乙醇水溶液的体积与为桑属植物为原料的质量的比较佳地为10;所述将浸膏加纯水分散的过程中,所述纯水与所述浸膏的质量比为本领域常规的纯水与浸膏的质量比,本发明较佳地为4;所述的萃取的操作和条件为本领域常规的操作和条件;所述的有机溶剂为烷烃类溶剂、氯代烃类溶剂、酯类溶剂和醇类试剂中的一种或多种;所述的烷烃类溶剂较佳地为石油醚;所述的氯代烃类溶剂较佳地为二氯甲烷;所述的酯类溶剂较佳地为乙酸乙酯;所述的醇类溶剂较佳地为正丁醇;所述过滤的操作和条件为本领域常规的过滤的操作和条件;所述减压浓缩的操作和条件为本领域常规的浓缩的操作和条件,所述浓缩较佳地为减压浓缩。
其中,步骤(2)中,还进一步包括冻干,所述的冻干较佳地为减压冻干技术,所述的减压冻干技术为本领域常规的减压冻干技术;所述的进一步纯化较佳地为高效液相色谱纯化;所述的高效液相色谱纯化在检测波长254nm,流速2.5ml/min条件下进行分离纯化,流动相为体积含量为55%的乙腈水溶液,收集保留时间为tr=20.3min组分,得到化合物i-1;流动相体积为含量为56%的乙腈水溶液,收集保留时间为tr=18.5min的组分,得到化合物i-2;所述的柱层析分离依次为经过正向硅胶柱层析,凝胶柱层析和反相硅胶柱层析分离;所述的正向硅胶柱层析的洗脱液为二氯甲烷-甲醇,所述的洗脱液二氯甲烷与甲醇的体积比依次为95:5、80:20、70:30、60:40和50:50;所述的凝胶柱层析的洗脱液为二氯甲烷-甲醇,所述的洗脱液二氯甲烷与甲醇的体积比为1:1;所述的反相硅胶柱层析的洗脱液为甲醇-水,所述的洗脱液甲醇与水的体积比依次为55:45、65:35、75:25和85:15;所述的硅胶层析柱中,层析柱的规格可以参照本领域的常规进行选择,本发明柱内径×柱长较佳地为10cm×100cm;所述的硅胶层析柱中,硅胶的规格可以参照本领域的常规进行选择,较佳地为200~300目;所述的硅胶层析柱中,硅胶的质量与提取物粗品的质量比可参照本领域的常规进行选择,较佳地为10;所述的每个梯度洗脱液的用量与柱体积比可参照本领域常规进行选择,较佳地为3;所述的凝胶柱可参照本领域的常规进行选择;所述的反相硅胶柱可参照本领域的常规进行选择。
本发明还提供了一种式i所示的狄尔斯-阿尔德型化合物或其药学上可接受的盐或酯在制备α-葡萄糖苷酶抑制剂中的应用。
本发明还提供了一种如式i所示的狄尔斯-阿尔德型化合物或其药学上可接受的盐或酯在制备降血糖的药物中的应用。
本发明还提供了一种药物组合物,包括含治疗有效剂量的如式i所示的狄尔斯-阿尔德型化合物或其药学上可接受的盐或酯以及药学上可接受的载体。
较佳地,所述的药物组合物还进一步包含其它降血糖的活性成分以及药学上可接受的载体;其中,所述的其它降血糖的活性成分优选阿卡波糖、伏格列波糖或其组合。
在一优选例中,如式i所示的狄尔斯-阿尔德型化合物活性成分与其他降血糖的活性成分的质量比较佳地为1:100~100:1,更佳地为1:10~10:1。
在一优选例中,所述的如式i所示的狄尔斯-阿尔德型化合物或其药学可接受的盐或酯在药物组合物中的含量可为质量百分比0.1%~99.5%,较佳地为质量百分比10%~99.9%,更佳的为70%~99.9%。
在另一优选例中,所述的如式i所示的狄尔斯-阿尔德型化合物或其药学可接受的盐或酯在药物组合物中的含量可为质量百分比60.0%~99.5%,较佳地为质量百分比70%~99.5%,更佳的为80%~99.5%。
所述的“药学上可接受的载体”指的是:一种或多种相容性固体或液体填料或凝胶物质,它们适合于人使用,而且必须有足够的纯度和足够低的毒性。“相容性”在此指的是组合物中各组份能和本发明的化合物以及它们之间相互掺和,而不明显降低化合物的药效。药学上可以接受的载体部分例子有纤维素及其衍生物(如羧甲基纤维素钠、乙基纤维素钠、纤维素乙酸酯等)、明胶、滑石、固体润滑剂(如硬脂酸、硬脂酸镁)、硫酸钙、植物油(如豆油、芝麻油、花生油、橄榄油等)、多元醇(如丙二醇、甘油、甘露醇、山梨醇等)、乳化剂(如
本发明的药物组合物包含安全有效量范围内的狄尔斯-阿尔德型化合物或其药理上可接受的盐或酯及药理上可以接受的赋形剂或载体。其中“安全有效量”指的是:化合物的量足以明显改善病情,而不至于产生严重的副作用。通常,药物组合物含有狄尔斯-阿尔德型化合物或其药理上可接受的盐或酯1-2000mg/剂,较佳地,含有5-200mg/剂,更佳地,含有10-100mg/剂。所述的“一剂”较佳地为一个胶囊或药片。
本发明的药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服、直肠、肠胃外(静脉内、肌肉内或皮下)和局部给药,较佳地给药方式为口服给药。
所述的用于口服给药的固体剂型包括胶囊剂、片剂、丸剂、散剂和颗粒剂。在这些固体剂型中,活性化合物与至少一种常规惰性赋形剂或载体混合,如柠檬酸钠或磷酸二钙,或与下述成分混合:(a)填料或增容剂,例如,淀粉、乳糖、蔗糖、葡萄糖、甘露醇和硅酸;(b)粘合剂,例如,羟甲基纤维素、藻酸盐、明胶、聚乙烯基吡咯烷酮、蔗糖和阿拉伯胶;(c)保湿剂,例如,甘油;(d)崩解剂,例如,琼脂、碳酸钙、马铃薯淀粉或木薯淀粉、藻酸、某些复合硅酸盐、和碳酸钠;(e)缓溶剂,例如石蜡;(f)吸收加速剂,例如,季胺化合物;(g)润湿剂,例如鲸蜡醇和单硬脂酸甘油酯;(h)吸附剂,例如,高岭土;和(i)润滑剂,例如,滑石、硬脂酸钙、硬脂酸镁、固体聚乙二醇、十二烷基硫酸钠,或其混合物。胶囊剂、片剂和丸剂中,剂型也可包含缓冲剂。
固体剂型如片剂、糖丸、胶囊剂、丸剂和颗粒剂可采用包衣和壳材制备,如肠衣和其它本领域公知的材料。它们可包含不透明剂,并且,此种组合物中活性化合物或化合物的释放可以延迟的方式在消化道内的某一部分中释放。可采用的包埋组分的实例是聚合物质和蜡类物质。必要时,活性化合物也可与上述赋形剂中的一种或多种形成微胶囊形式。
所述的口服给药的液体剂型包括药学上可接受的乳液、溶液、悬浮液、糖浆或酊剂。除了活性化合物外,液体剂型可包含本领域中常规采用的惰性稀释剂,如水或其它溶剂,增溶剂和乳化剂,例知,乙醇、异丙醇、碳酸乙酯、乙酸乙酯、丙二醇、1,3-丁二醇、二甲基甲酰胺以及油,特别是棉籽油、花生油、玉米胚油、橄榄油、蓖麻油和芝麻油或这些物质的混合物等。
除了这些惰性稀释剂外,组合物也可包含助剂,如润湿剂、乳化剂和悬浮剂、甜味剂、矫味剂和香料。
除了活性化合物外,悬浮液可包含悬浮剂,例如,乙氧基化异十八烷醇、聚氧乙烯山梨醇、脱水山梨醇酯、微晶纤维素、甲醇铝和琼脂或其混合物等。
用于肠胃外注射的组合物可包含生理上可接受的无菌含水或无水溶液、分散液、悬浮液或乳液,和用于重新溶解成无菌的可注射溶液或分散液的无菌粉末。适宜的含水和非水载体、稀释剂、溶剂或赋形剂包括水、乙醇、多元醇及其适宜的混合物。
用于局部给药的剂型包括软膏剂、散剂、贴剂、喷射剂和吸入剂。活性成分在无菌条件下与生理上可接受的载体及任何防腐剂、缓冲剂,或必要时可能需要的推进剂一起混合。
所述的药物组合物可以单独给药,或者与其它药学上可接受的化合物联合给药,例如阿卡波糖。
使用药物组合物时,是将安全有效量的本发明化合物适用于需要治疗的哺乳动物(如人),其中施用时剂量为药学上认为的有效给药剂量,对于60kg体重的人而言,日给药剂量通常为1~2000mg,优选5~500mg,更优选为10~100mg。当然,具体剂量还应考虑给药途径、病人健康状况等因素,这些都是熟练医师技能范围之内的。
一种筛选降血糖的候选药物的方法,包括以下步骤:
步骤1:提供待测化合物以及阳性对照化合物,所述的阳性对照化合物为式i所示的狄尔斯-阿尔德型化合物或其药学上可接受的盐或酯;
步骤2:在测试组中,检测所述待测化合物对α-葡萄糖苷酶的影响,并与阳性对照组以及阴性对照组中相应的实验结果进行比较,其中,在阳性对照组中,检测阳性对照化合物对α-葡萄糖苷酶的影响;
其中,如果所述待测化合物对α-葡萄糖苷酶的抑制程度显著高于阴性对照组,则提示所述待测化合物是降血糖的候选药物。
在另一优选例中,在步骤(2)中,将测试组与阳性对照组相比,并比较i1与i2的比值,其中i1为所述待测化合物对α-葡萄糖苷酶的抑制程度,而i2为阳性对照化合物对α-葡萄糖苷酶的抑制程度,如果i1/i2≥80%,则提示所述待测化合物是降血糖的候选药物。
在符合本领域常识的基础上,上述各优选条件,可任意组合,即得本发明各较佳实例。
本发明所用试剂和原料均市售可得。
本发明的积极进步效果在于:本发明的狄尔斯-阿尔德型化合物为新结构类型的α-葡萄糖苷酶抑制剂,可用来预防或治疗糖尿病。本发明的狄尔斯-阿尔德型化合物具有高效的α-葡萄糖苷酶抑制活性,是阳性化合物阿卡波糖的840倍左右。本发明的狄尔斯-阿尔德型化合物从多种桑属植物中均能提取得到,来源多样化,获取方便。
附图说明
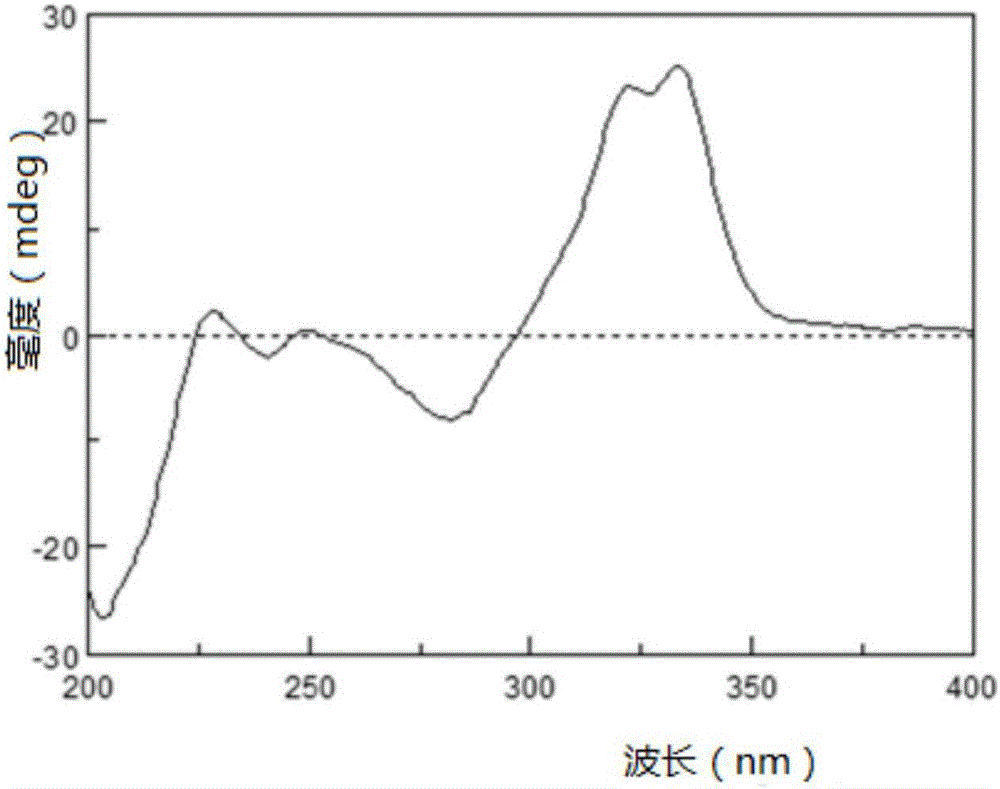
图1为实施例1制得的化合物i-1的ecd图谱
图2为实施例1制得的化合物i-2的ecd图谱
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将本发明限制在所述的实施例范围之中。下列实施例中未注明具体条件的实验方法,按照常规方法和条件,或按照商品说明书选择。
实施例1
以下实施例在统计学上均以*p<0.05视为显著差异。
仪器及试剂
核磁共振仪:brukerdrx400(德国),tms内标;高分辨质谱仪:watersxevog2-xs(美国);中低压柱色谱仪(日本ymc公司);酶标仪:bio-teksynergy2(美国)。
硅胶(200–300目),薄层色谱分析预制板和制备预制板均为青岛海洋化工厂生产;c18填料(日本ymc公司)。所用试剂均为分析纯(国药集团化学试剂有限公司)。
1)提取:取奶桑茎皮(10kg),粉碎,加95%乙醇回流提取,醇用量为药材量的10(v/m)倍,提取3次,每次1.5小时,将提取液过滤后合并,干燥,得奶桑干浸膏。浸膏混悬于4倍量水中,分别用石油醚,二氯甲烷,乙酸乙酯和正丁醇萃取,得到不同的部位。对乙酸乙酯部位进行减压浓缩,计算干重量为70g。
2)柱层析:将得到的乙酸乙酯部位,进行硅胶柱层析(10倍体积于样品质量的硅胶,100cm×10cm的玻璃柱),分别用二氯甲烷-甲醇溶液(95:5→80:20→70:30→60:40→50:50)梯度洗脱,每个梯度所用混合溶剂量为3倍柱体积,依次收集、合并,共得到10个大组分。取第四个大组分fr.d(6.0g)依次通过凝胶柱层析(二氯甲烷:甲醇=1:1)和反相硅胶柱层析(甲醇:水=55:45→65:35→75:25→85:15)得到次级组分d-g(58mg)和d-e(50mg)。
3)hplc制备:将上述次级组分d-g(58mg)用hplc制备(55%乙腈水溶液,检测波长254nm,流速2.5ml/min),得到化合物i-1:macrourini(tr=20.3min);将上述次级组分d-e(50mg)经hplc制备(56%乙腈水溶液,检测波长254nm,流速2.5ml/min),得到化合物i-2:macrourinj(tr=18.5min)。
化合物i-1(macrourini),黄色无定形粉末,微溶于水,可溶于丙酮。hresi-msm/z647.2288[m-h]-,确定化合物分子量为648;[α]2d5+305.6°(c0.4,meoh);ecd(meoh,nm)λmax(δε)229(+1.41),282(-5.35),323(+15.28),334(+16.48);1h-nmr(acetone-d6,400mhz)δ:13.21(1h,s,10″-oh),7.99(1h,d,j=8.8hz,h-14″),7.40(1h,d,j=8.4hz,h-4),7.02(1h,brs,h-3),6.98(1h,d,j=2.0hz,h-7),6.89(1h,brs,h-20″),6.84(1h,d,j=2.0hz,h-6′),6.81(1h,dd,j=8.4,2.0hz,h-5),6.80(1h,d,j=2.0hz,h-2′),6.32(1h,d,j=8.8hz,h-13″),6.24(1h,d,j=2.4hz,h-17″),6.14(1h,dd,j=8.4,2.4hz,h-19″),4.60(1h,brs,h-4″),3.83(1h,brs,h-3″),3.58(1h,brs,h-5″),2.55(2h,brt,j=7.2hz,h-21″),2.43(1h,brd,j=12.4hz,h-2″a),2.19(1h,brs,h-6″a),1.88(1h,brd,j=12.4hz,h-2″b),1.77(2h,brt,j=7.2hz,h-22″),1.43(3h,s,h3-7″),1.33(3h,s,h3-24″),1.30(3hs,h3-25″)。13c-nmr数据见表1。
化合物i-2(macrourinj),黄色无定形粉末,微溶于水,可溶于丙酮。hresi-msm/z647.2285[m-h]-,确定化合物分子量为648;[α]2d5+302.3°(c0.2,meoh);ecd(meoh,nm)λmax(δε)225(+0.23),236(-4.94),303(-5.90),324(+15.71,sh),334(+19.91);1h-nmr(acetone-d6,400mhz)δ:7.43(1h,d,j=8.8hz,h-14″),7.41(1h,d,j=8.4hz,h-4),7.00(1h,brs,h-3),6.98(1h,d,j=2.0hz,h-7),6.97(1h,brs,h-20″),6.83(1h,d,j=2.0hz,h-3),6.81(1h,dd,j=8.4,2.0hz,h-5),6.75(1h,d,j=1.6hz,h-2′),6.34(1h,d,j=8.4hz,h-13″),6.20(1h,d,j=2.4hz,h-17″),6.19(1h,dd,j=8.4,2.4hz,h-19″),4.52(1h,brs,h-4″),4.13(1h,brs,h-3″),3.54(1h,brs,h-5″),2.71(2h,brt,j=7.2hz,h-21″),2.31(1h,dd,j=12.8,2.4hz,h-2″a),2.19(1h,brs,h-6″a),1.93(1h,brd,j=12.8hz,h-2″b),1.90(2h,brt,j=7.2hz,h-22″),1.58(3h,s,h3-24″),1.53(3h,s,h3-25″),1.45(3h,s,h3-7″);13c-nmr数据见表1。
表1.化合物i-1~2的13c-nmr数据表
a信号没有观察到
b信号可调换
实施例2
1、仪器及材料
酶标仪(bio-teksynergy2),离心机ka-1000(上海飞鸽),双人超净工作台(苏州净化),可调式移液器(芬兰,2-20ul,20-200ul,100-1000ul),96孔板(corning,usa),进口枪头(axygen,usa),阳性化合物(阿卡波糖)。
2、方法
1)在250μl的反应体系中依次混合磷酸盐缓冲液(ph=7.6)、对硝基苯基α-d-吡喃葡萄糖苷、α-葡萄糖苷酶和待测化合物,30℃温孵30分钟。
2)加入终止剂碳酸钠溶液使反应停止。
3)使用酶标仪在405nm波长处检测。
3、待测样品,阳性药处理方法
待测样品和阿卡波糖精确称样,实验前使用dmso稀释到系列工作浓度。底物对硝基苯基α-d-吡喃葡萄糖苷按照说明书称量30.125mg加入50ml容量瓶用检测缓冲液稀释成工作液。
ac:对照组的吸光值,ab:空白组吸光值;as:样品组吸光值;asb:样品空白组吸光值
4、实验结果
4.1、初筛
表2.抑制率初筛表
4.1、ic50值测定
表3.化合物i-1~2α-葡萄糖苷酶抑制活性ic50表
备注:实验平行测定3次
结果如表2和表3所示。结果表明,本发明的狄尔斯-阿尔德型如式i所示的化合物具有高效的α-葡萄糖苷酶抑制活性,是阳性化合物阿卡波糖的840倍左右。因此,本发明的狄尔斯-阿尔德型式i化合物可预防或者治疗糖尿病,同时可以开发为新型高效α-葡萄糖苷酶抑制剂。
- 还没有人留言评论。精彩留言会获得点赞!