Wwox作为防治癌症的药物靶点的应用的制作方法
本发明属于分子生物学和生物医药领域,具体地,本发明涉及Wwox作为防治癌症的药物靶点的应用。
背景技术:
恶性肿瘤是一种复杂的、病因不明的疾病,严重威胁人类的生命健康。在中国,肿瘤的发生率和死亡率明显高于世界平均水平。在遗传和致癌因素的作用下,引起正常细胞遗传物质DNA的损伤、突变,并且同时伴随着多种癌基因的激活和抑癌基因的失活,使得癌细胞不受控制得生长和增殖,侵犯临近正常组织,转移到远端的组织器官。例如,乳腺癌是发生在乳腺腺上皮组织的恶性异质性肿瘤,具有不同的临床表现、组织病理学类型和分子特征,以及相应的不同的临床预后和对治疗的反应。在全球范围内,乳腺癌是女性最为常见的恶性肿瘤,也是女性癌症相关死亡率的主要原因,已成为当前社会的重大的公共卫生问题。全球乳腺癌的发病率自20世纪70年代末开始一直呈上升趋势。2012年WHO统计发现,在发达国家新生癌症患者中28.1%是乳腺癌,而乳腺癌在癌症死亡中所占比例是14.6%。尽管现在对于乳腺癌的早期诊断和治疗取得了比较大的成就,但是由于高复发率和死亡率,仍然受到全世界范围的高度关注。由于乳腺癌的复发、转移以及对治疗产生抵抗而导致临床治疗效果不佳,因此迫切需要鉴别出和乳腺癌分子亚型、乳腺癌侵袭表型有关的标志物,对于疾病监测、精确治疗和药物开发至关重要。
在癌细胞中,随着致癌基因的激活或抑癌基因的失活,细胞内正常的信号通途路就会变得异常活化。STAT3在许多人类癌症中经常被组织激活。在癌细胞中,STAT3持续性激活是常见的,这可能是由于STAT3的上游信号通路的异常活化所引起的。STAT3异常激活通常与更恶性的癌症行为相关,其中包括生长,上皮-间质转化,迁移,侵袭和转移。STAT3激活也与肿瘤存活和治疗抵抗有关。由于它与人类恶性肿瘤的相关性,广泛而深入地研究了参与信号通路转导的基因、多肽。正对STAT3信号通路的肿瘤靶向治疗目前也是肿瘤治疗的研究热点。
目前本领域还没有成熟的针对STAT3信号通路的肿瘤靶向治疗的方法,因此迫切需要开发特异性的靶点,用于癌症的预防或治疗。
技术实现要素:
本发明的目的在于提供针对JAK2/STAT3信号途径的靶向治疗方法以及将Wwox作为靶点进行癌症预防或治疗。
在本发明的一个方面,提供一种Wwox多肽或Wwox基因的上调剂的用途,用于制备药物或组合物,所述药物或组合物用于选自下组的一种或多种用途:
(1)增强Wwox与JAK2的相互作用;
(2)增强Wwox与STAT3的相互作用;
(3)抑制JAK2和STAT3的相互作用;
(4)抑制IL-6的合成;和
(5)预防或治疗体内STAT3异常活化所引起的癌症。
在另一优选例中,所述Wwox的上调剂选自下组:
(a)增强Wwox活性的物质;
(b)增强Wwox的表达、稳定性或有效作用时间的物质;
(c)增强Wwox与JAK2和/或STAT3的结合能力的物。
在另一优选例中,所述的Wwox多肽或基因来源于哺乳动物(包括人)。
在另一优选例中,所述Wwox的上调剂选自下组:Wwox的结合多肽、Wwox的化学上调剂、Wwox修饰多肽修饰酶、增强Wwox与JAK2和STAT3相互作用多肽或其组合。
在另一优选例中,所述Wwox基因的上调剂为:促进Wwox基因启动子驱动表达能力的上调剂、Wwox基因特异性的过表达多肽、Wwox基因特异性microRNA的下调剂、或其组合。
在另一优选例中,所述Wwox的上调剂为重组表达Wwox的构建物(如表达载体或宿主细胞)或Wwox基因特异性的过表达多肽。
在另一优选例中,所述的肿瘤选自下组:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌。
在另一优选例中,所述的肿瘤为乳腺癌,所述的肿瘤细胞是乳腺癌细胞(如MDA-MB-231)。
在另一优选例中,所述的肿瘤为基底样(Basal-like)乳腺癌或三阴乳腺癌。
在另一优选例中,所述的Wwox多肽选自下组:
(a)氨基酸序列如SEQ ID NO:2所示的多肽;
(b)氨基酸序列如SEQ ID NO:2所示的多肽的截短体,包括WW1结构域,或包括WW1和WW2结构域;
(c)将(a)或(b)所示的氨基酸序列经过一个或多个(通常为1-60个,较佳地1-30个,更佳地1-20个,更佳地1-10个,更佳地1-5个)氨基酸残基的取代、缺失或添加而形成的具有(a)或(b)多肽功能的Wwox衍生物,或其活性片段。
(d)序列与SEQ ID NO:2所示的氨基酸序列相比,同源性≥90%(较佳地≥95%,更佳地≥98%,最佳地≥99%)的Wwox衍生物,或其活性片段。
在另一优选例中,以上(c)中,相应于SEQ ID NO:2所示多肽的第14位和第49位不发生突变。
在本发明的第二方面,提供了一种药物组合物,包括药学上可接受的载体和有效量的活性成分,其中所述的活性成分为Wwox多肽上调剂或Wwox基因的上调剂。
在另一优选例中,所述的药物组合用于预防或治疗肿瘤。
在另一优选例中,所述Wwox的上调剂选自下组:Wwox的结合多肽、Wwox的化学上调剂、Wwox修饰多肽修饰酶、增强Wwox与JAK2和STAT3相互作用多肽或其组合。
在另一优选例中,所述Wwox基因的上调剂为:促进Wwox基因启动子的上调剂、Wwox基因特异性的过表达多肽、Wwox基因特异性microRNA的下调剂、或其组合。
本发明的第三方面提供了一种分离的复合物,所述复合物为Wwox或Wwox衍生物与JAK2或STAT3相结合所形成的复合物。
在另一优选例中,所述复合物的结构如式I所示:B-A-C式I,式中,A为Wwox或Wwox衍生物;B为无或JAK2;C为无或STAT3,“-”表示元件A与元件B和/或元件C之间的相互结合的结合力。
在另一优选例中,所述复合物的分子量≥100KD;优选地所述复合物的分子量≥150KD。
在另一优选例中,所述的Wwox的衍生物包括但不限于:Wwox多肽的活性片段、Wwox多肽的截短形式(如包括WW1结构域的截短形式,或包括WW1和WW2结构域的截短形式)。
本发明的第四方面,提供了本发明第三方面所述的复合物的应用,用于筛选药物或化合物,所述药物或化合物促进或抑制所述复合物的形成。
在另一优选例中,当应用所述复合物筛选药物时,所述应用包括步骤:
(a)在测试组中,在待测物质存在下,培养细胞,并且设置无待测物质的对照组;
(b)检测测试组中所述复合物的含量H1并与对照组中的复合物含量H0进行比较,其中当H1显著高于(如高5%、10%、20%、50%、100%或更高)H0,则表示所述测试物为Wwox的上调剂;当H1显著低于(如低5%、10%、20%、50%、100%或更低)H0,则表示所述测试物为Wwox的下调剂。
本发明的第五方面,提供了抑制体内STAT3活性的方法,包括包括步骤:促进Wwox的活性、表达水平或Wwox与JAK2和/或STAT3的相互作用。
在另一优选例中,当需要降低体内STAT3活性水平,执行增强Wwox的活性或表达水平的步骤。
在另一优选例中,所述方法包括步骤:给需要的对象施用本发明
第三方面所述复合物的上调剂。
本发明的第六方面,提供了一种多肽或调节剂的用途,所述的多肽选自下组:Wwox、JAK2、STAT3或其组合,并且所述多肽和/或其调节剂用于制备本发明第三方面所述复合物形成的组合物。
在另一优选例中,所述的组合物包括药物组合物。
在另一优选例中,所述的调节剂包括下调剂或上调剂。
在另一优选例中,所述“下调”指抑制本发明第三方面所述的复合物形成。
在另一优选例中,所述“上调”指促进本发明第三方面所述的复合物形成。
在另一优选例中,所述调节剂包括Wwox的衍生多肽。
本发明的第七方面,提供了一种药物筛选方法,所述方法包括检测本发明第三方面所述的复合物是否形成的步骤和/或检测本发明第三方面所述的复合物的含量的步骤。
在另一优选例中,所述的方法包括步骤:
(a)在测试组中,在待测物质存在下,培养细胞,并且设置无待测物质的对照组;
(b)检测测试组中所述复合物的含量H1并与对照组中的复合物含量H0进行比较,其中当H1显著高于(如高5%、10%、20%、50%、100%或更高)H0,则表示所述测试物为Wwox的上调剂;当H1显著低于(如低5%、10%、20%、50%、100%或更低)H0,则表示所述测试物为Wwox的下调剂。所述的Wwox的上调剂可以作为抑制IL-6的合成或预防或治疗体内STAT3异常活化所引起的肿瘤的药物。
本发明的第八方面,提供了一种治疗或预防STAT3异常活化所引起的癌症的方法,包括步骤:促进Wwox的活性、表达水平或Wwox与JAK2或STAT3的相互作用。
在另一优选例中,增强Wwox的活性或表达水平的步骤。
在另一优选例中,所述方法包括步骤:给需要的对象施用本发明第三方面所述的复合物的上调剂。
本发明的第九方面,提供了一种抑制肿瘤细胞的方法,包括步骤:在Wwox多肽上调剂或Wwox基因上调剂存在的条件下,处理肿瘤细胞(或细胞培养物),从而抑制肿瘤细胞。
在另一优选例中,所述Wwox的上调剂增强肿瘤细胞中Wwox活性;或Wwox的表达或稳定性;或Wwox与JAK2和STAT3中之一的结合能力的衍生多肽或片段。
在另一优选例中,所述的抑制肿瘤细胞为抑制肿瘤细胞的转移或抑制肿瘤细胞成瘤转移。
在另一优选例中,与对照肿瘤细胞相比,所述肿瘤细胞中Wwox的活性升高20%以上,较佳地升高50%以上,更佳地升高80%以上。
在另一优选例中,与对照肿瘤细胞相比,所述肿瘤细胞中Wwox的基因表达升高20%以上,较佳地升高50%以上,更佳地升高80%以上。
Wwox多肽或其编码基因的用途,用于制备对肿瘤进行诊断或预后的试剂;较佳地,所述的肿瘤选自下组:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌;更佳地,所述的肿瘤为基底样乳腺癌或三阴乳腺癌。
本发明的第九方面,提供特异性识别Wwox多肽或其编码基因的试剂的用途,用于制备诊断或预后肿瘤的试剂或试剂盒;较佳地,所述的肿瘤选自下组:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌;更佳地,所述的肿瘤为基底样乳腺癌或三阴乳腺癌。
在另一优选例中,所述的特异性识别Wwox多肽或其编码基因的试剂选自:特异性扩增Wwox基因的引物;特异性识别Wwox基因的探针;或特异性结合Wwox多肽的抗体或配体。
应理解,在本发明范围内中本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
下列附图用于说明本发明的具体实施方案,而不用于限定由权利要求书所界定的本发明范围。
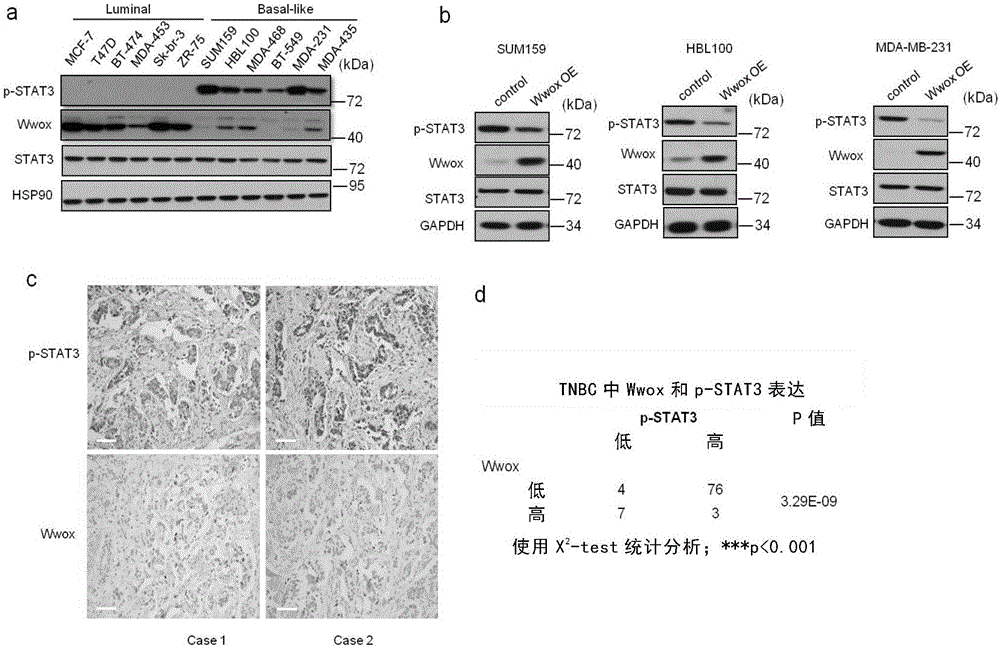
图1、在乳腺癌细胞系和乳腺癌样本中,Wwox的表达和STAT3的活性呈现负相关关系。图1a:分别检测12种乳腺癌细胞系中Wwox和p-STAT3的蛋白水平;图1b:在Basal乳腺癌细胞系中(SUM159,HBL100,MDA-MB-231)过表达Wwox,检测p-STAT3的蛋白水平;图1c,d:免疫组化检测90例乳腺癌样本中Wwox和p-STAT3的表达情况。Wwox和p-STAT3免疫组化代表性结果(c)和统计结果(d)。TNBC:三阴性乳腺癌。
图2、Wwox可以抑制乳腺癌细胞的转移和生长。图2a,b:通过Tranwell检测Wwox对乳腺癌细胞(SUM-159,MDA-MB-231)迁移能力的影响;图2c-h:MDA-MB-231细胞过表达Wwox,原位注射到脂肪垫中,观察肿瘤细胞的生长情况,并且观察肿瘤细胞在肝脏中的转移情况;图2i-n:在NIH3T3过表达STAT3C和SRC,持续活化STAT3,进一步过表达Wwox,观察Wwox对细胞成瘤性的影响。
图3、Wwox通过特定结构域和STAT3相互作用。图3a,b:免疫共沉淀实验观察Wwox与STAT3之间的相互作用;图3c,d:构建Wwox不同的截短体,观察和STAT3结合的结构域;图3e,f:构建STAT3不同的截短体,观察和Wwox结合的结构域。
图4、Wwox可以通过抑制STAT3的磷酸化影响STAT3的转录活性。图4a,b:在MCF-7细胞中分别下调和过表达Wwox,转入STAT3的报告基因,观察Wwox对STAT3转录活性的影响;图4c:EMSA实验检测Wwox对STAT3的DNA结合能力影响;图4d,e:Wwox可以抑制p-STAT3的水平。分别在SUM159(d)和MCF-7(e)中过表达和下调Wwox,观察IL-6对STAT3活化的影响;图4f,g:Wwox抑制STAT3的磷酸化。通过IL-6刺激不同的时间点,分别过表达和下调Wwox,检测p-STAT3的蛋白水平。
图5、Wwox通过特定结构域和JAK2相互作用。图5a,b:免疫共沉淀实验观察Wwox与JAK2之间的相互作用;图5c:构建Wwox不同的截短体,观察和JAK2结合的结构域;图5d,e:构建JAK2不同的截短体,观察和Wwox结合的结构域。
图6、Wwox通过抑制JAK2磷酸化和STAT3之间的结合,抑制STAT3磷酸化。图6a:在乳腺癌细胞中过表达Wwox,观察JAK2和STAT3的磷酸化水平的改变;图6b:免疫共沉淀检测在IL-6刺激条件下,JAK2和Wwox之间的相互作用;图6c:免疫共沉淀检测下调Wwox的表达条件下,JAK2和STAT3之间的相互作用的改变。图中W2delete是指缺失第55~第103位氨基酸(SEQ ID NO:2)。
图7、Wwox的磷酸化可以影响STAT3的活化。图7a:Western检测Wwox截短体对STAT3和JAK2的影响;图7b:免疫共沉淀检测Wwox截短体对JAK2和STAT3相互作用的影响;图7c:免疫共沉淀检测Wwox磷酸化位点突变体和JAK2之间相互作用的改变;图7d:免疫共沉淀检测Wwox不同的磷酸化位点突变体对JAK2和STAT3之间相互作用的影响;图7e:通过报告STAT3报告基因观察Wwox不同突变体的作用;图7f:Western blot检测Wwox突变体对STAT3和JAK2磷酸化的影响。
图8、Wwox通过STAT3抑制IL-6的表达。图8a:通过细胞因子抗体芯片检测Wwox对细胞因子的影响;图8b:ELISA检测Wwox过表达细胞中IL-6蛋白的水平;图8c:qPCR检测乳腺癌细胞中Wwox和IL-6的水平;图8d:ELISA检测乳腺癌细胞系中IL-6蛋白水平;图8e:构建IL-6不同的长度的启动子区域,检测Wwox对IL-6启动子的影响;图8f:通过Chip实验检测Wwox对STAT3在IL-6启动子区域结合的影响。
图9、乳腺癌中Wwox的高表达和病人临床预后呈现正相关关系。图9a-c:根据Oncomine数据库的芯片数据结果,分析Wwox在乳腺癌中的表达情况;图9d:免疫组化监测150例乳腺癌中Wwox的表达情况和病人临床预后的关系;图9e:分析来自于Kaplan Meier-plotter网站的数据,观察Wwox的表达情况和病人临床预后的关系。
具体实施方式
本发明人首次发现在肿瘤细胞,特别是一些乳腺癌细胞中,Wwox的表达和STAT3活化水平呈现负向相关关系。过表达Wwox可以明显抑制乳腺癌细胞的迁移能力,细胞的成瘤和转移能力。同时发现Wwox一方面通过抑制JAK2的磷酸化,另外一方面通过和JAK2的作用,抑制JAK2和STAT3结合能力,进而抑制STAT3的磷酸化,此外Wwox也可以通过STAT3来抑制IL-6的表达,并且Wwox表达量的高低在乳腺癌病人的预后有显著的相关性。因此Wwox在肿瘤特别是乳腺癌中起到非常重要的作用,是一个癌症治疗靶点。
JAK-STAT3信号通路
信号转导和转录活化因子3(signal transducer and activator of transcription3,STAT3)是信号转导与转录活化蛋白(STAT)家族中的重要成员之一,是一种重要的核转录因子,调控多种基因的表达。STAT3的结构与其他STAT蛋白相似,具有以下结构域:N端多聚化结构域,一段保守的序列;卷曲螺旋结构域,主要介导STAT3和其他蛋白的相互作用,与N端多聚化结构域参与信号通路的激活;结合DNA结构域,针对性结合在活性干扰素回文序列原件;SH2结构域,磷酸化的STAT3通过SH2结构域相互作用,与STAT3本身或其他STAT蛋白形成同源或异源二聚体,转位到细胞核;C端转录激活结构域,在转录激活区内的丝氨酸(S727)或接近C端的酪氨酸(Y705)磷酸化后STAT3被激活,调控靶基因的转录。
在静息状态下,STAT3存在于细胞质中。STAT3可被白介素6(interleukin-6,IL-6)、表皮生长因子受体(epidermal growth-factor receptor,EGFR)和JAK激酶(Janus kinase)等多种细胞因子、生长因子受体或癌基因的激活,参与细胞增殖、存活、凋亡、转化、细胞免疫等重要的生理病理过程。目前发现,在许多肿瘤中广泛存在STAT3的异常活化,提示STAT3与肿瘤形成存在密切的关系。STAT3处于多条参与肿瘤进程的信号通路的交汇点,其中JAK-STAT信号通路是STAT3参与信号通路中最直接和研究的最为深入的通路。
JAK是JAK-STAT信号通路非常重要的上游因子,主要包括JAK1,JAK2,JAK3以及Tyk2。JAK属于酪氨酸激酶,发挥磷酸化作用,不仅可以活化与其结合的细胞因子受体,也可以活化STAT等含有SH2结构域的重要蛋白,其中JAK2与肿瘤进程的关系最为密切。STAT家族成员主要包括STAT1,STAT2,STAT3,STAT4,STAT5a,STAT5b和STAT6。STAT3在该通路下游信号转导中发挥着重要的作用。
当相应的细胞因子与受体结合后,可以激发受体的寡聚化或二聚化,在细胞质中与JAK2相互作用,并使得自身和JAK2的酪氨酸磷酸化。磷酸化的受体或JAK2召集细胞质中的STAT3,使得STAT3酪氨酸磷酸化而被激活。活化的STAT3离开受体,通过分子间Src同源结构域SH2与酪氨酸磷酸化位点相互作用,使得STAT3在细胞质内形成二聚体。STAT3二聚体迅速转位到细胞核内,结合到靶基因的启动子区域,诱导相关基因的表达。JAK-STAT信号通路的异常与肿瘤形成有密切关系,特别是STAT3在肿瘤形成中发挥着重要的作用。现在认为STAT3参与肿瘤形成最终可能通过STAT3异常活化及STAT3基因突变起作用。
Wwox
Wwox(WW domain-containing oxidoreductase)基因跨越超过1Mbp的基因座,包含编码1245大小碱基的开放阅读框的9个外显子。蛋白序列包括两个WW结构域和一个短链脱氢酶/还原酶(short-chain dehydrogenase/reductase,SDR)结构域,其与17β羟基甾醇还原酶3同源,可能参与性激素代谢途径。Wwox基因跨越一个脆性位点FRA16D,并且包含了涉及多个骨髓瘤染色体易位的基因组区域以及在癌症和癌细胞系中的半纯合和纯合缺失(homozygous deletion,HD)中的基因组区域(66-68)。Wwox N端有两个WW结构域,主要是介导蛋白质与蛋白质相互作用。已有文献报道Wwox作为抑癌基因,可以和许多转录因子结合,参与许多肿瘤相关的信号通路。Wwox的抑癌作用已有研究,对Wwox抑癌作用机制的研究,会又有益于Wwox在肿瘤治疗中的作用。为了更好地了解Wwox的功能,需要去发现新的Wwox相互作用的蛋白,了解特定细胞类型中WW结构域相互作用的网络,也需要了解SDR结构域在正常和肿瘤环境下的生物学功能,进而全面了解Wwox对于特定类型的细胞的生长、分化和凋亡的作用。
本发明涉及Wwox蛋白作为靶点用于预防或治疗癌症。具体地,本发明公开了Wwox参与乳腺癌生长和转移的生物学过程。在基底样乳腺癌细胞系(Basal-like cell)和三阴乳腺癌(Triple-negative)组织样本中发现Wwox的低表达与STAT3的高度激活密切相关,同时Wwox通过与JAK2和STAT3相互作用抑制STAT3的活化,阻止乳腺癌的增殖和转移;Wwox还能抑制STAT3结合在白介素-6(IL-6)的启动子,抑制IL-6的表达。因此Wwox可以作为癌症的诊断或治疗的靶点。
如本文所用,术语“Wwox基因”、“Wwox编码基因”、“Wwox的编码序列”可以互换使用,都是质编码Wwox蛋白的多核苷酸序列。本领域的普通技术人员可以使用常规方法获得Wwox基因的序列,如从NCBI获取。
在本发明的一个优选的实施方式中,所述的Wwox的氨基酸序列如下,共414个氨基酸残基。
本发明的可以是重组多肽、天然多肽或合成多肽。本发明的Wwox可以是天然纯化的产物或是化学合成的产物,或使用重组技术从原核或真核宿主中产生。根据重组生产方案所用的宿主,本发明的Wwox可以是糖基化的或非糖基化的。本发明的Wwox还可包括或不包括起始的甲硫氨酸残基。本发明还包括具有Wwox或Wwox活性的Wwox多肽片段和类似物。
此外,所述术语“Wwox的衍生蛋白”还包括具有结合JAK2和/或STAT3功能的SEQ ID:1序列的变异形式。这些变异形式包括(但并不限于):1-3个(通常为1-2个,更佳地1个)氨基酸的缺失、插入和/或取代,以及在C末端和/或N末端添加或缺失一个或数个(通常为3个以内,较佳地为2个以内,更佳地为1个以内)氨基酸。例如,在本领域中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能。又比如,在C末端和/或N末端添加或缺失一个或数个氨基酸通常不会改变蛋白质的结构和功能。此外,所述术语还包括单体和多聚体形式的本发明多肽。该术语还包括线性以及非线性的多肽(如环肽)。
本发明的多肽片段、衍生物或类似物可以是(i)有一个或多个保守或非保守性氨基酸残基(优选保守性氨基酸残基)被取代的多肽,而这样的取代的氨基酸残基可以是也可以不是由遗传密码编码的;或(ii)在一个或多个氨基酸残基中具有取代基团的多肽;或(iii)成熟多肽与另一化合物(比如延长多肽半衰期的化合物,例如聚乙二醇)融合所形成的多肽;或(iv)附加的氨基酸序列融合到此多肽序列而形成的多肽(如前导序列或分泌序列或用来纯化此多肽的序列或蛋白原序列,或融合蛋白)。根据本文的定义这些片段、衍生物和类似物术语本领域熟练技术人员公知的范围。
本发明还包括与本发明的Wwox具有50%或以上(优选60%以上,70%以上,80%以上,更优选90%以上,更优选95%以上,最优选98%以上,如99%)同源性的具有相同或相似功能的多肽或蛋白。在蛋白质变体可以经过若干个(通常为1-60个,较佳地1-30个,更佳地1-20个,最佳地1-10个)取代、缺失或添加至少一个氨基酸所得的衍生序列,以及在C末端和/或N末端添加一个或数个(通常为20个以内,较佳地为10个以内,更佳地为5个以内)氨基酸。例如,在所述蛋白中,用性能相近或相似的氨基酸进行取代时,通常不会改变蛋白质的功能,在C末端和/或末端添加一个或数个氨基酸通常不会改变蛋白质的功能。本发明包括Wwox类似物与天然Wwox的差别可以是氨基酸序列上的差别,也可以是不影响序列的修饰形式上的差别,或者兼而有之。这些蛋白的类似物包括天然或诱导的遗传变异体。诱导变异体可以通过各种技术得到,如通过辐射或暴露于诱变剂而产生随机诱变,还可以通过定点诱变法或其他已知分子生物学技术。类似物还包括具有不同于天然L-氨基酸的残基(如D-氨基酸)的类似物,以及具有非天然存在的或合成的氨基酸(如β、γ-氨基酸)的类似物。应理解,本发明的蛋白并不限于上述列举的代表性蛋白。
修饰(通常不改变一级结构)形式包括:体内或体外蛋白的化学衍生形式如乙酸化或羧基化。修饰还包括糖基化,如那些在蛋白合成和加工中进行糖基化修饰而产生的多肽。这种修饰可以通过将多肽暴露于进行糖基化的酶(如哺乳动物的糖基化酶或去糖基化酶)而完成。修饰形式还包括具有磷酸化氨基酸残基(如磷酸酪氨酸,磷酸丝氨酸,磷酸苏氨酸)的序列。还包括被修饰从而提高其抗蛋白水解性能或优化了溶解性能的多肽。
本发明还提供了编码Wwox的多核苷酸序列。本发明的多核苷酸可以是DNA形式或RNA形式。DNA形式包括:DNA、基因组DNA或人工合成的DNA,DNA可以是单链的或是双链的。编码成熟多肽的多核苷酸包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。术语“编码多肽的多核苷酸”可以是包括编码此多肽的多核苷酸,也可以是还包括附加编码和/或非编码序列的多核苷酸。本发明还涉及上述多核苷酸的变异体,其编码与本发明有相同的氨基酸序列的多肽片段、类似物和衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
在本发明优选例中,编码Wwox的DNA序列如SEQ ID NO:1所示,其编码SEQ ID NO:2所示的Wwox。
根据本文所述的核苷酸序列,本技术领域人员可方便地用各种已知方法制得本发明的编码核苷酸。这些方法例如但不限于:PCR,DNA人工合成等。具体的方法可参见J.萨姆布鲁克,《分子克隆实验指南》。作为本发明的一种实施方式,可通过分段合成核苷酸序列再进行重叠延伸PCR的方法来构建本发明的编码核苷酸序列。
Wwox的上调剂
如本文所用,术语“Wwox多肽的上调剂”包括了促进剂、激动剂、激活剂。所述的“上调”、“促进”包括了蛋白活性的“上调”、“促进”或蛋白表达的“上调”、“促进”。任何可提高Wwox的活性、提高Wwox的稳定性、上调Wwox的表达、增加Wwox有效作用时间的物质,这些物质均可用于本发明,作为对于上调Wwox有用的物质,从而可用于发挥调控作用或治疗疾病。它们可以是化合物、化学小分子、生物分子。所述的生物分子可以是核酸水平(包括DNA、RNA)的,也可以是蛋白水平的。
Wwox多肽的上调剂选自:Wwox的结合蛋白、Wwox的化学上调剂、Wwox修饰蛋白修饰酶、增强Wwox与JAK2和STAT3相互作用的衍生蛋白、化合物或其组合。
如本文所用,术语“Wwox基因的上调剂”是指激活Wwox基因复制或转录的物质,或增加Wwox基因表达(表达产物如mRNA)的物质,Wwox基因的上调剂包括(但不限于):促进Wwox基因启动子的上调剂、Wwox基因特异性的过表达蛋白、Wwox基因特异性microRNA的下调剂、促进相互作用的衍生蛋白、化合物或其组合。
药物组合物
本发明的药物组合物包含安全、有效量范围内的本发明Wwox或衍生物、上调剂及药理上可以接受的赋形剂或载体。
如本文所用,术语“安全、有效量”是指可对人和/或动物产生功能或活性的且被人和/或动物所接受的量。
如本文所用,“药学上可接受的”的成分是适用于人和/或哺乳动物而物过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂与给药方式匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
本发明所述的活性成分可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领有普通技术人员根据各因素来确定(例如通过临床试验)。所述的因素包括(但不限于):所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病严重程度、患者体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约0.00001mg-50mg/kg动物体重(较佳的0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明组合物可以单独用药,或者与其他药学上可接受的化合物联合用药。
本发明所述的药学上可接受的载体包括(但不限于):脂质体、纤维素、纳米凝胶、水、盐水、蛋白、肽类物质、蛋白-抗体缀合物、或其组合。载体的选择应与给药方式相匹配,这些都是本领域普通技术人员所熟知的。
应用
基于本发明人的新发现,在得知了Wwox与JAK2、STAT3的密切相关性后,可以基于该特征来筛选调节它们之间相互作用,进而对于防治肿瘤有用的潜在物质。
一种筛选防治肿瘤的潜在物质的应用包括:(1)用候选物质处理Wwox与JAK2和/或STAT3的相互作用的体系;和(2)检测所述体系中Wwox与JAK2和/或STAT3的相互作用情况;其中,若所述候选物质可促进这种相互作用,则表明该候选物质是预防、缓解或治疗肿瘤的潜在物质。
所述的Wwox与JAK2和/或STAT3的相互作用的体系例如可以是细胞(或细胞培养物)体系,所述的细胞可以是内源性表达Wwox、JAK2和/或STAT3的细胞;或可以是重组表达(过表达)Wwox、JAK2和/或STAT3的细胞。所述的表达Wwox、JAK2和/或STAT3的体系还可以是亚细胞体系、溶液体系、组织体系、器官体系或动物体系(如动物模型,优选非人哺乳动物的动物模型,如鼠、兔、羊、猴等)等。
在本发明的优选方式中,在进行筛选时,为了更易于观察到Wwox与JAK2和/或STAT3的相互作用的改变,还可设置对照组,所述的对照组可以是不添加所述候选物质的Wwox与JAK2和/或STAT3的相互作用的体系。
作为本发明的优选方式,所述的方法还包括:对获得的潜在物质进行进一步的细胞实验和/或动物试验,以进一步选择和确定对于预防、缓解或治疗肿瘤真正有用的物质。
本发明对于Wwox、JAK2和/或STAT3的表达、活性、存在量或分泌情况的检测方法没有特别的限制。可以采用常规的定量或半定量检测技术。
本发明提供了一种抑制肿瘤细胞的方法。包括步骤:在Wwox蛋白上调剂或Wwox基因上调剂存在的条件下,处理肿瘤细胞,从而抑制肿瘤细胞。所述的肿瘤选自下组:乳腺癌、肺癌、结肠癌、胰腺癌、胃癌、肝癌、前列腺癌、淋巴癌、黑色素瘤;较佳地为乳腺癌。
在本发明的优选实施方式中,所述的抑制肿瘤细胞为抑制肿瘤细胞的转移或抑制肿瘤细胞成瘤转移。
在本发明的优选实施方式中,与对照肿瘤细胞相比,所述肿瘤细胞中Wwox的活性升高20%以上,较佳地升高50%以上,更佳地升高80%以上。
在本发明的优选实施方式中,与对照肿瘤细胞相比,所述肿瘤细胞中Wwox的基因表达升高20%以上,较佳地升高50%以上,更佳地升高80%以上。
基于本发明人的上述新发现,还可以将Wwox或其与JAK2和/或STAT3的复合物作为肿瘤诊断或预后评估的标志物:(i)进行肿瘤的分型和/或鉴别诊断;(ii)评估相关人群的患病风险、药物疗效、预后,以及选择合适的治疗方法。比如,可分离出由基因表达异常的人群,从而可进行更有针对性地治疗。
根据本发明人的新发现,可以通过判断待评估样本中Wwox的表达情况或活性情况,或判断待评估样本中Wwox与JAK2和/或STAT3的相互作用情况来预测提供该待评估样本的受试者的肿瘤预后情况,选择合适的药物实施治疗。通常,可以规定一个Wwox的阈值或Wwox与JAK2和/或STAT3的相互作用的阈值,当低于所规定的阈值时,考虑采用提高Wwox的方案进行治疗。所述的阈值对于本领域技术人员而言是易于确定的。
可采用各种本领域已知的技术来检测Wwox基因的存在与否以及表达情况,或检测Wwox与JAK2和/或STAT3的相互作用情况。这些技术均包含在本发明中。例如可用已有的技术如Southern印迹法、Western印迹法、DNA序列分析、PCR、免疫共沉淀等,这些方法可结合使用。
本发明的主要优点在于:
(1)首次揭示了Wwox与JAK2的相互作用;
(2)首次揭示Wwox与Wwox的相互作用;
(3)首次揭示了Wwox能够调节JAK2和STAT3的结合
(4)首次揭示了Wwox能够通过JAK2/STAT3信号通路抑制乳腺癌的生长的转移;
(5)首次揭示Wwox可以抑制IL-6的表达;
(6)揭示Wwox的表达量高低能够指示乳腺癌病人的预后情况。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
材料与方法
1.1实验材料
1.1.1细胞系
实施例涉及的乳腺癌细胞系分类如下:
Basal-like乳腺癌细胞:SUM159、MDA-MB-231(简称MDA-231)、HBL100、MDA-MB-468(简称MDA-468)、BT549、MDA-MB-435(简称MDA-435);
Luminal型乳腺癌细胞:MCF7、T47D、BT-474、MDA-MB-453(简称MDA-453)、ZR-75、SKBR3。
人肾胚细胞系HEK-293T细胞,小鼠成纤维细胞NIH3T3均购自ATCC。
1.1.2试剂
DMEM培养基、RPMI-1640培养基购自Hyclone公司;胎牛血清(FBS)购自BI;胰酶(Trypin-EDTA)和青霉素和链霉素(Penicillin-streptomycin)购自Gibco公司;细胞转染试剂Lipofectamine 2000购自Life Technologies公司。双荧光报告基因检测试剂盒、转染试剂FuGENEHD购自Promega公司。凝胶迁移实验EMSA试剂盒购自ThermoFisher公司,STAT3生物素标记探针购自碧云天公司。Transwell小室购自CORNING公司。0.45μm、0.22μm的滤器购自Millipore公司。人细胞因子白介素IL-6购自R&D公司。
TRIzol RNA提取试剂购自Invitrogen公司;RT-PCR试剂盒和荧光定量试剂Premix Ex TaqTM来自Takara公司。PCR所用PrimerSTAR Max DNA Polymerase试剂盒购自Takara公司;PCR产物纯化以及琼脂糖凝胶DNA回收试剂盒、质粒小提制备试剂盒、去内毒素质粒大量制备试剂盒均购自天根生物有限公司。蛋白定量试剂盒Bio-Rad protein assay kit购自ThermoFisher公司;蛋白酶抑制剂和磷酸酶抑制剂购自Roche公司;Western所使用的PVDF膜购自Millipore公司;ECL化学发光试剂购自Sigma公司。
1.1.3抗体
Anti-Wwox、STAT3抑制剂Stattic和所有的siRNAs都购自SantaCruz生物科技公司;anti-STAT3、p-STAT3、JAK2、p-JAK2、anti-Myc、anti-HA抗体和辣根过氧化物酶HRP交联的二抗购自Cell signaling公司;anti-GAPDH、β-actin抗体购自Abmart;anti-FLAG抗体购自Sigma公司。
1.2实验方法
1.2.1细胞转染
脂质体转染:对于乳腺癌细胞系,按照Invitrogen公司Lipofectamine 2000试剂说明书进行:(1)转染前24h将细胞铺板,转染时使细胞密度达到60~70%。(2)根据铺细胞的板的大小,使用不同体积的Opti-MEM培养液分别稀释质粒和Lipofectamine 2000(两者比例是1:2~1:3),混合均匀,室温放置5分钟。(3)将含有Lipofectamine 2000的稀释液加入到质粒稀释液中,混合均匀,室温放置20min。(4)逐滴将上述混合溶液加入到含有Opti-MEM培养液的培养板中,摇动培养板使其混合均匀。(5)放入细胞培养箱中培养培养4-6小时后,将培养液换为完全培养基,继续培养24~48小时后进行生物学功能检测。
1.2.2蛋白抽提、免疫共沉淀与免疫印迹
吸去细胞培养液,用PBS洗一遍细胞,将PBS吸走,培养皿放置在冰上,加入含有蛋白酶抑制剂Cocktail和磷酸酶抑制剂的细胞裂解液,刮取细胞放入到EP管中,放在冰上裂解30min,4℃离心机12000rpm离心10min,取蛋白上清,通过BCA法测定蛋白浓度,取等量蛋白样品然后加入5×SDS loading buffer 100℃煮10min,使其充分变性后冻存。免疫共沉淀前面步骤和蛋白收取相同,裂解离心收取的蛋白上清,取出一部分作为input对照。其余分成三管加入对应的抗体和阴性对照抗体,放置在转轮中4度旋转过夜;准备beads,600ul样品中加入20ul beads,按此比例及样品总数准备适量的beads,用1mlPBS冲洗beads 2次,4000rpm离心1min,吸去PBS,将beads分别加入到样品管中,放置于转轮4℃旋转4h。离心去上清,用1ml蛋白裂解液洗beads,4000rpm 4℃洗3次,每次离心1min,洗完后尽量将残夜吸干,加入100ul 2×上样缓冲液煮沸待上样跑胶。
根据蛋白大小配置相应浓度的SDS聚丙烯酰胺凝胶,将配好的凝胶胶板固定在电泳装置上,并向电泳仪中加入1×Tris-甘氨酸电泳缓冲液,每孔上样30μg蛋白样品,接通电源,首先在80V恒压下跑胶,待样品到分离胶时,将电压调制100V恒压持续电泳至溴酚蓝到达分离胶的底部,终止电泳。电泳结束后,将裁剪好的PVDF膜置于甲醇中激活半分钟左右,打开转膜夹,黑色面浸于transfer溶液中,于黑白夹面各放置一张用transfer浸泡好滤纸。撬开胶板,切去浓缩胶,将分离胶从长胶板上取下,放于黑色夹面,用手指稍微固定凝胶,将激活好的PVDF膜在transfer涮洗一下,盖在胶上,将膜与胶之间的气泡赶出,合上转膜夹,放入电泳槽中,加入适量的转膜液及冰盒,并以100V恒压方式转膜120min。此时蛋白质从SDS聚丙烯酰胺凝胶上转移到PVDF膜上。取下PVDF膜后,根据所需蛋白分子量裁剪条带,用封闭液(5%脱脂牛奶TBST溶液)室温孵育1小时。封闭完成之后用TBST洗一下PVDF膜,然后加入相应的用3%BSA TBST缓冲液稀释的抗体,4℃孵育过夜。第二天将一抗回收,取出PVDF膜,使用TBST缓冲液清洗3次,每次10分钟;加入HRP交联的二抗,室温孵育1小时;二抗封闭完成之后,再次用TBST缓冲液清洗3次,每次10分钟。使用ECL发光液对PVDF膜显色,在暗室中用X光片压片。
1.2.3 RNA提取、逆转录和Real-Time PCR
细胞总RNA利用TRIzol试剂提取。用PBS洗一下细胞,向待裂解的细胞中加入1ml TRIzol吹打。按照1ml trizol加入0.2ml氯仿(1/5的trizol量的三氯甲烷),剧烈震荡15s,室温放置5min,12000g,15min,4℃离心。将450ul上清转移到另一个EP管内,加入等量的异丙醇沉淀,充分缓慢混匀溶液后,室温放置10min沉淀RNA。4℃12000g离心10分钟。弃上清,加入1ml 75%乙醇/DEPC水洗涤沉淀2次,4℃,7500g,离心5min。等RNA沉淀变透明后,加入适量的DEPC水,在55℃烘箱内孵育10min。吸净并晾干,加入适量的DEPC水,充分溶解后,测定RNA的浓度。
取上述提取测好浓度的RNA每个样品的量按照Takara公司PrimerScript RT-PCR Kit建议反应体系:5×buffer 4ul;Enzyme mix 1ul;Oligo dT 1ul;Random primer 1ul;RNA模板含量1ug;DEPC水补齐至20ul。37℃加热15分钟后,85℃反应5秒,获得cDNA模板原液,最后双蒸水1:10稀释反转PCR产物作为Real-time PCR反应模板。Real-time PCR具体操作根据SYBR Premix Ex Ta(Takara)试剂盒说明书进行,最后置于ABI仪器中进行扩增。扩增条件如下:50℃,2分钟→95℃,10分钟→(95℃,15秒→60℃,1分钟)×40个循环。所用引物如下:
IL6-F:TCGAGCCCACCGGGAACGAA(SEQ ID NO:3);
IL6-R:GCAACTGGACCGAAGGCGCT(SEQ ID NO:4);
Wwox-F:GAACATCCAAAAACTGGAAAAAG(SEQ ID NO:5);
Wwox-R:CATCAGTTTCTTGTTCCCATCC(SEQ ID NO:6);
β-actin-F:CCTGCACCCACACAAT(SEQ ID NO:7);
β-actin-R:GGGCGGACTCGTCAAC(SEQ ID NO:8)。
1.2.4 Transwell小室迁移实验
用胰酶充分消化,终止消化后离心弃去培养基,用含0.2%BSA的无血清培养基重悬细胞,将8μm小室置于24孔板中,并在每个小室中加入200μl细胞稀释液(细胞数目根据不同细胞迁移能力不同做相应调整),小室底部加入600μl完全培养基。常规培养24-48小时后,取出小室,PBS润洗3遍,放在4%多聚甲醛PFA中固定30min,然后用0.1%结晶紫溶液染色30min,用棉球拭去小室内层的细胞,待小室底部干燥后,显微镜选取不同的视野拍照并使用ImageJ计数。
1.2.5凝胶迁移实验(Electrophoretic mobility shift assay,EMSA)
EMSA实验根据Thermo公司LightShift Chemilumininescent EMSA试剂盒说明书进行。生物素标记的STAT3探针(5’-AGCTTCATTTCCCGTAAATCCCTAAAGCT-3’(SEQ ID NO:9))购自Beyotime公司。使用Thermo公司细胞核质分离试剂盒提取细胞核物质,将提取物与结合缓冲液(50%甘油、100mM MgCl2、1%NP-40、1μg/μL poly(dI·dC)、100mM Tris、500mM KCl、10mM DTT)混匀后室温放置20min。用0.5XTBE准备非变性的聚丙烯酰胺凝胶,100V电压下在0.5XTBE缓冲液进行电泳,电泳样本直到溴酚蓝跑过凝胶总长度的2/3到3/4时。在0.5×TBE中浸泡尼龙膜至少10分钟;依照说明将胶合尼龙膜放于(夹住)清洁的电泳转移装置中。在380mA(~100V)中转移30分钟。转移完成后,将溴酚蓝部分的膜放于干的纸巾上进行DNA交联。添加20mL封闭缓冲液来对膜进行封闭,并轻柔摇动的情况下孵育15分钟。并与生物素标记的辣根过氧化物酶(1:300)一起温和摇动孵育15分钟。用Wash buffer洗4次,每次5分钟,加入底物平衡液轻微晃动下孵育5分钟。然后用化学发光试剂进行显影曝光。
1.2.6染色质免疫共沉淀(ChIP)
染色质免疫共沉淀是按照EZ-ChIP(Millipore)试剂盒说明来操作。简单来说,细胞室温下用1%的福尔马林室温摇床振荡10分钟,交联DNA。加入终浓度为0.125M的甘氨酸终止交联,室温摇床震荡5分钟。收集细胞离心去上清,用PBS洗涤细胞后,每管加入含有蛋白酶抑制剂的SDS裂解液重悬细胞。超声震碎细胞DNA,断裂为200-1000bp大小的片段,12000rpm 4℃离心10分钟。转移上清至EP管中,一部分用作Input使用,一部分加入IgG作为阴性对照,剩余部分加入相对性的抗体,4℃旋转过夜。再加入适量的已经洗好的Protein G Agarose到管中,4℃旋转2h,离心去上清,接着分别使用低盐、高盐、LiCl缓冲液分别4℃旋转5分钟洗beads,然后将洗涤缓冲液洗脱交联的DNA用DNA纯化柱抽提DNA并进行后续的PCR分析。ChIP所用引物如下:-750F,GAGCACTAAAAATG(SEQ ID NO:10);-1000R,TCACAATCGGTTTC(SEQ ID NO:11)。
1.2.7肿瘤细胞分泌的细胞因子检测
将相同数目的细胞接种在培养皿中,完全培养基37℃培养箱孵育24小时,让细胞完全贴壁,然后将培养基换为无血清的培养基,孵育48小时后,收集条件培养基,4℃2000g离心10分钟,将所得上清用于实验,按照Human Cytokine Atibody Arrays C5试剂盒说明进行操作。简单来说,用条件培养基将细胞因子Array 4℃孵育过夜,用Wash buffer室温洗涤Array 5次,每次5分钟。然后用生物素标记的抗体室温孵育Array 1.5-2小时。洗好Array后,用生物素标记好的HRP室温孵育2小时,用Wash buffer洗4次,每次5分钟,然后用化学发光试剂进行显影曝光。
1.2.8酶联免疫吸附测定(ELISA)检测IL-6的浓度
将相同数目的细胞接种在培养皿中,完全培养基37℃培养箱孵育48小时,收集条件培养基,4℃2000g离心10分钟,将所得上清用于实验,按照IL-6ELISA(Raybiotech)试剂盒说明书来操作。简单来说,将等量(100ul)的标准品和样品加入到小孔内,然后放在室温孵育2.5个小时。小孔洗好后,每个孔加入100ul的生物素抗体,室温孵育1个小时。洗涤后每孔再加入100ul的链霉亲和素溶液,室温孵育45分钟。用水洗好后每孔再加入100ul的反应底物,室温孵育30分钟。最后在加入50ul的终止液,立即用酶标仪检测450nm的吸光度值。使用已知浓度的纯的人细胞因子OD值做一个浓度的标准曲线,根据标准曲线算出样品中的细胞因子浓度。
1.2.9荧光素酶报告实验
将细胞铺到24孔板中,待细胞长到50%-60%细胞密度时,每个孔中转染STAT3报告基因质粒500ng,或500ng IL-6pGL3luciferase载体和50ng pRL-TK renilla载体,24小时后,细胞用IL-6处理6小时后,用Passive裂解液裂解细胞,使用Dual-Luciferase Reporter Assay System(Promega)在luminometer(Applied Biosystems)仪器上检测荧光素酶活性,计算Firefly/Renella值。
1.2.10小鼠异体移植瘤模型
所有的动物实验均得到中科院上海生命科学研究院营养科学研究所动物伦理委员会的批准,按照上海生命科学研究院动物保护与使用委员会批准的方案进行。5周龄的nu/nu裸鼠和6周大小的C57BL/6J购自上海斯莱克实验动物有限公司,饲养于SPF级动物房中。对于皮下成瘤实验,将细胞消化消化离心收集后重悬于含有30%基质胶Matrigel的无血清培养基中,然后向每只裸鼠腹股沟内注射1×106个细胞;每七天测量肿瘤的大小并计算肿瘤的体积(mm3)按照以下计算公式计算;1/2×a×b2,a为肿瘤的长度,b为肿瘤的宽度。小鼠处死后,取出肿瘤然后称重,计算每组肿瘤的平均重量,观察肝脏转移情况,取出的肝脏用多聚甲醛固定,用于后续的免疫组化分析,计算转移灶的数目。对于肺部转移模型,将细胞消化消化离心收集后用PBS重悬后,然后通过小鼠尾静脉注射4×105个细胞,注射后21天,取出小鼠的肺组织,用4%多聚甲醛PFA固定,石蜡包埋并进行后续的HE染色。显微镜观察染色后的肺组织切片,随机选取每只小鼠的5张组织切片,每张切片随机选取5个视野,统计并计算每组小鼠肺部转移灶的平均值。
1.2.11 Oncomine数据库和Kaplan Meier-plotter分析
简单来讲,我们通过在Oncomine数据库中对Wwox使用如下的搜索条件:P值≤0.05;fold-change≥2;基因位于差异基因表达的前10%。然后Oncomine数据库会罗列出符合条件的数据,并根据P值大小排序,对于每个来源于已发表文章的数据,每个原始芯片数据会以图表的形式显示出来,图片中每个样品的数值都已经通过Log2转化过,P值通过Student’s t-test计算得出。Wwox表达水平与乳腺癌病人生存率的统计数据来自http://kmplot.com/analysis/。简单来讲,在Wwox水平与病人生存率的关系分析中我们将病人群体的Wwox表达分为高表达组和低表达组。存活曲线中的数据均符合the best cut-off。Hazard ratios(HR)和P值(log rank p)均在曲线图中显示出来。
1.2.12免疫组织化学
乳腺癌组织芯片购自与上海芯超生物有限公司,免疫组化的实验步骤根据之前的操作步骤进行。简单地来说,首先在烘箱中烤一下组织芯片,再使用二甲苯进行脱蜡,使用梯度乙醇对TMA再水化,在Tris缓冲盐溶液中洗涤,通过链霉亲和素-生物素-过氧化物酶复合方法进行处理。在柠檬酸钠缓冲液(PH6.0)中进行抗原修复。在内源性过氧化物酶活性猝灭和阻断非特异性结合后,将组织芯片与一抗在4℃中孵育过夜,洗完后将组织芯片与相应的二抗室温孵育1小时。用Tris缓冲溶液进一步洗涤后,将芯片与StrepABComplex/辣根过氧化酶一起在室温孵育30分钟,使用0.05%3,3’-二氨基联苯胺进行显色免疫定位,使用苏木精复染。组织芯片中Wwox和p-STAT3蛋白的表达强度的鉴定主要采用双盲的打分方式,具体规则如下:0,阴性;1,很少量的细胞(<5%)显示弱的淡棕色;2,少量的细胞(<10%)显示较弱到中等棕色;3,少量的细胞(<10%)显示中等到深棕色;4,大量的细胞(>10%)显示中等到深棕色;5,大量的细胞(>20%)显示中等到深棕色。
1.2.13重组细胞的构建
过表达Wwox的重组细胞的建立
重组表达Wwox的重组载体的构建:以人cDNA为模板,以cgcggatccatggcagcgctgcgcta和acgcgtcgacttagccggactggctgcc为引物,扩增获得扩增产物,插入到PCMV载体的BamHI/SalI位点中。
将上述构建的过表达重组载体转化Basal-like型乳腺癌细胞系SUM159,HBL100,MDA-MB-231,获得过表达Wwox的重组细胞。
过表达STAT3C的重组细胞的建立
重组表达STAT3C的重组载体的构建:以STAT3C质粒为模板,以tccaagcttgcccaatggaatcagctac(SEQ ID NO:12)和ttatctcgagtcacatgggggaggtagcg(SEQ ID NO:13)为引物,扩增获得扩增产物,插入到PCMV载体的kpnI/salI位点中。
将上述构建的过表达重组载体转化小鼠成纤维细胞NIH3T3细胞,获得过表达STAT3C的重组细胞。
过表达v-Src的重组细胞
重组表达v-Src的重组载体的构建:以Src质粒为模板,以ATGGGCAGCAACAAGAGC(SEQ ID NO:14)和CTATAGGTTCTCCCCGGG(SEQ ID NO:15)为引物,扩增获得扩增产物,插入到PCMV载体的kpnI/saiI位点中。
将上述构建的过表达重组载体转化小鼠成纤维细胞NIH3T3细胞,获得过表达v-Src的重组细胞。
Wwox、STAT3C过表达的NIH3T3细胞的建立
将如前述获得的重组表达Wwox的重组载体、重组表达STAT3C的重组载体共同转化小鼠成纤维细胞NIH3T3细胞,获得Wwox、STAT3C过表达的NIH3T3细胞。
Wwox、v-Src过表达的NIH3T3细胞的建立
将如前述获得的重组表达Wwox的重组载体、重组表达v-Src的重组载体共同转化小鼠成纤维细胞NIH3T3细胞,获得Wwox、v-Src过表达的NIH3T3细胞。
Wwox过表达细胞-SUM159
将如前述获得的重组表达Wwox的重组载体转化SUM159细胞,获得Wwox过表达细胞-SUM159。
Wwox下调的细胞中(MCF-7)的建立(siRNA)
合成的Wwox siRNA序列(ccatacggatgggaacaagaa(SEQ ID NO:16))使用Lipofectamine2000转染,方法参照产品说明书。对于6孔板的一个孔,转染剂量为5ul Wwox siRNA。为了检测Wwox对STAT3磷酸化的影响,在转染后24小时,再分别在特定时间点加入等量的LPS处理细胞
在细胞中上调或下调基因表达的其它宿主细胞的构建方法同上。
1.2.14数据统计
所有的体外实验重复至少三次,所有的体内实验至少进行两次。且以mean±SD的形式表示;unpaired two-tailed Student’s t-test用于评价各种细胞水平和小鼠肿瘤实验的统计显著性,通过Kaplan-Meier方法计算病人的生存曲线,不同组间的统计学差异是用log-rank test的方法计算,分析乳腺癌病人样本中的临床特征和Wwox和p-STAT3的表达关系是用Chi square test方法分析。绘图和P值得计算是用Graphprism 5.0,p<0.05认为具有统计的显著性差异。
实施例1、在乳腺癌细胞系和乳腺癌病人样本中检测发现Wwox
为了探究Wwox和p-STAT3在乳腺癌中的表达情况,本发明人利用Western检测12种乳腺癌细胞,发现在Luminal型乳腺癌细胞中Wwox高表达,而STAT3则低表达。在基底细胞样(Basal-like)型乳腺癌细胞中STAT3高度活化,而Wwox是低表达状态(图1a)。
并且,在Basal-like型乳腺癌细胞系中(SUM159,HBL100,MDA-MB-231)过表达Wwox,可以明显降低STAT3的磷酸化水平(图1b)。
此外,发明人通过免疫组化检测了90例三阴乳腺癌病人样本中Wwox和p-STAT3的表达水平,发现几乎在所有的三阴乳腺癌样本中Wwox的表达检测不到,而STAT3的活化水平是明显增高的(图1c,d)。
图1的结果表明,在乳腺癌细胞系和乳腺癌样本中,Wwox的表达和STAT3的活性呈现负相关关系。
实施例2、Wwox可以抑制乳腺癌细胞的转移和生长
为了研究Wwox在乳腺癌进程中的作用,首先发明人通过Tranwell迁移实验发现,在Basal-like乳腺癌细胞(SUM159,MDA-MB-231)中过表达Wwox可以明显抑制细胞的迁移能力(图2a,b)。
接下来,发明人通过原位乳腺脂肪垫体内观察Wwox对于乳腺癌增殖和转移的影响。通过体内注射MDA-MB-231对照细胞和Wwox过表达细胞,发现Wwox可以明显抑制肿瘤的生长,肿瘤的大小明显减少,肿瘤的肝脏转移数量也明显减少。以上体内和体外实验都证明,Wwox可以显著地抑制乳腺癌的转移(图2c-h)。
为了研究Wwox是通过抑制STAT3的磷酸化来影响肿瘤进程的直接证据,发明人在NIH3T3细胞中过表达STAT3C(STAT3持续活化的状态)和v-Src(可以诱导STAT3的持续活化)。在裸鼠皮下成瘤实验中也发现,Wwox可以明显抑制由于STAT3活化而引起的肿瘤生长。Wwox过表达的改造NIH3T3细胞的肿瘤的大小和生长速率明显降低(图2i-n)。
实施例3、Wwox通过特定的结构域和STAT3相互作用
根据以上研究结果,本发明人认为Wwox与STAT3之间可能也存在相互作用,通过免疫共沉淀(IP)实验在293T细胞中分别过表达外源性的Wwox和STAT3(图3a),证明两者之间存在相互作用。
进一步通过IP实验发现在MCF-10A,MCF-7和T47D细胞中,内源性STAT3和Wwox两者之间也存在相互作用(图3b)。
本发明人分别构建和表达Wwox和STAT3的不同片段,截短体的建立如图3c,f,过表达于293T细胞(此处过表达于哪一具体细胞)。通过免疫沉淀实验发现,Wwox是通过WW1结构域(存在于SEQ ID NO:2中第1~54位)和STAT3相互作用(图3c,d),而STAT3是通过coiled-coil结构域和Wwox相互作用(图3e,f)。
实施例4、Wwox可以通过抑制STAT3的磷酸化影响STAT3的转录活性
为了鉴别Wwox是否会影响STAT3的转录活性,发明人通过荧光素酶报告实验来观察STAT3报告基因的变化。发现过表达Wwox抑制IL-6诱导的STAT3转录活性的升高,而下调Wwox的表达促进IL-6诱导的STAT3转录活性的升高(图4a,b)。
为了阐明Wwox对于STAT3转录活性抑制作用的分子机制,发明人通过凝胶迁移实验去检测Wwox是否影响STAT3DNA结合的能力。IL-6可以促进STAT3的DNA结合能力,而在SUM159或者HBL100中过表达Wwox,可以减弱IL-6对于STAT3的结合能力(图4c)。
发明人也发现在SUM159细胞中过表达Wwox,可以降低IL-6促使的p-STAT3的聚集(图4d),而在Wwox下调的细胞中(MCF-7)可以进一步促进IL-6对于STAT3的活化能力(图4e)。
发明人用细胞因子刺激来观察STAT3的磷酸化。通过Western Blot检测发现在Wwox下调的MCF-7细胞中,用IL-6刺激不同的时间点,可以发现p-STAT3的蛋白水平峰值是明显高于对照组(图4f),而在Wwox过表达细胞-SUM159中,IL-6刺激下的p-STAT3的蛋白峰值是明显低于对照组(图4g)。
图4结果表明,Wwox是通过影响STAT3的磷酸化来抑制STAT3的活化状态。
实施例5、Wwox通过特定结构域和JAK2相互作用
JAK2/STAT3信号通路已经被报道参与许多肿瘤进程,其中就包括乳腺癌。发明人通过免疫沉淀实验,在293T细胞中过表达外源性JAK2和Wwox,证明两者之间存在相互作用(图5a)。
进一步通过IP实验发现,在MCF-10A和T47D细胞中,内源性的JAK2和Wwox之间也存在相互作用(图5b)。
通过构建一系列编码JAK2和Wwox不同片段的质粒,表达于293T细胞中,免疫沉淀实验发现,JAK2和Wwox的第一个WW结构域结合(图5c),而Wwox是通过JAK2的TycKc结构域和JAK2相互作用(图5d,e)。
实施例6、Wwox通过抑制JAK2磷酸化和STAT3之间的结合,抑制STAT3磷酸化
接下来,发明人检测Wwox是否会影响JAK2的磷酸化。在基底样细胞MDA-MB-231中过表达Wwox,可以抑制IL-6介导的STAT3和JAK2磷酸化的增加(图6a)。
并且在IL-6的刺激下,JAK2和Wwox之间的相互作用是增强的(图6b)。为了证明Wwox是否可以抑制JAK2和STAT3之间的相互作用,发明人在Wwox下调的MCF-7细胞(此处具体是MCF-7细胞)检测JAK2和STAT3之间的相互作用。实验结果发现JAK2和STAT3之间的相互作用增强(图6c)。
实施例7、Wwox的磷酸化可以影响STAT3的活化
将Wwox截短体或突变体过表达于293T细胞中,该细胞同时过表达全长的STAT3和JAK2。
发明人首先检测了Wwox和JAK2、STAT3相互作用结构域的截短体对STAT3和JAK2的影响。可以发现Wwox截短体(1~104aa)可以抑制JAK2和STAT3的磷酸化水平(图7a),并且过表达Wwox截短体可以抑制JAK2和STAT3之间的相互作用(图7b)。
此外,发明人发现在Wwox第一个WW结构域上有几个磷酸化位点对于Wwox和其他蛋白相互作用的重要性。通过点突变将可能的磷酸化位点突变,发现S14A和T49A突变后,Wwox(全长)与JAK2之间的相互作用是减弱的(图7c)。
并且当Wwox S14A或者T49A过表达后,JAK2和STAT3之间的相互作用和野生型Wwox相比是增强的(图7d)。
发明人通过荧光素酶报告实验发现,过表达WwoxS14A或者T49A不能抑制IL-6诱导的STAT3转录活性的升高(图7e)。并且WwoxS14A或者T49A不能抑制STAT3的磷酸化(图7f)。
图7结果表明,Wwox通过抑制JAK2磷酸化STAT3。
实施例8、Wwox通过STAT3抑制IL-6的表达
STAT3作为一个转录因子发挥功能,所以发明人认为Wwox在STAT3介导的转录活性中发挥作用。所以探究一下Wwox在基底样乳腺癌细胞分泌细胞因子中的作用。利用RayBio人的细胞因子阵列来筛选细胞条件性培养基中细胞因子的变化。在筛选的80种细胞因子中,过表达Wwox的SUM159细胞培养基上清和对照相比,IL-6的分泌水平下降得最为明显(图8a)。
进一步用ELISA检测了IL-6的蛋白水平。和对照组细胞相比,过表达Wwox可以明显抑制IL-6的蛋白水平(图8b)。
进一步发现基底样乳腺癌细胞中IL-6的mRNA水平是明显高于Luminal型乳腺癌细胞系。而在Luminal型乳腺癌细胞中Wwox的mRNA却是明显高于基底样乳腺癌细胞。进一步通过ELISA分析发现,基底样乳腺癌细胞系分泌的IL-6至少比Luminal细胞中高80倍(图8c~d)。
这些结果提示,Wwox会抑制基底样细胞中IL-6的mRNA和蛋白水平。为了确认Wwox是否会调节IL-6的转录,构建含有IL-6启动子不同区域的报告基因。在细胞中分别过表达IL-6启动子的报告基因和Wwox,可以发现Wwox可以明显抑制IL-6启动子介导的荧光素酶活性(图8e)。
染色质免疫共沉淀实验发现,STAT3可以直接结合到IL-6的启动子区域,进一步过表达Wwox,发现可以明显抑制STAT3和IL-6启动子的结合(图8f)。
图8结果显示,Wwox可以抑制STAT3介导的IL-6的转录激活。
实施例9、乳腺癌中Wwox的高表达和病人临床预后呈现正相关关系
为了了解Wwox的表达和临床预后之间的关系,发明人检测了临床样本中Wwox的表达水平。获取了来自Oncomine数据库的芯片结果。首先本发明人分析了不同类型乳腺癌中Wwox的mRNA表达水平。和正常的乳腺组织相比,其它类型的乳腺癌中Wwox的mRNA都是降低的,如图9a~c。
本发明人通过免疫组化检测了150例乳腺癌样本中Wwox的表达情况。通过Kaplan-Meier分析发现,Wwox高表达的乳腺癌患者(n=83,中位生存时间116个月)的生存时间是明显高于Wwox低表达的乳腺癌患者(n=67,中位生存时间是89个月)通过来自于Kaplan Meier-plotter网站的数据发现(130),低表达Wwox的乳腺癌患者(n=1977)的无复发生存率是明显低于Wwox高表达的患者(n=1974),如图9d~e。
这些临床数据提示,Wwox的表达是乳腺癌恶性程度的预后指标。
实施例10、筛选方法
设置:
测试组:NIH3T3细胞(其中同时表达Wwox、JAK2、STAT3),并给予候选物质;
对照组:NIH3T3细胞(其中同时表达Wwox、JAK2、STAT3),不给予候选物质。
分别检测测试组和对照组中Wwox、JAK2、STAT3的相互作用情况,并进行比较。如果测试组中Wwox与JAK2或Wwox与STAT3的相互作用在统计学上发生增强(如增强30%或更高)对照组,就表明该候选物是抑制抑制IL-6的合成或预防或治疗体内STAT3异常活化所引起的肿瘤的潜在物质。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110> 中国科学院上海生命科学研究院
<120> Wwox作为防治癌症的药物靶点的应用
<130> 181733
<160> 16
<170> SIPOSequenceListing 1.0
<210> 1
<211> 1245
<212> DNA
<213> Homo sapiens
<400> 1
atggcagcgc tgcgctacgc ggggctggac gacacggaca gtgaggacga gctgcctccg 60
ggctgggagg agagaaccac caaggacggc tgggtttact acgccaatca caccgaggag 120
aagactcagt gggaacatcc aaaaactgga aaaagaaaac gagtggcagg agatttgcca 180
tacggatggg aacaagaaac tgatgagaac ggacaagtgt tttttgttga ccatataaat 240
aaaagaacca cctacttgga cccaagactg gcgtttactg tggatgataa tccgaccaag 300
ccaaccaccc ggcaaagata cgacggcagc accactgcca tggaaattct ccagggccgg 360
gatttcactg gcaaagtggt tgtggtcact ggagctaatt caggaatagg gttcgaaacc 420
gccaagtctt ttgccctcca tggtgcacat gtgatcttgg cctgcaggaa catggcaagg 480
gcgagtgaag cagtgtcacg cattttagaa gaatggcata aagccaaggt agaagcaatg 540
accctggacc tcgctctgct ccgtagcgtg cagcattttg ctgaagcatt caaggccaag 600
aatgtgcctc ttcatgtgct tgtgtgcaac gcagcaactt ttgctctacc ctggagtctc 660
accaaagatg gcctggagac cacctttcaa gtgaatcatc tggggcactt ctaccttgtc 720
cagctcctcc aggatgtttt gtgccgctca gctcctgccc gtgtcattgt ggtctcctca 780
gagtcccatc gatttacaga tattaacgac tccttgggaa aactggactt cagtcgcctc 840
tctccaacaa aaaacgacta ttgggcgatg ctggcttata acaggtccaa gctctgcaac 900
atcctcttct ccaacgagct gcaccgtcgc ctctccccac gcggggtcac gtcgaacgca 960
gtgcatcctg gaaatatgat gtactccaac attcatcgca gctggtgggt gtacacactg 1020
ctgtttacct tggcgaggcc tttcaccaag tccatgcaac agggagctgc caccaccgtg 1080
tactgtgctg ctgtcccaga actggagggt ctgggaggga tgtacttcaa caactgctgc 1140
cgctgcatgc cctcaccaga agctcagagc gaagagacgg cccggaccct gtgggcgctc 1200
agcgagaggc tgatccaaga acggcttggc agccagtccg gctaa 1245
<210> 2
<211> 414
<212> PRT
<213> 智人(Homo sapiens)
<400> 2
Met Ala Ala Leu Arg Tyr Ala Gly Leu Asp Asp Thr Asp Ser Glu Asp
1 5 10 15
Glu Leu Pro Pro Gly Trp Glu Glu Arg Thr Thr Lys Asp Gly Trp Val
20 25 30
Tyr Tyr Ala Asn His Thr Glu Glu Lys Thr Gln Trp Glu His Pro Lys
35 40 45
Thr Gly Lys Arg Lys Arg Val Ala Gly Asp Leu Pro Tyr Gly Trp Glu
50 55 60
Gln Glu Thr Asp Glu Asn Gly Gln Val Phe Phe Val Asp His Ile Asn
65 70 75 80
Lys Arg Thr Thr Tyr Leu Asp Pro Arg Leu Ala Phe Thr Val Asp Asp
85 90 95
Asn Pro Thr Lys Pro Thr Thr Arg Gln Arg Tyr Asp Gly Ser Thr Thr
100 105 110
Ala Met Glu Ile Leu Gln Gly Arg Asp Phe Thr Gly Lys Val Val Val
115 120 125
Val Thr Gly Ala Asn Ser Gly Ile Gly Phe Glu Thr Ala Lys Ser Phe
130 135 140
Ala Leu His Gly Ala His Val Ile Leu Ala Cys Arg Asn Met Ala Arg
145 150 155 160
Ala Ser Glu Ala Val Ser Arg Ile Leu Glu Glu Trp His Lys Ala Lys
165 170 175
Val Glu Ala Met Thr Leu Asp Leu Ala Leu Leu Arg Ser Val Gln His
180 185 190
Phe Ala Glu Ala Phe Lys Ala Lys Asn Val Pro Leu His Val Leu Val
195 200 205
Cys Asn Ala Ala Thr Phe Ala Leu Pro Trp Ser Leu Thr Lys Asp Gly
210 215 220
Leu Glu Thr Thr Phe Gln Val Asn His Leu Gly His Phe Tyr Leu Val
225 230 235 240
Gln Leu Leu Gln Asp Val Leu Cys Arg Ser Ala Pro Ala Arg Val Ile
245 250 255
Val Val Ser Ser Glu Ser His Arg Phe Thr Asp Ile Asn Asp Ser Leu
260 265 270
Gly Lys Leu Asp Phe Ser Arg Leu Ser Pro Thr Lys Asn Asp Tyr Trp
275 280 285
Ala Met Leu Ala Tyr Asn Arg Ser Lys Leu Cys Asn Ile Leu Phe Ser
290 295 300
Asn Glu Leu His Arg Arg Leu Ser Pro Arg Gly Val Thr Ser Asn Ala
305 310 315 320
Val His Pro Gly Asn Met Met Tyr Ser Asn Ile His Arg Ser Trp Trp
325 330 335
Val Tyr Thr Leu Leu Phe Thr Leu Ala Arg Pro Phe Thr Lys Ser Met
340 345 350
Gln Gln Gly Ala Ala Thr Thr Val Tyr Cys Ala Ala Val Pro Glu Leu
355 360 365
Glu Gly Leu Gly Gly Met Tyr Phe Asn Asn Cys Cys Arg Cys Met Pro
370 375 380
Ser Pro Glu Ala Gln Ser Glu Glu Thr Ala Arg Thr Leu Trp Ala Leu
385 390 395 400
Ser Glu Arg Leu Ile Gln Glu Arg Leu Gly Ser Gln Ser Gly
405 410
<210> 3
<211> 20
<212> DNA
<213> 引物(Primer)
<400> 3
tcgagcccac cgggaacgaa 20
<210> 4
<211> 20
<212> DNA
<213> 引物(Primer)
<400> 4
gcaactggac cgaaggcgct 20
<210> 5
<211> 23
<212> DNA
<213> 引物(Primer)
<400> 5
gaacatccaa aaactggaaa aag 23
<210> 6
<211> 22
<212> DNA
<213> 引物(Primer)
<400> 6
catcagtttc ttgttcccat cc 22
<210> 7
<211> 16
<212> DNA
<213> 引物(Primer)
<400> 7
cctgcaccca cacaat 16
<210> 8
<211> 16
<212> DNA
<213> 引物(Primer)
<400> 8
gggcggactc gtcaac 16
<210> 9
<211> 29
<212> DNA
<213> 引物(Primer)
<400> 9
agcttcattt cccgtaaatc cctaaagct 29
<210> 10
<211> 14
<212> DNA
<213> 引物(Primer)
<400> 10
gagcactaaa aatg 14
<210> 11
<211> 14
<212> DNA
<213> 引物(Primer)
<400> 11
tcacaatcgg tttc 14
<210> 12
<211> 28
<212> DNA
<213> 引物(Primer)
<400> 12
tccaagcttg cccaatggaa tcagctac 28
<210> 13
<211> 29
<212> DNA
<213> 引物(Primer)
<400> 13
ttatctcgag tcacatgggg gaggtagcg 29
<210> 14
<211> 18
<212> DNA
<213> 引物(Primer)
<400> 14
atgggcagca acaagagc 18
<210> 15
<211> 18
<212> DNA
<213> 引物(Primer)
<400> 15
ctataggttc tccccggg 18
<210> 16
<211> 21
<212> DNA
<213> 引物(Primer)
<400> 16
ccatacggat gggaacaaga a 21
- 还没有人留言评论。精彩留言会获得点赞!