一种具有三个连续手性中心的八氢吖啶骨架及其制备方法与流程
本发明属于有机化合物以及不对称有机催化合成技术领域,具体涉及一种具有三个连续手性中心的八氢吖啶骨架及其制备方法。
背景技术
含氮杂环大量存在于天然产物和药物分子结构中,其中四氢喹啉结构就表现出非常重要的生物活性。八氢吖啶含有四氢喹啉核心结构,具有潜在的生物活性,1,2,3,4,4a,9,9a,10-八氢吖啶就是一种非常重要的胃酸分泌抑制剂和抗疟疾的试剂;八氢吖啶的衍生物在药物、农药以及荧光探针等领域均有应用,基于八氢吖啶这类结构在药物化学具有非常重要的研究价值,因而研发具有八氢吖啶结构的骨架对合成八氢吖啶的衍生物具有重要的意义。
目前,合成八氢吖啶骨架的主要合成方法有酸催化的异佛尔酮与苯胺缩合反应、肟磺酸盐的贝克曼重排、吖啶的催化氢化、香叶苯胺的氨基克莱森重排酸催化的氮杂的d/a反应等,但是上述方法合成的八氢吖啶骨架是消旋的,不具备光学活性。为获得具有光学活性的八氢吖啶骨架,chenm.w等通过吖啶的不对称氢转移动力学拆分来获得具有三个连续手性中心的八氢吖啶(chenm.w.;caix.f.;chenz.p.;chenzh.p.;shi,l.;zhou,y.g.chem.commun.,2014,50(83):12526–12529.)。dickmeiss,g等利用胺类催化剂催化的丙二氰衍生物和α,β-不饱和醛先生成一个中间产物再和苯胺缩合串联反应来构建官能团化的八氢吖啶结构(dickmeiss,g.;jensen,k.l.;worgull,d.;franke,p.t.;
技术实现要素:
本发明的目的是提供一种产率高、对映体选择性高、工艺简单和普适性高的具有三个连续手性中心的八氢吖啶骨架及其制备方法。
本发明这种具有三个连续手性中心的八氢吖啶骨架,其结构式如下:
其中:r1为h、f、cl、br、i、me和ome中的一种;r2为ts、phso2、4-clphso2、4-no2phso2、4-cf3phso2和ch3so2中的一种;n为0或1或2。
本发明这种具有三个连续手性中心的八氢吖啶骨架的合成路线如下:
本发明这种具有三个连续手性中心的八氢吖啶骨架的制备方法,包括以下步骤:
1)将化合物1溶解于由吡啶和甲苯组成的混合溶剂中,接着加入催化剂,混匀后,加入化合物2,然后立即将其置于恒温冰浴中进行反应,反应完成后,得到反应液;
2)将步骤1)中的反应液过色谱柱进行纯化,得到白色固体,烘干后,即得八氢吖啶骨架。
所述步骤1)中,化合物1、催化剂和化合物2的摩尔比为1:(0.15~0.25):(2~3),化合物1与混合溶剂的摩尔体积比为(0.15~0.25)mmol/ml,吡啶与甲苯的比例为7:(2~4)。
所述步骤1)中,恒温冰浴需要维持反应温度为0℃,反应时间为10~48h,反应完成后进行点板,确认反应完全。
所述步骤2)中,过色谱柱采用体积比为(10~25)%乙酸乙酯和石油醚作为洗脱剂。
本发明的反应机理,如下所示:
本发明的反应主要是通过氮杂的diels-alder反应实现的。n-保护的邻氨基苯甲醛(化合物1)在二级胺(催化剂)和极性溶剂的作用下,化合物1首先脱掉了带酸性的氮-氢,接着异构化形成氮杂双烯的中间体;同时催化剂又可以通过亚胺形式来活化环烯酮(化合物2),形成相应的亚胺离子int-i;活泼的氮杂双烯体又和催化剂通过氢键结合稳定,得到一个过渡态ts;紧接着与int-i发生一个[4+2]的环加成反应,得到中间体int-ii,随着催化剂的脱去,获得八氢吖啶骨架。
本发明的有益效果:1)本发明提供的这种八氢吖啶骨架具有三个连续手性中心和两个活泼官能团,而且该骨架结构特殊,同一个环上新生成的三个键(a,b,c)朝向一致,易于衍生化成结构更为复杂的分子;2)本发明根据氮杂的diels-alder反应的原理,采用了硅烷修饰的4-羟基脯氨酸作为催化剂,使得反应更为简单,获得的产品产率更高;同时在该催化剂的作用下,使得生成新生成的三个键朝向一致,且结构稳定;4)本发明在制备过程中形成了一个氮杂双烯的中间体,可以用于合成更加复杂的杂环体系,简化制备工艺,而且生成的吖啶骨架对映体选择性更高。5)本发明的原料易获得,反应条件温和,底物普适性强。无需使用除水除氧这种严苛的反应条件,制备工艺简单,产率最高可达99%,对映体选择性最高可达99%。
附图说明
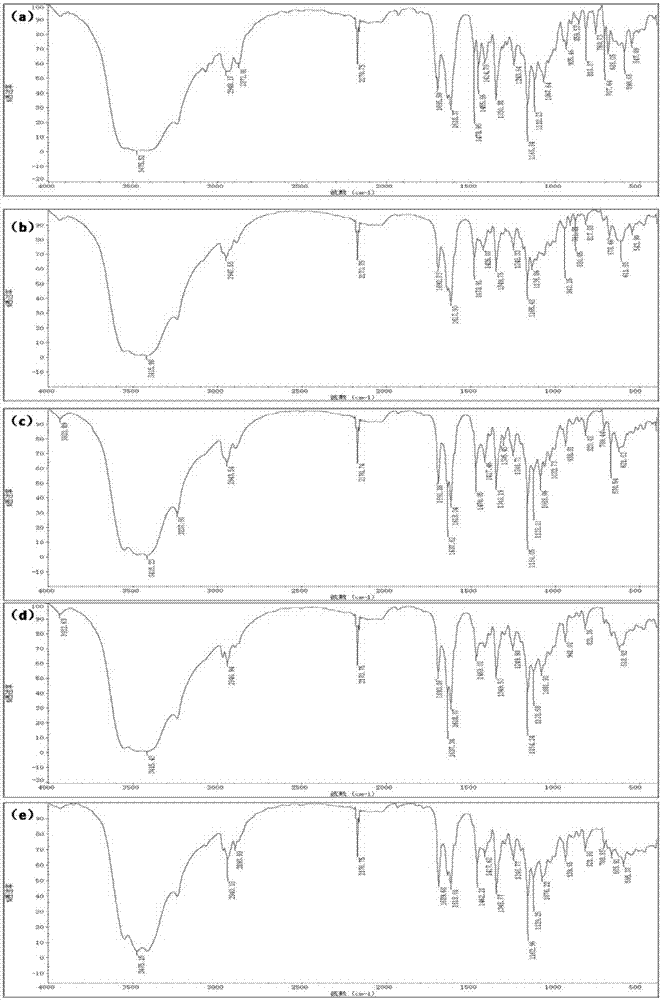
图1为本发明实施例1~5所制备的八氢吖啶骨架的红外图谱,a)实施例1;b)实施例2;c)实施例3;d)实施例4;e)实施例5。
图2为本发明实施例6~10所制备的八氢吖啶骨架的红外图谱,a)实施例6;b)实施例7;c)实施例8;d)实施例9;e)实施例10。
图3为本发明实施例11~15所制备的八氢吖啶骨架的红外图谱,a)实施例11;b)实施例12;c)实施例13;d)实施例14;e)实施例15。
图4为实施例1的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图5为实施例2的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图6为实施例3的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图7为实施例4的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图8为实施例5的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图9为实施例6的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图10为实施例7的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图11为实施例8的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图12为实施例9的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图13为实施例10的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图14为实施例11的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图15为实施例12的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图16为实施例13的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图17为实施例14的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
图18为实施例15的产物的液相图谱(a),产物所对应的消旋体的液相图谱(b)。
具体实施方式
实施例中液相测试条件为:流动相为体积比为80:20的正己烷和异丙醇;检测为紫外检测,检测波长为254nm,测试温度为30℃;旋光度是指当平面偏振光通过含有某些光学活性的化合物液体或溶液时,能引起旋光现象,使偏振光的平面向左或向右旋转,其计算公式为[α]td=α/(l*c),其中,α是旋光仪测定的度数、t是测定时的温度(一般为20℃)、d是指旋光仪光源纳米的d线波长(λ=589nm)、l指测定管长度(dm)、c指溶液浓度(g/ml)。ee值即对映体过量值,它表示一个对映体(r)对另一个对映体(s)的过量,通常用百分数表示,其计算公式为ee=(r-s)/(r+s)。
实施例1
将0.2mmoln-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为25%的乙酸乙酯和石油醚进行洗脱,得到白色固体69.8mg,产率94%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图1(a)所示,从图1(a)可知,其在3475,2948,2872,2171,1695,1618,1479,1456,1415,1350,1244,1166,1122,1068,935,860,818,708,686,591,547cm-1处有特征吸收峰。
核磁测试的结果如下:1hnmr(400mhz,cdcl3):δ=7.69(dd,j=1.2,8hz,1h),7.47-7.39(m,1h),7.33-7.22(m,2h),7.23-7.17(m,2h),7.16-7.09(m,2h),4.65-4.55(m,1h),4.11(d,j=11.2hz,1h),3.37(dd,j=4,11.6hz,1h),2.93(q,j=4hz,1h),2.35(s,3h),2.21-1.96(m,3h),1.92-1.76(m,2h);
13cnmr(400mhz,cdcl3):δ=213.6,144.3,138.2,134.2,134.0,129.6,127.9,127.0,126.6,123.8,68.4,58.0,54.9,41.7,32.2,21.6,18.7。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h21no4s[m+na]+394.1083,found:394.1087.
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度的测试结果为[α]20d=108.4(c0.51,ch2cl2),本实施例的产物是具备光学活性的。
高效液相色谱的测试结果如图4所示,结构如下:图4(a)主要有两个吸收峰t1=15.08min(minor),t2=18.34min(major),ee90%,通过与所对应的消旋体对比(图4b),本实施例的产物非消旋体,具有光学活性。
实施例2
将0.2mmol5-氟-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为25%的乙酸乙酯和石油醚洗脱,得到白色固体69.8mg,产率94%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图1(b)所示,本实施例的产物在3416,2948,2171,1693,1479,1426,1350,1248,1165,1137,942,911,880,818,679,612,544cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.59-7.53(d,j=8hz,1h),7.28-7.18(m,3h),7.13(d,j=8hz,2h),7.08(d,j=8hz,1h),4.58-4.53(m,1h),4.10(d,j=12hz,1h),3.34(dd,j=4,12hz,1h),2.90(q,j=4hz,1h),2.66,2.57(m,1h),2.36(s,6h),2.22-1.94(m,3h),1.89-1.79(m,2h);
13cnmr(400mhz,cdcl3):δ=213.5,144.5,144.0,140.9,127.0,114.7,111.4,111.1,77.4,77.0,76.7,68.2,54.7,41.7,32.2,21.6,18.7。
质谱测试结果为hrms(esi)m/zcalculatedforc20h20nfo4s[m+na]+412.0989,found:412.0996。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=174.0(c0.3,ch2cl2),本实施例的产物是具备光学活性的。
高效液相测试结果如图5所示,由图可知,图5(a)中有两个特征吸收峰t1=15.03min(minor),t2=18.07min(major),ee87%,通过与所对应的消旋体对比(图5b),本实施例的产物非消旋体,具有光学活性。
实施例3
将0.2mmol5-氯-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为15%的乙酸乙酯和石油醚洗脱,得到白色固体77.8mg,产率96%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图1(c)所示,本实施例的产物在3929,3415,3237,2944,2171,1692,1638,1618,1470,1417,1349,1305,1249,1164,1128,1088,1033,934,820,709,670,622cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.62(d,j=8hz,1h),7.44-7.39(m,1h),7.28-7.21(m,3h),7.18-7.14(m,2h),4.61-4.54(m,1h),4.15(d,j=12hz,1h),3.38-3.26(m,1h),2.94(q,j=4hz,1h),2.62(d,j=16hz,1h),2.37(s,3h),2.24-2.07(m,2h),2.06-1.96(m,1h),1.94-1.67(m,3h);
13cnmr(400mhz,cdcl3):δ=213.4,144.6,139.9,132.7,129.8,128.7,128.0,127.0,124.2,68.1,58.0,54.6,41.7,32.1,21.6,18.7。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h20no4scl[m+na]+428.0694,found:428.0693。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=99.5(c0.58,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图6所示,由图可知,图6(a)中有两个特征吸收峰t1=15.63min(minor),t2=18.31min(major),ee93%;通过与所对应的消旋体对比(图6b),本实施例的产物非消旋体,具有光学活性。
实施例4
将0.2mmol5-溴-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为16%的乙酸乙酯和石油醚洗脱,得到白色固体88.9mg,产率99%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图1(d)所示,本实施例的产物在3933,3415,2941,2171,1693,1637,1618,1469,1349,1250,1164,1129,1082,941,821,619cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.59-7.54(m,2h),7.44-7.39(m,1h),7.28-7.20(m,2h),4.60-4.54(m,1h),4.14(d,j=12hz,1h),3.33(dd,j=4,12,1h),2.93(q,j=4hz,1h),2.67-2.58(m,1h),2.37(s,3h),2.25-2.07(m,2h),2.06-1.95(m,1h),1.93-1.72(m,1h);
13cnmr(400mhz,cdcl3):δ=213.3,144.6,140.1,133.8,133.4,131.0,129.8,128.9,127.2,127.0,120.7,68.0,58.0,54.6,41.7,32.1,21.6,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h20no4sbr[m+na]+472.0189,found:472.0177。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=132.5(c0.58,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图7所示,由图可知,图7(a)中有两个特征吸收峰t1=8.87min(minor),t2=17.56min(major);ee92%,通过与所对应的消旋体对比(图7b),本实施例的产物非消旋体,具有光学活性。
实施例5
将0.2mmol5-碘-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为20%的乙酸乙酯和石油醚洗脱,得到白色固体97.4mg,产率98%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图1(e)所示,本实施例的产物在3475,2940,2894,2171,1690,1618,1462,1418,1349,1247,1163,1129,1076,940,822,709,666,595cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.77-7.73(m,1h),7.62(dd,j=4,8hz,1h),7.43(d,j=8hz,1h),7.28-7.21(m,2h),7.20-7.14(m,2h),4.59-4.53(m,1h),4.13(d,j=12,1h),3.32(dd,j=4,12hz,1h),2.91(q,j=4hz,1h),2.63(d,j=1.6,1h),2.38(s,3h),2.26-2.07(m,2h),2.07-1.95(m,1h),1.93-1.72(m,2h);
13cnmr(400mhz,cdcl3):δ=213.3,144.6,140.1,137.0,133.0,129.8,129.1,127.0,92.0,68.0,58.0,54.6,41.7,32.0,21.6,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h20no4si[m+na]+520.0050,found:520.0049。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=112.3(c0.58,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图8所示,由图可知,图8(a)中有两个特征吸收峰t1=9.35min(minor),t2=18.54min(major);ee95%;通过与所对应的消旋体对比(图8b),本实施例的产物非消旋体,具有光学活性。
实施例6
将0.2mmol5-甲基-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应11h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为20%的乙酸乙酯和石油醚洗脱,得到白色固体73.2mg,产率95%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图2(a)所示,本实施例的产物在3415,2939,2171,1696,1638,1618,1484,1421,1346,1247,1163,821,624cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.54(d,j=8hz,1h),7.29-7.18(m,1h),7.16-7.11(m,2h),7.11-7.06(m,1h),4.63-4.50(m,1h),4.10(d,j=12hz,1h),3.34(dd,j=4,8hz,1h),2.89(q,j=4hz,1h),2.66-2.57(m,1h),2.35(s,6h),2.22-1.95(m,3h),1.90-1.79(m,2h);
13cnmr(400mhz,cdcl3):δ=213.7,144.1,137.8,136.5,134.1,129.58,128.55,127.21,127.04,124.3,68.5,57.7,54.8,41.7,32.2,21.56,21.27,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc21h23no4s[m+na]+408.1240,found:408.1237。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=123.8(c0.65,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图9所示,由图可知,图9(a)中有两个特征吸收峰t1=11.30min(minor),t2=14.13min(major);ee86%,通过与所对应的消旋体对比(图9b),本实施例的产物非消旋体,具有光学活性。
实施例7
将0.2mmol5-甲氧基-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应11h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为15%的乙酸乙酯和石油醚洗脱,得到白色固体74.6mg,产率93%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图2(b)所示,本实施例的产物在3415,2943,2171,1700,1617,1488,1350,1242,1205,1162,1123,1086,1035,953,878,814,714,677,609,544cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.58(d,j=12hz,1h),7.29-7.18(m,2h),6.84-6.78(m,1h),7.23-7.18(m,2h),7.17-7.11(m,2h),6.98-6.93(m,1h),4.58-4.51(m,1h),4.17(d,j=12hz,1h),3.82(s,3h),3.28(dd,j=4,12hz,1h),2.89(q,j=4hz,1h),2.61(d,j=12,1h),2.37(s,3h),2.22-1.93(m,3h),1.91-1.79(m,2h);
13cnmr(400mhz,cdcl3):δ=213.7,158.4,144.1,140.0,129.6,127.1,126.9,113.4,109.0,68.5,57.8,55.4,54.7,41.7,32.2,21.6,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc21h23no5s[m+na]+424.1189,found:424.1181。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=167.2(c0.50,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图10所示,由图可知,图10(a)中有两个特征吸收峰t1=13.10min(minor),t2=29.68min(major);ee81%,通过与所对应的消旋体对比(图10b),本实施例的产物非消旋体,具有光学活性。
实施例8
将0.2mmol4-溴-n-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为10%的乙酸乙酯和石油醚洗脱,得到白色固体83.5mg,产率93%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图2(c)所示,本实施例的产物在3416,2171,1619,1471,1354,1163,624cm-1有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.87(d,j=4hz,1h),7.40-7.35(m,1h),7.33-7.29(m,1h),7.28-7.23(m,2h),7.19-7.13(m,2h),4.61-4.55(m,1h),4.12(d,j=12hz),3.82(dd,j=4,12hz),2.94(q,j=4hz),2.37(s,3h),2.28-2.08(m,2h),2.07-1.96(m,1h),1.94-1.73(m,2h);
13cnmr(400mhz,cdcl3):δ213.5,144.6,137.2,135.5,133.8,130.0,129.71,129.66,127.0,125.4,121.0,68.2,58.2,54.6,41.7,32.1,21.6,18.7。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h20no4sbr[m+na]+472.0189,found:472.0185。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=140.3(c0.68,ch2cl2),本实施例的产物是具备光学活性的。
高效液相测试结果如图11所示,由图可知,图11(a)中有两个特征吸收峰t1=12.07min(minor),t2=17.66min(major);ee93%,通过与所对应的消旋体对比(图11b),本实施例的产物非消旋体,具有光学活性。
实施例9
将0.2mmoln-苯磺酰基邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为25%的乙酸乙酯和石油醚洗脱,得到白色固体66.4mg,产率93%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图2(d)所示,本实施例的产物在3926,3416,3080,2967,2934,1893,2867,2171,1693,1618,1479,1450,1411,1349,1286,1221,1200,1166,1120,1069,1001,941,858,763,743,682,615,591,559,529cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.70(d,j=8hz),7.57-7.49(m,1h),7.46-7.39(m,1h),7.38-7.21(m,6h),4.61(s,1h),4.10(d,j=12hz),3.29(d,j=8hz),2.97-2.88(m,1h),2.63(d,j=16hz),2.22-2.11(m,2h),2.08-1.95(m,1h),1.90-1.79(m,2h);
13cnmr(400mhz,cdcl3):δ213.6,138.3,136.7,134.0,133.3,129.0,127.9,127.3,127.1,126.9,126.7,123.8,68.3,58.0,54.8,41.7,32.2,18.7。
质谱测试结果为:hrms(esi)m/zcalculatedforc19h19no4s[m+na]+380.0927,found:380.0929。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=140.3(c0.68,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图12所示,由图可知,图12(a)中有两个特征吸收峰t1=12.44min(minor),t2=14.46min(major);ee95%,通过与所对应的消旋体对比(图12b),本实施例的产物非消旋体,具有光学活性。
实施例10
将0.2mmoln-(4’-氯苯磺酰基)邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比15%的乙酸乙酯和石油醚洗脱,得到白色固体75.1mg,产率96%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图2(e)所示,本实施例的产物在3845,3488,3192,3090,2934,2139,1696,1653,1579,1480,1454,1398,1359,1332,1248,1171,1007,960,937,869,826,757,704,626,597,553,528,483,456cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.72-7.65(m,1h),7.45(d,j=4hz,1h),7.37-7.21(m,6h),4.62-4.56(m,1h),4.13(d,j=12hz,1h),3.42(dd,j=4,12hz,1h),2.96(q,j=4hz,1h),2.62(d,j=16hz,1h),2.25-1.95(m,3h),1.94-1.75(m,2h);
13cnmr(400mhz,cdcl3):δ213.3,140.0,138.1,135.3,133.7,129.3,128.1,127.2,127.0,124.0,68.5,58.3,54.8,41.7,32.2,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc19h18no4scl[m+na]+414.0537,found414.0505。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=133.4(c0.58,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图13所示,由图可知,图13(a)中有两个特征吸收峰t1=11.36min(minor),t2=16.61min(major);ee95%,通过与所对应的消旋体对比(图13b),本实施例的产物非消旋体,具有光学活性。
实施例11
将0.2mmoln-(4’-硝基苯磺酰基)邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比15%的乙酸乙酯和石油醚洗脱,得到白色固体77.2mg,产率96%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图3(a)所示,本实施例的产物在3845,3488,3192,3090,2934,2139,1696,1653,1579,1480,1454,1398,1359,1332,1248,1171,1007,960,937,869,826,757,704,626,597,553,528,483,456cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.72-7.65(m,1h),7.45(d,j=4hz,1h),7.37-7.21(m,6h),4.62-4.56(m,1h),4.13(d,j=12hz,1h),3.42(dd,j=4,12hz,1h),2.96(q,j=4hz,1h),2.62(d,j=16hz,1h),2.25-1.95(m,3h),1.94-1.75(m,2h);
13cnmr(400mhz,cdcl3):δ213.3,140.0,138.1,135.3,133.7,129.3,128.1,127.2,127.0,124.0,68.5,58.3,54.8,41.7,32.2,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc19h18no4scl[m+na]+414.0537,found414.0505。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=133.4(c0.58,ch2cl2),本实施例的产物是具备光学活性的。
高效液相测试结果如图14所示,由图可知,图14(a)中有两个特征吸收峰t1=14.31min(minor),t2=23.24min(major);ee99%,通过与所对应的消旋体对比(图14b),本实施例的产物非消旋体,具有光学活性。
实施例12
将0.2mmoln-(4’-三氟甲基苯磺酰基)邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应10h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比20%的乙酸乙酯和石油醚洗脱,得到白色固体81.6mg,产率98%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图3(b)所示,本实施例的产物在3935,3415,2950,2171,1698,1618,1480,1455,1410,1330,1248,1171,1134,1064,943,840,766,715,684,617cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.80-7.55(m,3h),7.54-7.21(m,5h),4.62(s,1h),4.12(d,j=12hz,1h),3.45-3,32(m,1h),2.97(s,1h),2.63(d,j=12hz,1h)2.25-1.97(m,3h),1.95-1.74(m,2h);
13cnmr(400mhz,cdcl3):δ213.1,140.4,138.0,133.5,128.1,127.5,126.2,126.1,124.2,68.5,58.4,54.7,41.6,32.2,18.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc20h18nf3o4s[m+na]+448.0801,found:448.0792。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=88.9(c0.68,ch2cl2),本实施例的产物是具备光学活性的。
高效液相测试结果如图15所示,由图可知,图15(a)中有两个特征吸收峰t1=6.85min(minor),t2=13.37min(major),ee99%,通过与所对应的消旋体对比(图15b),本实施例的产物非消旋体,具有光学活性。
实施例13
将0.2mmoln-ms邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环己烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应24h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比15%的乙酸乙酯和石油醚洗脱,得到白色固体53.1mg,产率90%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图3(c)所示,本实施例的产物在3929,3415,3001,2924,2191,1711,1691,1638,1618,1480,1454,1419,1334,1242,1156,1072,972,762,621,514cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ7.70-7.54(m,2h),7.35-7.18(m,2h),4.76(s,1h),4.66(d,j=12hz,1h),4.32(d,j=12hz,1h),3.25-3.16(m,1h),2.69(s,3h),2.50(d,j=16hz,1h),2.28-2.12(m,2h),2.10-1.96(m,1h),1.96-1.72(m,2h);
13cnmr(400mhz,cdcl3):δ213.4,136.7,134.0,128.3,126.5,126.0,124.5,69.1,58.3,55.0,41.7,36.1,32.1,18.4。
质谱测试结果为:hrms(esi)m/zcalculatedforc14h17no4s[m+na]+318.0770,found:318.0776。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=91.4(c0.39,ch2cl2);本实施例的产物是具备光学活性的。
高效液相测试结果如图16所示,由图可知,图16(a)中有两个特征吸收峰t1=11.83min(minor),t2=15.42min(major);ee51%,通过与所对应的消旋体对比(图16b),本实施例的产物非消旋体,具有光学活性。
实施例14
将0.2mmoln-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环戊烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应24h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为15%的乙酸乙酯和石油醚洗脱,得到白色固体42.8mg,产率60%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图3(d)所示,本实施例的产物在3494,3238,2985,2896,2171,1921,1724,1637,1618,1480,1452,1406,1345,1309,1248,1161,1091,1068,959,876,813,760,710,653,625,594,567,542,482cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.72-7.65(m,1h),7.46-7.41(m,1h),7.38-7.25(m,3h),7.28-7.21(m,1h),7.21-7.14(m,2h),5.08-5.00(m,1h),3.93(d,j=8hz,1h),3.67(q,j=4hz,1h),3.00-2.93(m,1h),2.44-2.34(m,5h),2.24-2.12(m,1h),1.93-1.79(m,1h);
13cnmr(400mhz,cdcl3):δ=144.2,136.4,133.89,133.88,129.9,128.5,127.6,127.0,126.6,66.4,56.7,54.3,37.8,31.6,21.6。
质谱测试结果为:hrms(esi)m/zcalculatedforc19h19no4s[m+h]+380.0927,found380.0893。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=148.0(c0.35,ch2cl2)本实施例的产物是具备光学活性的。
高效液相测试结果如图17所示,由图可知,图17(a)中有两个特征吸收峰t1=13.93min(minor),t2=18.33min(major);ee97%,通过与所对应的消旋体对比(图17b),本实施例的产物非消旋体,具有光学活性。
实施例15
将0.2mmoln-ts邻氨基苯甲醛溶解于1ml吡啶和甲苯的混合溶剂(吡啶与甲苯的体积比为7:3),接着加入催化剂硅烷修饰的4-羟基脯氨酸0.04mmol,再接着加入0.5mmol环庚烯酮,然后立即置于恒温冰浴中,并保持反应温度为0℃,反应24h后,进行点板,确认反应完毕后,将反应液过色谱柱,并使用体积比为20%的乙酸乙酯和石油醚洗脱,得到白色固体37.7mg,产率49%,将固体进行旋光度、红外、核磁、高效液相色谱和质谱进行测试。
红外测试结果如图3(e)所示,本实施例的产物在3411,2924,2865,2171,1678,1638,1618,1490,1454,1343,1308,1251,1218,1158,1093,1035,928,868,814,795,752,729,703,654,622,583,498cm-1处有特征吸收峰。
核磁测试结果为:1hnmr(400mhz,cdcl3):δ=7.74(d,j=8hz,1h),7.43-7.16(m,3h),7.36-7.30(m,1h),7.29-7.23(m,1h),7.21-7.13(m,2h),4.70-4.09(m,1h),4.24(t,j=8hz,1h),3.04(d,j=4hz,1h),2.93(t,j=8hz,1h),2.52-2.44(m,1h),2.37(s,3h),2.31-2.18(m,1h),2.16-1.99(m,1h),1.92-1.65(m,4h);
13cnmr(400mhz,cdcl3):δ=213.4,144.1,133.8,129.8,128.4,127.04,126.88,126.58,126.46,65.5,57.1,55.0,44.7,33.5,26.0,23.5,21.5。
质谱测试结果为:hrms(esi)m/zcalculatedforc21h23no4s[m+h]+408.1240,found:408.1243。
结合红外、核磁和质谱的测试结果,可得本实施例产物的结构如下:
旋光度测试结果为:[α]20d=71(c0.5,ch2cl2),本实施例的产物是具备光学活性的。
高效液相测试结果如图18所示,由图可知,图18(a)中有两个特征吸收峰t1=17.92min(minor),t2=20.56min(major);ee30%,通过与所对应的消旋体对比(图18b),本实施例的产物非消旋体,具有光学活性。
- 还没有人留言评论。精彩留言会获得点赞!