一个特异响应氧化胁迫信号的启动子P-osi及其应用的制作方法
本发明涉及一个能够特异响应氧化胁迫信号的启动子DNA序列。本发明还涉及该启动子在微生物发酵工业与基因工程领域中的应用。
背景技术:
:
现代生物技术是利用微生物的生长和相应的代谢活动生产各种有用物质的一种工程技术,而基因工程菌株是整个现代生物技术的研究热点。基因工程菌株在生产发酵时常常面临高浓度底物和产物形成的多种环境胁迫,导致菌株细胞内出现大量活性氧自由基(ROS)影响微生物生理功能发挥,限制微生物产量和目的产物的生产。因此发现能够特异响应氧化胁迫信号的启动子序列,对微生物菌株进行遗传改造,以增强微生物对氧化胁迫的响应效率与适应能力。
许多细菌非编码RNA在细胞应激反应过程中能够高效表达,进而在细菌的胁迫应答反应系统中发挥着重要的调节作用。耐辐射异常球菌(Deinococcus radiodurans)具有极强的逆境胁迫适应性,对强氧化剂(如过氧化氢)、高温、辐射(UV辐射、γ辐射等)和干旱等都具有超强的抗性。近年来有关耐辐射微生物ncRNA的研究已有报道,有关研究认为耐辐射异常球菌ncRNA在辐射、氧化等胁迫抗性反应中发挥了极其重要的作用。
技术实现要素:
:
本发明的目的是得到一个能够响应氧化胁迫信号,并能够有效启动目的基因转录的启动子DNA序列,以应用于发酵工程与基因工程中工程菌株的改造。
本发明首次发现了耐辐射异常球菌的一个非编码RNA OsiR基因,该基因能够特异响应氧化胁迫信号进行转录,发挥调控功能。
通过实验本发明鉴定了非编码RNA OsiR的启动子序列并证实其功能:
1.OsiR基因的鉴定及其启动子P-Osi分析
本发明人在进行耐辐射异常球菌(Deinococcus radiodurans)的转录组分析过程中,首次发现了一种可转录的有功能性的非编码RNA新基因,其表达受氧化胁迫诱导(图1),参与细菌的抵抗逆境的生命过程,命名为OsiR基因。
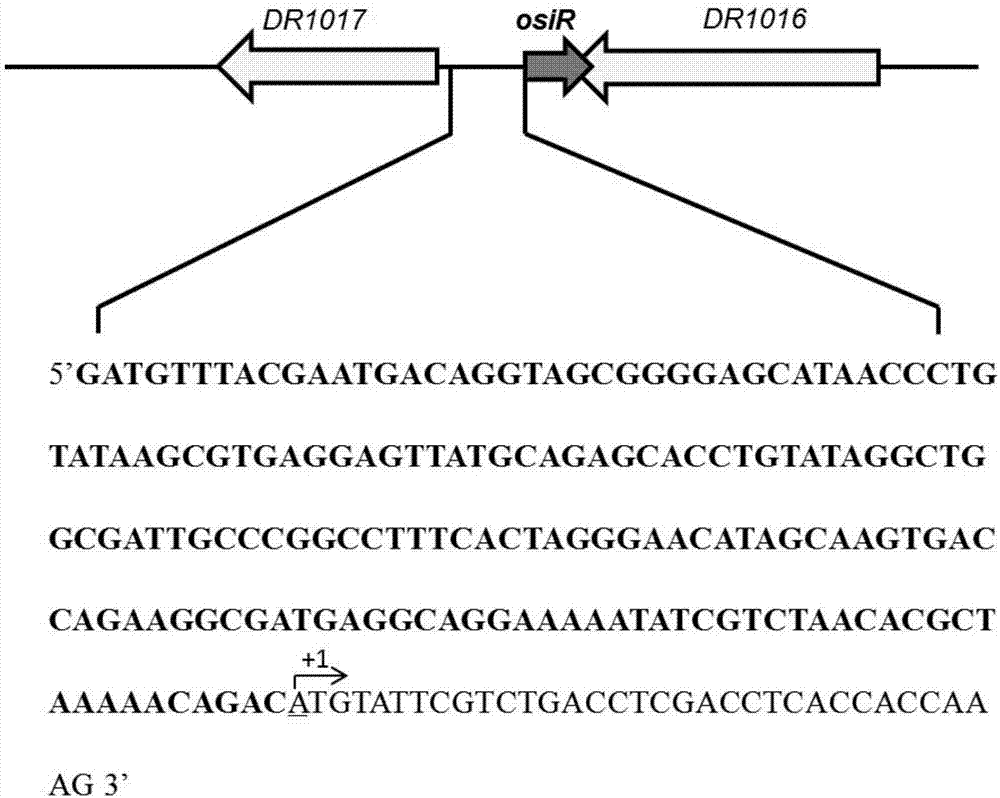
通过5'-RACE实验确定OsiR的转录起始位点和方向。结果表明OsiR的转录起始位点始于一个腺嘌呤(A),确定从该转录起始位点起上游170bp的基因区域为OsiR基因的启动子,命名为P-Osi(图2),其核苷酸序列是SEQ ID NO:1。
2.构建启动子P-Osi融合表达载体,并分别转入3种不同细菌,获得3种重组表达菌株
利用PCR扩增获得完整的启动子P-Osi片段,克隆片段进行MulI和SpeI双酶切,插入到启动子表达载体pRADZ3的报告基因lacZ前,获得启动子P-Osi与lacZ基因的融合表达载体pRAD-P-Osi-lacZ(图3)。将该表达载体分别转入大肠杆菌(Escherich coli)、枯草芽孢杆菌(Bacillus subtilis)或谷氨酸棒状杆菌(Corynebacterium glutamicum),获得3种重组表达菌株:E.coli(P-Osi-lacZ);B.subtillis(P-Osi-lacZ);C.glutamicum(P-Osi-lacZ)。
3.启动子P-Osi对氧化胁迫信号的响应的验证实验
将上述3种重组表达菌株分别进行H2O2氧化胁迫处理,测定在诱导条件下重组菌中lacZ基因编码产物β-半乳糖苷酶的酶活。研究结果显示,3株重组菌中,氧化胁迫信号能够激活本发明启动子的表达启动lacZ基因的翻译。
实验证实,在氧化胁迫条件下,本发明所述启动子无论是在3种工业微生物发酵菌株中都能够特异、高效的启动目的基因的表达,可应用于微生物发酵工程菌株的遗传改造。序列信息
SEQ ID NO:1:非编码RNA OsiR基因的启动子P-Osi核苷酸序列
附图说明
图1:耐辐射异常球菌中非编码RNA OsiR基因的启动子分析
图中osiR基因的转录起始位点用下划线表示,转录方向用箭头表示。启动子序列用黑色粗体表示;
图2:耐辐射异常球菌非编码RNA osiR氧化胁迫信号响应的分析;
图3:启动子P-Osi与目的基因融合表达示意图;
图4:氧化胁迫下3株重组表达菌株β-半乳糖苷酶的酶活测定结果
其中,E、B、C分别代表E.coli(P-Osi-lacZ);B.subtillis(P-Osi-lacZ);C.glutamicum(P-Osi-lacZ)。
具体实施方式
下面结合具体实施例,进一步阐述本发明。实施例仅用于举例说明本发明的方法,而不能够限制本发明的范围。凡未注明具体实验条件的,均为按照本领域技术人员熟知的常规条件或按照制造厂商所建议的条件。
实施例1非编码RNA OsiR基因的鉴定及其启动子分析
一、实验材料:
试验菌株:耐辐射异常球菌(Deinococcus radiodurans)
购置于中国普通微生物菌种保藏管理中心,菌株编号CGMCC 1.633。
二、实验方法:
通过5’RACE实验方法确定了osiR的转录起始位点和转录方向。具体步骤参照Roche公司的5’/3’RACE Kit试剂盒说明书。将目的片段切胶回收进行序列测序,将测序获得的序列通过与耐辐射异常球菌基因组中的序列进行比对分析最终确定OsiR的转录起始位点和方向。
三、实验结果:
通过5’RACE实验结果表明,osiR为反向转录,转录起始于一个腺嘌呤(A)。同时,在通过5’RACE确定的转录起始位点上游的启动子区进行序列分析发现了保守的-10区和-35区(AGGAAA-N17-TAAAAT),从该转录起始位点起上游170bp的基因区域为OsiR基因的启动子,命名为P-Osi(图1)
四、实验结论:
研究结果表明,osiR为反向转录,转录起始于一个腺嘌呤(A),该转录起始位点起上游170bp的基因区域为OsiR基因的启动子,命名为P-Osi。
实施例2非编码RNA OsiR基因氧化胁迫下表达特征分析
一、实验材料:
试验菌株:耐辐射异常球菌(Deinococcus radiodurans)
购置于中国普通微生物菌种保藏管理中心,菌株编号CGMCC 1.633。
二、实验方法:
(1)将耐辐射异常球菌在TGY液体培养基中活化,30℃过夜培养。次日转接至TGY培养基中30℃培养至OD600≈1.0;
(2)首先各取1mL菌体,作为对照,然后再各取1mL菌体加入终浓度为80mmol/L H2O2,30℃冲击30min;
(3)8000×g离心5min,收集菌体。采用Promega试剂盒Z3741提取细菌总RNA,将使用量相同的样品RNA进行cDNA反转;
(4)通过qRT-PCR方法对OsiR基因在不同胁迫条件下的表达水平进行了分析。
三、实验结果:
研究结果显示,与未处理条件下相比,H2O2氧化胁迫条件下OsiR基因的转录水平显著提高,高达约51倍(图2)。
四、实验结论:
实验结果表明,OsiR受氧化胁迫诱导,能响应氧化胁迫过程中产生的信号,调控其它基因的表达。
实施例3启动子P-Osi融合表达载体的构建
一、实验材料:
载体:pRADZ3:本实验室保存质粒
受体菌株:E.coli、B.subtilis和C.glutamicum:本实验室保存菌株
二、实验方法:
(1)OsiR基因启动子片段的PCR扩增:以耐辐射异常球菌基因组DNA为模板,利用引物P-Osi-F和P-Osi-R进行PCR扩增获得长度约为170bp的启动子P-Osi的片段;
引物:
P-Osi-F:ACCACGCGTGATGTTTACGAATGACAGG
P-Osi-R:CCGACTAGTGTCTGTTTTTAGCGTGTTAG
(2)OsiR基因启动子表达载体的构建:将PCR扩增获得的OsiR基因启动子片段进行MulI和SpeI双酶切后,连入启动子检测载体pRADZ3上,挑取阳性克隆提取质粒,酶切和PCR验证后得到lacZ融合载体pRAD-P-Osi-lacZ。
(3)重组表达菌株的获得:将构建的启动子pnfiS融合表达载体分别通过电激转入E.coli、B.subtilis和C.glutamicum中,通过抗性筛选和PCR验证获得3株重组表达菌株。
三、实验结果:
成功构建融合载体pRAD-P-Osi-lacZ,启动子P-Osi插入在报告基因lacZ上游(图3)。通过电激转化法将融合载体pRAD-P-Osi-lacZ分别转化E.coli、B.subtilis和C.glutamicum中,获得重组表达菌株。
四、实验结论:
构建启动子P-Osi与lacZ基因的融合表达载体pRAD-P-Osi-lacZ。获得3种重组表达菌株:大肠杆菌E.coli(P-Osi-lacZ);枯草芽孢杆菌B.subtilis(P-Osi-lacZ);谷氨酸棒状杆菌C.glutamicum(P-Osi-lacZ)。
实施例4氧化胁迫下3株重组表达菌株β-半乳糖苷酶的活性测定
一、实验材料:
实验菌株:大肠杆菌E.coli(P-Osi-lacZ);枯草芽孢杆菌B.subtilis(P-Osi-lacZ);谷氨酸棒状杆菌C.glutamicum(P-Osi-lacZ)。
二、实验方法:
E.coli、B.thuringiensis、C.glutamicum的β-半乳糖苷酶活性测定的方法如下:
(1)分别挑取3株重组菌株单菌落,接种于含抗生素的LB液体培养基,过夜培养。其中E.coli(P-Osi-lacZ)培养温度为37℃,其余2株重组菌株的培养温度为30℃。次日按照2%转接量接种于新鲜LB液体培养基,测菌液OD600值,直到OD600值达到0.6以上,分别加入40、60mmol/L H2O2,冲击10min,未冲击菌株作为阴性对照;
(2)取适量菌液,4℃,5,000×g离心5min,弃上清,用无菌水洗两次,弃上清。按需要重新悬浮菌体。菌体悬浮液与bufferZ混合,使总体积为1mL,加入2-3滴氯仿,混匀。开盖于37℃保温40min。转入30℃保温5min,之后加入200μL(4.0mg/mL)邻硝基苯-β-D-半乳吡喃糖苷(ONPG),混匀后30℃继续保温,开始反应,记录反应起始时间。待样品出现黄色,再加入500μL 1mol/L的Na2CO3终止反应,记录反应终止时间,样品放冰上待测。
(3)用紫外分光光度计分别测定OD420和OD550值。按照以下公式计算β-半乳糖苷酶活性值
β-Galactosidase Units=1000×(OD420-1.75×OD550)/(T×V×OD600)。
每株重组表达菌株的以上每个实验均进行平行实验三次,所得到的结果是计算了三次独立实验的平均误差的β-半乳糖苷酶活性值。
三、实验结果:
不同浓度的H2O2冲击均能够激活本发明启动子序列,进而提高报告基因lacZ的表达,启动子P-Osi的活性与H2O2浓度正相关(图4)。其中:
大肠杆菌E.coli(P-Osi-lacZ)在40mM的H2O2冲击诱导下β-半乳糖苷酶的活性为192.2±7.26U,而在60mM的H2O2冲击诱导下,β-半乳糖苷酶的活性进一步提高为446.3±12.40U。
枯草芽孢杆菌B.subtilis(P-Osi-lacZ)在60mM的H2O2冲击诱导下,β-半乳糖苷酶的活性为293.7±21.32U;
谷氨酸棒状杆菌C.glutamicum(P-Osi-lacZ))在60mM的H2O2冲击诱导下,β-半乳糖苷酶的活性也提高为385.3±19.19U。
说明在氧化透胁迫条件下,启动子P-Osi在3株不同的工业微生物菌株中都能够特异、高效地启动下游目的基因的表达。
四、实验结论:
本发明发现的启动子能够特异响应氧化胁迫信号,启动目的基因表达,可以应用于发酵工程与基因工程中工程菌株的改造。
序列表
<110> 中国农业科学院生物技术研究所
<120> 一个特异响应氧化胁迫信号的启动子P-osi及其应用
<160> 1
<170> PatentIn version 3.1
<210> 1
<211> 170
<212> DNA
<213> 耐辐射异常球菌(Deinococcus radiodurans)
<400> 1
gatgtttacg aatgacaggt agcggggagc ataaccctgt ataagcgtga ggagttatgc 60
agagcacctg tataggactg gcgattgccc ggcctttcac tagggaacat agcaagtgac 120
cagaaggcga tgaggcagga aaaatatcgt ctaacacgct aaaaacagac 170
- 还没有人留言评论。精彩留言会获得点赞!