一种单细胞测序检测活化T细胞的方法与流程
本发明属于生物医学领域,尤其是涉及一种单细胞测序检测活化t细胞的方法。
背景技术:
t细胞是淋巴细胞的一种,在免疫反应中扮演着重要的角色。t细胞在胸腺内分化成熟,成熟后移居于周围淋巴组织中。t细胞主要用以抵抗外来入侵物且具有多样的生物学功能。
t细胞治疗是细胞免疫治疗的核心手段,被认为最具前景、最有希望消灭肿瘤的方法。然而,目前使用的t细胞存在活性不强、数量不足、不能向肿瘤部位聚集、无有效的疗效监测手段等难题。因此,围绕这些关键科学技术问题,我们前期通过解除t细胞抑制因子pd-1,构建活性t细胞;以异源基因杂交细胞扩增t细胞并赋予其抗癌特性,从而获得数量更多、活性更强的ctls,发挥更理想的高效抗癌效应。然而,利用传统的方法(流式细胞仪检测细胞表面活化分子、细胞杀伤试验、elisa检测细胞活化后分泌的细胞因子等)在体外对所诱生的ctls的活化程度进行检测,存在检测结果受时间和空间影响较大的问题。
同一细胞在不同的生长时期及生长环境下,其基因表达情况是不完全相同的,单细胞测序技术可以在单细胞水平对全转录组进行扩增与测序,在整体水平上研究细胞中基因转录的情况及转录调控的规律。因此,利用单细胞测序技术及生物信息学分析技术,对t细胞进行分析,可以更好地研究其单个细胞内整体水平的基因表达状态和基因结构信息,了解其基因转录情况、转录调控规律并进行验证,为能更早期、更准确的了解t细胞活化状态提供新途径、新方法。
技术实现要素:
本发明的目的在于针对上述存在的科学问题,提供一种单细胞测序检测活化t细胞的方法。
本发明的技术方案概述如下:
本发明的单细胞测序检测活化t细胞的方法,包括以下步骤:
1)获取经异源基因杂交细胞诱导扩增的肿瘤特异性ctls;
2)分离单细胞并进行裂解:分离单细胞,加入裂解缓冲液中进行裂解;
3)对样品的mrna进行逆转录得到cdna:使用美国thermofisher公司的superscript试剂盒构建逆转录体系,对上述步骤2)获得的细胞裂解液进行逆转录,得到cdna;
4)以cdna为模板进行pcr扩增,构建测序文库,进行测序:使用美国illumina公司的nexteraxt试剂盒,按照说明书对上述步骤3)得到的逆转录产物进行扩增和纯化,构建高通量测序文库;完成后将文库送交测序;
5)对测序结果进行生物信息学分析,检测t细胞的活化程度。
优选的,以上所述步骤1)中,将体外诱导扩增的肿瘤特异性ctls进行单细胞测序,从mrna水平上检测单细胞活化程度。
本发明突出的实质性特点和显著的进步是:
通过利用单细胞测序技术早期、准确的了解t细胞的活化情况,将体外诱导扩增的肿瘤特异性ctls进行单细胞测序,从mrna水平上检测单细胞活化程度,较传统方法如流式细胞仪检测细胞表面活化分子、细胞杀伤试验、elisa检测细胞活化后分泌的细胞因子等,更为早期、快速、准确。
附图说明
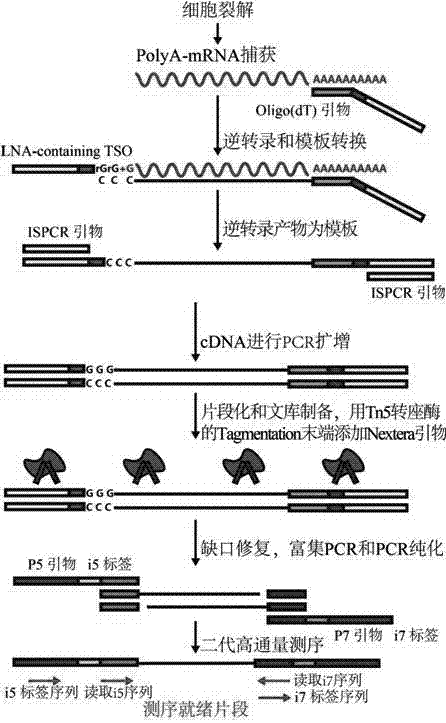
图1为逆转录及构建测序文库的示意图。
图2为二次磁珠细胞分选法分选小鼠记忆性cd8+t细胞的结果图。
图3为纯化后得到的小鼠记忆性cd8+t细胞激光共聚焦验证结果图。
图4为使用6%page凝胶检测标记反应前cdna文库的片段大小分布图。
图5为使用6%page凝胶检测标记反应和连接接头后文库片段大小分布图。
图6使用美国agilent公司的2100bioanalyzer检测标记反应和连接接头后文库片段大小分布图。
具体实施方式
下面对本发明的实施操作做详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施案例。
下面结合具体实施例对本发明作进一步的说明。
参看附图1所示,本发明的利用单细胞测序检测活化t细胞的方法,具体如下:
1.应用自创的新型基因编辑技术对t细胞的pd-1基因进行高效敲除。
2.应用自创的高效异源基因杂交细胞快速诱生大量高活性ctls。用自创的新型基因编辑技术将超急性排斥反应基因(猪α1,3gt)与smp30等新肿瘤相关抗原基因、endoglin基因敲入癌细胞,制备高效异源树突状细胞/癌杂交细胞;运用本杂交细胞将pd-1-t细胞诱生成ctl。
3.准备ctl单细胞样品。分离单细胞并进行裂解:分离单细胞,加入裂解缓冲液中进行裂解。
4.对样品的mrna进行逆转录得到cdna:使用美国thermofisher公司的superscript试剂盒构建逆转录体系,对步骤3)获得的细胞裂解液进行逆转录,得到cdna。
5.以cdna为模板进行扩增,构建测序文库,进行测序,使用美国illumina公司的nexteraxt试剂盒,按照说明书对步骤4)得到的逆转录产物进行扩增和纯化,构建高通量测序文库;完成后将文库送交测序。
6.通过生物信息学分析了解t细胞的活化情况。
实施例1
本实施例选择小鼠(musmusculus)为实验材料,对其记忆性cd8+t细胞进行了单细胞转录组的测序。
1.获取脾脏中t细胞:
1)小鼠颈椎脱臼处死,浸泡于75%酒精中5min。
2)超净台中无菌操作取出老鼠脾脏放置于盛有pbs的平皿中,取两支1ml注射器,用镊子将针头折成90°,一支固定脾脏、一支用针尖刺破脾脏包膜,随后用针壁将脾脏细胞从两端刮出;用滴管将脾脏细胞反复吹打成细胞悬液。
3)随后将细胞悬液移至50ml离心管,1200rpm/min离心6min;弃掉上清液,弹匀细胞。
4)加入1ml的红细胞裂解液,室温作用5min。
5)加入30mlpbs稀释红细胞裂解液,将细胞悬液用200目滤器过滤至另一个50ml离心管中,1200rpm/min离心6min。用pbs缓冲液冲洗2次。
6)显微镜下记数活细胞总数。用磁性细胞分选试剂盒中稀释后的缓冲液调整细胞浓度至1×108/ml,备用。
2.记忆性cd8+t细胞的提取:
1)cd8+t细胞的纯化
配制缓冲液:取5ml的10×缓冲液(magcellect10×buffer),加入45ml的灭菌单蒸水稀释,冰上保存。
将1ml混合淋巴细胞悬液(1×108细胞)移至5mlep管中,加入200μl生物素标记的cd8+t细胞混合抗体(magcellectmousecd8+tcellbiotinylatedantibodycocktail),轻轻混匀,避免产生气泡。4℃孵育15分钟后加入250ul链霉素亲和磁珠(magcellectstreptavidinferrofluid),轻轻吹匀,4℃孵育15分钟后继续加入1.55ml缓冲液,定容至3ml,并轻轻吹匀。注意管壁上有无残留。将ep管放入磁力架,室温(18-25℃)静置6分钟,可见棕色磁珠向管壁移动。保持ep管在磁力架中,使用巴氏吸管或移液管将上清移至新的5mlep管中。再次将ep管放入磁力架,室温静置6分钟后将上清移至新的5mlep管中,以尽可能去除磁珠。最终获得的细胞为小鼠脾脏cd8+t细胞,备用。
2)记忆性cd8+t细胞纯化
将cd8+t细胞离心后弃上清,用100ul的缓冲液重悬,加入0.5ul的cd62l-生物素抗体,4℃孵育15分钟后加入12.5ul链霉亲和素磁珠,于4℃孵育15分钟。将ep管放入磁力架,室温(18-25℃)静置6分钟,可见棕色磁珠向管壁移动。保持ep管在磁力架中,使用巴氏吸管或移液管将上清移至新的2mlep管。最终获得的细胞为高纯度的小鼠脾脏记忆性cd8+t细胞,可用于后续实验(参看附图2和图3所示)。
3.分离单细胞并进行裂解:
1)以rnasezap和无dna的溶液清理工作台及移液枪头;
2)混合以下试剂作为裂解缓冲液:
a)0.2%triton-x100溶液19μl;
b)40u/μl的rnase抑制剂1μl。
3)向0.2ml的薄壁pcr管中加入1.19μl裂解缓冲液;
4)以最小体积从步骤(2)所得的细胞中分离单细胞,体积一般为0.3μl,加入含裂解缓冲液的pcr管中。
4.对样品的mrna进行逆转录得到cdna:
1)混合以下试剂作为引物-dntp预混液:
a)dntp(10mm)10μl;
b)oligo-dt30vn引物(10μm)10μl。
2)混合以下试剂作为逆转录预混液:
a)美国thermofisher公司的superscriptiiifirst-strand缓冲液2μl;
b)美国thermofisher公司的superscriptiiireversetranscriptase溶液0.5μl;
c)rnase抑制剂(40u/μl)0.25μl;
d)dtt溶液(100mm)0.5μl;
e)甜菜碱溶液(5m)2μl;
f)氯化镁溶液(1m)0.06μl;
g)tso溶液(100μm)0.2μl;
h)ercc外源rna标准样溶液0.5μl。
3)在步骤(3)所得的含有细胞和裂解缓冲液的pcr管中加入2μl引物-dntp预混液;
4)快速涡旋震荡pcr管使溶液充分混合,在室温下以700g离心10s后立即置于冰上;
5)以72℃孵育样品3min,立即放回冰上;
6)在室温下以700g离心10s,收集pcr管底部的液体,将其置于冰上;
7)将逆转录预混液加入单细胞裂解产物中,使用移液器轻轻吹吸几次混匀样品,混匀过程中避免产生气泡;
8)在室温下以700g离心10s,收集pcr管底部的液体;
9)将含样品的pcr管置于pcr仪中,设定程序进行细胞mrna的逆转录,得到cdna第一链反应产物,逆转录程序的热循环条件表示在表1中。
表1:逆转录程序的热循环条件
5.以cdna为模板进行扩增,构建测序文库,进行测序:
1)混合以下溶液作为pcr混合液:
a)步骤(4)中得到的第一链反应产物10μl;
b)美国rochemolecularsystems公司的kapahifihotstartreadymix溶液12.5μl;
c)ispcr引物溶液(10μm)0.25μl;
d)无核酸酶水2.25μl。
2)取15μl步骤1)中的pcr混合液加入pcr管中,涡旋震荡使样品混合,在室温下以700g离心10s,收集pcr管底部的液体;
3)将含样品的pcr管置于pcr仪中,设定程序进行细胞cdna的扩增,程序的热循环条件表示在表2中;
表2:cdna扩增程序的热循环条件
4)在室温下将美国beckmancoulter公司的ampurexp磁珠放置15min,涡旋震荡混匀;
5)将25μl磁珠加入等体积步骤3)所得到的cdna扩增产物中,用移液器吹吸10次混匀,将溶液转移到96孔板中,在室温下孵育8min;
6)将96孔板在磁力架上放置5min,待溶液澄清,小心移除上清液;加入200μl的80%乙醇清洗磁珠,孵育30s后将小心移除乙醇,重复2次;
7)完全移除乙醇后,在室温下放置5min,待磁珠表面出现一道裂缝后,加入15μl的eb溶液,用移液器吹吸10次混匀;
8)移除磁力架,室温放置2min;将96孔板再放回磁力架上,放置2分钟,待溶液澄清后,吸取13μl的上清液,移到一个新的0.2ml薄壁pcr管中;
9)使用6%的page凝胶检测cdna扩增产物的片段大小分布,好的文库应该片段大小应该在500~3000bp之间,没有小于500bp的短片段,而且峰应该出现在1500~2000bp之间(参看附图4所示);
10)混合以下溶液作为标记预混液:
a)美国illumina公司的标记dna缓冲液4μl;
b)美国illumina公司的标记酶混合液1.67μl;
c)美国illumina公司的重悬缓冲液1.33μl。
11)取1μl步骤8)中得到的cdna,加入7μl步骤10)中的标记预混液,在55℃孵育10min,对cdna进行标记;
12)再加入2μl的美国illumina公司的nt缓冲液,在室温下孵育5min,完成标记反应;
13)混合以下溶液作为接头连接扩增预混液:
a)美国rochemolecularsystems公司的kapahifihotstartreadymix溶液15μl;
b)美国illumina公司的index1引物溶液2.5μl;
c)美国illumina公司的index2引物溶液2.5μl。
14)向步骤12)中得到的10μl标记产物中加入20μl步骤13)中的接头连接预混液,置于pcr仪中,设定程序进行接头的连接,程序的热循环条件表示在表3中。
表3:接头连接程序的热循环条件
15)在室温下将美国beckmancoulter公司的ampurexp磁珠放置15min,涡旋震荡混匀;
16)将24μl磁珠按照0.8:1的体积比加入步骤13)得到的30μl产物中,用移液器吹吸10次混匀,将溶液转移到96孔板中,在室温下孵育8min;
17)重复步骤6)至步骤8),纯化扩增产物;
18)使用6%的page凝胶和美国agilent公司的2100bioanalyzer检测步骤17)中获得测序文库的片段大小分布(参看附图5和图6所示),并用美国thermofisher公司的qubit3.0荧光计测量各文库dna的浓度;
19)根据步骤18)中测得各文库的浓度及所需测序的数据量,计算最终文库混合液中各文库的摩尔比例,按比例将文库混合,使用qubit3.0荧光计测量,调整终浓度达到5nm;
20)送测序公司进行高通量测序。
选择小鼠(musmusculus)的记忆性cd8+t细胞为实验材料仅是为了举例,证明此方法可以成功应用于哺乳动物活化t细胞的单细胞转录组测序,但本发明同样可以应用于人类及其他哺乳动物的活化t细胞的单细胞转录组测序。
本发明并不局限于前述的具体实施方式,本发明扩展到任何本说明书中披露的新特征或新的组合,以及披露的任一新方法或过程的步骤或新的组合。
- 还没有人留言评论。精彩留言会获得点赞!