一种在低氧条件下体外扩增人血管内皮祖细胞的方法与流程
本发明属于医药生物领域,具体涉及一种在低氧条件下体外扩增人血管内皮祖细胞的方法。
背景技术
骨髓含有能够迁移到外周血并分化成为成熟内皮细胞的祖细胞,被称为血管内皮祖细胞(endothelialprogenitorcells,epcs),其为血管内皮细胞的前体细胞,主要存在于脐带血、成人外周血、骨髓。内皮祖细胞与造血干细胞来自共同的中胚层前体细胞血液血管母细胞,在生理或病理因素刺激下,可以从骨髓动员到外周血中参与损伤血管的修复,而脐血中的内皮祖细胞起源于胎儿的肝脏。近年来的研究显示血管内皮祖细胞(epcs)已被证明对多种血管病变有治疗作用,在心脑血管疾病、外周血管疾病、肿瘤血管形成及创伤愈合等方面均发挥重要作用,例如:a.促进血管新生的作用,改善脏器缺血导致的功能障碍,epcs的体内回输可用来治疗人体缺血性疾病:如缺血性心脏病、脑缺血、肾缺血、肢端缺血坏死等一系列疾病,尤其将在心肌梗死、心绞痛等缺血性心脏病的治疗过程中起到巨大作用;b.帮助修复损伤的血管内膜,如经皮冠状动脉腔内成形术(ptca)和其他血管的介入手术不可避免的多少会损伤血管内膜,epcs的回输将促进损伤内膜的修复,减少因内膜损伤而导致的介入术后的血管再狭窄;c.帮助恢复和重建动脉粥样硬化的血管内皮功能,防止动脉粥样硬化的进一步恶化,减少心肌梗死的发生;d.在肿瘤学方面,通过研究epcs在肿瘤血管生成过程中的作用,采取相应的抑制措施,为抑制肿瘤血管生成以及抑制肿瘤生长开辟新途径。同时,因其可分化为表达fviii的血管内皮细胞,可作为一种细胞治疗途径用于fviii缺乏的甲型血友病。
但是由于能从骨髓中分离的epcs极少,所以有必要进行体外扩增。epcs位于骨髓的低氧微环境中。然而,基本上所有的epcs的研究都是在非生理环境空气中处理的细胞进行的。而且,虽然内皮祖细胞的培养技术可以获得一定数量供科研需要,但还无法实现较大规模生产的需求,并且不能充分保持祖细胞的干性。因此,本领域亟待提高扩增的效率并同时保留祖细胞的干性。
技术实现要素:
有鉴于此,本发明的目的在于提供一种在低氧条件下体外扩增人血管内皮祖细胞的方法,包括从人骨髓中分离出epcs,并在低氧条件下于培养箱中培养。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述低氧条件为1%o2的低氧条件。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述培养epcs的培养基为ebm-2培养基。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述培养epcs的时间为21天左右。
本发明的另一方面在于,通过提供上述扩增人血管内皮祖细胞的方法,发明人发现所述低氧条件对epcs基因表达包括以下基因的差异表达:下调基因loc102723946、c1qc、tyrobp、pnliprp3、mmp10、folr3、vsig4、dcdc2c、f13a1、serpinb4、ivl、adora3、linc00520、lonrf3、ephb1、fcgr3a、mrc1、loc284561、ppm1l、tfec、cobl、siglec1、gprc5c、postn、tfpi2、kynu、pid1、pdk4、akr1c2、fam84a、gdf15、cxcl5、tfrc、igfbp3;上调基因rp11-909m7.3、papl、pik3r6、tctex1d1、plk1、pip、mvd、cdc20、ccnb1、prkcdbp、hmgcs1、scube3、ube2c、ebp。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述差异表达基因至少涉及以下生物过程:细胞对脂肪酸的反应、调节有丝分裂细胞周期转变的泛素-蛋白连接酶活性的正调控、乙酰辅酶a代谢过程以及调节有丝分裂的细胞周期相变。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述差异表达基因的表达至少与kegg途径相关:脂质代谢、p53信号传导途径、萜类和聚酮化合物代谢、补体和凝血级联和细菌(百日咳)。
优选地,本发明所述的扩增人血管内皮祖细胞的方法中,所述差异表达基因的蛋白质相互作用网络中评分≥0.9的相互作用包括plk1-cdc20,plk1-ccnb1,cdc20-ccnb1,ube2c-cdc20,mvd-hmgcs1,ube2c-plk1,cxcl5-adora3。
本发明与现有技术相比,本发明具有以下优点:
干细胞的干性主要表现为细胞的自我更新和分化的能力。目前广泛采用的epcs培养方法是在“5%co2,95%空气”的常规培养箱下进行培养并扩增(氧气浓度~20%),这种在空气中培养被认为是“常氧”,然而发明人发现传统常氧培养对于epcs来说是极度高氧的;高氧对于epcs的危害在于:细胞在有氧代谢时因氧化应激产生的活性氧簇(ros)会损伤细胞的dna,造成遗传的不稳定性。因此,本发明提供了一种在保持干细胞的干性同时能够有效增加epcs体外扩增的方法。
意外地,本发明的培养方法相比于常氧培养,低氧(缺氧)环境与骨髓微环境更为相似,更有利于epcs保持其原有的特性。
另一方面,本发明通过对不同培养方法导致的epcs中基因表达的改变进行分子水平的评价,给出了低氧或缺氧条件对细胞干性影响的差异表达基因与差异表达基因的分子途径,并用于改善目前的干细胞的培养方法。
附图说明
图1为本发明的一个实施例中的常氧(20%o2)以及低氧(1%o2)条件下对epcs的增殖能力影响图;
图2为本发明的一个实施例中的1%o2条件培养增强epcs成血管及迁移能力图;
图3为本发明的一个实施例中的使用软件处理degs的geneontology分析图;
图4为本发明的一个实施例中的degs的蛋白质相互作用网络(ppi)图;
图5为本发明的一个实施例中的degs的生物信息学go聚类分析示意图。
具体实施方式
下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1低氧条件下体外扩增人血管内皮祖细胞
1.从人骨髓中分离出epcs,并在不同氧浓度下进行培养。
在获得知情同意后,从3名志愿者中获得骨髓。使用人外周血淋巴细胞分离液(tbd,货号:lts1077)从骨髓中分离骨髓单个核细胞(mnc),并以4×105个细胞/cm2接种于纤维粘连蛋白(bd,货号:354008)包被的25cm2易用培养瓶(nunc,货号:156367)中。培养血管内皮祖细胞的培养基为egm-2培养基,然后将培养瓶分别置于37℃,5%co2,1%o2(低氧)或20%o2(常氧)条件下进行培养。
egm-2培养基为套装,包含500mlebm-2基础培养基并添加0.5mlhegf(人重组表皮生长因子)、0.2mlhydrocortisone(氢化可的松)、2.0mlhfgf-b(人成纤维细胞生长因子基本与肝素)、0.5mlvegf(血管内皮生长因子)、0.5mlr3-igf-1(人重组胰岛素样生长因子)、0.5ml抗坏血酸、0.5mlga-1000(庆大霉素,两性霉素-b)、0.5ml肝素、10mlfbs(胎牛血清,终浓度为2%)。
分离当天算第0天,4天后通过换液去除悬浮细胞,此后每隔两天半量换液。细胞70%-85%融合时进行传代(第11天左右进行第一次传代,总培养时间为3周左右)。
2.epcs的鉴定
通过免疫荧光染色和流式细胞仪对培养至p1(第16天左右)的细胞进行epcs的鉴定。
3.epcs体外增殖能力
通过细胞计数来确定epcs的体外增殖能力。并按照公式:群体倍增数(pd)=log2(收获时的细胞数-接种时的细胞数),而群体倍增时间(pdts)=接种和收获的时间间隔/pd。
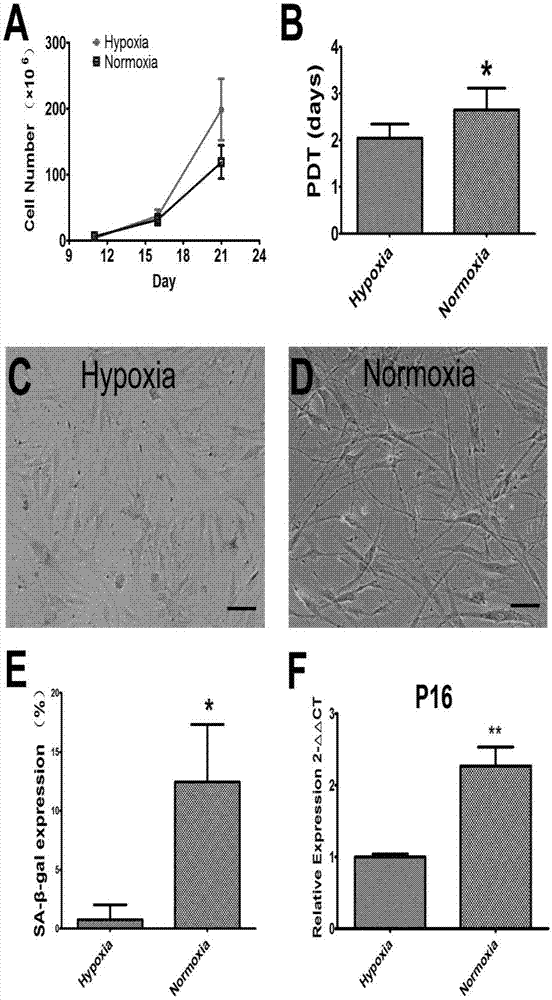
为了比较常氧(20%o2)以及低氧(1%o2)条件下epcs的增殖能力。首先通过细胞计数绘制出细胞生长曲线(图1a),并且通过公式计算出群体倍增时间(pdts)(图1b),通过图1a可以看出,低氧条件epcs的增殖速率高于常氧下培养epcs;通过图1b可以看出,与常氧条件相比,低氧条件下群体倍增时间(pdts)的明显减少。因此,20%o2条件培养不利于epcs的体外扩增,增加了细胞衰老。如图1所示,其中a.在低氧条件下,epcs的增殖速率高于常氧下培养;b.低氧条件下epcs群体倍增时间(pdts)明显小于常氧下;c.d.典型的β-半乳糖苷酶(sa-β-gal)染色显示在低氧或常氧下培养的epcs的细胞衰老图;e.低氧条件下epcs衰老细胞的比例明显低于常氧下培养的细胞;f.qrt-pcr发现低氧条件下,p16的表达量明显低于常氧条件下。*:p<0.05;**:p<0.01。
4.细胞衰老相关β-半乳糖苷酶(sa-β-gal)染色
按照制造商的protocol,用衰老β-半乳糖苷酶染色试剂盒测定epcs细胞内衰老(碧云天)。当细胞达到60%融合后,吸除细胞培养液,用pbs洗涤1次,加入1mlβ-半乳糖苷酶染色固定液,室温固定15分钟;然后吸除细胞固定液,用pbs洗涤细胞3次;最后吸除pbs,每孔加入1ml染色工作液。放入1%o2或20%o2培养箱37℃孵育过夜。放大倍数10倍时,选择10个随机视野计数衰老epcs的百分比(即sa-β-gal阳性)。
结果发现,衰老相关β-半乳糖苷酶染色以及衰老相关基因p16的pcr检测发现,与常氧相比,低氧条件下epcs衰老细胞的比例明显降低(图1e),衰老相关基因p16的表达量也明显降低(图1f)。
实施例2低氧条件对epcs分化与干性的影响
为了检测低氧条件培养对epcs功能的影响,我们分别对两种条件下培养的epcs做了成血管实验以及transwell迁移实验,以分析epcs的体外血管生成功能及其归巢能力。
1.迁移实验
在24孔板transwell小室(孔径8.0μm;corning)中进行transwell迁移实验。将悬浮于无血清ebm-2基础培养基(lonza,货号:cc-3156)中的epcs(200μl,1x105个细胞,实施例1获得)接种于transwell上室,并将500μl补充有10%fbs的ebm-2培养基,添加至transwell下室。分别在37℃/1%o2与20%o2下孵育24小时后,用棉签小心去除滤纸表面的细胞后,使用75%酒精固定以及0.1%结晶紫染色,在10倍镜下每个膜拍摄五个随机视野的图像。
2.成血管实验
成血管实验用以估计epcs的体外血管生成能力。简言之,将epcs(3×104个细胞,实施例1获得)接种于铺有生长因子减少的基质胶(70μl/孔;bdbiocoat)的96孔板上,在ebm-2培养基(lonza)37℃/1%o2或20%o2孵育8小时后,在倒置显微镜下观察每个孔中成管情况并以10x放大倍数拍照。使用imagej插件'angiogenesisanalyze'计算管长度。
与常氧相比,低氧条件培养epcs体外形成管状结构的长度明显增加(图2c),transwell实验中细胞迁移数量也明显增加(图2f)。
如图2所示,1%o2条件培养增强epcs成血管及迁移能力。a.b.典型的在低氧和常氧条件下培养的epcs体外管状结构构成图;a`和b`分别为a和b图以imagejangiogenesisanalyze分析所形成的中间图;c.低氧下培养的epcs形成体外管状结构的长度高于常氧条件下培养的细胞;d.e.典型的transwell实验显示的低氧和常氧下培养的epcs细胞迁移图;f.低氧培养的epcs的transwell细胞迁移数量明显高于常氧条件下的epcs。*:p<0.05。
实施例3低氧条件对epcs的基因表达的影响
1.rna测序和预处理
将实施例1培养的细胞用trizol保存,然后使用rnasimple总rna提取试剂盒(tiangen,货号:dp419)提取总rna,并将其保存在含有rna酶抑制剂的depc水溶液(abcam,货号:ab146240)中。rna样品经安捷伦2100生物分析仪检测后,总量不低于2ug,浓度不低于50ng/ul,rin值不低于7。达到此标准后的样品利用neb的转录组建库试剂盒(neb,货号:e7530)进行建库。库检合格后通过illumina公司测序平台对rna进行测序,每个样品产生不少于8gb的数据,测序模式为150pe,插入片段大小为280bp。
数据下机后,首先利用fastqc进行数据质控,然后利用软件tophat2(v2.1.1)和软件cufflinks进行差异表达分析。所使用的参考基因组为grch38,基因组序列文件和基因组注释文件下载链接:(ftp://ftp.ncbi.nlm.nih.gov/genomes/all/gcf/000/001/405/gcf_000001405.26_grch38)
基因表达计算方法为:fpkm(expectednumberoffragmentsperkilobaseoftranscriptsequencepermillionsbasepairssequenced),即每百万fragments中来自某一基因每千碱基长度的fragments数目;基于基因定量结果,通过cufflinks软件cuffdiff模块进行差异表达分析。差异结果筛选标准为|log2ratio|≥1且qvalue≤0.05。
结果:
进行rna测序以鉴定低氧(1%o2)条件对基因表达的影响。与常氧(空气,
log2(fold_change)表示该基因在低氧中的表达相对于常氧的差异倍数的log2值。如值1.0表示相对于常氧,低氧中表达下调2倍;p-value表示表达差异的统计显着性,p值越小越显著;q-value,是做过多重假设检验校正之后的p-value,取值范围为0到1,越接近于零,表示富集越显著。
表1.差异表达基因列表
2.degs的go分析
生物信息学分析有助于差异基因的聚类分析,并发现响应低氧的基因相关的生化途径。使用r软件包(版本3.3.2)处理degs的geneontology分析(go,https://www.geneontology.org/)[2]和京都基因和基因组百科全书分析(kegg,http://www.genome.jp/kegg/pathway.html)[3]。
go分析可以提示受到低氧影响的基因更具体的功能模式(见图3和图5)。基因(pdk4/pid1/ccnb1)在细胞对脂肪酸的反应中富集,基因(plk1/cdc20/ccnb1/ube2c)与泛素蛋白连接酶活性正向调节有关、基因(pdk4/kynu/mvd)与乙酰辅酶a代谢过程有关、基因(pid1/plk1/cdc20/ccnb1/ube2c)与有丝分裂细胞周期相变的调节有关;degs也在其他生物过程(bp)富集:如白细胞介导的免疫、对维生素的反应。总体而言,发现degs主要涉及四个生物过程(bp):包括细胞对脂肪酸的反应、涉及调节有丝分裂细胞周期转变的泛素-蛋白连接酶活性的正调控、乙酰辅酶a代谢过程以及调节有丝分裂的细胞周期相变(图5a)。此外,在bp中与泛素蛋白和有丝分裂细胞周期有关的基因在细胞组分(cc)中的后期促进复合物和缩合核染色体着丝粒中富集。并且在分子功能(mf)中,igg结合被富集(图5b、c)。
3.degs的kegg途径分析
为了更好地理解低氧条件影响epcs干性的分子机制,对差异表达基因进行了kegg途径分析。通过kegg富集分析,富集6条途径(表2),其中,两条途径与脂质代谢(酮体的合成和降解,类固醇生物合成)有关,1条途径与细胞生长和死亡有关(p53信号传导途径),另外三条途径分别是:萜类和聚酮化合物代谢(与萜类骨架生物合成相关),免疫系统(与补体和凝血级联相关)和细菌(百日咳)。
表2.差异表达基因富集的信号途径列表
4.蛋白质-蛋白质交互网络(ppi)分析
在线数据库string(http://string-db.org)[4]用于分析基于degs的蛋白质-蛋白质相互作用网络(ppi),并使用r包stringdb进行分析。
43个degs(5个degs不在数据库中)组成了43个节点和59个边缘的ppi网络(图4)。根据得分,富集度评分≥0.9的蛋白质相互作用如下:plk1-cdc20,plk1-ccnb1,cdc20-ccnb1,ube2c-cdc20,mvd-hmgcs1,ube2c-plk1,cxcl5-adora3。富集评分越高,说明蛋白质之间的相互作用关系可能越强。
如图4所示,ppi网络中的每个结点(圆圈)代表一种蛋白质,连接两个蛋白质之间的线代表他们之间的某种相互作用关系(已知的、预测、从数据库和实验确定的、基因邻域、融合和共现、文本连接)。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
参考文献
[1].kim,d.,etal.,tophat2:accuratealignmentoftranscriptomesinthepresenceofinsertions,deletionsandgenefusions.genomebiol,2013.14(4):p.r36.
[2].dennis,g.j.,etal.,david:databaseforannotation,visualization,andintegrateddiscovery.genomebiol,2003.4(5):p.p3.
[3].duj,etal.,kegg-path:kyotoencyclopediaofgenesandgenomes-basedpathwayanalysisusingapathanalysismodel.molbiosyst,2014.10(9):p.2441-7.
[4].vonmering,c.,etal.,string:adatabaseofpredictedfunctionalassociationsbetweenproteins.nucleicacidsres,2003.31(1):p.258-61.
- 还没有人留言评论。精彩留言会获得点赞!