一种基于银染增强的纳米金技术检测核酸的方法与流程
本发明涉及一种基于银染增强的纳米金技术检测核酸的方法,属于分子生物学和核酸化学领域。
背景技术
现知的人类疾病都与基因有着直接或间接的关系,核酸的检测和分析在遗传性疾病、传染病和肿瘤等领域的应用日益广泛,所以建立一种高灵敏度、高选择性和特异性的检测方法具有十分重要的意义。以往的方法大多建立在标记放射性元素、荧光以及电化学发光物质的探针与目标物序列的杂交的体系上。但由于其试剂价格昂贵,且需要的实验环境以及设备要求高等方面加大限制了其应用。所以建立一种高灵敏度、高选择性的检测方法极其必要。
随着纳米技术的发展,纳米金的应用得到了广泛的关注。金纳米粒子(aunps)有着其独特的物理和化学性质,如极高的消光系数、稳定的化学性质、优异的荧光淬灭能力以及显著的催化作用,使其成为了纳米科学研究中不可分割的一部分,纳米金作为标记物,广泛应用于蛋白质、癌症标记物、免疫球蛋白以及寡核苷酸的检测。硫醇化的dna修饰aunps的在生物分析、诊断方面更是受到广泛的重视,dna-aunps结构稳定,更是具有优秀的单碱基错配特异性识别能力。同时,由于金纳米良好的催化功能,使用银染的方式沉积银进行信号的扩大取得了不错的结果,在遗传疾病的临床诊断中起到了重大的实际意义和应用价值。
技术实现要素:
本发明的目的是提供一种基于银染增强的纳米金技术检测核酸的方法。
具体步骤为:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行。通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别探针(au-rp)的制备:移取60μl浓度为10μmol/l巯基修饰的dna识别探针(rp)加入60μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph5.8的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入1ml步骤(1)合成的浓度为5.8nmol/ml金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时;接着分别往里加入11.3μl质量百分比浓度为10%的十二烷基硫酸钠(sds)溶液,使最终质量百分比浓度为0.1%,加入125.7μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l,再加入66.16μl浓度为2mol/l的nacl,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs缓冲溶液中并重复清洗3次,去掉上清液,最后分散至含1ml含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中储存备用。
(3)磁珠标记捕获探针(mb-cp)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清液,然后用100μlttl缓冲溶液(100mmol/ltris-hcl;ph8.0,体积百分比浓度为的0.1%tween®20;1mol/llicl)溶液清洗1次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l生物素修饰的dna(cp),在室温下轻微震荡孵育15分钟,以使生物素修饰的探针与链霉亲和素包被的磁珠轻缓而充分地结合,最后使用100μltt缓冲溶液(250mmol/ltris-hcl;ph8.0,体积百分比浓度为0.1%的tween®20)清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中储存备用。
(4)探针杂交反应:移取10μl步骤(3)中浓度为10mg/ml的捕获探针(mb-cp)、10μl浓度范围为50fmol/l~250pmol/l的目标物和30μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs放进0.2ml离心管,震荡混匀后置于pcr仪中30℃加热30分钟,取出溶液进行磁性分离,用含0.1mol/lnacl浓度为10mmol/lph7.4pbs清洗2次后,分散在50μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,随后往溶液中加入10μl步骤(2)中浓度为5.8nmol/ml识别探针(au-rp),震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,分别用100μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs、含0.1mol/lnano310mmol/lph7.4pbs以及0.1mol/lnano3进行清洗,去除游离的纳米金探针。
(5)银染和电化学分析检测:银增强剂溶液通过混合三种溶液制备,首先制备浓度为15mmol/lagno3(溶液a),浓度为50mmol/l对苯二酚(溶液b)以及浓度为150mmol/l柠檬酸和浓度为50mmol/l柠檬酸三钠(溶液c),使用前的体积比为1:1:1,溶液b和溶液c在银染之前的半个小时左右开始在水浴锅中保持30℃温育。在清洗后的产物中加入银染溶液并快速震荡混匀且放置在光线暗淡的环境中反应12分钟(3分钟/次),反应完毕后立即加入50μl浓度为0.3mol/l的na2s2o3溶液终止反应,避免产生非特异性的沉淀。磁性分离去除上清液,加入去离子水清洗3~5次后加入100μl体积百分比浓度为50%的hno3消解30分钟;消解完毕后将溶液全部移至1.9ml浓度为0.1mol/lhno3/kno3溶液中,应用处理好的玻碳电极在-0.5v搅拌富集5分钟,静置30秒,利用时差脉冲溶出伏安法在0v~0.7v范围内扫描,记录电化学响应。峰电流信号与不同目标物浓度成正相关,通过一系列实验条件优化,确定杂交时间60分钟,银染的时间12分钟(3分钟/次),沉积时间300秒,沉积电位-0.5v为最优实验条件,还原峰电流与目标物浓度的对数有着良好的线性关系(y=1.2632x+11.6395,r=0.9911),检测范围为50fmol/l~250pmol/l,检出限为17fmol/l。
(6)方法特异性:在最优的实验条件下,分别取10µlx相同浓度的错配序列dna-7a、dna-7b、dna-7c、dna-7d、dna-7e、dna-7g按照以上实验原理进行杂交、银染和检测。
本发明方法的优点如下:
首先,该方法灵敏度高,利用金纳米良好的催化性质,加入银染试剂沉积银使其放大信号,检出限可到17fmol/l;具有较高的选择性和特异性,能够很好地区分互补目标与单碱基错配和非互补序列;分析步骤简便且时间较短,磁珠材料的应用更是为分离步骤节约时间;结合电化学检测方法,分析速度快、灵敏高且易于实现自动化。
附图说明
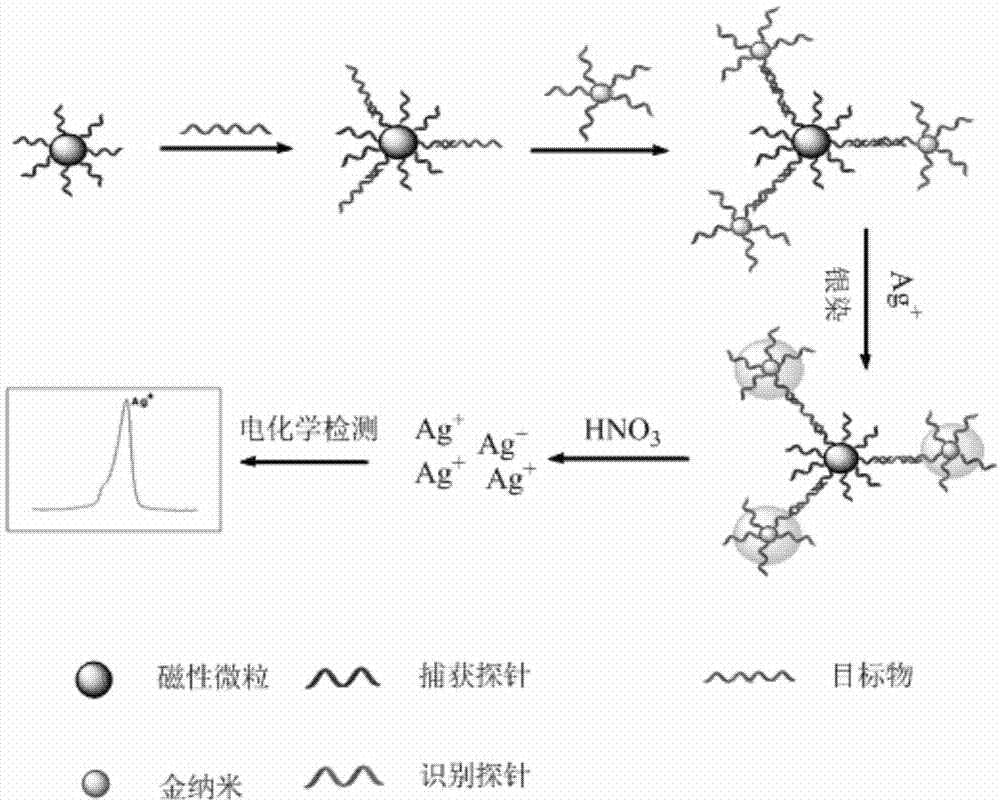
图1为本发明银染增强的纳米金技术检测核酸的原理图。
图2为本发明实施例纳米金的扫描电镜图(a)和粒径分布图(b)。
图3为本发明实施例金纳米(a)和金纳米标记探针(b)紫外可见吸收光谱图。
图4为本发明实施例杂交时间优化图。
图5为本发明实施例银染时间优化图。
图6为本发明实施例沉积时间优化图。
图7为本发明实施例沉积电位优化图。
图8为本发明实施例目标物电化学响应图(a)线性曲线图(b)。
图9为本发明实施例错配dna序列电化学响应图。
具体实施方式
以下将结合说明书附图和具体实施例对本发明做详细说明。
实施例:
(1)纳米金合成制备:移取100ml质量百分比浓度为0.01%的氯金酸溶液倒入圆底烧瓶中,将其放置油浴锅中加热煮沸后迅速加入3ml质量百分比浓度为1%的柠檬酸钠溶液作为还原剂,继续加热15分钟,观察溶液的颜色从最初的淡黄色逐渐变成酒红色,最后停止加热冷却至室温,并且全程处于搅拌状态下进行。通过扫描电子显微镜表征可知纳米金的粒径为16nm。
(2)金标记识别探针(au-rp)的制备:移取60μl浓度为10μmol/l巯基修饰的dna识别探针(rp)加入60μl含10mmol/l三(2-羧乙基)膦(tcep)浓度为10mmol/lph5.8的磷酸盐缓冲溶液(pbs)中活化2小时,活化完毕后加入1ml步骤(1)合成的金纳米溶液,立即震荡均匀并迅速裹上锡纸避光孵育16小时。接着分别往里加入11.3μl质量百分比浓度为10%的sds溶液,使最终质量百分比浓度为0.1%,加入125.7μl浓度为0.1mol/lph7.4pbs溶液,使其最终浓度为10mmol/l,再加入66.16μl浓度为2mol/l的nacl,使其最终浓度为0.1mol/l。在孵育24小时后使用高速离心机离心(10000转/分钟,20分钟),分散至含0.1mol/lnacl浓度为10mmol/lph7.4pbs缓冲溶液中并重复清洗3次,去掉上清液,最后分散至含1ml含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,震荡均匀,放置在4℃的黑暗环境中储存备用。
(3)磁珠标记捕获探针(mb-cp)的制备:量取1mg磁珠置于离心管中,经过磁性分离,弃去上清,然后用100μlttl缓冲溶液(100mmol/ltris-hcl;ph8.0,体积百分比浓度为0.1%的tween®20;1mol/llicl)溶液清洗一次,接着分散至200μlttl缓冲溶液中,然后往溶液中加入50μl浓度为10μmol/l生物素修饰的dna(cp),在室温下轻微震荡孵育15分钟,以使生物素修饰的探针与链霉亲和素包被的磁珠轻缓而充分地结合,最后使用100μltt缓冲溶液(250mmol/ltris-hcl;ph8.0,体积百分比浓度为0.1%tween®20)清洗2次,磁性分离,弃去上清液,分散至500μl含0.2mol/lnacl浓度为10mmol/lph7.4pbs溶液中储存备用。
(4)探针杂交反应:移取10μl步骤(3)中的捕获探针(mb-cp)、10μl浓度为10pmol/l的目标物dna-7a和30μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs放进0.2ml离心管,震荡混匀后置于pcr仪中30℃加热30分钟,取出溶液进行磁性分离,用含0.1mol/lnacl浓度为10mmol/lph7.4pbs清洗2后,分散在50μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs溶液中,随后往溶液中加入10μl步骤(2)中的识别探针(au-rp),震荡混匀后置于pcr仪中在30℃下孵育45分钟,磁性分离,分别用100μl含0.1mol/lnacl浓度为10mmol/lph7.4pbs、含0.1mol/lnano310mmol/lph7.4pbs以及0.1mol/lnano3进行清洗,去除游离的纳米金探针。
(5)银染和电化学分析检测:银增强剂溶液通过混合三种溶液制备,首先制备浓度为15mmol/lagno3(溶液a),浓度为50mmol/l对苯二酚(溶液b)以及浓度为150mmol/l柠檬酸和浓度为50mmol/l柠檬酸三钠(溶液c),使用前的体积比为1:1:1,溶液b和溶液c在银染之前的半个小时左右开始在水浴锅中保持30℃温育。在清洗后的产物中加入银染溶液并快速震荡混匀且放置在光线暗淡的环境中反应12分钟(3分钟/次),反应完毕后立即加入50μl浓度为0.3mol/l的na2s2o3溶液终止反应,避免产生非特异性的沉淀。磁性分离去除上清液,加入去离子水清洗3次后加入100μl体积百分比浓度为50%的hno3消解30分钟。消解完毕后将溶液全部移至1.9ml浓度为0.1mol/lhno3/kno3溶液中,应用处理好的玻碳电极在-0.5v搅拌富集5分钟,静置30秒,利用时差脉冲溶出伏安法在0v~0.7v范围内扫描,记录电化学响应。峰电流信号与不同目标物浓度成正相关,通过一系列实验条件优化,确定杂交时间60分钟,银染的时间12分钟(3分钟一次),沉积时间300秒,沉积电位-0.5v为最优实验条件,还原峰电流与目标物浓度的对数有着良好的线性关系(y=1.2632x+11.6395,r=0.9911),检测范围为50fmol/l~250pmol/l,检出限为17fmol/l。
(6)方法特异性:在最优的实验条件下,分别取10µl浓度为200pmol/l的错配序列dna-7a、dna-7b、dna-7c、dna-7d、dna-7e、dna-7g按照以上实验原理进行杂交、银染和检测。
如图1所示,磁珠标记的捕获探针与金纳米标记的识别探针在目标物对得存在下,形成“三明治”结构,磁性分离,去掉游离的识别探针,加入银染试剂(含对苯二酚,硝酸银等成分),利用金纳米的催化作用,对苯二酚可以将银离子(ag+)还原成银原子(ag),被还原的银原子围绕纳米金颗粒形成一个“银壳”,这起到了一个信号放大的作用,消解后采用高灵敏度的差分脉冲伏安法对ag+检测。
图2a和2b为分别为金纳米的透射电子显微镜图换和粒径分布图,可以从图看出:金纳米颗粒粒径均一,分散性好,粒径大概在13nm左右。
图3为金纳米标记识别探针的紫外可见吸收光谱图,由图3可以看出,裸金(a)和修饰了识别探针的金纳米(b)的吸收波长相差不大,说明识别探针成功修饰上了金纳米上面。
由图4可以看出,最佳的杂交反应时间为60分钟。
由图5可以看出,最佳的银染时间为12分钟。
由图6可以看出,最佳的沉积时间为300秒。
由图7可以看出,最佳的沉积电位为-0.5v。
由图8可以看出,峰电流信号与目标物浓度的对数有一个良好线性关系。
由图9可以看出,目标物dna-7a的还原峰电流信号远远比空白和错配序列高,此可知本发明的方法能够很好地区分互补目标与单碱基错配和非互补序列,具有高灵敏度和特异性。
以上仅是本发明的优选实施方案,本发明的保护范围并不仅局限于上述实施例,与本发明构思无实质性差异的各种工艺方案均在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!