一种重组变构胶原酶的制备方法及其应用与流程
本发明属于生物制品制药
技术领域:
,涉及重组变构胶原酶的纯化方法及其应用。
背景技术:
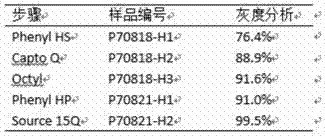
胶原蛋白酶无论在医疗健康、生产实践及科研方面都有着广泛的应用,比如医学上用于清创、治疗腰椎间盘突出、治疗罕见病如杜普伊特伦挛缩与佩罗尼氏症等,并有望开发出溶脂、除疤、皮肤微整形的新药,生产上用于食品软化等,科研实验方面用于细胞分离、考古样本的处理等。随着人们生活水平的日益提高,肥胖人群越来越常见,对爱美的人士来说肥胖是个大问题。目前减肥市场产品很多,脂肪抽吸术是一种应用较多的减脂方法。脂肪抽吸是一种借助仪器的物理方法,对身体有一定的损伤,抽吸部位的其他组织很容易损伤,也容易发生感染、瘀伤、血肿、深静脉血栓等副作用。目前,市场上还有激光辅助溶脂、超声辅助溶脂和注射溶脂等有创溶脂,还有冷冻溶脂、射频、超声等无创溶脂。局部皮下脂肪团,例如双下巴,是一种比较常见的脂肪堆积现象,这种局部皮下脂肪团难以用运动进行消除。2015年,美国fda批准了全球首个“双下巴”溶脂针kybella(atx-101),用于中度至重度“双下巴”成人,该针剂是用于消除多余颏下脂肪(双下巴)的首个也是唯一一个非手术治疗产品。kybella是人工合成的脱氧胆酸,其主要作用于细胞膜,而使细胞破裂,进而实现溶脂效果。由于脱氧胆酸的作用机理,kybella的作用没有特异性,除脂肪细胞外,也能作用于其他细胞,因此有较大副作用,容易造成下颌缘神经损伤、咽下困难、注射部位血肿/瘀伤等。随着胶原酶的发现和应用,其特殊的作用机制使得其能应用于溶脂领域。当前商业化的胶原蛋白酶(包括来自溶组织梭状芽胞杆菌的胶原蛋白酶)都是直接从生物样本中分离提取的,由于胶原酶在生物体中存在多种同工酶,这些商业化的品种往往是由5-6种胶原蛋白酶组成的混合物。即使经过高度纯化,具有相似的分子量和等电点(pis)的colh和colg也是很难进行分离的。因此,来自溶组织梭状芽胞杆菌的高度纯化的胶原蛋白酶仍然是包含colg和colh的混合物。2015年上市的xiaflex就是colh和colg两种胶原酶的混合物,而且纯度较低。由于成分的非单一性,实际应用方面存在较多限制,比如在动物注射时容易引起出血,副作用不易把控。eijitamai等的研究(eijitamai等,high-levelexpressionofhis-taggedclostridialcollagenaseinclostridiumperfringen,applmicrobiolbiotechnol(2008)80:627–635)用产气荚膜梭菌分泌表达胶原酶colh,为了便于纯化,colh的c端带his标签。经过硫酸铵沉淀、锌柱亲和纯化、monoq阴离子交换层析等步骤得到纯度约90%的重组colh。paulinaducka等的研究(paulinaducka等,auniversalstrategyforhigh-yieldproductionofsolubleandfunctionalclostridialcollagenasesine.coli,applmicrobiolbiotechnol(2009)83:1055–1065)用大肠杆菌表达colh,经镍柱亲和纯化、阴离子交换层析、分子筛层析得到纯度约90%的重组colh。这些研究得到的colh纯度及质量控制都难以达到临床应用要求。纯化自商业来源的胶原蛋白酶(包括来自溶组织梭状芽胞杆菌的)是由5-6种胶原蛋白酶组成的混合物。即使经过高度纯化,具有相似的分子量和等电点(pis)的colh和colg也是很难进行分离的。因此,来自溶组织梭状芽胞杆菌的高度纯化版本的胶原蛋白酶仍然包括colg和colh的混合物。在我们进行的肥胖大鼠实验中,通过常规过程纯化的野生型胶原蛋白酶诱导了大量出血。cn101678088公开了一种重组变构胶原酶在溶脂方面的应用,该变构酶序列含有gst标签,并在coih(glu451asp)前附加有肽基序,经镍柱亲和层析纯化得到纯度约为90%的蛋白产品,但在实际应用过程中发现该产品难以制药产业化,不能进入市场。主要存在以下两个问题:(1)蛋白纯度较低。蛋白纯化一直是影响蛋白药物产业化的难点问题,蛋白药物杂质来源包括a.工艺相关杂质如宿主细胞成分、内毒素等;b.下游工序产生的杂质如蛋白溶解剂、还原剂、变性剂、微量金属、纯化色谱配体等;c.产品相关杂质如前体、错误折叠蛋白、产品片段及某些降解产物等。杂质因具有潜在的健康危险性(致癌性、过敏性、抗原性、一般或特殊毒性),因此对于治疗性蛋白药物的纯度一般要求大于95%以上。(2)产品包含gst标签,属于非天然序列。亲和层析是目前常用的蛋白分离纯化手段,gst是最常用的亲和层析纯化标签之一,带有此标签的重组蛋白质可用交联谷胱甘肽的层析介质纯化,但蛋白质上的gst必须能合适地折叠,形成与谷胱甘肽结合的空间结构才能用此方法纯化;并且,gst标签多达220个氨基酸,如此大的标签可能会影响表达蛋白质的可溶性,使其形成包涵体,这会破坏蛋白质的天然结构,难于进行结构分析,有时即便纯化后再酶切去除gst标签也不一定能解决问题(欧芹,林雪松主编,生物化学与分子生物学实验教程第2版,北京大学医学出版社,2015.08,第18页)。技术实现要素:本发明涉及一种组合物,包括一种高纯度单一突变体胶原蛋白酶colh(编号:rjv001)。天然胶原酶由于活性较高,对胶原的降解较剧烈,容易引起副作用。而且,天然胶原酶是一种混合酶,不利于cmc(化学品生产控制),每一批次的产品各组分比例难以一致,对后续应用于人体产生一定的风险。为了得到能产业化的胶原酶colh,本发明将溶组织梭菌中表达胶原蛋白酶colh经e451d单点突变后,降低催化活性,使其作用于动物组织时相对温和,更有利于开发新药,有希望用于更多的适应症。具体地,变构colh的比活约是天然胶原酶的10%,km值与天然胶原酶相比变化不大,但kcat值明显降低。(km值为米氏常数,是衡量酶与底物亲和力的。kcat又叫转化数,利用vmax除以酶浓度进行计算。所以可以知道,kcat衡量的是在最优条件下酶催化生成底物的速率。kcat是一个常数,其单位是1/s,也可以将kcat理解成单个酶分子在一秒内转化底物的数量,或者单个酶分子转换一个底物分子所需的时间。)因此,变构colh相对于天然colh具有更温和的催化作用,能够缓慢剪切胶原蛋白。另外,在得到了高纯度(98%以上)的变构胶原酶后,对变构胶原酶的稳定性进行了检测,发现变构胶原酶的稳定性更好。本发明涉及的组合物可以进一步包括药学上可接受的载体。药学上可接受的载体,包括对突变体colh呈惰性的载体,例如那些选生理盐水、葡聚糖水溶液和羟乙基淀粉水溶液所组成的组,优选适合缓冲至中性ph。另外还可以使用纤维蛋白胶作为载体,其包括纤维蛋白或纤维蛋白前体,例如纤维蛋白原加凝血酶等。另一方面,本发明开发了一种利用重组大肠杆菌生产高纯度梭菌胶原蛋白酶的工艺方法。通过摸索发酵条件和优化培养基,使目的蛋白在大肠杆菌中表达后大部分可溶,并且发酵周期较短,胶原蛋白酶产量较高,催化活性稳定;菌体收获后经高压匀浆破碎,经中空纤维柱过滤澄清、5步柱层析纯化,最后得到纯度98%以上的胶原蛋白酶,该产品无需添加人血白蛋白等保护剂,在2-8℃及-70℃保存均相对稳定。具体的,本专利中的重组变构胶原酶由大肠杆菌表达。菌种经过发酵,高压匀浆破碎,破碎上清经过五步纯化步骤得要达标产品。五步纯化步骤分别如下:第一步:captophenylhs疏水层析;平衡captophenylhs疏水层析柱,菌体破碎上清经过硫酸铵沉淀重悬后上样,洗脱液进行洗脱,收集洗脱峰。第二步:captoq阴离子交换层析;平衡captoq阴离子交换层析柱,第一步得到的收集液上样,洗脱,收集主峰。第三步:captooctyl疏水层析;平衡captooctyl疏水层析柱,第二步得到的收集液上样,洗脱,收集主峰。第四步:phenylhp疏水层析;平衡phenylhp疏水层析柱,第三步得到的收集液经过高盐处理后上样,洗脱,收集主峰。第五步:source15q阴离子交换层析;平衡source15q阴离子交换层析柱,第四步得到的收集液上样,洗脱,收集主峰。再将纯化得到的目标产物通过超滤置换缓冲液,并浓缩,过滤除菌,冻干,得到终产品。采用上述工艺,65l罐发酵得到菌体鲜重为65-80g/l,菌体酶活在25-35u/g菌体;经过澄清和5步层析纯化,最终得到纯度高达98%以上的胶原蛋白酶,活性在1.1-1.4u/mg蛋白,整个纯化收率在10-20%;-80℃及2-8℃存放,均无明显的多聚体产生或明显的活性损失。此工艺生产的突变胶原蛋白酶纯度高,稳定性好,与之前的胶原蛋白酶商品相比具有明显的优势,酶比活显著提高。本发明还涉及一种减少体内指定位置的脂肪组织数量的方法,其包括向所述组织引入有效量的高纯度的变构胶原酶。根据本发明,本发明的高纯度的变构胶原酶可以伴随透皮技术用作脂肪分解霜,或替代脂肪抽吸术的表皮霜剂。换言之,本发明提供一种新的方法来减少过量的不美观和/或冗余的皮下脂肪组织,其为非-介入性的方法,例如注射或表皮霜剂。高纯度的变构胶原酶可以被开发为药物,因为它是一种纯度较高较少杂质单一的物质,易于进行cmc(化学品生产控制)。当高纯度的变构胶原酶被引入活体动物的皮下脂肪组织中的时候,在该部位脂肪组织发生分解和减少。该方法既温和又精确,其不会对人体造成外伤,也不会产生感染。实际实施例中,将终产品用生理盐水稀释成0.015mg/ml、0.05mg/ml、0.15mg/ml、0.25mg/ml,注射到迷你猪背部两侧脂肪层,通过脂肪层超声检查及解剖验证,注射位点脂肪层明显减少。说明经过纯化的重组变构胶原酶对脂肪有明显消除作用。本发明额外的应用是疤痕减少,无论疤痕是否发现于皮肤表面。高纯度的变构胶原酶能够消化凸起的疤痕组织中过度生长的胶原蛋白,从而减少疤痕的高度和外观。本发明还可以被用于治疗脂肪瘤和其它脂肪组织,其可以在人和动物体内、在野生动物中、在人类家庭中、或在动物园里。本发明的其他特征和优点将在随后的具体实施方式部分予以详细说明。附图说明图1描述了e451d单点突变colh变构胶原酶核苷酸序列。图2描述了e451d单点突变colh变构胶原酶蛋白序列。图3描述了宿主菌的筛选。其中bl21(de3)相对于bl21(de3)plays,能够更多地表达目的蛋白,而transetta则无法表达足够的目的蛋白,不能满足进一步实验要求。图4描述了菌种发酵诱导温度筛选。相对于37摄氏度,采用低温28.5摄氏度进行发酵,能够明显提高目的蛋白产量。图5描述了未加入captophenylhs疏水层析步骤时仅进行captoq;captooctyl;phenylhp;source15q四步纯化后的蛋白纯度,sds-page灰度分析结果显示,蛋白产物纯度仅为94.6%,无法满足生产需求。图6描述了captoq阴离子交换层析与captodeae阴离子交换层析操作比较。结果表明,captodeae分离度较差,无法获得合适的目的蛋白。captoq分离度较好,适宜本发明目的蛋白分离。图7描述了sds-page纯度检测五步纯化蛋白纯度结果。图8描述了sds-page检测五步纯化蛋白纯度步骤灰度分析结果。经过五步纯化,蛋白产物纯度达到了99.5%。图9描述了ce-sds检测五步纯化蛋白结果。蛋白产物纯度达到98.740%。图10描述了sec检测五步纯化蛋白结果。蛋白产物纯度达到98.8%。图11描述了五步纯化各步蛋白内毒素分析。图12描述了五步纯化后高纯度(>98%)变异胶原酶(rjv001)与之前一步镍柱纯化低纯度(~90%)变异胶原酶(rcolh(fm))产品体外酶比活测定结果。rjv001酶比活显著提高,具有统计学差异。图13描述了ph对制剂稳定性考察(一个月)。图14描述了钙离子对制剂稳定性考察(三个月)。图15描述了原液稳定性考察-反复冻融。图16描述了原液稳定性考察-冻存(-70度)。图17描述了原液稳定性考察-低温图18描述了巴马香猪模型注射溶脂实验中活体超声结果(部分)图19描述了巴马香猪模型注射溶脂实验中表皮观察结果(部分)图20描述了巴马香猪模型注射溶脂实验中解剖结果(部分)图21描述了巴马香猪模型注射溶脂实验中活体超声统计结果具体实施方式实施例1重组变构胶原酶菌种构建仪器与材料colh变构胶原酶基因序列为人工合成,pet-30a(+)、宿主菌bl21(de3)、bl21(de3)plays、transetta购自默克公司,内切酶购自thermo公司。实验方法图1描述了e451d单点突变colh变构胶原酶序列。图2描述了e451d单点突变colh变构胶原酶蛋白序列。将合成回来的质粒及pet-30a(+)空载体经ndei/xhoi双酶切,电泳检测,割胶回收目的片段和载体片段。将回收后的两个片段用t4dna连接酶连接,10ul连接产物转化到100ul感受态细胞,涂板挑单克隆,测序结果正确的克隆为目的菌种。检测选择不同宿主菌对蛋白表达的影响,图3结果表明,bl21(de3)相对于bl21(de3)plays、能够更多地表达目的蛋白,而transetta无法表达足够的目的蛋白,不能满足进一步实验要求。实施例2重组变构胶原酶菌种发酵仪器与材料bioflo61065.0l发酵罐购自eppendorf公司,高速冷冻离心机购自thermo公司,工作种子批,蛋白胨、酵母浸出物购自oxid公司,各种试剂购自国药化学试剂公司。实验方法摇瓶种子培养过夜后在合适状态下接种到种子罐,培养一定时间后将种子液注入到与其相连的生产罐中,37℃培养一定时间,生产培养基配方为蛋白胨13.5051g/l,酵母粉7g/l,硫酸镁0.4g/l;生产罐接种4h后加iptg终浓度为0.5mm进行诱导,诱导时间7-8小时,中间需要补料;监测溶氧和ph,取样检测od600和粗酶活。发酵结束后进行离心收集菌体。发酵温度是影响蛋白产量的重要因素,因此,对菌种发酵过程中发酵温度进行筛选。研究发现,将发酵温度从37℃适当降低如32℃、31.5℃、30℃、29.5℃、29℃、28.5℃、28℃、27.5℃、27℃,均能够提高蛋白产量。图4示例性结果表明,降低温度至28度左右,能够明显提高目的蛋白产量。实施例3重组变构胶原酶的纯化方法仪器与材料captophenylhs、captoq、captooctyl、phenylhp等填料购自ge公司,aktapurifier层析系统(ge公司),中空纤维柱超滤系统(pall)。实验方法1)菌体收获与澄清发酵结束后通过离心方式收集菌体;进一步地,放大后可通过膜处理等方式进行菌体收集。鲜菌体可通过冷冻保存,或直接进行破碎处理进入下一步。待破碎菌体在tris缓冲液中重悬均匀,重悬浓度10-20%,经高压均质机600-700bar压力破碎,过高压阀3次,破碎过程中控温2-8℃。菌体裂解液经0.65μm中空纤维膜柱过滤(在一定泵压下进行),将细胞碎片和可溶成分分离,得澄清溶液,检测澄清度和收率。2)captophenylhs疏水层析清洁captophenylhs疏水层析系统,除热原。用流动相a(50mmtris,1-2mnacl,ph8.0)进行平衡,上样,再用流动相a进行冲洗。用流动相b(50mmtris-hcl,ph8.0)进行梯度或等度洗脱,收集洗脱峰。图5结果表明,在没有进行captophenylhs疏水层析步骤操作,仅进行captoq阴离子交换层析;captooctyl疏水层析;phenylhp疏水层析;source15q阴离子交换层析四步纯化操作时,最终蛋白纯度仅为94.6%,难以实现产业化。因此为了增加一步强疏水,增加了captophenylhs疏水层析步骤。结果表明,最终蛋白纯度提高至99.5%(图8)。3)captoq阴离子交换层析用流动相a(50mmtris-hcl,ph8.0)进行平衡,将captophenylhs疏水层析得到的收集液上样,再用流动相a进行冲洗。用流动相b(50mmtris-hcl,0.1mnacl-1mnacl,ph8.0)进行梯度或等度洗脱,收集洗脱峰。阴离子交换层析需要根据目的蛋白选择合适的交换介质。图6结果考察了选择强阴离子交换剂captoq与弱阴离子交换剂captodeae对纯化结果的影响。结果表明,captodeae分离度较差,无法获得合适的目的蛋白。captoq分离度较好,适宜本发明目的蛋白分离。4)captooctyl疏水层析用流动相a(50mmtris-hcl,1-2mnacl,ph8.0)平衡captooctyl疏水层析柱,将captoq阴离子交换层析得到的收集液上样,用流动相b(50mmtris-hcl,ph8.0)进行梯度或等度洗脱,收集主峰。5)phenylhp疏水层析用流动相a(50mmtris-hcl,1-2mnacl,ph8.0)平衡phenylhp疏水层析柱,将captooctyl疏水层析得到的收集液经过高盐处理后上样,用流动相b(50mmtris-hcl,ph8.0)进行梯度或等度洗脱,收集主峰。6)source15q阴离子交换层析用流动相a(50mmtris-hcl,ph8.0)平衡source15q阴离子交换层析柱,将phenylhp疏水层析得到的收集液上样,用流动相b(50mmtris-hcl,0.1mnacl-1mnacl,ph8.0)进行梯度或等度洗脱,收集主峰。7)超滤浓缩及缓冲液置换将source15q阴离子交换层析收集到的目标蛋白用终缓冲液(pbs)稀释,使用milliporepellicon超滤系统进行超滤浓缩及缓冲液置换,置换为终缓冲液(pbs),所用膜包孔径为10kd。8)真空冷冻干燥将浓缩后目的蛋白分装,进行真空冷冻干燥。本发明的纯化方案是首次实现重组变构胶原酶colh的高纯度制备,并对产品进行相关检测,达到产业化质量和规模要求。实施例4重组变构胶原酶的检测1)sds-page检测将经五步纯化的目的蛋白、标准品、蛋白marker等进行sds-page电泳检测,检测结果如图7。目标蛋白与标准品分子量一致,图8显示纯度≥99%。2)ce-sds检测用非还原性ce-sds毛细管电泳对样品进行纯度分析,按照药典中的方法进行分析,结果见图9。3)分子排阻色潽(sec-hplc)检测使用sec柱子(ge公司),流动相:20mmpbs,ph7.4,检测波长280nm,实施例所得目的蛋白检测结果见图10。4)内毒素考察通过检测rjv001相关产品的生化活性,考察了ph、钙离子、冻干时间、反复冻融以及温度(40℃,室温,低温,-70℃)对rjv001冻干制剂生化活性影响,具体实验结果见附图11。5)生化活性检测(1)准备工作:准备若干个1.5mlep管、10ml塑料离心管,根据样品名称标记;水浴锅温度设置到25℃;紫外分光光度计开机,并设置波长为320nm。(2)反应体系准备:用移液枪吸取0.1mcacl2溶液到1.5mlep管中,再加1ml底物溶液,混匀,置于25℃水浴锅中。(3)酶促反应:待反应体系温度变为25℃时,按照标记加入50ul各自的样品,其中空白对照用50μl0.1mtris缓冲液代替。加完样品后,重新置于水浴锅中,计时15min。(4)吸水剂:称取0.37g左右无水硫酸钠至10ml离心管中,盖上盖子。(5)萃取液:加1ml柠檬酸溶液于10ml离心管中,再加入5ml乙酸乙酯,乙酸乙酯在柠檬酸溶液上层,盖上盖子。(6)待计时器响起,立即用移液枪吸取0.5ml反应体系于萃取液中,立即涡旋20s,此时上层乙酸乙酯层为浑浊液,吸取3ml乙酸乙酯层溶液于含吸水剂的10ml离心管中,立即摇动,此时乙酸乙酯变为澄清液体。(7)测量a320:先测空白对照,再测各个样品,a320读数最好在0.3-0.9之间。(8)酶活计算公式酶活(u/ml)=(a-ab)x[vtxve/(εxvxvrxbxt)]xda=标样及样品吸收值ab=空白对照吸收值vt=反应体积,1.25mlve=萃取液中乙酸乙酯体积,5mlε=320nm萃取液摩尔吸收系数,21ml/(μmol·cm)v=所加样品或标品体积,0.05mlvr=转移到萃取液中的反应体积,0.5mlb=光程,1cmt=酶促反应时间,15mind=样品稀释倍数对冻干后成品进行酶活测定,实验结果数据见图12。其中,rcolh(fm)为与之前技术类似采用一步镍柱纯化得到的变异胶原蛋白酶,纯度约为90%,其451位点谷氨酸被突变成天冬氨酸,并包含his标签;rjv001为本发明专利中经五步纯化获得的纯度大于98%的变异胶原蛋白酶,其451位点谷氨酸被突变成天冬氨酸,且不包含gst或his标签。.purity451dmutanthis-tagrcolh(fm)~90%yyrjv001>98%yn图12表明,低纯度变异胶原酶rcolh(fm)的比活为0.74u/mg,而通过本专利技术获得的高纯度变异胶原酶rjv001其比活为1.10u/mg,两者存在显著性差异(p<0.05),证明本专利技术提高了产品纯度后,对其比活产生了较大的提升。6)稳定性检测通过检测rjv001相关产品(原液与冻干制剂)的生化活性,考察了ph、钙离子、冻干时间对冻干制剂的生化活性影响,以及反复冻融与温度(40℃,室温,低温,-70℃)对原液生化活性的影响,具体实验结果见图13-图20。图13表明,ph范围从7.23上升到8.58时,中性ph下无论是5℃还是25℃rjv001的生化活性都得到了很好的保持,而在弱碱性ph下,生化活性仅略有下降。图14表明,钙离子的添加在两个不同批次下三个月时间内对rjv001冻干制剂的生化活性没有显著影响。图15表明,在两个rjv001生产批次的实验下,冻融四次并没有对生化活性产生显著的影响。图16表明,-70℃下冻存三个月对rjv001原液的生化活性没有影响。图17表明,低温下冻存三个月对rjv001原液的生化活性没有影响。实施例5重组变构胶原酶rjv001在巴马香猪模型上的注射溶脂本发明的重组变构胶原酶的一个应用之一就是溶脂领域。将冻干制剂用生理盐水溶解,对迷你猪进行注射,空白对照注射生理盐水,通过脂肪层超声及解剖观察对溶脂效果进行评价。具体实验方案与实验结果如下:实验目的:研究变构胶原酶rjv001在巴马香猪模型脂肪组织中的药效学制剂:rjv001冻干制剂保存条件:4-8℃下稳定存放3个月纯度:98.6%动物模型:巴马香猪,雌性,约70kg,由wujiangtianyubiotechnologyco.,ltd提供动物饲养环境:巴马香猪被饲养在一个室内的满足aaalac要求的猪舍中,室温控制在16-26℃,相对湿度保持在40%-70%,光照由荧光灯控制,保持12小时光照(8:00-20:00)以及12小时黑暗。动物饲养食物与水源:动物有自由的食物与水源供应,相应设备由北京keaoxielifeedco.,ltd公司提供,并经过验证。水源通过过滤系统纯化并满足who人类饮用标准。水质量分析每年进行两次,包括重金属、硝酸盐、矿物质、菌落数等。实验设计与治疗过程:巴马香猪的三个部位脂肪组织被选择用于研究,分别是左侧腹部、右侧腹部与背部脂肪。对于左侧腹部脂肪,每一个治疗位点都接收低剂量的治疗(0.075mg),每个区域六点注射,每个点注射体积为400μl,且注射深度为0.7cm。对于右侧腹部脂肪,每一个治疗位点都接收中等剂量(0.15mg)的治疗,每个区域六点注射,每个点注射体积为400μl,且注射深度为0.7cm。对于背部脂肪,每一个治疗位点都接收高剂量(0.30mg)的治疗,每个区域六点注射,每个点注射体积为400μl,且注射深度为0.7cm。阴性对照组选择在巴马香猪模型中的两个区域进行六点注射。血样采集:每只巴马香猪将采集1ml血液,分别在第一/二次治疗前,以及治疗后0.5小时与1小时时间点。实验观察与结果评估:(a)超声检测:在第一次给药后的每一周,都将在注射前对动物给药位点的皮下脂肪层厚度进行超声检测。并保证每次超声检测时的超声功率一致。(b)表皮分析:每隔一周对巴马香猪给药位点皮肤表面进行观察,并拍摄照片记录。(c)解剖:所有的实验动物都将在给药后第八周使用戊巴比妥钠注射安乐死后进行解剖,每一个实验部位都会被取出并拍照记录。(d)病理学:解剖后的每一个脂肪块都会在10%福尔马林中浸泡至少48小时,送到组织处理实验室。之后使用h&e染色进行炎症分析,并使用masson三色染色进行组织纤维化分析。图18展示了给药位点在给药前与单次给药31天后脂肪层厚度的变化,根据活体超声结果显示,脂肪层厚度从给药前1.22cm下降到了给药31天后的1.07cm。图19展示了单次给药31天后的局部表皮分析。从图中可以发现给药后局部的表皮出现了明显的凹陷,说明皮下脂肪被有效地溶解。图20展示了单次给药31天后的生理解剖结果,从图中解剖结果显示,给药区域的脂肪层厚度明显低于未给药区域,与解剖前的超声结果相吻合。图21展示了通过对多个给药位点的活体超声结果进行分析,多个位点的相对脂肪层厚度在给药后31天平均下降10%。以上详细描述了本发明的优选实施方式,但是,本发明并不限于此。在本发明的技术构思范围内,可以对本发明的技术方案进行多种简单变型,包括各个技术特征以任何其它的合适方式进行组合,这些简单变型和组合同样应当视为本发明所公开的内容,均属于本发明的保护范围。序列表:<110>杭州观苏生物技术有限公司<120>一种重组变构胶原酶的制备方法及其应用<130>无<160>2<210>1<211>2946<212>dna<213>e451d单点突变colh变构胶原酶序列<400>1atggttcagaatgagagtaaacgttataccgttagctacctgaaaacactgaactattatgatctggtggatctgctggtgaagacagagattgaaaacttacctgatctgttccagtacagcagcgatgccaaagagttttacggcaacaagacccgtatgagcttcatcatggacgagattggccgtcgtgcccctcagtataccgaaatcgaccataagggcatcccgaccctggttgaggttgtgcgtgccggtttctacctgggcttccacaataaagagctgaacgaaatcaataaacgtagctttaaggagcgcgtgattcctagtattctggccattcagaaaaatcctaatttcaagctgggtactgaagtgcaggacaaaatcgttagcgccacggggttactggcaggcaatgaaaccgccccgccggaggttgtgaataacttcaccccgatcttgcaggactgcatcaaaaacatcgaccgctatgccctggacgacctgaaaagtaaggcactgttcaacgtgctggccgcacctacatacgatatcacagaatacttacgcgccaccaaggagaaaccggagaataccccgtggtacggcaagattgacggcttcattaacgagctgaaaaaactggcattatacggcaaaatcaatgacaacaacagctggattatcgataatggcatttaccacattgcacctctgggtaaactgcatagcaacaataaaattggtattgagaccctgaccgaagttatgaaagtttacccgtacctgagcatgcagcatctgcaaagcgccgatcaaatcaaacgccactacgatagcaaggatgccgaaggcaacaagatccctctggataaatttaaaaaagaaggtaaagaaaaatattgtccgaaaacctatacatttgatgatggcaaagttattattaaggcaggcgcacgcgtggaagaggagaaagtgaaacgcctgtattgggccagcaaagaggtgaacagtcagttcttccgcgtttatggcatcgacaagccgctggaagaaggcaacccggatgacattctgacgatggtgatctataacagcccggaggagtacaagctgaatagtgtgttatatggttatgataccaataatggtggtatgtatatcgagccggaaggcaccttcttcacctatgagcgtgaagcccaagagagtacctataccctggaggagctgttccgtcacgagtatacacactacctgcaaggccgctatgcagttccgggtcaatggggccgcaccaaactgtatgacaacgaccgtctgacctggtatgaggagggcggtgcagacttatttgccggtagtacccgtaccagcggtattctgccgcgtaagagcatcgttagcaacattcataataccacacgtaacaatcgttacaaactgagtgataccgttcacagcaaatacggcgcaagtttcgaattttataattacgcatgcatgtttatggactacatgtataataaagatatgggcatcctgaataaactgaatgatctggccaagaataatgatgttgacggttacgataactacatccgcgatctgagcagcaattacgccctgaatgataagtatcaggaccacatgcaggagcgcatcgacaattacgagaacttaaccgtgccgttcgttgccgacgactacctggttcgtcatgcctataagaatccgaatgaaatctacagtgaaattagcgaggttgcaaagctgaaagacgccaagagcgaggtgaaaaaaagtcagtatttcagtaccttcaccttacgcggcagttacacggggggcgccagcaagggtaagctggaagaccagaaagccatgaataaatttatcgatgatagcttaaaaaaattagatacctatagctggagtggctacaaaaccctgaccgcatacttcaccaactataaggtggatagcagtaatcgcgtgacctatgacgtggtgtttcacggctacctgccgaatgagggtgatagcaagaacagcttaccgtacggtaagatcaacggcacctacaagggcaccgaaaaggagaagattaagttcagcagtgaaggcagcttcgaccctgacggcaaaattgtgagttacgagtgggacttcggcgatggcaacaagagcaacgaggagaacccggaacacagttacgacaaggtgggcacctacacagtgaaactgaaagtgaccgatgacaaaggcgaaagcagcgttagcaccacaaccgcagagatcaaagacttaagcgagaataaactgccggtgatttacatgcacgtgccgaaaagtggcgccctgaaccagaaagtggtgttttatggcaaaggtacatacgacccggatggcagcatcgccggttatcagtgggattttggcgacggcagtgatttcagcagcgagcagaacccgagtcatgtttacaccaagaagggcgaatataccgtgaccctgcgtgtgatggacagcagcggccagatgagtgaaaaaaccatgaaaatcaaaattaccgacccggtgtacccgattggcaccgagaaagaaccgaacaacagcaaggagaccgccagcggccctatcgttcctggtattcctgttagcggcaccattgagaacacaagcgatcaggactatttctattttgatgtgatcaccccgggcgaagtgaagattgacattaacaaactgggttatggtggcgccacctgggtggtgtacgatgagaacaacaatgccgtgagttacgcaaccgacgatggccagaatctgagcggcaaattcaaagccgacaagccgggtcgctattacattcatctgtatatgttcaacggcagctacatgccgtatcgtattaacattgaaggtagcgtgggtcgc<210>2<211>982<212>prt<213>e451d单点突变colh变构胶原酶蛋白序列<400>2mvqneskrytvsylktlnyydlvdllvkteienlpdlfqyssdakefygnktrmsfimdeigrrapqyteidhkgiptlvevvragfylgfhnkelneinkrsfkervipsilaiqknpnfklgtevqdkivsatgllagnetappevvnnftpilqdciknidryalddlkskalfnvlaaptyditeylratkekpentpwygkidgfinelkklalygkindnnswiidngiyhiaplgklhsnnkigietltevmkvypylsmqhlqsadqikrhydskdaegnkipldkfkkegkekycpktytfddgkviikagarveeekvkrlywaskevnsqffrvygidkpleegnpddiltmviynspeeyklnsvlygydtnnggmyiepegtfftyereaqestytleelfrheythylqgryavpgqwgrtklydndrltwyeeggadlfagstrtsgilprksivsnihnttrnnryklsdtvhskygasfefynyacmfmdymynkdmgilnklndlaknndvdgydnyirdlssnyalndkyqdhmqeridnyenltvpfvaddylvrhayknpneiyseisevaklkdaksevkksqyfstftlrgsytggaskgkledqkamnkfiddslkkldtyswsgyktltayftnykvdssnrvtydvvfhgylpnegdsknslpygkingtykgtekekikfssegsfdpdgkivsyewdfgdgnksneenpehsydkvgtytvklkvtddkgessvstttaeikdlsenklpviymhvpksgalnqkvvfygkgtydpdgsiagyqwdfgdgsdfsseqnpshvytkkgeytvtlrvmdssgqmsektmkikitdpvypigtekepnnsketasgpivpgipvsgtientsdqdyfyfdvitpgevkidinklgyggatwvvydennnavsyatddgqnlsgkfkadkpgryyihlymfngsympyriniegsvgr序列表<110>杭州观苏生物技术有限公司<120>一种重组变构胶原酶的制备方法及其应用<130>无<141>2018-07-30<160>2<170>siposequencelisting1.0<210>1<211>2946<212>dna<213>e451d单点突变colh变构胶原酶序列()<400>1<210>2<211>982<212>prt<213>e451d单点突变colh变构胶原酶蛋白序列()<400>2metvalglnasngluserlysargtyrthrvalsertyrleulysthr151015leuasntyrtyraspleuvalaspleuleuvallysthrgluileglu202530asnleuproaspleupheglntyrserseraspalalysgluphetyr354045glyasnlysthrargmetserpheilemetaspgluileglyargarg505560alaproglntyrthrgluileasphislysglyileprothrleuval65707580gluvalvalargalaglyphetyrleuglyphehisasnlysgluleu859095asngluileasnlysargserphelysgluargvalileproserile100105110leualaileglnlysasnproasnphelysleuglythrgluvalgln115120125asplysilevalseralathrglyleuleualaglyasngluthrala130135140proprogluvalvalasnasnphethrproileleuglnaspcysile145150155160lysasnileaspargtyralaleuaspaspleulysserlysalaleu165170175pheasnvalleualaalaprothrtyraspilethrglutyrleuarg180185190alathrlysglulysprogluasnthrprotrptyrglylysileasp195200205glypheileasngluleulyslysleualaleutyrglylysileasn210215220aspasnasnsertrpileileaspasnglyiletyrhisilealapro225230235240leuglylysleuhisserasnasnlysileglyilegluthrleuthr245250255gluvalmetlysvaltyrprotyrleusermetglnhisleuglnser260265270alaaspglnilelysarghistyraspserlysaspalagluglyasn275280285lysileproleuasplysphelyslysgluglylysglulystyrcys290295300prolysthrtyrthrpheaspaspglylysvalileilelysalagly305310315320alaargvalglugluglulysvallysargleutyrtrpalaserlys325330335gluvalasnserglnphepheargvaltyrglyileasplysproleu340345350glugluglyasnproaspaspileleuthrmetvaliletyrasnser355360365progluglutyrlysleuasnservalleutyrglytyraspthrasn370375380asnglyglymettyrilegluprogluglythrphephethrtyrglu385390395400argglualaglngluserthrtyrthrleuglugluleuphearghis405410415glutyrthrhistyrleuglnglyargtyralavalproglyglntrp420425430glyargthrlysleutyraspasnaspargleuthrtrptyrgluglu435440445glyglyalaaspleuphealaglyserthrargthrserglyileleu450455460proarglysserilevalserasnilehisasnthrthrargasnasn465470475480argtyrlysleuseraspthrvalhisserlystyrglyalaserphe485490495gluphetyrasntyralacysmetphemetasptyrmettyrasnlys500505510aspmetglyileleuasnlysleuasnaspleualalysasnasnasp515520525valaspglytyraspasntyrileargaspleuserserasntyrala530535540leuasnasplystyrglnasphismetglngluargileaspasntyr545550555560gluasnleuthrvalprophevalalaaspasptyrleuvalarghis565570575alatyrlysasnproasngluiletyrsergluilesergluvalala580585590lysleulysaspalalyssergluvallyslysserglntyrpheser595600605thrphethrleuargglysertyrthrglyglyalaserlysglylys610615620leugluaspglnlysalametasnlyspheileaspaspserleulys625630635640lysleuaspthrtyrsertrpserglytyrlysthrleuthralatyr645650655phethrasntyrlysvalaspserserasnargvalthrtyraspval660665670valphehisglytyrleuproasngluglyaspserlysasnserleu675680685protyrglylysileasnglythrtyrlysglythrglulysglulys690695700ilelysphesersergluglyserpheaspproaspglylysileval705710715720sertyrglutrpasppheglyaspglyasnlysserasnglugluasn725730735progluhissertyrasplysvalglythrtyrthrvallysleulys740745750valthraspasplysglygluserservalserthrthrthralaglu755760765ilelysaspleusergluasnlysleuprovaliletyrmethisval770775780prolysserglyalaleuasnglnlysvalvalphetyrglylysgly785790795800thrtyraspproaspglyserilealaglytyrglntrpaspphegly805810815aspglyseraspphesersergluglnasnproserhisvaltyrthr820825830lyslysglyglutyrthrvalthrleuargvalmetaspsersergly835840845glnmetserglulysthrmetlysilelysilethraspprovaltyr850855860proileglythrglulysgluproasnasnserlysgluthralaser865870875880glyproilevalproglyileprovalserglythrilegluasnthr885890895seraspglnasptyrphetyrpheaspvalilethrproglygluval900905910lysileaspileasnlysleuglytyrglyglyalathrtrpvalval915920925tyraspgluasnasnasnalavalsertyralathraspaspglygln930935940asnleuserglylysphelysalaasplysproglyargtyrtyrile945950955960hisleutyrmetpheasnglysertyrmetprotyrargileasnile965970975gluglyservalglyarg980当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1