一种来自多能干细胞的神经嵴谱系周细胞及其诱导分化方法与流程
本发明属于生物与医学领域,更具体地,本发明涉及一种来自多能干细胞的神经嵴谱系周细胞及其诱导分化方法。
背景技术
周细胞(pericytes)又称rouget细胞或血管壁细胞,覆盖在微脉管内皮细胞的外面,存在于毛细血管、毛细血管后微静脉和毛细血管前微动脉。近年来周细胞的功能越来越受到关注,它在血管的形态发生和功能、心血管稳态以及缺血性中风、糖尿病视网膜病变等疾病中起到重要作用。但目前对周细胞并没有明确的定义,作为一种折衷方案,通常是综合位置、形态、基因/蛋白表达模式来判断。
周细胞在血管中无处不在,体内大约80%的微脉管有周细胞覆盖,他们嵌在与内皮细胞基底膜相连的血管基底膜中,但通常不在毛细淋巴管中。周细胞沿着内皮管表面伸展出胞质突。这些胞质突通常跨越几个内皮细胞,偶尔会与邻近的毛细管分支桥连。周细胞胞体一般在毛细管分枝点上,初级胞质突延伸到每个分支,形成一个y字型。不同器官和血管床之间的周细胞密度不同,中枢神经系统(cns)的血管系统通常被认为是周细胞覆盖最广泛的,内皮细胞和周细胞的比例为1-3:1,血管表面覆盖率大约30%,是血脑屏障(bbb)的重要组成部分。周细胞的分子标记目前不是很明确,而且他们的表达会随着发育状态、病理反应和体外培养出现动态变化,有一些已经验证的和经常使用的标记,比如pdgfr-β、ng2、cd13、αsma和desmin等。
不同部位的周细胞发育起源也不同。quail-chick嵌合实验表明位于中枢神经系统前脑的周细胞发育于外胚层来源的神经嵴(neuralcrest,nc),而覆盖在中脑、脑干和脊髓血管上的周细胞以及位于肠、肺、肝等体腔器官的壁细胞都是由中胚层-间皮发育而来。
脑血管周细胞不仅仅是血脑屏障的重要组成部分,在由内皮细胞、星形胶质细胞和神经元组成的神经血管单位(nvu)中也占据中心位置。周细胞接收来自临近细胞的信号,并进行编排和处理,从而发挥多种神经血管功能,包括对毛细血管血流动力学的调控、血脑屏障渗透性、对有毒代谢物的清除、血管生成以及干细胞活动,所有这些调控都是对正常大脑内稳态的维持是必要的。由于脑血管周细胞的功能多样性,近年来越来越多的研究关注脑周细胞在缺血性脑卒中的作用。
缺血性中风是一种缺血性脑血管病,病因是血管突然阻塞引起相关脑区的供血缺失,最终导致脑组织坏死。目前有效治疗缺血性中风的手段是相当有限的,主要是对闭塞的血管再通。由于周细胞在生理条件下起着重要的作用,在缺血性中风中介导着重要的病理进程,以周细胞为治疗靶点的治疗策略正逐渐兴起,例如直接移植周细胞。
为解决周细胞的来源与扩增的问题,不少研究致力于将胚胎干细胞(es)及诱导多能干细胞(ips)诱导分化为周细胞。据文献报道,2012年ayeletdar等人将hpsc制备成拟胚体,从自发分化的拟胚体中分离出cd105+cd90+cd73+cd31-中胚层祖细胞,培养扩增这群细胞,他们表达周细胞标记物(cd146、ng2、pdgfr-β),并且具有促进肢体缺血的血管和肌肉再生的功能。
2016年发表在scientificreports杂志上的一篇文章同样采用es-拟胚体的方法,分化为间充质样细胞,文章中称这群细胞为血管周的祖细胞(pc-a),pc-a具有成骨能力和维持血管生成能力。
2017年kumar等人首先将人类多功能干细胞与op9细胞共培养或采用化学小分子培养基诱导出中胚层,利用半固体的克隆形成无血清培养基诱导出mesenchymoangioblast(mb),mb克隆在小分子pdgf-bb和fgf2作用下分化为未成熟的周细胞,未成熟的周细胞在两种化学小分子培养基诱导下诱导出两种类型周细胞,一种为ng2+smalow/-desminlow/-calponinlow/-myh11-毛细血管表型周细胞,另一种为ng2highsma+desmin+calponinlow/-myh11-小动脉表型周细胞。这两种类型周细胞都具有体内体外稳定血管能力。
但是,这些文献或专利报道的方法得到的周细胞要么是经中胚层分化而来的,要么未控制分化路径,只着重于解决周细胞的来源问题,未针对周细胞的发育起源不同提供相应的解决方案,因此诱导所得的细胞可能异质性较强;同时,这些方案未将细胞的功能作为重点考察对象,而治疗效果不佳的产品必定会极大地限制其应用。
技术实现要素:
基于此,为了克服上述现有技术的缺陷,本发明提供了一种来自多能干细胞的神经嵴谱系周细胞及其诱导分化方法。
为了实现上述发明目的,本发明采取了以下技术方案:
一种来自多能干细胞的神经嵴谱系周细胞的诱导分化方法,包括以下步骤:
(1)体外贴壁培养多能干细胞,保持其未分化状态;
(2)当(1)中细胞长到80%-90%密合度后,在accutase作用下消化成单个细胞,用含有5~15μmrockinhibitor的cdm培养液重悬细胞;
(3)将细胞悬液按1×104~1×105/cm2的密度贴壁培养在培养皿中;
(4)第二天将培养液更换为含chir99021和sb431542的ncn2培养液;
(5)贴壁培养8天,以accutase消化收集细胞;
(6)贴壁培养收集的细胞,并将培养液更换为周细胞诱导液,传代培养2~5次后检测周细胞表型,即得。
在其中一些实施例中,步骤(2)所述cdm培养液包括85-100%的dmem/f12。
在其中一些实施例中,步骤(2)所述cdm培养液还包括以下组分的一种或几种:n2:0.1-2%、b27:0.1-2%、l-glu:0.1-5%、2-mercaptoethanol:0.01mm-1mm、memminimumnonessentialaminoacidssolution:0.1-5%、bsa:0.01-0.1%、bfgf:2-50ng/ml、egf:2-50ng/ml、penicillin-streptomycin:50-200u/ml。
在其中一些实施例中,步骤(3)所述贴壁培养为:将细胞悬液接种至包被了matrigel或层粘连蛋白的培养皿中以促进细胞的贴壁。
在其中一些实施例中,步骤(4)所述ncn2培养液包括85-100%的dmem/f12。
在其中一些实施例中,步骤(4)所述ncn2培养液还包括以下组分的一种或几种:n2:0.1-2%、b27:0.1-2%、sb431542:1μm-100μm、chir99021:1μm-100μm、penicillin-streptomycin:50-200u/ml。
在其中一些实施例中,步骤(5)还包括使用p75与hnk1抗体标记收集的细胞,再通过流式分选p75与hnk1双阳的细胞的步骤。
在其中一些实施例中,步骤(6)所述周细胞诱导液为添加了pdgf-bb和bfgf的含血清完全培养液。
本发明还提供了上述诱导分化方法诱导分化而得的来自多能干细胞的神经嵴谱系周细胞。
本发明针对现有技术诱导得到的周细胞的缺陷,提供了一种优化的周细胞亚群,用以增强细胞的细胞学或治疗功能。本发明同时提供周细胞亚群细胞的获取方法。与现有技术相比,本发明具有如下优点:
(1)本发明通过先将多能干细胞诱导为神经嵴细胞,再进一步诱导为周细胞,可解决从人脑原代提取周细胞及其他非限定诱导途径多能干细胞来源的周细胞异质性与混杂的缺点,可解决脑周细胞来源受限的问题,获得的神经嵴谱系周细胞具有更强的维持血管稳定能力;
(2)本发明通过标准化诱导分化程序,可保证不同批次间获得的细胞群具有良好的一致性。
附图说明
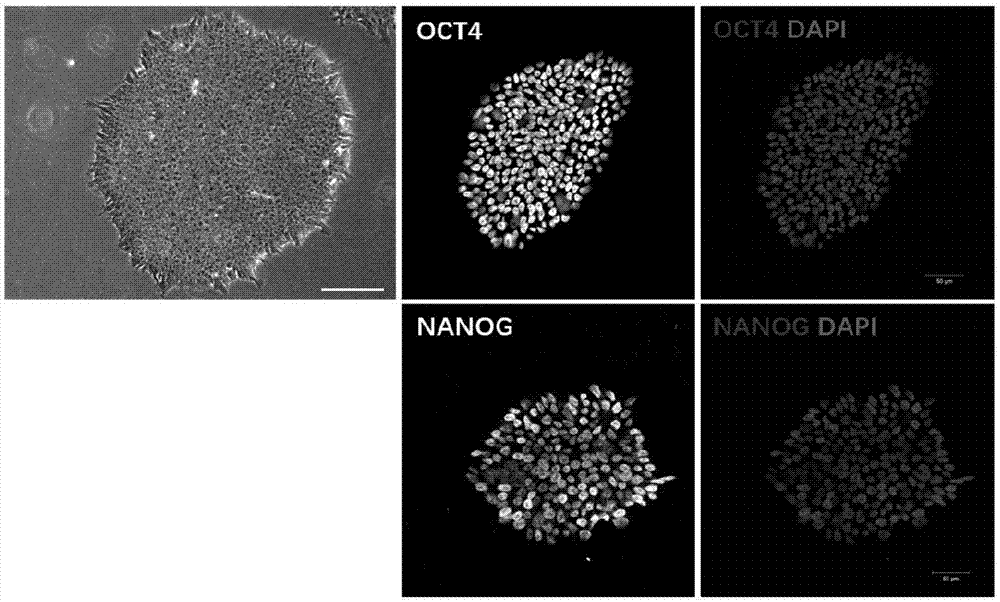
图1为实施例1中培养的ips细胞的细胞形态图和多能性标记免疫荧光照片;
图2为实施例1中ips向神经嵴干细胞诱导流程图和流式细胞分选图;
图3为实施例1中分选后的神经嵴细胞的细胞形态图与神经嵴干细胞和颅神经嵴干细胞标记物的q-pcr图;
图4为实施例1中神经嵴细胞在周细胞诱导液中传代4次后的细胞形态图及细胞表面标记流式分析图;
图5是本发明试验例1中获得的神经嵴谱系周细胞体外维持血管稳定图;
图6是本发明试验例2中神经嵴谱系周细胞收缩能力图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施的限制。以下实施例中所涉及的技术,除非特别说明,均是本领域技术人员熟知的细胞生物学、生物化学、分子生物学等各个领域的常规技术。
实施例1来自多能干细胞的神经嵴谱系周细胞的诱导分化方法
本实施例的来自多能干细胞的神经嵴谱系周细胞的诱导分化方法,包括以下步骤:
一、体外贴壁培养多能干细胞,保持其未分化状态;
多能干细胞,包括胚胎干细胞及诱导多能干细胞可以方便地通过商业化或本实验室构建获得。本实施例着重阐述在稳定建立的多能干细胞系(wicellresearchinstitute购买)基础上的进一步培养与分化操作。
多能干细胞可在无饲养层的条件下大规模扩增且保持未分化状态。培养液可选用stemcell公司的mtesr系列产品、e8等,与上述几种培养液相适应的,需要在培养皿/板上包被基质胶,如matrigel或层粘连蛋白。保证高质量的多能干细胞是进行下一步诱导的关键。
基于mtesr1与matrigel培养体系,具体的培养操作如下:
1、培养皿的包被:冰上融解matrigel,dmem/f12稀释matrigel至1:20至1:200,加入孔板中室温包被1h以上备用。
2、从液氮中取出冻存管,于37℃水浴中快速解冻细胞株,转移入已加有5mlmtesr1完全培养液的15ml离心管中,300g离心5min收集细胞。
3、吸去包被的matrigel,以2mlmtesr1重悬细胞,均匀地将细胞接种入包被好的孔板中,放入37℃、5%co2和95%湿度的培养箱中静置贴壁培养。
4、每天更换培养液,彻底吸去旧的培养液,加入新鲜的预热好的培养液,继续培养,直至细胞克隆长至适合传代的大小。
5、细胞传代前,使用pbs洗涤细胞两次,加入0.5mm的edta于37℃孵育1至10min,镜下观察,使细胞解离成小的细胞团块,吸去edta,以pbs轻轻吹打细胞,保证细胞维持小团块状;
6、转移细胞团块入15ml离心管中,300g离心5min收集细胞。
7、以mtesr1重悬细胞,以1:6或其他合适的比例均匀地将细胞接种入包被好的孔板中,放入37℃、5%co2和95%湿度的培养箱中静置贴壁培养。
8持续传代以获取足够的细胞量进行下一步的分化诱导。
培养的ips细胞的多能性标记免疫荧光照片如图1所示。
二、神经嵴干细胞的制备与培养
当(一)中细胞长到80%-90%密合度后,解离细胞制备成单细胞悬液;
1、使用pbs洗涤细胞两次,加入accutase于37℃孵育5至15min,镜下观察,当所有的细胞呈现为单个细胞时,以pbs轻轻吹打细胞。
2、转移细胞悬液入15ml离心管中,200g离心4min收集细胞。
3、以含有rockinhibitor的cdm培养液(95%dmem/f12、1%n2、2%b27、1%l-glu、1%memminimumnonessentialaminoacidssolution、0.1%bsa、0.1mm2-mercaptoethanol、10ng/mlbfgf)重悬细胞,以2×104/cm2的密度将细胞接种入matrigel包被的培养皿中。放入37摄氏度、5%co2和95%湿度的培养箱中静置贴壁培养。
4、贴壁培养第二天,吸去cdm培养液,换以ncn2培养液(99%dmem/f12、1%n2、1μmchir99021、2μmsb431542)于37摄氏度、5%co2和95%湿度的培养箱中静置贴壁培养。
5、贴壁培养8天,期间每天换液。
6、细胞贴壁培养8d后,使用pbs洗涤细胞两次,加入accutase,于37摄氏度孵育5至15min,镜下观察,细胞开始收缩变亮时,以pbs轻轻吹打细胞,转移细胞入15ml离心管中,200g离心4min收集细胞。
7、以0.1至1ml含1%bsa的pbs重悬细胞,分成两份,一份依据抗体说明书加入适量p75与hnk1抗体,另一份加入igg抗体,在4摄氏度孵育30min。
8、加入pbs洗涤孵育完抗体的细胞,于200g离心4min弃上清。
9、含1%bsa的pbs重悬细胞,以标记了igg的细胞作为阴性对照,流式分选p75与hnk1双阳细胞,从而分离出神经嵴细胞。
ips向神经嵴干细胞诱导流程图和神经嵴干细胞流式细胞分选图如图2所示。分选后的神经嵴干细胞的细胞形态与标记物的表达如图3所示。
三、神经嵴干细胞向周细胞的诱导分化
1、神经嵴干细胞培养液重悬神经嵴干细胞,以5~10×104/cm2的密度接种于包被了基质胶的孔板中,于37摄氏度、5%co2和95%湿度的培养箱中静置贴壁培养。
2、第二天,更换神经嵴干细胞培养液为周细胞诱导液(添加了pdgf-bb和bfgf的商业化的含血清完全培养液),于37摄氏度、5%co2和95%湿度的培养箱中静置培养,每2~3d换液。
3、细胞生长至80~90%融合后,以accutase消化传代,接种入包被了基质胶的细胞培养皿,静置贴壁培养;同时取一部分细胞检测p75、hnk1、cd44、cd73、cd90、cd13、cd45、cd140b、ng2、cd146等抗体表达情况。
4、重复步骤3,直至表达ng2、cd73、cd105、cd44的细胞达到90%以上;表达p75、hnk1的细胞少于10%,即得神经嵴谱系周细胞。
神经嵴干细胞在周细胞诱导液中传代4次后的细胞形态及细胞表面标记流式分析如图4所示。
5、诱导所得的周细胞更换为周细胞培养液(市售商业化的含血清完全培养液)培养,每天或2-3天换液。
试验例1神经嵴谱系周细胞的体外维持血管稳定能力检测
包括以下步骤:
1、matrigel至于冰上融化,24孔细胞板和枪头放入4℃冰箱预冷。
2、待matrigel融化后,用预冷枪头在每孔加入250μlmatrigel,冰上操作,避免产生气泡。在37℃培养箱放置30分钟左右。
3、消化hbme、神经嵴谱系周细胞和hbvp,以含有20ng/mlvegf的内皮细胞培养基重悬细胞。
4、细胞计数,取出每孔含3×104hbme的体积,以hbme与神经嵴谱系周细胞/hbvp2:1的比例分别将hbme与神经嵴谱系周细胞/hbvp混合,加入含有20ng/mlvegf的内皮细胞培养基使每孔细胞悬液为300μl。
5、将混合的细胞悬液接种于matrigel包被的孔板中。于37摄氏度、5%co2和95%湿度的培养箱中静置培养。
6、接种后的3h、1天、2天、3天、4天、7天镜下观察并拍照。
结果如图5所示,结果显示神经嵴谱系周细胞较人脑来源的周细胞(hbvp)具有更强的维持血管稳定能力。
试验例2神经嵴谱系周细胞的收缩性能检测
包括以下步骤:
1、2.4体积的胶原蛋白溶液(5mg/ml)、1体积的5×pbs、1.6体积的0.1nnaoh混合,得到ph为7.4的2mg/ml的胶原凝胶工作液,置于冰上。
2、消化收集神经嵴谱系周细胞和hbvp,以商品化的周细胞培养基重悬细胞,得到密度为5×106/ml的细胞悬液。
3、制备细胞-胶原蛋白混合物:2体积的细胞悬液与8体积的胶原凝胶工作液混合。
4、在24孔板中每孔加0.5ml的细胞-胶原蛋白混合物。于37摄氏度、5%co2和95%湿度的培养箱中静置培养2小时。
5、培养2小时后,细胞-胶原蛋白混合物形成凝胶,小心地将凝胶从孔板底部分离,每孔加培养基0.5ml。
6、培养2小时和48小时拍照,统计凝胶大小。
结果如图6所示,结果显示神经嵴谱系周细胞具有与人脑来源的周细胞相当的收缩能力。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!