一种在低氧环境中从胎盘中获取造血干细胞的方法与流程
本发明涉及造血干细胞的获取方法技术领域,尤其涉及一种在低氧环境中从胎盘中获取造血干细胞的方法。
背景技术
造血干细胞(hematopoieticstemcells,hsc)是一小群具有高度自我更新和多向分化潜能的造血前体细胞。目前已证实hsc至少能够分化成12个系列的血细胞及其它细胞,包括红细胞、粒细胞、单核细胞、嗜酸粒细胞、嗜碱粒细胞、肥大细胞、血小板、淋巴总细胞、b淋巴细胞、树突状细胞、自然杀伤细胞,以及骨髓中的成骨细胞及成纤维细胞。造血干细胞移植是治疗恶性血液性疾病和某些免疫疾病的重要手段。一般造血干细胞来源于骨髓、脐带血。
异体骨髓造血干细胞移植存在较高的致死率和致残率,需要hla抗原配型,但很难找到合适配型,且配型过程漫长、复杂、移植后需要使用昂贵的免疫抑制剂、存在较高近远期排斥反应,取材困难,易被供者拒绝。胎盘和脐带血都是产后废弃物,对产妇和胎儿无任何损害。寻找hla相合脐带血所需时间短,可根据患者需要及时进行移植,且免疫细胞不成熟,移植后急、慢性移植物抗宿主病(gvhd)的发生率低且严重程度较轻。但脐带血只能收集来自于脐带的血液,由于其细胞数量有限,用于成人移植有一定的限制,只能应用于儿童。胎盘为产后废弃物,而胎盘内含有多种可参与细胞、组织甚至器官修复的干细胞,其中就含有大量hsc。胎盘来源hsc具有以下几个优点:首先,作为医疗废物,易于获取,无伦理问题;其次,胎盘中hsc数量较大,研究表明胎盘中造血干细胞表面标志分子cd34+数量是脐血10倍。胎盘来源hsc较脐血来源hsc更为原始,含有大量表型为cd133+cd34-的不成熟造血干/祖细胞(hspc),该细胞群是cd34+细胞以及血管内皮组织的的祖细胞。由此可见,足量的、高活性的胎盘来源造血干细胞有望成为基础研究和临床造血干细胞移植的新来源。
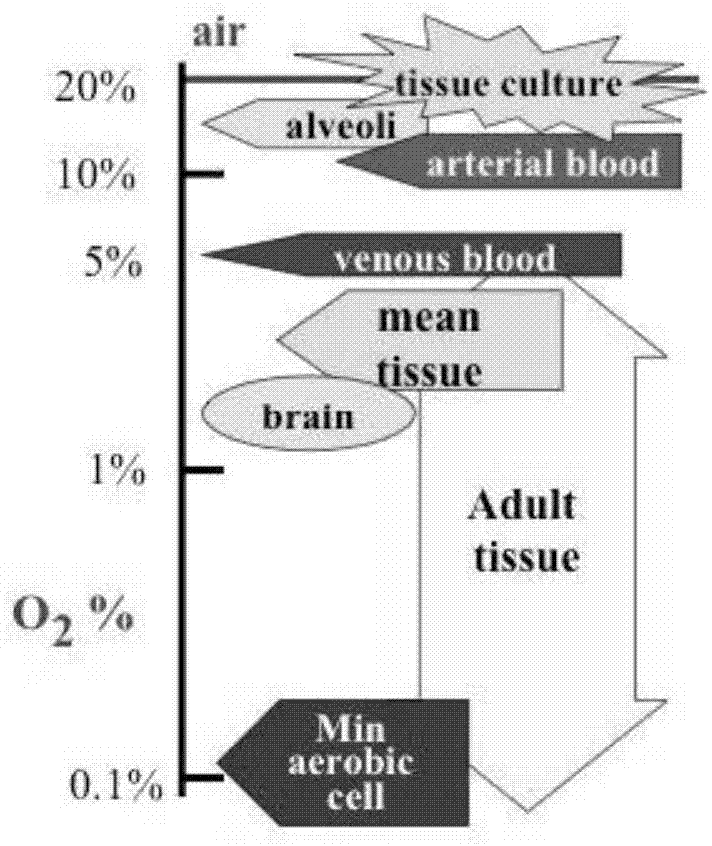
无论是骨髓、脐带血还是胎盘,造血干细胞在体内所处的位置都是属于低氧环境(如图1,图中数据来自英国基尔大学干细胞生物学副教授,nicholasr.forsythphd)。然而,到目前为止,几乎所有的造血干细胞研究结果都是基于非生理条件下的氧分压,即常氧,而常氧环境下获取的干细胞数量往往被低估。近年来有研究发现,通过将造血干细胞的相关实验操作放置于低氧条件下进行,即便细胞短暂暴露于常氧环境中,也会导致长时程造血干细胞的数目大量减少,这种现象被为非生理氧压应激(ephoss,extraphysiologicoxygenshock/stress)。
技术实现要素:
本发明是为了解决上述问题而进行的,目的在于提供一种在进行体外获取胎盘造血干细胞过程中,在一个模拟生物体内的正常低氧环境条件下,克服因短暂高氧造成的非生理氧压应激,获得数量多、状态原始、增殖能力强的造血干细胞的方法。
本发明提供了一种在低氧环境中从胎盘中获取造血干细胞的方法,包括以下步骤:
步骤1,胎盘采集:使用脐带夹夹住胎盘中的脐带末端,将胎盘立刻放入盛有足量组织保护液的无菌采样袋中,确保胎盘全部没入该组织保护液中,排除多余空气,封好无菌采样袋,立即于低温环境下运输至实验室,所述低温环境的温度要求为:2-24℃;
步骤2,胎盘预处理:在无菌低氧环境下,将胎盘从无菌采样袋中取出,用75%酒精擦拭胎盘组织表面,再用无菌生理盐水将胎盘组织上残留的组织保护液清洗干净,去除死细胞和血凝块,移除羊膜和蜕膜等组织,剪去步骤1中用脐带夹夹住的那端的部分脐带,胎盘上余留下的脐带长度为5-6cm,用无菌处理过的脐带夹夹住所述余留下的脐带末端,防止脐带血流失;
步骤3,获取脐带血:在无菌低氧环境下,松开脐带末端的脐带夹,将脐带末端放入50ml离心管中,挤压胎盘,将脐血挤到离心管中,再将脐血从离心管转移至无菌血袋中,待从中获取造血干细胞;
步骤4,胎盘灌注:在无菌低氧环境下,再次用无菌处理过的脐带夹夹住脐带末端,将灌注液1注射至脐带静脉或者动脉中,注射的同时摇晃胎盘,使得灌注液1进入胎盘血管网络,随后将脐带末端放入50ml离心管,挤压胎盘,从脐带末端流入离心管中的混合液体即为收集液1;重复此注射收集操作5-10次,直至胎盘胎儿面发白,汇集收集液1;
步骤5,胎盘再灌注:在无菌低氧环境下,将灌注液2注射入脐动脉或者脐静脉中,注射得灌注液2为20-50ml,用无菌处理过的脐带夹夹住脐带末端,再将所述胎盘放入玻璃皿中,低氧环境中,37℃孵育1h;
步骤6,脐血单个核细胞分离:在无菌低氧环境下,步骤5中在灌注液2注射入胎盘的脐动脉或者脐静脉操作时,注射的同时摇晃胎盘,使得灌注液2进入胎盘血管网络,随后将脐带末端放入离心管内,挤压胎盘,从脐带末端流入离心管中的混合液体即为收集液2;所述注射收集操作重复2次,汇集收集液2;将收集液2与步骤4中获取的收集液1混合,在200g离心力、4℃条件下,离心10min;保留沉淀,用磷酸缓冲液重悬后,形成重悬液,再加入人淋巴细胞分离液,重悬液体积与人淋巴细胞分离液体积之比为3:4-3:5,低氧环境中进行离心,在离心力800g,温度20℃条件下,离心20min;收集沉淀即为单个核细胞1,即为脐血单个核细胞;
步骤7,绒毛组织消化:在无菌低氧环境下,将胎盘绒毛物理分割至0.1-0.2mm3大小,300目筛网过滤组织碎块,过滤时不断添加组织保护液,去除红细胞;收集滤渣,将所述滤渣分装于离心管中,每个离心管中的滤渣体积为17-23ml,再加入消化液,其中滤渣与消化液的体积比为2:3;将离心管置于低氧环境中,37℃孵育1.5h;
步骤8,胎盘单个核细胞分离:在无菌低氧环境下,将步骤7中的滤渣与消化液的混合物,于300目筛网过滤,过滤的同时加入组织保护液,将滤液收集后离心,得到沉淀,汇集沉淀,加入组织保护液重悬,形成重悬液,再加入人淋巴细胞分离液,人淋巴细胞分离液与重悬液体积之比为4:3,在低氧环境中进行离心,在离心力800g,温度20℃条件下,离心20min;收集沉淀,即为单个核细胞2,即为胎盘单个核细胞;
步骤9,汇集单个核细胞1和单个核细胞2,形成总胎盘单个核细胞,即获得造血干细胞。
进一步的,步骤1中所述组织保护液的配制方法为:100ml的容量瓶中加入1ml双抗和5mg环孢素a,加入磷酸缓冲液定容至100ml。
进一步的,步骤4中所述灌注液1成分:含有10%胎牛血清的磷酸缓冲液。
进一步的,步骤5中所述灌注液2成分:含0.15%胶原酶的磷酸缓冲液。
进一步的,步骤7中所述消化液成分为:每30ml消化液中包括5ml分散酶,2.5mli型胶原酶,1mldna酶1,0.5ml双抗,21ml含10%胎牛血清的磷酸缓冲液。
进一步的,步骤2至步骤8中的低氧环境的氧浓度均为2%。
本发明的优点如下:
(1)本发明在组织保护液中添加了环孢素a,能够使短暂处于空气常氧的胎盘中的造血干细胞避免发生非生理氧压应激反应,从而增加可用于移植的造血干细胞数目。
(2)本发明获取造血干细胞的过程全部在低氧环境中进行,可克服因短暂高氧造成的非生理氧压应激,且获得的造血干细胞数量多、状态原始、增殖能力强。
(3)本发明使用胶原酶联合分散酶消化胎盘绒毛组织,分散酶可分散组织,而胶原酶用于消化组织中连接部分,使其成为单个细胞,对上皮组织影响不大。此两种酶都很温和,不会给细胞膜带来伤害,且因为来自细菌,故不会引入支原体或任何动物病毒。
(4)本发明所使用的消化液中添加了dna酶。可有效防止在操作过程中,因细胞破碎导致dna释放,使得消化液粘稠,影响后续的过滤效率。
附图说明
图1是背景技术中不同组织的生理氧压示意图;
图2是本发明的实施例中低氧工作站的示意图;
图3是本发明的实施例中总胎盘单个核细胞流式检测结果图;
图4是本发明的实施例中第16天bfu-e(集落形成单位-爆红系)的集落形成显微镜40倍图;
图5是本发明的实施例中第16天cfu-gm(集落形成单位-粒细胞-巨噬细胞)的集落形成显微镜40倍图;
图6是本发明的实施例中第16天cfu-gemm(集落形成单位-粒细胞-红系-巨噬细胞-巨核细胞)的集落形成显微镜40倍图。
具体实施方式
本发明公开了一种在低氧环境中从胎盘中获取造血干细胞的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法进行改动或适当变更与组合,来实现和应用本发明技术。
前期准备,具体如下:
1.胎盘组织来源情况
胎盘来源对象家族中无遗传性疾病和先天性疾病史;年龄20-36周岁,妊娠34-42周,非双胎、多胎、试管婴儿;妊娠期血液检测,无发现地中海贫血、肝功能、乙肝、丙肝抗体、艾滋病毒抗体、梅毒、巨细胞病毒及其他传染病毒感染;无接受器官和组织移植;孕期无妊娠合并症及并发症,近1年未接受过输血;产前体温正常、胎膜早破未超过24小时,无感染,无胎盘早剥、脐带畸形。
2.低氧工作站的设置
低氧工作站模拟生物体内环境,可精确控制站内气体浓度、温度和湿度,并拥有iso4级hepa过滤系统,达到十级洁净程度,为实验提供一个稳定适宜的操作环境。低氧工作站工作区分为左右2个操作台和中间1个转移匣,两个操作台之间的物料传递和操作台与外界的物料传递都可以经过转移匣完成。本实施例中所采用的低氧工作站具体包括左侧操作台1、右侧操作台2、转移匣3、控制面板4、操作口5,如图2所示。
本实验所有无菌操作均在低氧工作站中进行,实验前3小时打开低氧工作站,通过控制面板设置氧气浓度为5%,左侧操作台温度为5℃,右侧操作台温度为20℃,对相应试剂、耗材和设备进行氧气浓度和温度平衡。
所有试剂,包括磷酸缓冲液、各类酶、人淋巴细胞分离液(ficoll)、医用酒精、肝素钠溶液、清洗液等,都在低氧工作站内配制,配制完成后用封口膜封口,放入医用冰箱保存备用;实验前将足量的各类试剂耗材都放入低氧工作站中。所有耗材,如移液管、离心管、注射器等都打开包装或封口,平衡氧浓度3小时。
本发明提供一种在低氧环境中从胎盘中获取造血干细胞的方法,具体操作步骤如下:
1.胎盘采集
产房收集新鲜胎盘,使用脐带夹夹住脐带末端,将胎盘立刻放入盛有足量组织保护液的无菌采样袋中,确保胎盘全部没入组织保护液中,排除多余空气,封好无菌采样袋,立即低温条件运输至实验室。低温条件为2-24℃。组织保护液的配制方法为:100ml的容量瓶中加入1ml双抗和5mg环孢素a,加入磷酸缓冲液定容至100ml。
2.胎盘预处理
胎盘预处理过程在低氧工作站中进行,设置氧浓度为2%。
无菌环境下,将胎盘从无菌采样袋从低温环境中取出后,放入低氧工作站的转移匣中。在转移匣内,用75%酒精擦拭胎盘组织表面,传入低氧工作站的左侧操作台;再将胎盘转移入大型不锈钢托盘,用无菌生理盐水将胎盘组织上残留的组织保护液清洗干净,去除死细胞和血凝块,移除羊膜和蜕膜等组织,剪去用脐带夹夹住的那端的部分脐带,胎盘上余留下的脐带长度为5-6cm,用经无菌处理过的脐带夹夹住余留下的脐带末端,防止脐带血流失。
3.脐带血获取
脐带血获取过程在低氧工作站中进行,设置氧浓度为2%。
无菌条件下,松开脐带末端的脐带夹,将脐带末端放入50ml离心管中,挤压胎盘,尽量多的将脐血挤到离心管中,再将脐血从离心管转移至无菌血袋中,待从中获取造血干细胞。
4.胎盘灌注
胎盘灌注过程在低氧工作站中进行,设置氧浓度为2%。
再次用无菌处理过的脐带夹夹住脐带末端,用50ml注射器将灌注液1注射至脐带静脉或者动脉中,注射的同时摇晃胎盘,使得灌注液1尽量多的进入胎盘血管网络,随后将脐带末端放入50ml离心管,挤压胎盘,从脐带末端流入离心管中的混合液体即为收集液1;重复此操作过程5-10次,直至胎盘胎儿面发白;汇集收集液1。灌注液1成分为:含有10%胎牛血清的磷酸缓冲液。
5.胎盘再灌注
胎盘再灌注过程在低氧工作站中进行,设置氧浓度为2%。
在无菌环境下,用注射器将灌注液2注射入脐动脉或者脐静脉中,注射得灌注液2约为20-50ml,无菌处理过的脐带夹夹住脐带末端,放入玻璃皿中。低氧工作站右侧操作台中放置小型恒温混匀仪,设置氧浓度为2%。将盛有胎盘的玻璃皿转移至小型恒温混匀仪中,在2%氧浓度、37℃条件下,孵育1h。灌注液2成分为:含0.15%胶原酶的磷酸缓冲液。
6.脐血单个核细胞分离
脐血单个核细胞分离过程在低氧工作站中进行,设置氧浓度为2%。
无菌条件下,在灌注液2注射入胎盘的脐动脉或者脐静脉操作时,注射的同时摇晃胎盘,使得灌注液2进入胎盘血管网络,随后将脐带末端放入离心管内,挤压胎盘,从脐带末端流入离心管中的混合液体即为收集液2;此过程重复2次,汇集收集液2。将收集液2与收集液1混合,在离心力200g、4℃条件下,离心10min;汇集沉淀,磷酸缓冲液重悬后加入ficoll,重悬体积与ficoll体积之比为3:4-3:5,转移入低氧工作站右侧操作台的离心机,在离心力800g,温度20℃条件下,离心20min,收集沉淀,获取单个核细胞1,即为脐血单个核细胞分离。
7.绒毛组织消化
绒毛组织消化过程在低氧工作站中进行,设置氧浓度为2%。
在无菌条件下,将胎盘绒毛组织剪至新的玻璃皿中,物理分割至0.1-0.2mm3大小,300目筛网过滤组织碎块,过滤时不断添加组织保护液,去除红细胞;收集滤渣,每个离心管放入滤渣约20ml,再加入30ml消化液,形成终体积为50ml的绒毛组织和消化液的混合液。
将上述50ml绒毛组织和消化液的混合液转移至低氧工作站右侧操作台的小型恒温摇床中,37℃孵育1.5h。消化液具体成分见表1,消化液中双抗为市售产品,是青霉素-链霉素混合液,细胞培养液中青霉素的工作浓度为100u/ml,链霉素的工作浓度为0.1mg/ml。
表1.消化液成分
8.胎盘单个核细胞分离
胎盘单个核细胞分离过程在低氧工作站中进行,设置氧浓度为2%。
将离心管中所有物质汇集,加入组织保护液,通过300目过滤网过滤,得到滤液;收集滤液,离心后,得到沉淀,汇集沉淀,加入组织保护液重悬,加入人淋巴细胞分离液(ficoll),ficoll与重悬液体积之比为4:3,转入右侧操作台的离心机,在离心力800g,温度20℃条件下,离心20min;收集沉淀,获取单个核细胞2,即为胎盘单个核细胞。
9.获取胎盘造血干细胞
汇集单个核细胞1和单个核细胞2,形成总胎盘单个核细胞,即可获取胎盘造血干细胞群。
对本实施例获取的造血干细胞群进行流式检测和集落形成检测,具体操作如下:
1.流式检测
流式计数并鉴定造血干细胞(cd34+细胞)占胎盘中有核细胞总量的比例,具体步骤如下:分别取总胎盘单个核细胞(细胞密度为2×106/200ul),加入2只流式管中;于其中一只流式管中分别加入fitc-hcd45抗体和pe-hcd34抗体各20ul;于另一只流式管中分别加入fitc-hcd45抗体和同型对照抗体pe-igg1各20ul;混匀后室温下避光孵育15min;加入10%溶血素稀释液500ml,混匀后室温下避光孵育15min;在150rpm/min条件下,离心5min后弃去上清;分别加入300ul磷酸缓冲液重悬细胞;流式细胞仪检测细胞表面抗原。
结果如表2所示,本实施例获取的单个核细胞总量以及细胞活率优于常规方法下获取的单个核细胞总量以及细胞活率;如图3所示,本实施例获取的造血干细胞(cd34+细胞)占比平均为0.87±0.19%,明显优于常规方法下获取的造血干细胞占比,说明本发明提供的从胎盘中获取的造血干细胞数量多。
表2.本实施例获取的总胎盘单个核细胞样本与常规方法获取的总胎盘单个核细胞样本对比分析
2.集落形成检测
集落形成检测是目前唯一一种可以直接衡量个体造血干细胞扩增潜能的检测,一份脐血中的细胞集落总数是用来预测脐带血移植后的血细胞复苏及存活的最佳单一参数。
调整本实施例所获得的总胎盘单个核细胞的细胞浓度至2×105/ml,取100ul总胎盘单个核细胞加入1.1mlmethocult培养基中,该培养基为市售产品,其中包含生长因子和添加物,再用注射器接种到培养皿中,于37℃,5%co2的培养箱中培养,每天定时观察。
总胎盘单个核细胞接种到培养皿后第6天开始有集落形成,第14-16天的集落形成良好。第16天的集落形成图参见图4-6。集落培养结果显示,本实施例获取的胎盘造血干细胞在体外有良好的增殖和分化能力。
综上所述,本发明提供的从胎盘中获取造血干细胞的方法与现有技术相比,获得的造血干细胞数量多、状态原始,且在体外有良好的增殖和分化能力。
以上所述的实施例仅用于说明本发明的技术思想及特点,其目的在于使本领域内的技术人员能够了解本发明的内容并据以实施,不能仅以本实施例来限定本发明的专利范围。
- 还没有人留言评论。精彩留言会获得点赞!