有机光电化合物及其应用的制作方法
本发明涉及光电材料领域,尤其是涉及一种有机光电化合物及其应用。
背景技术:
随着现代通讯技术的发展,光电通讯已经越来越普及,光电通讯器件的关键材料是需要电致控制材料调节光通讯信号的电光材料,该类材料具有较大的电致极化率,有机电光材料成本低,可以广泛用于光电通讯。如何进一步提高光电传输效率,减少器件成本,必须研制出具有较大极化率的有机光电分子。
有鉴于此,特提出本发明。
技术实现要素:
本发明的第一目的在于提供一种有机光电化合物,具有高极化率的优异性能。
本发明的第二目的在于提供一种上述有机光电化合物的应用。
本发明的第三目的在于提供一种光纤通讯的光电器件,该光纤通讯的光电器件包含上述有机光电化合物。
本发明的第四目的在于提供一种抗肿瘤的药物,该抗肿瘤的药物包含上述有机光电化合物。
为解决上述技术问题,本发明特采用如下技术方案:
一种有机光电化合物,所述有机光电化合物具有pi-D-A结构;其中,pi为共轭单元;D为电子给体单元;A为电子受体单元;所述共轭单元和所述电子受体单元通过电子给体单元互相连接;
所述共轭单元包含:噻吩及其衍生物、联噻吩及其衍生物,并噻吩及其衍生物、呋喃及其衍生物、联呋喃及其衍生物、并呋喃及其衍生物、吡咯及其衍生物、联吡咯及其衍生物、并吡咯及其衍生物、吡喃及其衍生物、联吡喃及其衍生物、吡啶及其衍生物和/或联吡啶及其衍生物;
所述电子给体单元包含芳基胺;所述电子受体单元包含吸电子基团。
本发明还提供了上述有机光电化合物的应用,包括如下(x1)-(x4)中的至少一种:
(x1)制备有机电致发光器件;
(x2)制备有机光致发光器件;
(x3)用于光纤通讯的光电器件;
(x4)制备用于抗肿瘤的药物。
本发明还提供了一种光纤通讯的光电器件,该光电器件包含上述有机光电化合物。
本发明还提供了一种抗肿瘤的药物,该药物包含上述有机光电化合物。
与现有技术相比,本发明具有如下有益效果:
本发明提供的有机光电化合物,具有pi-D-A结构,其中,pi为共轭单元,共轭单元拥有和储存了大量电子,并且共轭单元中的共轭体系可以使电子离域移动。D为电子给体单元,该单元包含芳基胺,具有输送电子的功能,在激发状态下将π电子送到电子受体单元。A为电子受体单元,该单元包含吸电子基团,可以接受电子。
上述具有pi-D-A结构的化合物可以增强材料的极化,从而得到高的beta值。基态偶极矩、激发态偶极矩随激发态的变化而变化,激发态给出了不同的电子离域,显示了不同的分子极化水平。
本发明提供的上述有机光电化合物可应用于多个领域,包括制备有机电致发光器件,制备有机光致发光器件,和用于光纤通讯的光电器件,具有极化率高的优点。同时,本发明提供的有机光电化合物还具有一定的抗肿瘤的效果,可用于制备抗肿瘤的药物。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
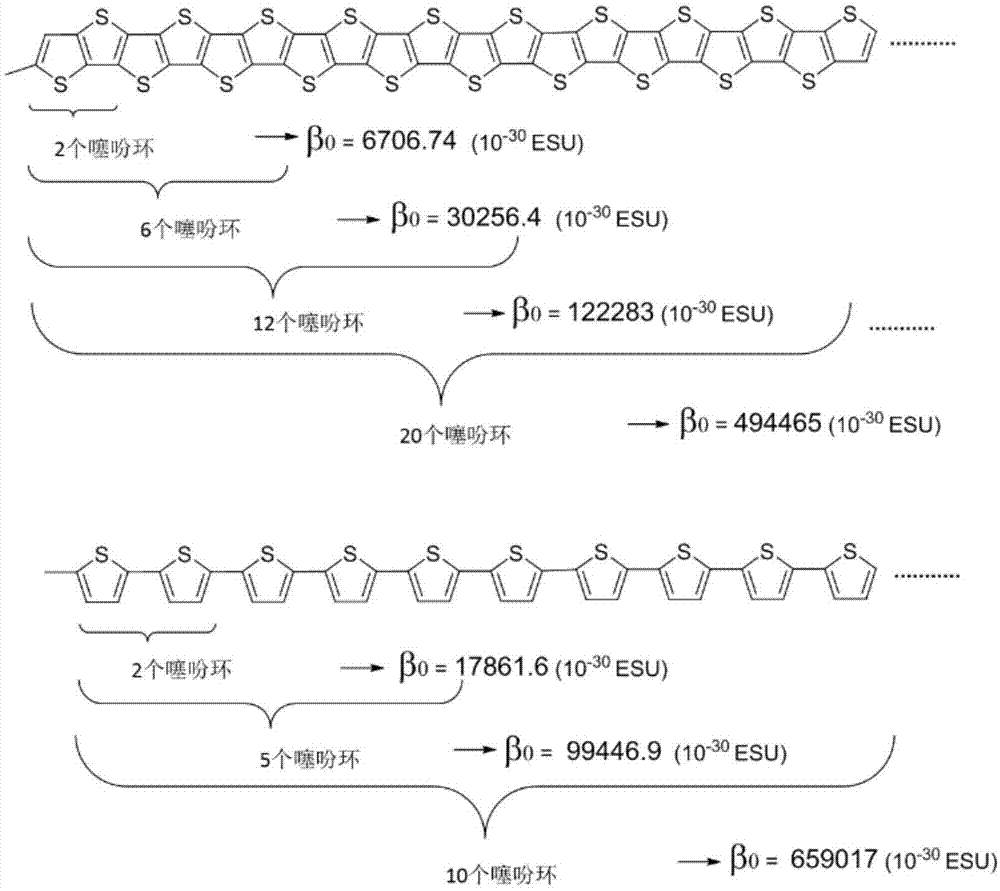
图1为本发明提供的有机光电化合物,当共轭单元包含联噻吩和/或并噻吩时,有机光电化合物的极化率随着噻吩环个数的增加而递增的示意图;
图2为本发明提供的有机光电化合物高极化率机理的示意图;
图3为本发明实施例1提供的有机光电化合物的中间体BBT的核磁共振氢谱;
图4为本发明实施例1提供的有机光电化合物的核磁共振氢谱。
具体实施方式
下面将结合附图对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明提供了一种有机光电化合物,该有机光电化合物具有pi-D-A结构;其中,pi为共轭单元;D为电子给体单元;A为电子受体单元;所述共轭单元和所述电子受体单元通过电子给体单元互相连接;
所述共轭单元包含:噻吩及其衍生物、联噻吩及其衍生物,并噻吩及其衍生物、呋喃及其衍生物、联呋喃及其衍生物、并呋喃及其衍生物、吡咯及其衍生物、联吡咯及其衍生物、并吡咯及其衍生物、吡喃及其衍生物、联吡喃及其衍生物、吡啶及其衍生物和/或联吡啶及其衍生物;
所述电子给体单元包含芳基胺;所述电子受体单元包含吸电子基团。
上述D即donor的缩写,为电子给体单元,是指在化合物中起到电子提供体的基团;上述A即Acceptor,为电子受体单元,是指在化合物中起到电子接受体的基团;pi即为π,是指包含共轭体系的基团。三个单元以π-π共轭键或p-π共轭键相连接。
共轭单元拥有和储存了大量电子,并且共轭单元中的共轭体系可以使电子离域移动。电子供体单元具有输送电子的功能,在激发状态下将π电子送到电子受体单元,电子受体单元可以接受电子。
具有pi-D-A结构的化合物可以增强材料的极化,从而得到高的beta值。基态偶极矩和激发态偶极矩随激发态的变化而变化,激发态给出了不同的电子离域,显示了不同的分子极化水平。
在一些可选的实施方式中,所述共轭单元包括:噻吩及其衍生物、联噻吩及其衍生物和/或并噻吩及其衍生物。所述联噻吩例如可以为但不限于为二联噻吩、三联噻吩、四联噻吩、五联噻吩或六联噻吩中的一种或多种;所述并噻吩例如可以为但不限于为并二噻吩、并三噻吩、并四噻吩、并五噻吩或并六噻吩中的一种或多种。
需要说明的是,本发明对联噻吩和并噻吩中的噻吩环的数量不做限制,并且所述有机光电化合物的极化率随着噻吩环个数的增加递增,如图1所示。β值为计算得出π-D-A(pi-D-A)型有机光电分子的二阶极化率。
在一些可选的实施方式中,所述芳基胺包括三苯胺基、二苯胺基、苯胺基或联苯氨基,所述电子给体单元优选包括如下结构式的基团:
在一些可选的实施方式中,所述吸电子基团包括硝基、三卤甲基、氰基和磺酸基中的一种或者多种;优选包括氰基和/或硝基;更优选包括氰基。
在一些优选的实施方式中,所述电子受体单元包括如下结构式的基团:
由于噻吩、TCF和TPA具有更好的热稳定性、光稳定性,适合器件的生产。因此在一些优选的实施方式中,所述有机光电化合物为以下化合物中的任意一种:
其中,n1、n2、n3、n4和n5分别独立的为大于等于1的整数,优选为1-20的整数。可选地,联噻吩和并噻吩分别独立的例如可以,但不限于包括1个噻吩环、2个噻吩环、3个噻吩环、4个噻吩环、5个噻吩环、10个噻吩环、15个噻吩环或者20个噻吩环。
所述有机光电化合物更优选为以下化合物中的任意一种:
如图2所示,展示了pi-D-A型EO分子的机理。EO发色团π-conjugated主动段可视为一个偶极球体(椭球)。利用量子化学理论模拟确定了相关偶极子矢量的大小和分布。电子给体单元TPA从π共轭噻吩循环中获得电子,并将电子泵入电子受体单元TCF。TCF提高了受激态下的吸引电子能力,使分子形成大范围的电子离域。球体模型给出了很大的偶极变化。pi-D-A系统产生从基态到激发态极性变化的电子云,并显示出较大的高极化率值。
pi-D-A具有很高的极化水平。从优化结果来看,分子具有刚性结构,使分子保持在一个平面内,具有较高的稳定性。刚体平面分子结构在激发态跃迁过程中能量损失很小,可以大大提高分子内电荷转移效率和能量转移效率。大共轭非局部化区域,聚噻吩易于将电子传递给电子供体单元和电子受体单元。pi-D-A型分子具有较大的ICT现象,具有较好的非线性光学性质,具有较高的beta值。
上述TCF为具有结构式的基团;
上述TPA为具有结构式的基团。
本发明还提供了上述有机光电化合物的应用,包括(x1)-(x4)中的至少一种:(x1)制备有机电致发光器件;(x2)制备有机光致发光器件,和(x3)用于光纤通讯的光电器件,具有极化率高的优点。同时,本发明提供的有机光电化合物还具有一定的抗肿瘤的效果。可用于制备于抗肿瘤的药物。
本发明还提供了一种包含上述有机光电化合物的光纤通讯的光电器件,由于本发明提供的有机光电化合物具有极化率高的优点,因此使用其制备的光电器件性能优异。
本发明还提供了一种包含上述有机光电化合物的抗肿瘤的药物,具有较好的抗肿瘤性能,可选地,所述抗肿瘤的药物可以以所述有机光电化合物为主要活性成分或者协助增效成分。
在一些可选地实施方式中,所述抗肿瘤药物为外用药,可选参考如下方法使用:
将所述有机光电化合物取1克,装入PE聚乙烯塑料袋内,制成一寸见方大小的A袋,并密封口部,防止药品泄露。将A袋贴敷于里肿瘤最近的部位,(如肾部肿瘤将A袋贴敷于腰部,胃部肿瘤贴于胃腹部)贴敷时间每次一分钟,每天五到十次,次与次间隔5到10分钟。贴敷一周算一个疗程。
该用于抗肿瘤的外用药还可以参考如下方法使用:
将所述有机光电化合物取5克放入偏平的玻璃瓶内,密封口部,防止药品泄露,制成B瓶。将B瓶贴敷于里肿瘤最近的部位,(如肾部肿瘤将B瓶贴敷于腰部,胃部肿瘤贴于胃腹部)。贴敷时间每次一分钟,每天三到五次,次与次间隔5到10分钟。贴敷一周算一个疗程。
使用上述方法贴敷,皮肤会有油汗感,说明起到活动肿瘤部位的气血的效果,该方法辅助肿瘤尽早凋亡,帮助病人恢复健康。
下面结合优选实施方式进一步说明本发明的有益效果。
实施例1
本实施例提供了一种有机光电化合物,具有如结构式(Ⅰ′)所示结构:
该化合物以三苯胺为原料,经过一系列的反应合成三苯胺噻吩类化合物,合成步骤如下:
(A)5-溴-2,2'-联噻吩的合成
用30.0ml CCl4溶解2.8g联二噻吩(17.1mmol),冰浴下,再加入0.9g NBS(17.1mmol),室温下搅拌10h,TCL监测反应进行程度,反应完成后,水洗,加CH2Cl2,振荡分液,将下层有机相取出,再将溶剂旋干,烘干得绿色固体4.0g,产率:94%。反应式如下:
(B)三苯胺单醛(DPA)的合成
冰浴,氮气保护的条件下,将10.0ml POCl3(0.1mol)滴加到12.0ml DMF(0.15mol)中,再加入20.0ml溶剂CCl4,搅拌1h使之混合均匀。准确称取3.0g三苯胺(10.0mmol)溶解在30.0ml CCl4,再加入反应器中,室温下搅拌1h,将温度调到80℃,回流10h。TLC观察反应进行程度,待物质完全反应后,旋干溶剂,再向其中倒入大量冰水,调pH=7-8,有黄色固体析出,抽滤,干燥,柱层析(石油醚:乙酸乙酯=10:1),得淡黄色固体2.5g,产率93%。反应式如下:
(C)三苯胺双溴单醛(BBP)的合成
氮气保护下,将2.5g DPA(9.1mmol)溶解在20ml CCl4中,室温搅拌0.5h,再称取1.1g NBS(18.2mmol)加入到烧瓶中,80℃反应6h。TLC观察反应进行程度,待物质完全反应后,旋干溶剂,倒入冷水,有暗黄色固体析出,抽滤,干燥,得3.5g淡黄色固体,产率90%。合成路线反应式如下:
(D)BTM的合成
氮气保护下,将3.5g BBP(8.2mmol),2.1g联硼酸频那醇酯(8.2mmol),0.4g Pd[P(C6H5)3]4,少量碳酸钾,溶解在50.0ml DMF中,80℃回流10h,TLC观察反应进行程度,待物质完全反应后,旋干溶剂,倒入冰水,有黄色固体析出,干燥后,柱层析(CH2Cl2)得黄色固体3.7g,产率80%。反应式如下:
(E)BBT的合成
氮气保护下,将3.7g BTM(7.0mmol),3.5g 5-溴-2,2'-联噻吩(14.0mmol),0.4g Pd[P(C6H5)3]4,少量碳酸钾,溶解在50.0ml DMSO中,100℃下回流10h,TLC观察反应进行程度,待物质完全反应后,旋干溶剂,倒入冰水,有黄色固体析出,干燥后,柱层析(CH2Cl2)得黄色固体3.3g,产率80%。产物BBT的核磁共振氢谱如图3所示,反应式如下:
(F)BPA的合成
将1.1g 2-(3-腈基-4,5,5-三甲基呋喃-2-烯)丙二腈(TCF)(5.5mmol),3.3g BBT(5.5mmol),溶解在30.0ml DMF中,搅拌下再加入0.5g C2H5ONa,最后再加入20.0ml DMF[23],100℃回流24h,点板监测反应,反应完成后,旋干溶剂,倒入大量冷水,有固体析出,过滤,干燥,柱层析(CH2Cl2)得紫黑色固体3.2g,产率75%。产物的核磁共振氢谱如图4所示:
反应式如下:
实施例1提供的有机光电化合物的极化率如下表所示:
实施例2
本实施例提供了一种有机光电化合物,具有如结构式(Ⅱ′)所示结构:
合成路线如下所示:
实施例3
取实施例1化合物0.2克,装入PE聚乙烯塑料袋内,制成边长为1cm大小的A袋,并密封口部,防止药品泄露。将5×106的HeLa细胞种入小鼠右侧腋下,待肿瘤长至150mm3时,将A袋贴敷于小鼠腋下,贴敷时间每次一分钟,每天五到十次,次与次间隔5分钟。阴性对照组不做处理,半个月后观测肿瘤生长的情况,阴性对照小鼠的相对肿瘤体积增加至240%,而使用本实施例提供的A袋贴敷的小鼠相对肿瘤体积增加为160%。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
- 还没有人留言评论。精彩留言会获得点赞!