含4-二氰基甲基苯并吡喃单元的近红外荧光染料及其制备方法和应用与流程
本发明属于生物医学材料领域中的肿瘤荧光成像领域,具体涉及一类可修饰的含4-二氰基甲基苯并吡喃单元的近红外染料及其制备方法以及在生物医学荧光成像领域中的应用。
背景技术:
癌症(又称恶性肿瘤)严重威胁着人类健康。由于医疗技术水平的限制,目前缺乏对晚期癌症的有效治疗手段,所以癌症的早期诊断对患者来说尤为重要,如果能早期诊断肿瘤并及时采取治疗,可以显著提高癌症患者的存活率。非侵入式的活体荧光成像等分子影像技术的出现为癌症的早期诊断开拓了新的发展道路。
生物组织在<700nm范围内有较强的自身荧光且有严重的光吸收,会严重干扰荧光成像效果。在近红外区(700~1600nm)生物组织光吸收或自身荧光强度都很小,近红外荧光成像技术受到越来越多的关注。由于近红外荧光对生物组织穿透能力较强,且成像信噪比和分辨率都较高,近红外荧光成像更有希望在未来的活体成像、肿瘤早期诊断等领域发挥重大作用。
迄今为止,近红外荧光成像材料主要为生物相容性差,毒性大或生物体难以吸收、代谢、排泄的成像试剂,主要包括单层碳纳米管(Nat.Photonics.,2014,8,723-730;Angew.Chem.Int.Ed.,2015,54,14758-14762)、高分子聚合物(Nat.Commun.,2014,5,4206)、量子点(ACS.Nano.,2012,6,3695-3702;Angew.Chem.Int.Ed.,2012,51,9818-9821;Biomaterials.,2015,53,265-273)、稀土纳米微粒(Nat.Commun.,2013,4,2199;J.Mater.Chem.B.,2016,4,87-95)等。
为了获得具有优异成药性的近红外荧光成像探针,非常需要发展具有高灵敏度、高生物相容性、高发光亮度、光稳定性好、无毒且更易于排泄的小分子近红外荧光成像染料。
技术实现要素:
本发明公开了一类含有4-二氰基甲基苯并吡喃和三苯胺的近红外荧光成像剂及其制备方法。具体来讲,本发明涉及一类可以用于癌症诊断成像的荧光探针材料,并成功地将材料应用于肿瘤荧光成像。
为实现上述发明目的,本发明提供如下技术方案:
一类含4-二氰基甲基苯并吡喃单元的近红外染料,具有通式(1)所述的结构:
其中:X为:O,S或Se;
R1,R2独立地为:
R1和R2不同时为H,n=0~18,m=1~200,X=F,Cl,Br,I或N3。
所述的具有通式(1)所示的结构的荧光化合物,其荧光发射波长为680~800nm。
一种制备通式(1)所述的荧光化合物的方法,反应路线如下:
反应过程为:
取化合物(2)和(3)加入反应容器中,在氮气或氩气保护下加入甲苯溶解,向反应液中通入氩气或氮气排除体系内氧气,加入哌啶和醋酸,然后在氮气或氩气保护下在115℃回流反应8~12小时,反应结束后纯化得到产品(1)。
本发明用于生物体内成像的近红外荧光成像探针,特别是应用于癌症诊断中,是在通式(1)所示的化合物可修饰位点修饰上聚乙二醇、多肽、蛋白、核酸适配体、叶酸及其衍生物所得。此处,癌症主要指肺癌、脑胶质瘤、乳腺癌、前列腺癌、黑色素瘤、结肠癌、胃癌、食道癌、宫颈癌和卵巢癌。本发明公开了所述的近红外荧光成像探针在生物体内成像中的应用。
本发明所得的如通式(1)所述的终产物为具有可修饰基团的全新化合物,其荧光发射波长位于近红外区,无毒,生物相容性好,易被生物体吸收和代谢。经不同后修饰或包载后,可用于肿瘤等不同疾病的检测以及血管和淋巴结成像。
本发明的近红外荧光成像探针,从实施例中可知该方案合成路线简单,反应效率高,收率高,具有较高的工业应用前景。本发明的创造性在于将4-二氰基甲基苯并吡喃中的氧原子替换为硫或硒,可增加荧光染料的发射波长,从而增加其荧光成像的穿透能力和分辨率。三苯胺上引入可修饰基团,增加的可修饰位点可用于连接不同的生物活性官能团,进而增加荧光探针的应用领域以及改善其水溶性和生物相容性。在生物医学成像实验中发现该荧光探针成像效果非常好,具有广阔的应用前景。
附图说明
图1为具体实施方式中近红外荧光成像探针1a的合成方法。
图2为近红外荧光成像探针1a在水中的吸收和荧光发射光谱图。
图3为尾静脉注射化合物1a进入右前肢接种肿瘤细胞的荷瘤小鼠体内近红外成像效果。
图4为将尾静脉注射1a进入右前肢接种肿瘤细胞的荷瘤小鼠体内,20小时后将小鼠解剖,离体组织和器官的近红外成像效果。
具体实施方式
以下结合附图对本发明的优选实施例进行说明,应当理解,此处所描述的优选实施例仅用于说明和解释本发明,并不用于限定本发明。
实施例1:化合物2的制备
冰浴条件下,将POCl3(7.83mL、10eq)滴入DMF(7.77mL、11eq)中,维持此温度反应2小时。冰浴条件下,取化合物1(3.5g、7.18mmol)溶于2mLDMF,滴入反应体系中,室温反应过夜。反应结束后,直接将反应也倒入冰水中,用碳酸钠将溶液pH调至近中性,然后用EA萃取,水(50mL×3)洗三次,饱和食盐水(50mL×3)洗三次。有机相用无水硫酸钠干燥,过滤,滤液旋干过硅胶柱(PE:EA=20:1)得3.5g化合物2。收率:94%。
化合物结构测定数据如下:
1H NMR(400MHz,CDCl3)δ9.80(s,1H),7.68(d,J=8.6Hz,2H),7.34(t,J=7.8Hz,2H),7.19(t,J=7.6Hz,5H),7.11(d,J=8.3Hz,2H),7.00(d,J=8.6Hz,2H),4.23–4.18(m,2H),2.96(t,J=7.7Hz,2H),2.64(t,J=7.8Hz,2H),1.03–0.98(m,2H),0.06(s,9H).
13C NMR(101MHz,CDCl3)δ190.39,172.95,153.39,146.12,144.24,137.73,131.32,129.73,129.68,128.93,126.48,126.26,125.09,119.06,62.75,35.94,30.42,17.33,-1.42.
HRMS(ESI)Calcd for:C27H32NO3Si+([M+H]+):446.6415.Found:446.6466.
实施例2:化合物4的制备
取化合物2(445mg,1mmol)、化合物3(208mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得417mg化合物4。收率:65%。
化合物4结构测定数据如下:
1H NMR(400MHz,CDCl3)δ8.91(d,J=8.3Hz,1H),7.78–7.70(m,1H),7.62–7.54(m,2H),7.44(t,J=8.9Hz,3H),7.34(t,J=7.8Hz,2H),7.21–7.14(m,5H),7.07(dd,J=26.8,8.5Hz,4H),6.81(s,1H),6.64(d,J=15.8Hz,1H),4.30–4.16(m,2H),2.97(t,J=7.8Hz,2H),2.65(t,J=7.8Hz,2H),1.08–0.96(m,2H),0.07(s,9H)
13C NMR(101MHz,CDCl3)δ173.04,158.24,152.81,152.37,150.30,146.63,144.74,138.82,136.98,134.45,129.59,129.53,129.27,127.18,125.88,125.79,125.60,124.36,121.05,118.56,117.93,117.16,116.11,115.47,106.09,62.77,61.41,36.01,30.41,17.34,-1.43.
HRMS(ESI)Calcd for:C40H38N3O3Si+([M+H]+):636.8465.Found:636.8478.
实施例3:化合物5的制备
取化合物4(20mg,0.03145mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得15mg化合物5,收率89%。
化合物5结构测定数据如下:
1H NMR(400MHz,CDCl3)δ8.92(dd,J=8.4,1.0Hz,1H),7.78–7.71(m,1H),7.61–7.54(m,2H),7.49–7.41(m,3H),7.34(t,J=7.8Hz,2H),7.17(dd,J=15.1,6.4Hz,5H),7.07(dd,J=26.3,8.5Hz,4H),6.83(s,1H),6.66(d,J=15.8Hz,1H),2.99(t,J=7.7Hz,2H),2.74(t,J=7.7Hz,2H).
13C NMR(101MHz,CDCl3)δ177.84,158.22,152.87,152.38,150.24,146.60,144.91,138.77,136.45,134.46,129.61,129.49,129.26,127.26,125.86,125.83,125.61,124.39,121.14,118.55,118.19,117.94,116.84,115.56,106.14,53.47,30.05,29.35.
HRMS(ESI)Calcd for:C35H26N3O3+([M+H]+):536.6105.Found:536.6167.
实施例4:化合物7的制备
取化合物2(445mg,1mmol)、化合物6(224mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得405mg化合物7。收率:62%。据文献报道,类似化合物B-DCM-P的最大发射波长为660nm(Journal of Materials ChemistryB,4(27)),而我们将其中的氧原子替换为硫原子后,最大发射波长红移了70nm,达到730nm。显然,荧光探针有着更长的发射波长就有着更低的活体组织自荧光干扰、更高的成像分辨率、更深的组织穿透能力,也就有着更有潜力的应用前景。
化合物7结构测定数据如下:
1H NMR(400MHz,CDCl3)δ8.93(d,J=8.2Hz,1H),7.66(ddd,J=15.1,8.1,1.2Hz,2H),7.59–7.54(m,1H),7.52(s,1H),7.40(d,J=8.7Hz,2H),7.33(t,J=7.9Hz,2H),7.24(d,J=16.0Hz,1H),7.20–7.12(m,5H),7.06(dd,J=23.4,8.6Hz,4H),6.98(d,J=16.0Hz,1H),4.25–4.17(m,2H),2.96(t,J=7.8Hz,2H),2.65(t,J=7.8Hz,2H),1.06–0.97(m,2H),0.07(s,9H).
13C NMR(101MHz,CDCl3)δ173.05,155.84,150.01,148.06,146.70,144.82,137.21,136.86,134.89,131.84,129.56,129.49,128.95,128.33,128.13,127.48,127.35,125.76,125.67,125.47,124.23,122.32,121.30,120.70,116.20,67.58,62.76,36.01,30.41,17.34,-1.44.
HRMS(ESI)Calcd for:C40H38N3O2SSi+([M+H]+):652.9075.Found:652.9087.
实施例5:化合物8的制备
取化合物7(20mg,0.03067mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得15mg化合物8,收率88%。
化合物8结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=15.0Hz,2H),7.59–7.48(m,3H),7.31–7.13(m,8H),7.13–7.06(m,3H),7.03(d,J=15.0Hz,3H),6.81(d,J=30.2Hz,1H),2.67–2.57(m,2H),2.56–2.45(m,2H).
13C NMR(101MHz,CDCl3)δ176.11,168.48,146.93,145.50,143.45,137.17,134.27,132.81,132.03,131.41,129.62,129.37,129.27,128.06,127.96,127.93,127.62,124.67,124.16,124.08,123.50,123.46,122.99,116.02,76.95,35.25,30.23.
HRMS(ESI)Calcd for:C35H26N3O2S+([M+H]+):552.6715.Found:552.6765.
实施例6:化合物10的制备
取化合物2(445mg,1mmol)、化合物9(271mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得440mg化合物10。收率:63%。
化合物10结构测定数据如下:
1H NMR(400MHz,CDCl3)δ8.77–8.69(m,1H),7.79–7.71(m,1H),7.63(s,1H),7.59–7.50(m,2H),7.43–7.30(m,4H),7.20–7.06(m,9H),7.03(d,J=8.6Hz,2H),4.26–4.16(m,2H),2.96(t,J=7.8Hz,2H),2.65(t,J=7.8Hz,2H),1.06–0.98(m,2H),0.07(s,9H).
13C NMR(101MHz,CDCl3)δ173.07,158.80,150.09,149.92,146.71,144.82,138.14,136.83,133.80,131.63,129.56,129.50,129.41,128.94,128.09,127.65,127.10,125.75,125.45,124.48,124.22,122.73,121.33,117.03,115.82,71.53,62.78,36.02,30.41,17.33,-1.42.
HRMS(ESI)Calcd for:C40H38N3O2SeSi+([M+H]+):699.8075.Found:699.8099.
实施例7:化合物11的制备
取化合物10(20mg,0.02857mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得15mg化合物11,收率87%。
化合物11结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.31–7.20(m,6H),7.19–7.08(m,5H),7.08–6.90(m,4H),6.86–6.73(m,3H),2.68–2.57(m,2H),2.56–2.44(m,2H).
13C NMR(101MHz,CDCl3)δ176.11,167.44,146.93,145.50,143.45,137.16,135.46,132.81,132.03,131.44,131.37,129.67,129.37,129.27,128.36,128.24,126.13,124.67,123.50,123.46,122.99,120.45,116.02,115.42,68.22,35.25,30.23.
HRMS(ESI)Calcd for:C35H26N3O2Se+([M+H]+):599.5715.Found:599.5786.
实施例8:化合物13的制备
取化合物12(416mg,1mmol)、化合物3(208mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得357mg化合物13。产率59%。
化合物13结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.50(s,1H),7.44–7.18(m,5H),7.13(dd,J=21.0,5.9Hz,5H),7.04(dt,J=14.7,5.0Hz,4H),6.92–6.73(m,3H),5.66(s,1H),3.03(td,J=15.4,1.4Hz,2H),2.62(td,J=15.4,1.4Hz,2H),1.42(s,9H).
13C NMR(101MHz,CDCl3)δ162.72,158.57,157.25,150.17,146.93,145.50,143.87,136.93,132.81,132.03,130.66,129.84,129.27,128.41,125.14,124.67,124.29,123.50,122.99,121.87,121.32,119.34,118.76,116.02,110.50,80.89,80.10,43.43,35.82,28.33.
HRMS(ESI)Calcd for:C39H35N4O3+([M+H]+):607.7335.Found:607.7356.
实施例9:化合物14的制备
取化合物13(20mg,0.03296mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得16mg化合物14,收率95%。
化合物14结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.44–7.18(m,5H),7.13(dd,J=21.0,5.9Hz,5H),7.04(dt,J=14.7,5.0Hz,4H),6.92–6.74(m,3H),5.66(s,1H),3.09–2.89(m,2H),2.81–2.62(m,2H),1.60(s,2H).
13C NMR(101MHz,CDCl3)δ162.72,157.25,150.17,146.93,145.50,143.67,137.04,132.81,132.03,130.66,129.89,129.27,128.41,125.14,124.67,124.29,123.50,122.99,121.77,121.32,119.34,118.76,116.02,110.50,80.10,42.41,37.78.
HRMS(ESI)Calcd for:C34H27N4O+([M+H]+):507.6165.Found:507.6178.
实施例10:化合物15的制备
取化合物12(416mg,1mmol)、化合物6(224mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得384mg化合物15。收率:60%。
化合物15结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.60–7.47(m,3H),7.32–7.22(m,3H),7.22–7.09(m,6H),7.05(t,J=5.1Hz,2H),7.00(d,J=4.7Hz,1H),6.83(d,J=4.0Hz,2H),6.58(s,1H),3.03(td,J=15.4,1.4Hz,2H),2.62(td,J=15.4,1.3Hz,2H),1.42(s,9H).
13C NMR(101MHz,CDCl3)δ168.48,158.57,146.93,145.50,143.87,136.93,134.27,132.81,132.03,131.41,129.84,129.62,129.27,128.06,127.96,127.93,127.62,124.67,124.16,124.08,123.50,122.99,121.87,116.02,80.89,76.95,43.43,35.82,28.33.
HRMS(ESI)Calcdfor:C39H35N4O2S+([M+H]+):623.7945.Found:623.7965.
实施例11:化合物16的制备
取化合物15(20mg,0.03211mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得16mg化合物16,收率95%。
化合物16结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.54(dd,J=5.6,3.1Hz,2H),7.24(ddd,J=17.0,7.5,3.3Hz,5H),7.13(dd,J=21.0,5.9Hz,4H),7.02(dt,J=19.4,9.9Hz,4H),6.83(d,J=4.0Hz,2H),6.58(s,1H),3.08–2.92(m,2H),2.80–2.63(m,2H),1.60(s,2H).
13C NMR(101MHz,CDCl3)δ168.48,146.93,145.50,143.67,137.04,134.27,132.81,132.03,131.41,129.89,129.62,129.27,128.06,127.96,127.93,127.62,124.67,124.16,124.08,123.50,122.99,121.77,116.02,76.95,42.41,37.78.
HRMS(ESI)Calcd for:C34H27N4S+([M+H]+):523.6775.Found:523.6787.
实施例12:化合物17的制备
取化合物12(416mg,1mmol)、化合物9(271mg,1mmol)加入100mL圆底烧瓶中,在氩气保护下加入甲苯45mL溶解,加入哌啶0.5mL、醋酸0.5mL,氩气保护下在115℃油浴中加热回流反应12小时。反应结束后,冷却至室温,旋蒸除去甲苯,直接过硅胶柱分离纯化(PE:EA=10:1)得375mg化合物17。收率:56%。
化合物7结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.50(s,1H),7.32–7.16(m,8H),7.13(d,J=15.1Hz,2H),7.08(d,J=14.8Hz,2H),7.05–6.95(m,3H),6.85–6.76(m,3H),3.03(d,J=1.0Hz,1H),2.62(d,J=1.0Hz,1H),1.42(s,9H).
13C NMR(101MHz,CDCl3)δ167.44,158.57,146.93,145.50,143.87,136.93,135.46,132.81,132.03,131.44,131.37,129.84,129.67,129.27,128.35,128.24,126.13,124.67,123.50,122.99,121.87,120.45,116.02,115.42,80.89,68.22,43.43,35.82,28.33.
HRMS(ESI)Calcd for:C39H35N4O2Se+([M+H]+):670.6945.Found:670.6967.
实施例13:化合物18的制备
取化合物17(20mg,0.02986mmol)加入5mL圆底烧瓶中,在氩气保护下加入二氯甲烷1mL,置于冰浴中,滴加三氟乙酸0.5mL。反应液在25℃机械搅拌反应6小时。反应结束后直接旋蒸去除溶剂,过硅胶柱分离纯化(DCM:MeOH=20:1)、得13mg化合物18,收率76%。
化合物18结构测定数据如下:
1H NMR(400MHz,CDCl3)δ7.77(d,J=14.9Hz,2H),7.30–7.13(m,9H),7.10(d,J=5.7Hz,2H),7.02(dt,J=19.4,9.9Hz,4H),6.86–6.65(m,3H),3.17–2.87(m,2H),2.82–2.47(m,2H),1.60(s,2H).
13C NMR(101MHz,CDCl3)δ167.44,146.93,145.50,143.67,137.04,135.46,132.81,132.03,131.44,131.37,129.89,129.67,129.27,128.35,128.24,126.13,124.67,123.50,122.99,121.77,120.45,116.02,115.42,68.22,42.41,37.78.
HRMS(ESI)Calcd for:C34H27N4Se+([M+H]+):570.5775.Found:570.5779.
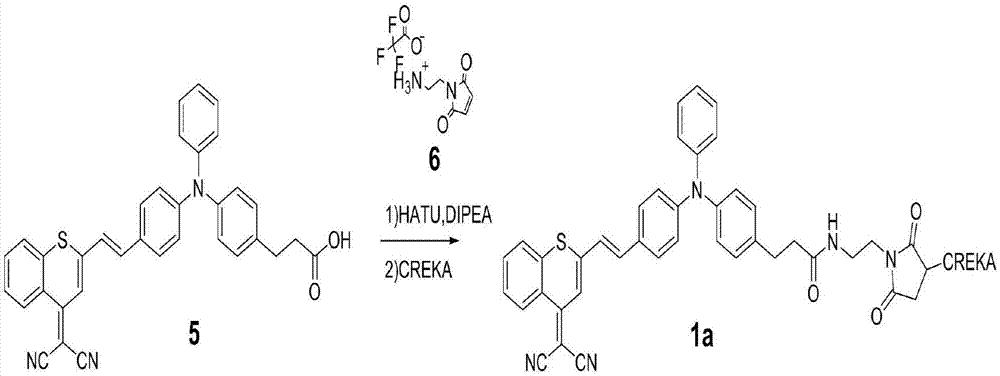
实施例14:化合物1a的制备及其肿瘤成像效果
取化合物8(1.3mg,0.0024mmol)加入5mL圆底烧瓶中,在氩气保护下加入无水DMF1mL,搅拌使溶解,随后加入HATU(1.14mg,0.003mmol)和DIPEA(5μL),搅拌十分钟后,加入化合物6(0.766mg,0.003mmol),反应液在25℃搅拌反应3小时。将多肽CREKA(1.817mg,0.003mmol)在300μL PBS中,用TCEP(0.86mg,0.003mmol)预处理10分钟后加入到反应体系中,室温反应6小时。反应结束后加乙醚沉淀,收集固体,固体复溶于去离子水-乙腈(v/v,7:3)中,通过半制备型高效液相色谱纯化,冻干得产品。
化合物1a结构测定数据如下:
MALDI-TOF-MSCalcdfor:C64H74N14O11S2:1279.5030,found:1280.5671.
通过尾静脉注射1a 50μg的PBS溶液200μL进入右前肢接种肿瘤细胞的荷瘤小鼠体内,近红外成像仪拍摄小鼠全身成像图,参见图3,肿瘤部位能够和其他组织明显区别。表明,荧光探针1a对肿瘤的主动靶向性较好。本发明所述材料在特异性诊断肿瘤方面具有较好的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!