一种混源萜二聚体类化合物及其药物组合物和其应用的制作方法
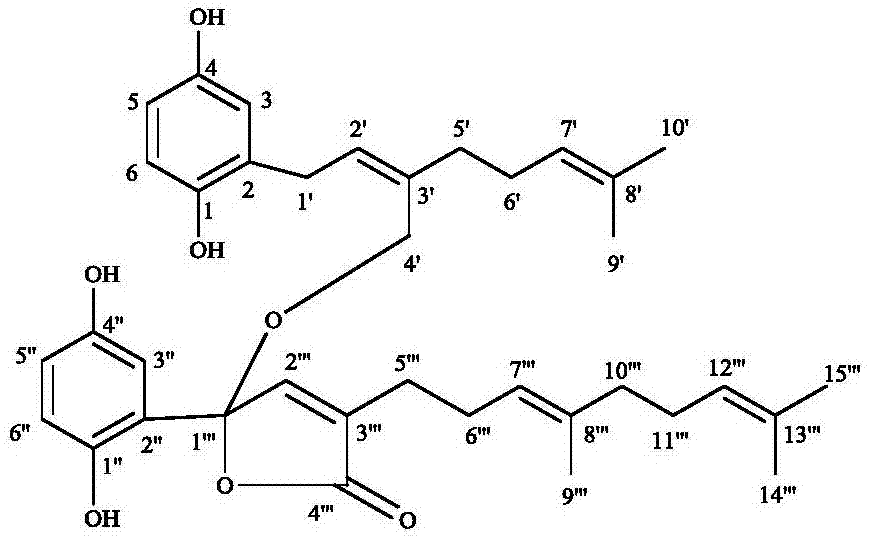
本发明属于药物学领域,具体涉及从反柄灵芝(G.cochlear)乙酸乙酯层分离得到的结构新颖的混源萜二聚体类化合物meroganocochlearin,及其药物组合物,以及其制备方法和在制备糖尿病或肥胖症药物中的用途。
技术背景:
随着生活水平不断提高、饮食结构日趋多元化,糖尿病已成为继肿瘤、心血管疾病之后的第三大严重威胁人类健康的疾病。据国际糖尿病联盟统计,2017年全球约4.25亿成人患糖尿病,预计到2045年,糖尿病患者可能达到6.29亿。因此,探寻有效预防和治疗糖尿病的药物尤为重要。α-葡萄糖苷酶属于低聚糖水解酶类,其抑制剂通过竞争性抑制小肠上皮绒毛膜上的糖苷酶的作用来减少糖类的降解,延缓糖类的消化和吸收,从而有效地降低糖尿病人餐后血糖浓度的峰值,达到控制血糖的目的。目前临床上广泛应用的α-葡萄糖苷酶抑制剂如阿卡波糖、伏格列波糖、米格列醇等会对人体造成胀气、腹痛等副作用。因此开发高效低毒的α-葡萄糖苷酶抑制剂是药学研究的热点。
肥胖是指能量摄入与消耗不平衡的一种营养障碍性疾病,由于体内脂质过量蓄积,肥胖容易引发心脑血管、肿瘤等疾病,严重危害身体健康。胰脂肪酶是脂肪水解过程中的关键酶,食物的脂肪在胰脂肪酶及胆汁的作用下分解成为甘油和脂肪酸才能消化吸收,所以胰脂肪酶是目前研究最广泛的减肥靴点。奥利司他作为FDA批准的首个上市的OTC减肥化学药物,具有强效胰脂肪酶抑制作用,但长期服用该药物仍然存在许多副作用,如胃胀气、大便失禁、脂肪便等。因此寻找新的、更加安全有效的胰脂肪酶抑制剂来预防和控制肥胖已经刻不容缓。
灵芝属(Ganoderma)是担子菌亚门(Basidimycotina),多孔菌目(Polyporales)灵芝科(Ganodermataceae)真菌,该属约有80种,主要生长在季风气候区域,在亚洲国家被广泛作为中药使用。我国古代药学专著《神农本草经》和《本草纲目》中均有灵芝的记载。反柄灵芝(G.cochlear)为灵芝属(Ganoderma)的一种。反柄灵芝(G.cochlear)广泛分布于我国云南、福建、广东、广西、香港等地,也可见于印度尼西亚等其它国家。《中华人民共和国药典》(2015年版第一部)仅收载了灵芝属的赤芝(G.lucidum)和紫芝(G.sinense),在中药材市场上广泛流通的反柄灵芝(G.cochlear)却极少有人关注。几十年来,灵芝属的化学成分备受关注,主要集中在灵芝三萜和多糖在抗肿瘤、抗病毒、降血压等方面的药理活性研究。但关于反柄灵芝(G.cochlear)来源的混源萜二聚体类化合物治疗糖尿病以及肥胖症的药理作用未见报道。
技术实现要素:
:
本发明的目的在于提供一种来源反柄灵芝(G.cochlear)的新的混源萜二聚体类化合物meroganocochlearin,及其药物组合物,其制备方法,以及其在制备糖尿病或肥胖症药物中的应用。本发明发现结构新颖的混源萜二聚体类化合物meroganocochlearin能够显著抑制胰脂肪酶和α-葡萄糖苷酶活性,该作用对糖尿病及肥胖症的预防和治疗具有积极意义。
为了实现本发明的上述目的,本发明提供了如下的技术方案:
如下结构式所示的化合物meroganocochlearin,
如所述的混源萜二聚体类化合物meroganocochlearin,该化合物还包括立体异构体。
本发明同时提供了一种药物组合物,其含有所述的混源萜二聚体类化合物meroganocochlearin作为有效成分,至少还包含一种药学上可接受的载体。
本发明还提供了所述的混源萜二聚体类化合物meroganocochlearin在制备治疗糖尿病药物中的应用。
以及,所述的混源萜二聚体类化合物meroganocochlearin在制备治疗肥胖症药物中的应用。
本发明所述的混源萜二聚体类化合物meroganocochlearin通过下述方法制备:
将反柄灵芝(G.cochlear)子实体(20kg)粉碎,用95%乙醇150L提取四次,每3天一次,提取液减压蒸馏浓缩至4L,然后用乙酸乙酯萃取四次,乙酸乙酯层减压浓缩得到浸膏850g。浸膏经硅胶色谱柱(氯仿:甲醇,V/V,100:0至0:100)的洗脱得到11个片段I-XI。将VII经中压柱色谱洗脱(MeOH:H2O,V/V,20:80,40:60,60:40,80:20,100:0)得到片段A-E。将片段D经LH-20(甲醇),LH-20(丙酮),正相硅胶柱层析得到meroganocochlearin粗品,再经pre-HPLC(MeOH-H2O,MeCN-H2O)得到98%纯的化合物meroganocochlearin。
化合物meroganocochlearin是黄色油状物,通过高分辨电喷雾电离质谱HR-ESI-MS(m/z,625.3136,[M+Na]+,计算值为625.3134,C37H46O7),确定其分子式为C37H46O7,不饱和度为15。在1H NMR中,芳香区显示有两个ABX取代的耦合系统,一个是δH 6.56,d,J=3Hz;δH6.47,dd,J=8.4Hz,3Hz;δH 6.62,d,J=8.4Hz;另一个是δH 6.99,d,J=2.9Hz;δH 6.73,dd,J=8.4Hz,2.9Hz;δH 6.76,d,J=2.9Hz。在芳香区显示4个烯氢信号(δH 5.51,δH 5.10,δH5.07,δH 5.08)加上5个单峰甲基和一个羟甲基(δH 4.09,4.23,δC 62.4)表明化合物meroganocochlearin中存在4个异戊烯基。在13C NMR和DEPT中,提示有5个甲基,8个亚甲基(一个连氧的),11个芳香区或是烯氢的次甲基,13个季碳(一个羰基,5个连氧的季碳),质子信号H-2”'(δH 7.48,s)和C-1”'(δC 107.5),C-2”'(δC 147.2),C-3”'(δC 135.7)和C-4”'(δC171.6)提示有γ内酯环。关键的HMBC相关(H2-4与C-1”'(δC 107.5)相关)确定了这两个片段的连接。通过一维核磁1HNMR、13CNMR以及和二维核磁HSQC,HMBC,1H-1HCOSY,ROESY等分析技术手段,确定了该化合物的相对构型,将其自命名为:meroganocochlearin。
本发明化合物用作药物上时,可以直接使用或者以药物组合物的形式使用。该药物组合物含有0.1~99%,优选0.5%~95%的本发明化合物,其余为药学上可以接受的盐,或对人和动物无毒的可药用载体和/或赋形剂。
本发明化合物的施用量可根据用药途径、患者的年龄、体重、所治疗的疾病的类型和严重程度等变化,其日剂量可以是0.01~10mg/kg体重,优选0.1~5mg/kg体重。可以一次或多次施用。
口服可用其固体或液体制剂,如粉剂、片剂、糖衣剂、胶囊、溶液、糖浆、滴丸等。
注射可用其固体或液体制剂,如粉针剂、溶液形注射剂等。
附图说明:
图1为本发明化合物meroganocochlearin的结构示意图;
图2a为Quercetin对α-葡萄糖苷酶的抑制作用;图2b为本发明化合物meroganocochlearin对α-葡萄糖苷酶的抑制作用;
图3a为Orlistat对胰脂肪酶的抑制作用;图3b为本发明化合物meroganocochlearin对胰脂肪酶的抑制作用。
具体实施方式:
下面结合附图,用本发明的实施例来进一步说明本发明的实质性内容,但并不以此来限定本发明。
实施例1:
将反柄灵芝(G.cochlear)子实体(20kg)粉碎,用95%乙醇150L提取四次,每3天一次,提取液减压蒸馏浓缩至4L,然后用乙酸乙酯萃取四次,乙酸乙酯层减压浓缩得到浸膏850g。浸膏经硅胶色谱柱(氯仿:甲醇,V/V,100:0至0:100)的洗脱得到11个片段I-XI。将VII经中压柱色谱洗脱(MeOH:H2O,V/V,20:80,40:60,60:40,80:20,100:0)得到片段A-E。将片段D经LH-20(甲醇),LH-20(丙酮),正相硅胶柱层析得到meroganocochlearin粗品,再经pre-HPLC(MeOH-H2O,MeCN-H2O)得到98%纯的化合物meroganocochlearin。化合物结构的鉴定通过波谱数据的比较和解析确定。具体核磁数据见表1
表1.化合物meroganocochlearin的核磁数据(δH/ppmδC/ppm,acetone-d6)
实施例2:
化合物meroganocochlearin对α-葡萄糖苷酶活性抑制实验:
实验试剂:α-葡萄糖苷酶、4-Nitrophenylα-D-glucopyranoside、阳性对照Quercetin购自Sigma公司。
实验方法:将不同浓度的待测化合物与α-葡萄糖苷酶溶液(终浓度0.025U/ml)、缓冲液、底物(终浓度1mM)顺序加入96孔酶标板,充分混匀,每个浓度设置3个重复孔。同时设置不含药物的空白对照和quercetin阳性对照。37℃孵育50min,酶标仪测定405nm处的OD值,计算得出α-葡萄糖苷酶活性的抑制率。
α-葡萄糖苷酶抑制率(%)=(1-实验孔OD405nm/对照孔OD405nm)×100%
实验结果:化合物meroganocochlearin对α-葡萄糖苷酶有很强的抑制作用,且呈浓度依赖性,即随meroganocochlearin浓度降低,抑制作用逐渐减弱。其IC50(50%Concentrationof Inhibition)为0.477μM(图2b),对照药物Quercetin IC50为7.096μM(图2a)。
实验结果表明,化合物meroganocochlearin对α-葡萄糖苷酶抑制活性明显强于阳性对照药物Quercetin,其IC50优于对照药物Quercetin14.88倍,具有成为预防和治疗糖尿病药物的前景。
实施例3:
化合物meroganocochlearin对胰脂肪酶活性抑制实验:
实验试剂:胰脂肪酶(PPL)、p-nitrophenyl butyrate(p-NPB)、Tris、阳性对照Orlistat购自Sigma公司;D-PBS购自Hyclone公司;无水氯化钙为成都市科龙化工试剂厂产品。
实验方法:在96孔酶标板上,将不同浓度的待测化合物与PPL溶液(终浓度1.25U/mL)充分混合,每个浓度均设定3个重复孔,37℃,15min;加入p-NPB(终浓度0.5mM),混合均匀,37℃,15min;BioTek PowerWave XS酶标仪测定OD400nm/630nm值,检测波长为400nm,参考波长为630nm。实验同时设置空白对照孔和Orlistat阳性对照孔。
PPL活性抑制率(%)=(1–实验孔OD400nm/630nm/对照孔OD400nm/630nm)×100%
实验结果:化合物meroganocochlearin对PPL有很好的抑制作用,且呈浓度依赖性,即随meroganocochlearin浓度降低,抑制作用逐渐减弱。其IC50(50%Concentration of Inhibition)为1.398μM(图3b),对照药物Orlistat的IC50为0.004μM(图3a)。
实验结果表明,化合物meroganocochlearin对PPL的明显抑制作用对预防和治疗肥胖症药物的研发具有积极意义。
实施例4:
按实施例1制得化合物meroganocochlearin 15.5mg,加入淀粉200mg,乳糖66.6mg,薄荷醇1mg,羧甲基淀粉钠50.6mg,制成含片,作为保健品。
实施例5:
按实施例1制得化合物meroganocochlearin 50mg,将其溶解于2mL丙二醇中,过滤所得溶液在无菌条件下装入安瓿瓶中。
实施例6:
按实施例1制得化合物meroganocochlearin,按其与赋形剂重量比为9:1的比例加入赋形剂,制成粉剂。
实施例7:
按实施例1制得化合物meroganocochlearin,按其与赋形剂重量比为1:1的比例加入赋形剂,制粒压片。
实施例8:
按实施例1制得化合物meroganocochlearin,按常规胶囊制剂方法制成胶囊。
实施例9:
按实施例1制得化合物meroganocochlearin,按常规口服液制法制成口服液。
- 还没有人留言评论。精彩留言会获得点赞!