亲和层析填料的筛选方法与流程
本发明涉及生物领域,特别是涉及一种亲和层析填料的筛选方法。
背景技术:
自第一个抗移植后免疫排斥反应的鼠源单克隆抗体muromonab-cd3(okt3)经美国食品药品监督管理局(foodanddrugadministration,fda)批准上市以来,单克隆抗体正越来越广泛地应用于治疗性制药领域。
在单克隆抗体的生产开发中,单克隆抗体纯化工艺的开发更是其中极其重要的一环。目前最普遍的平台化纯化技术为:将含有抗体的细胞培养液经过澄清处理、亲和层析、病毒灭活、离子交换层析中度纯化、离子交换层析精细纯化、除病毒过滤以及超滤浓缩及缓冲液置换,从而得到纯化的单克隆抗体。
在亲和层析工艺的开发过程中,如何快速高效地从品类繁多的层析填料中挑选出一至两种满足工艺需求的填料是富有挑战性的,主要涉及层析填料的动态吸附能力的评价。传统的筛选方法是通过设置不同的流速、保留时间,多次运行样品和层析介质的吸附/洗脱过程,通过利用蛋白纯化仪监测流穿中目标抗体的穿透位置及穿透的比例,拟合流穿曲线来确定。这种筛选方法的缺点是工艺时间长,材料及样品消耗量大。
技术实现要素:
基于此,提供一种快速的亲和层析的填料的筛选方法。
一种亲和层析的填料的筛选方法,包括以下步骤:
在相同的流速、保留时间下,将含有单克隆抗体的上样液分别连续上样到多个亲和层析柱中,使每个所述亲和层析柱过载,其中,每个所述亲和层析柱中含有一种亲和层析填料,且至少有两个所述亲和层析柱中的亲和层析填料不同;
将各个所述亲和层析柱的流穿液按照穿透的先后顺序分装为多个待测液;
检测各个所述待测液中所述单克隆抗体的浓度;
根据所述待测液中所述单克隆抗体的浓度,确定各种亲和层析填料对所述单克隆抗体的动态结合能力;及
根据所述动态结合能力筛选所述亲和层析填料。
上述亲和层析的填料的筛选方法,将含有单克隆抗体的上样液分别连续上样到多个亲和层析柱中,使亲和层析柱过载,并按照穿透的先后顺序将流穿液分装为多个待测液,通过比较待测液中的单克隆抗体的浓度,能够快速分析每种亲和层析填料对该单克隆抗体的动态结合能力,从而筛选得到适合该单克隆抗体的亲和层析填料。另外,整个筛选过程中,一次连续上样就能评价一种亲和层析填料的结合能力,单克隆抗体的用量少,涉及的耗材用量少。
在其中一个实施例中,加入到每个所述亲和层柱中的所述上样液的体积与该上样液中所述单克隆抗体的质量浓度之积大于所述亲和层析填料的固有载量与该亲和填料的体积之积。
在其中一个实施例中,所述检测每个所述待测液中所述单克隆抗体的浓度的步骤包括:
分别将各所述亲和层析填料装填到多孔过滤板上,用平衡液平衡各所述亲和层析填料,得到微孔层析板;
分别将各所述亲和层析柱的多个所述待测液等体积加到所述微孔层析板对应的孔中,得到多个待孵育液;
将各所述待孵育液孵育、离心及洗脱,得到多个洗脱液;及
检测各所述洗脱液中所述单克隆抗体的浓度,得到各所述待测液中所述单克隆抗体的浓度。
在其中一个实施例中,所述将各所述待孵育液孵育、离心、洗脱,得到多个洗脱液的步骤包括:
将各所述待孵育液孵育、离心,得到多个离心液;
检测各个所述离心液中的所述单克隆抗体的浓度,若所述离心液中的所述单克隆抗体的浓度与所述上样液中所述单体隆抗体的浓度的比值大于5%,则将所述离心液再次加入至所述微孔层析板对应的孔中进行孵育,然后离心、检测所述单克隆抗体的浓度,直至每个所述离心液中的所述单克隆抗体的浓度与所述上样液中所述单体隆抗体的浓度的比值不大于5%,得到吸附有所述单克隆抗体的微孔层析板;及
用洗脱缓冲液清洗所述吸附有所述单克隆抗体的微孔层析板,得到所述洗脱液。
在其中一个实施例中,所述上样液含有相同浓度的所述单克隆抗体,所述根据所述待测液中所述单克隆抗体的浓度,确定每种所述亲和层析填料对所述单克隆抗体的动态结合能力的步骤包括:
计算每个所述待测液对应的上样总体积;及
计算每个所述待测液中所述单克隆抗体的浓度与所述上样液中所述单克隆抗体的浓度的比值,在相同的所述比值下,所述上样总体积大的亲和层析填料的动态结合能力大。
在其中一个实施例中,每个所述亲和层析柱的多个所述待测液中,至少一个所述待测液的所述单克隆抗体的浓度与所述上样液中的单克隆抗体的浓度的比值处于0.05~0.15之间。
在其中一个实施例中,所述上样液为含有所述单克隆抗体的发酵液上清。
在其中一个实施例中,在所述在相同的流速、保留时间下,将含有单克隆抗体的上样液分别连续上样到多个亲和层析柱中,使每个所述亲和层析柱过载的步骤之前,还包括以下步骤:
确认每种所述亲和层析填料对所述单克隆抗体的静态结合能力。
在其中一个实施例中,所述确认每种所述亲和层析填料对所述单克隆抗体的静态结合能力的步骤包括:
将所述单克隆抗体配置成不同浓度的上样样品;
分别将各所述亲和层析填料等体积装填到多孔过滤板上,用亲和层析平衡液平衡每种所述亲和层析填料,得到微孔层析板;
分别将不同浓度的所述上样样品等体积加到所述微孔层析板上,并进行孵育、离心、收集上清液,检测所述上清液中的所述单克隆抗体的浓度;及
根据每种所述亲和层析填料的上清液中所述单克隆抗体浓度,确认每种所述亲和层析填料对所述单克隆抗体的静态结合能力。
在其中一个实施例中,采用梯度稀释法将所述单克隆抗体配置成不同浓度的上样样品。
附图说明
图1为实施1中上样浓度为14.9mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图2为实施1中上样浓度为29.1mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图3为实施1中上样浓度为43.7mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图4为实施1中上样浓度为57.2mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图5为实施1中上样浓度为69.9mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图6为实施1中上样浓度为79.2mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图7为实施1中上样浓度为84.7mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
图8为实施1中上样浓度为88.4mg/ml时穿透次数编号与未结合的单克隆抗体浓度占上样浓度比例关系图;
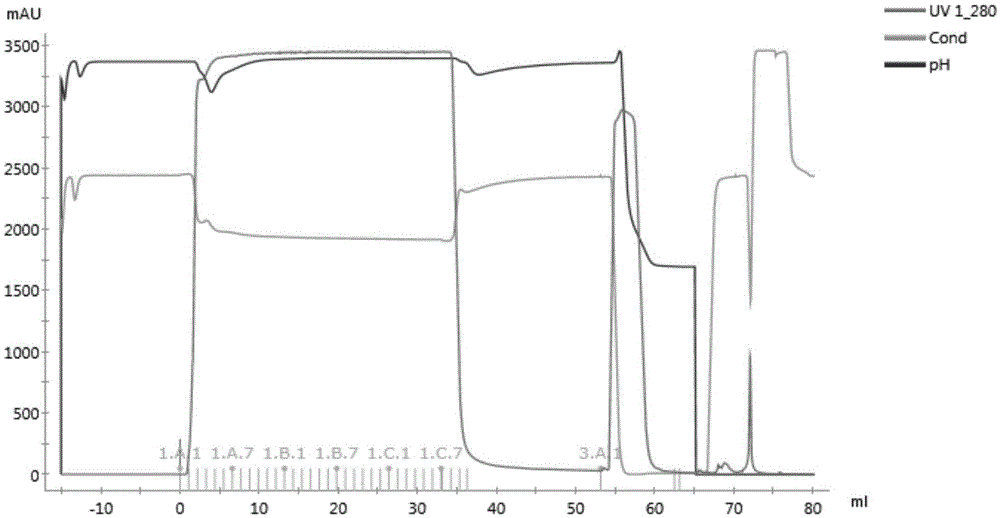
图9为实施例2中resind的层析图谱;
图10为实施例2中resine的层析图谱;
图11为实施例2中resinb的层析图谱;
图12为实施例2中resind、resine和resinb的流穿液中的单克隆抗体的含量变化图。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的部分实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使本发明公开内容更加透彻全面。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
一实施方式的亲合层析填料的筛选方法,包括以下步骤:
s110、确认每种亲和层析填料对单克隆抗体的静态结合能力。初步筛选适合于单克隆抗体的亲和层析填料。
具体地,步骤s110包括步骤s111~s117。
s111、制备微孔层析板。
具体地,分别将各亲和层析填料等体积装填到多孔过滤板上,用亲和层析平衡液平衡每种亲和层析填料,得到微孔层析板。
进一步地,将每种亲和层析填料制备成胶悬液,然后将胶悬液铺板、清洗及平衡,得到微孔层析板。
进一步地,制备胶悬液的操作包括:分别将各亲和层析填料与填料保存液混合。具体地,填料保存液为体积分数10%~30%的乙醇溶液。每种亲和层析填料与填料保存液的体积之比为1:0.5~2。优选地,填料保存液为体积分数20%的乙醇溶液。亲和层析填料与填料保存液的体积之比为1:1。
进一步地,铺板的操作包括:分别将每种由亲和层析填料制成的胶悬液加入多孔滤板的不同孔中。具体地,加入的胶悬液的体积为10μl/孔~40μl/孔。优选地,加入的胶悬液的体积为15μl/孔~25μl/孔。更优选地,加入的胶悬液的体积为20μl/孔。
进一步地,清洗及平衡的操作包括:先用超纯水、再用平衡缓冲液对铺板完成的滤板进行清洗。进一步地,用超纯水和平衡缓冲液对铺板完成的滤板清洗3~5次,每次清洗后直接抽滤去除清液,最后一次平衡后离心、去清液,得微孔层析板。在本实施方式中,平衡缓冲液为1*pbs(10mmpb,150mmnacl,ph7.4)。当然,在其他实施方式中,平衡缓冲液也可以根据亲和层析填料的说明书选择。
s113、将单克隆抗体配置成不同浓度的上样样品。
具体地,根据每种亲和层析填料的固有载量,将含有单克隆抗体的样品配置不同浓度的上样样品,以观察不同浓度下各亲和层析填料对该单克隆抗体的吸附情况。其中,在上样样品的浓度中至少包括能够使亲和层析填料过载的浓度。过载是指样品载量大于固有载量。也即是说,加入到各亲和层柱中的上样液的体积与该上样液中单克隆抗体的质量浓度之积大于该亲和层析柱中亲和层析填料的固有载量与该亲和填料的体积之积。当然,此时上样液的体积与亲和填料的体积的单位一致,单克隆抗体的质量浓度与固有载量的单位一致。样品载量等于上样样品中单克隆抗体的质量浓度与上样体积之积除以该亲和层析柱的填料体积。固有载量可以根据亲和层析填料的说明书获取。亲和填料的体积可根据加入的胶悬液的体积及亲和层析填料在胶悬液中的占比计算。
因为单克隆抗体的亲和层析纯化过程中,不同的亲和层析填料对不同的单克隆抗体的结合能力不同,纯化的效果也不相同,所以,单克隆抗体的亲和层析纯化需要筛选适合的亲和层析填料进行纯化。
进一步地,采用梯度稀释法将单克隆抗体配置成不同浓度的上样样品。
进一步地,将梯度稀释后的不同浓度的上样样品分别进行蛋白浓度检测,得到初始上样浓度。具体地,分别将梯度稀释后的上样样品置于多孔uv无吸收板的不同孔中,采用take3&96-well光程校正a280法(epoch,biotek)检测上样样品中单克隆抗体的浓度,得到上样样品的初始上样浓度。
s115、孵育。
具体地,分别将不同浓度的上样样品等体积加到微孔层析板上,然后孵育。进一步地,采用间歇震荡方式孵育。进一步地,在337.5rpm~675rpm转速(其林贝尔,qb-9001)下震荡30min~60min,暂停10s~60s,然后再震荡、暂停,重复3次~4次。
s117、检测单克隆抗体的含量。
具体地,将孵育完成的不同浓度的上样样品,离心,收集上清液,然后检测上清液中单克隆抗体的含量。通过上清液中单克隆抗体的含量,初步判断单克隆抗体与各亲和层析填料的静态结合能力。相同上样浓度的单克隆抗体,其上清液中单克隆抗体的含量越高,表示在该上样浓度下单克隆抗体与该亲和层析填料的静态结合能力越低,越不适合作为纯化此单克隆抗体的亲和层析填料。
进一步地,多次重复上样-孵育-离心-检测单克隆抗体的含量的步骤,直至检测到的数据平稳。重复上样-孵育-离心-检测的过程直至检测数据平稳,从而可以确定不同填料在不同孵育批次的吸附量,进而能够比较其载量和吸附快慢。
s130、根据亲和层析填料与单克隆抗体的动态结合能力,筛选适合于单克隆抗体的亲和层析填料。
具体地,步骤s130包括步骤s131~s135。
s131、上样并收集流穿液。
具体地,在相同的流速、保留时间下,将含有单克隆抗体的上样液分别连续上样到多个亲和层析柱中,使每个亲和层析柱过载。每个亲和层析柱中含有一种亲和层析填料,且至少有两个亲和层析柱中的亲和层析填料不同。将每个亲和层析柱的流穿液分别按照穿透的先后顺序分装为多个待测液。
进一步地,先根据各亲和层析填料的固有载量、上样时的单克隆抗体的浓度,计算过载时的上样液体积。每个亲和层析柱中,上样液体积与上样液中单克隆抗体的浓度之积大于亲和层析填料的固有载量与亲和填料体积之积,从而使得亲和层析柱过载。当然,此时上样液体积与亲和层析填料的单位一致,单克隆抗体的浓度与亲和层析固有载量的单位一致。然后连续上样至上样液体积时停止上样。自上样起开始收集流穿液,并按照穿透的先后顺序分装为多个待测液。进一步地,收集多个距离上样停止近的流穿液作为待测液。进步一地,每个亲和层析柱的多个待测液中至少一个待测液的单克隆抗体的浓度与上样液中单克隆抗体的浓度的比值为处于0.05~0.15之间。
进一步地,上样液中单克隆抗体的浓度相同。进一步地,上样液可以是包括单克隆抗体的发酵液上清,也可以是以单克隆抗体纯品制备的溶液。
s133、检测各个待测液中单克隆抗体的浓度。
具体地,分别将各亲和层析填料装填到多孔过滤板上,用平衡液平衡各所述亲和层析填料,得到微孔层析板。然后分别将各亲和层析柱的多个待测液等体积加到微孔层析板对应的孔中,得到多个待孵育液。然后将各待孵育液孵育、离心及洗脱,得到多个洗脱液。然后检测各洗脱液中单克隆抗体的浓度,得到各待测液中单克隆抗体的浓度。
进一步地,将各待孵育液孵育、离心,得到多个离心液,检测各离心液中的单克隆抗体的浓度,若离心液中的单克隆抗体的浓度与上样液中单体隆抗体的浓度的比值大于5%,则将离心液再次加入至微孔层析板对应的孔中进行孵育,然后离心、检测单克隆抗体的浓度,直至每个离心液中的单克隆抗体的浓度与上样液中单体隆抗体的浓度的比值不大于5%,得到吸附有单克隆抗体的微孔层析板。然后用洗脱缓冲液分别清洗吸附有单克隆抗体的微孔层析板的不同孔,得到多个洗脱液。然后再检测各洗脱液中的单克隆抗体的浓度,得到各待测液中单克隆抗体的浓度。
进一步地,在检测到每个离心液中的单克隆抗体的浓度与上样液中单体隆抗体的浓度的比值小于5%的步骤后,用洗脱缓冲液分别清洗吸附有单克隆抗体的微孔层析板的不同孔的步骤之前,还包括用平衡缓冲液清洗吸附有单克隆抗体的微孔层析板的步骤。具体地,用平衡缓冲液清洗吸附有单克隆抗体的微孔层析板,并抽滤弃上清,重复1次~3次后继续用平衡缓冲液对吸附有单克隆抗体的微孔层析板进行清洗,然后离心弃去上清液。上样液为含有单克隆抗体的发酵液时,发酵液中通常含有其他杂蛋白,此时,用平衡缓冲液清洗吸附有单克隆抗体的微孔层析板能够除去杂蛋白,便于洗脱液中单克隆抗体的检测。当然,可以理解的是,若上样液为以单克隆抗体纯品制备的溶液,可以不进行用平衡缓冲液清洗吸附有单克隆抗体的微孔层析板的步骤。
进一步地,采用take3&96-well光程校正a280法检测洗脱液中的单克隆抗体的浓度。
s135、根据各待测液中单克隆抗体的浓度,确定各种亲和层析填料对单克隆抗体的动态结合能力。根据动态结合能力筛选亲和层析填料。以动态结合能力大的亲和层析填料作为单克隆抗体的亲和层析填料。
具体地,计算每个待测液对应的上样总体积;计算每个待测液中单克隆抗体的浓度与上样液中单克隆抗体的浓度的比值;其中,在相同的上样浓度、相同的比值下,亲和层析填料对应的上样总体积大的亲和层析填料的动态结合能力大。
进一步地,以每个待测液中单克隆抗体的浓度与对应上样液中单克隆抗体的浓度的比值为纵坐标,按照时间先后顺序收集的待测液为横坐标绘制每种亲和层析柱中单克隆抗体的含量变化图。根据亲和层析填料的单克隆抗体的含量变化图,确定每种亲和层析填料对单克隆抗体结合能力,筛选适合该单克隆抗体的亲和层析填料。
上述亲和层析的填料的筛选方法至少具有以下优点:
(1)简便。含有单克隆抗体的上样液分别连续上样到多个亲和层析柱中,使亲和层析柱过载,并按照穿透的先后顺序将流穿液分装为多个待测液,通过比较待测液中的单克隆抗体的浓度,能够快速分析每种亲和层析填料对该单克隆抗体的动态结合能力,从而筛选得到适合该单克隆抗体的亲和层析填料。尤其是,在含有上样液中含有的单克隆抗体的浓度相同,待测液中单克隆抗体的浓度与上样液中单克隆抗体的浓度的比值相同的比值下,能够更快速的判断出各个亲和层析填料的动态结合能力大小,筛选出合适的亲和层析填料。
(2)节省时间。传统的筛选方法需要一次多个循环运行才能对单种层析填料进行评价。在层析填料筛选的初期,会涉及对多种层析填料保留时间的评价,整个筛选过程的工作量相当庞大。比如使用1ml体系对每种层析填料至少实施3次循环,共五种层析填料待筛选,每次上样以50mg/ml载量为准,则需5*3次=15次循环,需3天左右时间完成,整个过程不仅操作繁琐,还相当耗费时间。相比传统的筛选方法,上述亲和层析的填料的筛选方法结合高通量技术,同时运行多种亲和层析填料多个实验条件,实现多填料多条件下保留时间和结合载量的同时评估过程,评估过程被大大简化,使整个评估效率大大提高,操作也极大简化。
(3)节省样品及耗材。传统的筛选方法由于每种层析介质都需多轮循环上样检测,样品的消耗量是非常巨大。以上述每次上样以50mg/ml载量为例,则预计消耗样品50mg/次*15次=750mg,对于样品比较珍贵或者样品稳定性存在一定风险的前期开发来说,无疑加大了整个工艺开发的时间成本及材料成本。而上述亲和层析的填料的筛选方法每个实验条件的上样样品体积最小可减少至200μl,对于80mg/ml设计载量而言则仅需0.8mg蛋白,整个96孔板上样量不到50mg,样品消耗降低10倍以上,缓冲液消耗也更少,是一种极其经济的开发方法。
(4)采用传统评价方式,需要在上样过程中对流穿进行多次取样,则在此过程中所产生的流穿收集样品数将达百级以上,然后对各个收集样品实施分别检测,在纯化工艺开发初期,上样样品往往是发酵料液,这就使得在进行蛋白含量检测时不能直接采用a280法,而必须先经过纯化后再进行a280或hplc检测过程,对于样品数量在百级以上的样品而言,所带来的检测压力和挑战可想而知。上述亲和层析的填料的筛选方法,评估过程中收集到的多个流穿样品可一次性进行抗体含量评价,可以通过高通量检测,不再存在检测压力,对于时间和经济成本高居不下的抗体工艺开发来说,是一种快速经济的工艺开发方法。
具体实施例
采用96孔滤板(pall)及相应封板膜、震荡摇床(其林贝尔)、epoch(biotek,带take3微孔板)、96孔uv无吸收板(corning)、抽真空组件(pall)、超滤浓缩管(millipore)、秒表等进行高通量抗体含量检测,其中涉及到层析时以1*pbs(10mmpb,150mmnacl,ph7.4)为平衡缓冲液(buffera),以20mmnaac,ph3.4为洗脱缓冲液(bufferb1),以0.1mnaoh(bufferb2)为清洗缓冲液来进行。
实施例1
(1)样品预处理及梯度浓度样品稀释:取80mgpd1(programmedcelldeathprotein1)单克隆抗体(自产,深圳市菲鹏生物制药股份有限公司),经超滤浓缩管(millipore,
(2)梯度浓度样品稀释:将单克隆抗体的浓度为4mg/ml记作spl1,即为载量80mg/ml样品,spl1的体积为11ml。取2.625mlspl1,加入375μlpbs,混匀,记作spl2,即为载量70mg/ml样品。取2.25mlspl1,加入75μlpbs,混匀,记作spl3,即为载量60mg/ml样品。取1.875mlspl1,加入1125μlpbs,混匀,记作spl4,即为载量50mg/ml样品。取3mlspl1,加入3mlpbs,混匀,记作spl5,即为载量40mg/ml样品。取1.125mlspl1,加入1875μlpbs,混匀,记作spl6,即为载量30mg/ml样品。取3mlspl5,加入3mlpbs,混匀,记作spl7,即为载量20mg/ml样品。取3mlspl7,加入3mlpbs,混匀,记作spl8,即为载量10mg/ml样品。
(3)胶悬液制备:取5支15ml离心管,分别装入5种亲和层析填料,该亲和层析填料分别来源于gemabselectsure(下文记作“resina”)、mabselectsurelx(下文记作“resinb”)、merckeshmunoa(下文记作“resinc”)、tosohtoyapearlaf-rproteinahc-650f(下文记作“resind”)、bestchromatproteinadiamond)(下文记作“resine”),每种亲和层析填料的体积为2ml,配平后离心(175g*5min)。静置3min~5min,根据离心管上的刻度吸出或继续加入一定体积的20%etoh,使最终各离心管内亲和层析填料的体积浓度均为50%,重悬均匀,得胶悬液。
(4)铺板:用排枪重悬步骤(3)的50%胶浓度的胶悬液后,按照表1所示的位置,以20μl/孔加入对应的96孔滤板(pall)中(20μl/孔胶悬液对应于10μl/孔的亲和层析填料的体积)。
表1
(5)清洗及平衡:先超纯水、再用1*pbs(10mmpb,150mmnacl,ph7.4)平衡缓冲液(buffera)对步骤(4)得到的铺板完成的96孔滤板的所有孔以0.2ml/孔清洗3次,每次清洗后直接抽滤去除清液,最后一次平衡后离心去清液,得到96孔滤板。
(6)上样:按照230μl/孔将spl1~spl8转移至洁净96孔uv无吸收板(corning)对应孔内,96well光程校正法a280检测,得到初始上样样品浓度。然后将96孔板内的spl1~spl8样品用排枪以200μl/孔转移至步骤(5)得到的96孔滤板内。
(7)孵育及流穿抗体含量检测:675rpm转速下震荡,以使样品和填料能充分混匀,孵育30min后暂停,150g*5min离心,收集离心后的上清液,用96-well光程校正法&take3a280法测定上清液中未结合蛋白的浓度,查看上清液中未结合蛋白情况。然后,继续将收集到的上清液上样,同样孵育,675rpm转速下震荡(震荡摇床,其林贝尔,qb-9001),30min后暂停,150g5min离心,收集离心收集上清液,用96-well光程校正法&take3a280法进行浓度测定,查看上清液中未结合蛋白情况。重复上述孵育-上样-浓度检测过程共五次,所得上清液分别记作ft1~ft5(穿透次数编号)。根据每次的上清液中未结合蛋白情况绘制各层析填料中单克隆抗体浓度占上样样品中单克隆抗体的浓度比例,结果如图1~图8所示。
经检测,spl8~spl1的初始上样浓度分别为0.749mg/ml、1.455mg/ml、2.188mg/ml、2.863mg/ml、3.496mg/ml、3.963mg/ml、4.238mg/ml及4.423mg/ml,样品载量等于初始上样浓度与上样体积之积除以亲和层析填料体积,spl8~spl1对应的实际载量分别为14.9mg/ml、29.1mg/ml、43.7mg/ml、57.2mg/ml、69.9mg/ml、79.2mg/ml、84.7mg/ml、88.4mg/ml。
由图1~图8可知,resine和resind在多个上样浓度条件下,都表现出了更强的吸附能力,预示resine和resind具有高的吸附效率。resinb在<60mg/ml载量时,是吸附最慢的填料,resinb在高载量有改观。resinc总体上结合效率均低于其它填料。resinb、resind有较高的静态结合能力,其次是resine,resina与resinc的静态结合能力相对较低些。
实施例2
对resinb亲和层析填料的1ml柱,分别进行下述步骤:
(1)样品泵预先充满上样液:将buffer、上样口s、a1预先用buffera清洗,并在低流速、层析柱置by-pass状态下将样品小心泵入样品泵s,直至紫外出峰,不再对上样泵进行wash,同时对a泵再次wash,使样品泵内充满待上样料液。(2)设定保留时间=3min,以0.33ml/min流速连续上样,其中流穿液采用96孔板自上样开始以1.5ml/管进行收集,上样至设定体积(33.13ml)即停止上样,不进行样品泵buffer管路润洗及samplepumpwash。其中,将上述收集到的流穿自上样结束后前推30个样品作为待测液,自前往后分别对应编号为resinbft1~ft30。然后常规方法洗脱亲和层析柱。
(3)对resind和resine这两种亲和层析填料的1ml柱也分别进行步骤(1)~(2)相应的操作,收集到的流穿液自上样结束后前推30个样品作为对应的待测液,自前往后分别对应编号为resindft1~ft30、resineft1~ft30。
(4)待测液中抗体含量高通量测定:将空的96孔滤板参照实施例1的步骤(4)~(5)进行铺板、清洗及平衡得到用于测量待测液中单克隆抗体的96孔滤板。其中,96孔滤板的位置设置如表2所示(不设复孔)。然后分别将20μl步骤(2)得到流穿液resinbft1~ft30和步骤(3)得到的resindft1~ft30、resineft1~ft30流穿液对应加入用于测量流穿液中抗体的96孔滤板。其中,1.2mg/ml、0.6mg/ml、0.1mg/ml的proteina亲和洗脱样品(自产,深圳市菲鹏生物制药股份有限公司)为阳性对照。接着采用675rpm转速震荡,每10min暂停15s,孵育2h,之后150g*5min离心,采用96-well光程校正法测定穿透液中未结合的单克隆抗体的浓度。若穿透液中未结合的单克隆抗体的浓度与上样样品中该单克隆抗体的浓度的比值大于5%,则重复上样并继续以同样方式孵育1h。然后将结合有单克隆抗体的96孔滤板进行后续清洗、洗脱、cip、检测,得到每个待测液中单克隆抗体的浓度。
表2
根据resinb、resind和resine的各待测液中的单克隆抗体的含量、体积及对应的上样总体积,计算每个待测液中单克隆抗体的浓度与上样液中单克隆抗体的浓度的比值,并绘制每种亲和层析填料的流穿液中的单克隆抗体的含量变化图。
结果:resind、resine和resinb的层析图谱分别如图9~图11所示。图9~图11中,uv1_280表示280nm下的紫外吸收(mau),cond表示电导率(ms/cm),ph表示ph值。resine、resind和resinb的流穿液中的单克隆抗体的含量变化如图12所示。
由图12可知,在保留时间为3min时,resind、resine的dbc10%较高。约70mg单克隆抗体/ml填料,而resinb的dbc10%较低,约31mg单克隆抗体/ml填料。
因此,resind、resine在该保留时间下更适合作为目标单克隆抗体的亲和层析纯化填料。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!