一种检测A、B、J和K亚群禽白血病病毒的多重PCR引物组、试剂盒及方法与流程
本发明属于生物技术检测领域,具体涉及一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法。
背景技术:
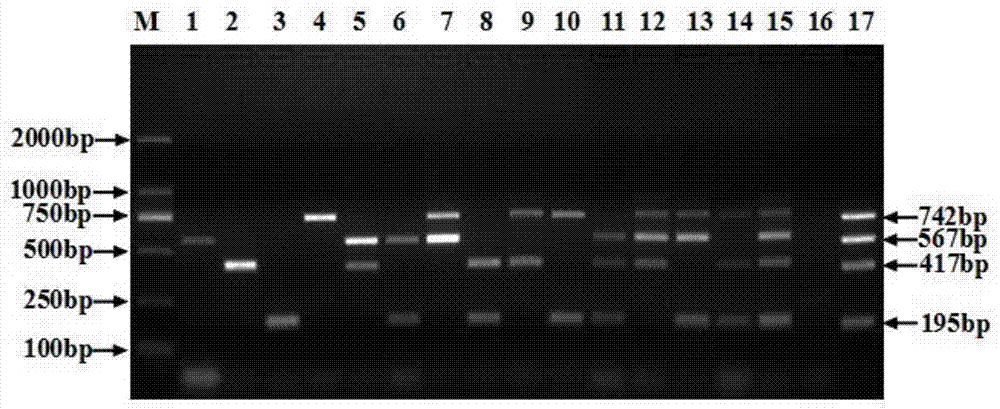
禽白血病病毒(avianleukosisvirus,alv)属于反转录病毒科α反转录病毒属成员,感染禽类能够引起多种肿瘤性疾病。根据病毒囊膜蛋白抗原性差异、病毒干扰实验及宿主范围,alv可分为a~k11个亚群(alv-a~k)。自然感染鸡的有a~e和j亚群,近年来又从我国地方品种鸡中分离并鉴定了k亚群禽白血病病毒(alv-k)。其中,alv-e为内源性病毒,对鸡不致病或致病性很弱。除alv-e外,其它均为外源性病毒。alv-a和alv-b在我国不同类型鸡群中普遍存在;alv-c和alv-d自然感染病例很少见到;alv-j与其它亚群病毒抗原性差异最大,且致病性和传染性最强,是发病鸡群中分离率最高的亚群。前六个亚群alv是欧美国家学者从该国饲养的主要类型鸡群中分离鉴定的;而alv-k是2012年我国学者从国内特有的地方品种鸡群首次分离鉴定的。经调查,alv-k在我国黄羽肉鸡和地方品种鸡中具有较高分离率,可能是我国或东亚地区地方品种鸡群中固有的亚群。alv感染鸡群后,可诱发多种多样的肿瘤。alv-j感染时最常见肝脏的骨髓细胞样瘤和皮肤血管瘤引起的死亡;其它亚群alv感染时,最常见内脏的淋巴细胞瘤及纤维肉瘤;alv-k复制能力相对弱,往往被其它亚群alv感染所掩盖而被忽视。这些肿瘤发生通常有较长的潜伏期,4~6个月甚至更长,是逐渐发展的慢性肿瘤。临床也会出现急性肿瘤,但比较少见。感染鸡可因肿瘤而导致死亡,死亡率一般为1%~2%,有的甚至更高。但大多数感染鸡仅表现亚临床症状,包括免疫抑制、生长迟缓、产蛋下降等。实际上,由alv感染后的亚临床病理作用带来的经济损失,可能大于临床上显示肿瘤性死亡带来的损失,严重危害了我国养鸡业的健康发展。禽白血病是垂直传播性疾病,控制该病最有效的措施是对鸡群进行种源净化,建立无外源性alv感染的种鸡核心群。其主要手段是通过对种鸡核心群定期进行外源性alv检测,及时淘汰阳性鸡,以净化和消除鸡群中的外源性alv。因此,高效、快速、便捷的检测方法有利于控制alv的传播。国内外对alv的检测和鉴定方法主要有病毒分离、elisa、间接免疫荧光试验、pcr等。病毒分离方法最可靠,但检测周期长,需要与其它方法配合才能鉴定亚群。群特异性抗原elisa检测方法在我国临床上应用最广,操作相对简便,有商品化试剂盒可以使用,但不能区分内源性和外源性alv。间接免疫荧光试验比较直观,但需要用到特异性单抗。针对alv的pcr方法已有报道,但多为鉴定一种亚群的单一pcr。多重pcr可在同一体系中同时扩增多个目的基因,节省时间和成本,检测效率显著高于单一pcr。已有报道建立了针对alv-a、alv-b和alv-j的多重pcr方法,但对于目前新鉴定且在黄羽肉鸡和地方品种鸡中广泛流行的alv-k并未涉及。技术实现要素:本发明的目的是针对现有禽白血病病毒检测技术的不足,提供一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法。采用本发明的引物组、试剂盒及方法检测alv,灵敏度高、特异性强、操作简便。本发明通过以下技术方案实现上述目的:本发明设计了一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组,包括一条针对alv的通用上游引物pf,由seqidno.1所示;一条针对alv-a的下游引物ar,由seqidno.2所示;一条针对alv-b的下游引物br,由seqidno.3所示;一条针对alv-j的下游引物jr,由seqidno.4所示;一条针对alv-k的下游引物kr,由seqidno.5所示。本发明构建了alv-a、alv-b、alv-j和alv-k标准质粒pmd19a、pmd19b、pmd19j和pmd19k,混合后作为多重pcr阳性对照dna模板。利用本发明设计的引物组,通过多重pcr确定最适模板浓度和最佳引物浓度。本发明组装了一种检测a、b、j和k亚群禽白血病病毒的多重pcr检测试剂盒,内容包括检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、premixextaqdna聚合酶、无菌双蒸水及阴阳性对照质粒dna模板。其中,多重pcr引物组,pf、ar、br、jr和kr引物浓度为5μmol/l,在pcr反应体系中,pf引物终浓度为0.2μmol/l,ar、br、jr和kr引物终浓度为0.1μmol/l;premixextaqdna聚合酶浓度为0.05u/μl,在pcr反应体系中,其终浓度为0.025u/μl;阴、阳性对照质粒dna模板浓度2.5×106拷贝/μl,在pcr反应体系中,其终浓度为1×105拷贝/μl。使用本发明组装的试剂盒,对多重pcr退火温度、循环数等反应条件进行了优化,并对其特异性、敏感性及重复性进行了验证,最终建立了检测a、b、j和k亚群禽白血病病毒的多重pcr方法,包括如下步骤:(1)病毒分离及基因组提取:无菌采集抗凝血,推入1.5ml灭菌离心管,1500r/min离心3min,取上清血浆接种df-1细胞;病料样品用含青链霉素的灭菌pbs研磨后,4℃、10000r/min离心10min,取上清接种df-1细胞;精液、蛋清样品用含青链霉素的灭菌pbs/dmem培养基做1:4~1:8倍稀释后,4℃、10000r/min离心10min,取上清接种df-1细胞;上述样品接种df-1细胞后,37℃、5%二氧化碳培养箱反应2h;pbs润洗一遍,加入1%胎牛血清dmem培养基维持培养7~9d;收集df-1细胞,采用dnaiso试剂提取前病毒dna作为pcr待检测模板。(2)多重pcr反应:25μl反应体系中,premixextaqdna聚合酶12.5μl,pf引物1μl,ar、br、jr和kr引物各0.5μl,待检测dna模板1μl,无菌双蒸水8.5μl。同时各取1μl阴、阳性质粒dna作为模板,设置阴、阳性对照。pcr仪进行扩增反应,反应条件为:95℃预变性1min;95℃变性30s,56℃退火30s,72℃延伸1min,共30个循环;最后72℃延伸5min,降温至4℃结束。(3)结果判断:取pcr扩增产物5μl,用2%琼脂糖凝胶进行电泳分析,在紫外灯照射下进行观察。阴性对照未有特异性扩增条带,而阳性对照分别在195bp、417bp、567bp及742bp位置出现四条特异性扩增条带,实验有效。检测样品如果在567bp位置出现单一扩增条带,则说明样品存在a亚群禽白血病病毒感染;如果在417bp位置出现单一扩增条带,则说明样品存在b亚群禽白血病病毒感染;如果在195bp位置出现单一扩增条带,则说明样品存在j亚群禽白血病病毒感染;如果在742bp位置出现单一扩增条带,则说明样品存在k亚群禽白血病病毒感染;如果在195bp、417bp、567bp及742bp位置出现两条、三条或四条扩增条带,则说明样品存在相对应的二重、三重或四重混合感染。与现有技术相比,本发明具有如下有益效果:(1)本发明设计的多重pcr引物组,通过共用一条alv通用上游引物,减少了多重pcr反应体系中引物数量,降低了反应中引物间互相干扰,提高了多重pcr的特异性。(2)本发明的多重pcr检测试剂盒设置了阴、阳性对照质粒模板,既可以用于验证因操作失误或pcr反应体系污染而引起的假阴性或假阳性结果,又可以作为参考marker用于结果判断,保证了试剂盒的可靠性。(3)本发明的多重pcr检测试剂盒,通过一个pcr反应,就能从样品中同时检测出目前国内养禽场主要流行、也是危害最为严重的外源性alv,包括alv-a、alv-b、alv-j和alv-k。具有操作简便、特异性强、敏感性高等优点,可节约时间、人力和物力成本,适合批量样品的检测,也适用于外源性alv的初步鉴定。附图说明图1为多重pcr对不同亚群alv标准质粒模板扩增的电泳结果图。图2为多重pcr对不同病毒dna或cdna模板扩增的特异性试验电泳结果图。图3为多重pcr对不同拷贝alv标准质粒混合模板扩增的敏感性试验电泳结果图。图4为多重pcr对不同浓度alv前病毒dna混合模板扩增的敏感性试验电泳结果图。图5为多重pcr对临床血浆样品前病毒dna检测的电泳结果图。图6为多重pcr对临床病料样品前病毒dna检测的电泳结果图。具体实施方式下面结合具体实施例来进一步阐述本发明。但这些实施例仅用于解释本发明,而非用于限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的试剂耗材等,如无特殊说明,均可从商业途径购买获得。实施例1一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组设计、试剂盒组装及方法建立1、引物的设计与合成根据genbank已发表的alv-a、alv-b、alv-j和alv-k参考株基因序列设计多重pcr引物组:在各亚群间均相对保守的pol基因序列设计一条通用上游引物pf;在亚群内相对保守,但在各亚群间差异较大的gp85基因序列,分别设计4条下游引物,alv-a下游引物ar,alv-b下游引物br,alv-j下游引物jr及alv-k下游引物kr,引物序列见表1。引物由上海生工生物工程有限公司合成。seqidno.引物名称引物序列(5’→3’)扩增片段大小(bp)扩增病毒1pfggagaagacacccttgctg2argaaagggaggattgtctaaggag567alv-a3brgaacccaacagttgtagttctgat417alv-b4jrggtgaggtcgctgactgtagact195alv-j5krtgtgcgtgtgcacccggtct742alv-k2、标准质粒样品的构建以临床分离并经测序鉴定的alv-a、alv-b、alv-j和alv-k分离株js15ajh03、js15bj01、js15yxb01和js17lk01前病毒dna为模板,分别使用通用上游引物和各亚群特异性下游引物进行pcr扩增,胶回收pcr产物,连接pmd19-t载体并转染jm109感受态细胞,同时设置阴性对照,划线接种含氨苄的lb固体培养皿,挑选菌落增菌培养,菌液经pcr鉴定后,用质粒提取试剂盒提取质粒,阳性样品分别命名为pmd19a、pmd19b、pmd19j和pmd19k,阴性对照亦提取质粒,测定质粒浓度。3、引物浓度和标准质粒样品浓度的确定用30%te缓冲液分别稀释引物pf、ar、br、jr及kr至10μmol/l、5μmol/l、2.5μmol/l、1.25μmol/l、0.625μmol/l、0.3125μmol/l,使用0.5~2.0μl引物量,以构建的标准质粒pmd19a、pmd19b、pmd19j和pmd19k混合物作为模板,进行多重pcr反应,摸索引物最适配比及浓度。结果,pf、ar、br、jr和kr引物浓度5μmol/l;在25μl反应体系中,pf引物取1μl,终浓度为0.2μmol/l;ar、br、jr和kr引物各取0.5μl,终浓度为0.1μmol/l,pcr反应后各扩增条带最为清晰明亮。用30%te缓冲液分别稀释标准质粒pmd19a、pmd19b、pmd19j和pmd19k至1×109拷贝/μl,等比例混合后,再做梯度稀释至单模板浓度2.5×108~2.5×104拷贝/μl,各取1μl,以最适引物浓度进行多重pcr反应,确定阳性对照质粒样品的最佳浓度。结果,当阳性对照质粒样品浓度为2.5×106拷贝/μl,终浓度为1×105拷贝/μl时,各扩增条带清晰度最高。4、退火温度和循环数的确定多重pcr反应体系确定后,对其反应条件进行了优化,包括退火温度和循环数。退火温度设置50.0℃、50.7℃、51.8℃、53.6℃、55.7℃、57.8℃、59.9℃、61.9℃、64.1℃、65.8℃、67.1℃、68.0℃共12个梯度,循环数设置为20、25、30、35、40共5个梯度。结果,多重pcr反应退火温度55.7℃~61.9℃,30个循环以上,扩增效果较好。则确定本发明的多重pcr反应退火温度为56℃,30个循环。5、多重pcr检测试剂盒的组装该试剂盒由引物组、dna聚合酶、阴阳性对照质粒模板、无菌双蒸水构成,其具体组分如下:5μmol/lpf、ar、br、jr和kr引物,0.05u/μlpremixextaqdna聚合酶,2.5×106拷贝/μl阴、阳性对照质粒dna模板。6、多重pcr检测方法的建立(1)病毒分离及基因组提取:无菌采集抗凝血,推入1.5ml灭菌离心管,1500r/min离心3min,取上清血浆接种df-1细胞;病料样品用含青链霉素的灭菌pbs研磨后,4℃、10000r/min离心10min,取上清接种df-1细胞;精液、蛋清样品用含青链霉素的灭菌pbs/dmem培养基做1:4~1:8倍稀释后,4℃、10000r/min离心10min,取上清接种df-1细胞;上述样品接种df-1细胞后,37℃、5%二氧化碳培养箱反应2h;pbs润洗一遍,加入1%胎牛血清dmem培养基维持培养7~9d;收集df-1细胞,采用dnaiso试剂提取前病毒dna作为pcr待检测模板。(2)多重pcr反应:25μl反应体系中,premixextaqdna聚合酶12.5μl,pf引物1μl,ar、br、jr和kr引物各0.5μl,待检测dna模板1μl,无菌双蒸水8.5μl。同时各取1μl阴、阳性质粒dna作为模板,设置阴、阳性对照。pcr仪进行扩增反应,反应条件为:95℃预变性1min;95℃变性30s,56℃退火30s,72℃延伸1min,共30个循环;最后72℃延伸5min,降温至4℃结束。(3)结果判断:取pcr扩增产物5μl,用2%琼脂糖凝胶进行电泳分析,在紫外灯照射下进行观察。如图1所示,泳道16阴性对照未有特异性扩增条带,而泳道17阳性对照分别在195bp、417bp、567bp及742bp位置出现四条特异性扩增条带,实验有效。检测样品如果在567bp位置出现单一扩增条带,则说明样品存在alv-a感染(泳道1);如果在417bp位置出现单一扩增条带,则说明样品存在alv-b感染(泳道2);如果在195bp位置出现单一扩增条带,则说明样品存在alv-j感染(泳道3);如果在742bp位置出现单一扩增条带,则说明样品存在alv-k感染(泳道4);如果在195bp、417bp、567bp及742bp位置出现两条、三条或四条扩增条带,则说明样品存在相对应的alv二重、三重或四重混合感染(泳道5~15)。实施例2一种检测a、b、j和k亚群禽白血病病毒的多重pcr试剂盒特异性试验使用实施例1构建的多重pcr试剂盒及方法,提取alv-a、alv-b、alv-j和alv-k分离株前病毒dna,同时以实验室保存的h9亚型禽流感病毒(aiv)cdna、新城疫病毒(ndv)cdna、马立克氏病病毒(mdv)dna、禽网状内皮组织增生症病毒(rev)cdna、传染性支气管炎病毒(ibv)cdna及禽呼肠孤病毒(arv)cdna作为模板,进行多重pcr特异性试验。结果如图2所示,泳道12阴性对照无特异性扩增条带,泳道13阳性对照在195bp、417bp、567bp及742bp位置有四条特异性扩增条带,实验有效。泳道1~5分别为alv-a、alv-b、alv-j、alv-k前病毒dna及四个亚群alv前病毒dna混合物多重pcr扩增产物,均能扩增出与目的片段相符的条带。而泳道6~11分别为aiv、ndv、mdv、rev、ibv及arvcdna或dna多重pcr产物,均未扩增出特异性条带。以上结果说明本发明的一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法可以特异性地检测出alv-a、alv-b、alv-j和alv-k。实施例3一种检测a、b、j和k亚群禽白血病病毒的多重pcr试剂盒敏感性试验使用实施例1构建的多重pcr试剂盒及方法,将阳性标准质粒pmd19a、pmd19b、pmd19j和pmd19k混合后,做10倍梯度稀释,1×109~1×100拷贝/μl;同时将alv-a、alv-b、alv-j和alv-k分离株前病毒dna混合后,亦做10倍梯度稀释,100ng/μl~0.1fg/μl,以此作为模板,进行多重pcr敏感性试验。结果如图3和图4所示,对于图3质粒模板,泳道1~10分别对应了1×109、1×108、1×107、1×106、1×105、1×104、1×103、1×102、1×101、1×100拷贝/μl阳性标准质粒,当质粒模板浓度为1×103拷贝/μl时,多重pcr仍能扩增出alv-a、alv-b、alv-j和alv-k四条特异性条带;对于图4前病毒dna模板,泳道1~10分别对应了100ng/μl、10ng/μl、1ng/μl、100pg/μl、10pg/μl、1pg/μl、100fg/μl、10fg/μl、1fg/μl、0.1fg/μl前病毒dna,当前病毒dna模板浓度为100pg/μl时,多重pcr仍能扩增出alv-a、alv-b、alv-j和alv-k四条特异性条带。以上结果说明本发明的一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法具有较高的敏感性,能对1×103拷贝/μl质粒混合模板和100pg/μl前病毒dna混合模板做出检测。实施例4多重pcr试剂盒对临床样品的检测按照实施例1构建的多重pcr试剂盒及方法,对从地方品种鸡采集的99份血浆样品及18份肝、脾、肾等肿瘤样品进行病毒分离及前病毒dna提取,以此作为模板进行多重pcr检测。结果如图5和图6所示,图5为血浆样品前病毒dna多重pcr检测结果,图6为病料样品前病毒dna多重pcr检测结果。图5中,泳道16为阴性对照,泳道17为阳性对照,泳道1~15为血浆样品。图6中,泳道16为阴性对照,泳道17为阳性对照,泳道1~15为病料样品。可以看到,血浆样品禽白血病感染类型比较多样,既有alv-a、alv-b、alv-j和alv-k的单一感染,又存在alv-j与alv-k、alv-b与alv-j的二重感染,以及alv-a、alv-b与alv-j/alv-k等的三重感染。相对来说,病料样品禽白血病感染类型更为简单。但无论血浆还是病料,alv-j单一感染最为普遍,阳性率45.3%(53/117);其次为alv-j与alv-k的二重感染,阳性率20.5%(24/117);再次为alv-k的单一感染,阳性率16.2%(19/117)。实验结果进一步证实了alv-k在地方品种鸡中流行的普遍性。对其中48个分离株分别进行alv-a、alv-b、alv-j和alv-k单一pcr,多重pcr与其符合率97.9%。由此可见,本发明的一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法在外源性alv检测及初步鉴定中,具有良好的应用效果和显著优势。序列表<110>江苏省家禽科学研究所<120>一种检测a、b、j和k亚群禽白血病病毒的多重pcr引物组、试剂盒及方法<160>5<170>siposequencelisting1.0<210>1<211>19<212>dna<213>禽白血病病毒(avianleukosisvirus)<400>1ggagaagacacccttgctg19<210>2<211>23<212>dna<213>禽白血病病毒(avianleukosisvirus)<400>2gaaagggaggattgtctaaggag23<210>3<211>24<212>dna<213>禽白血病病毒(avianleukosisvirus)<400>3gaacccaacagttgtagttctgat24<210>4<211>23<212>dna<213>禽白血病病毒(avianleukosisvirus)<400>4ggtgaggtcgctgactgtagact23<210>5<211>20<212>dna<213>禽白血病病毒(avianleukosisvirus)<400>5tgtgcgtgtgcacccggtct20当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1