一种提取富含果胶类多糖植物DNA的试剂盒及方法与流程
本发明属于基因工程技术领域,具体涉及一种提取富含果胶类多糖植物dna的试剂盒及方法。
背景技术
在分子生物学实验中,从细胞中分离提取的dna质量对于许多后续分子生物学实验至关重要,例如,限制性酶切分析、southern印迹、dna文库的构建等实验的成败在很大程度上取决于dna的质量,而提取方法是影响dna质量的一个重要因素。目前,在植物基因组dna的提取中,最常用的方法是经典的ctab(cetyl-trimethyl-ammoniumbromide,十六烷基三甲基溴化铵)法、sds(sodiumdodecylsulfate,十二烷基硫酸钠)法,但这些方法通常只适用于含多糖多酚等次生物质较低的植物。由于不同物种以及同一物种不同组织所含内含物的差异,导致其dna提取难易程度不同。比如对于富含多糖、多酚类物质的顽拗植物(如西南桦、黄秋葵),利用这些常规操作则很难获得高质量的dna,甚至无法获得dna。
曾杰等(2002)以西南桦为例发展了一种顽拗植物dna制备方案。此方案首先用不含裂解液的tris-hcl缓冲液洗去细胞匀浆中大部分多糖和其他次生物质。近年来,此法在其它顽拗植物基因组dna提取中得以借鉴和参考。如黄捷等(2008)在提取黄秋葵基因组dna时,采用不含ctab的缓冲液除去大部分的多糖,随后采用两步沉淀法,即先用异丙醇沉淀,再用乙醇沉淀,去除剩余的多糖。此法操作步骤繁琐,耗时秏力,难以适应科研快速发展的需求。黄秋葵是含果胶类多糖极高的顽拗植物。manoj-kumara等(2012)报道了一种改良的ctab法结合果胶酶消化果胶,提取黄秋葵基因组dna的方法。此法虽能获得高质量的dna,但也存在操作步骤繁琐、耗时长,实验成本高等缺点。
常规的ctab法和sds法在用异丙醇或无水乙醇沉淀dna时,果胶类多糖会与dna结合形成复合物,一起被沉淀,使得dna包埋其中而难以溶解,或溶解后产生黏稠状的溶液。使用常规试剂盒时,大量的多糖会堵塞吸附柱,提取的dna量极低,甚至不能获得dna。因此,采用现有技术难于从富含果胶类多糖的植物中获得高质高量的基因组dna。
技术实现要素:
鉴于此,本发明为了解决上述存在之不足,提供一种提取富含果胶类多糖植物dna的试剂盒及方法,主要对富含多糖、多酚以及其他大量次生代谢物的植物dna进行高效提取,使得提取的dna质量高。本发明具有成本低、操作简便快捷、高质高效、适用性广等特点。
本发明的发明人通过长期的探索尝试以及多次的实验和努力,不断改革与创新,为解决以上技术问题,所采用的具体技术方案是提供一种提取富含果胶类多糖植物dna的试剂盒及方法。
本发明首先提供了一种提取富含果胶类多糖植物dna的试剂盒,其组成包括:
去糖缓冲液:tris-hcl,nacl,edta,β-巯基乙醇;
裂解液:ctab,tris-hcl,edta,nacl,β-巯基乙醇;
抽提液:氯仿,异戊醇;
过柱缓冲液:盐酸胍,tris-hcl,edta;
去蛋白液:盐酸胍,tris-hcl,乙醇;
漂洗液:nacl,tris-hcl,乙醇;
洗脱液:tris-hcl,edta;
dna吸附柱。
根据本发明所述的一种提取富含果胶类多糖植物dna的试剂盒,其进一步的技术方案是:
所述去糖缓冲液由100mmol/l—200mmol/ltris-hcl,150mmol/l—250mmol/lnacl,20mmol/l—50mmol/ledta,0.5%—2%β-巯基乙醇组成;
裂解液由2%—3%ctab,100mmol/ltris-hcl,25mmol/ledta,1.5mol/lnacl,0.5%—2%β-巯基乙醇组成;
抽提液:氯仿与异戊醇的体积比为24:1;
过柱缓冲液由4mmol/l—6mmol/l盐酸胍,20mmol/l—50mmol/ltris-hcl,5mmol/l—10mmol/ledta组成,ph为4.5-6.8;
去蛋白液由4mmol/l—6mmol/l盐酸胍,10mmol/l—20mmol/ltris-hcl,30%-40%乙醇组成,ph为6.5;
漂洗液由10mmol/l—20mmol/lnacl,10mmol/l—20mmol/ltris-hcl,70%-80%乙醇组成,ph为7.5;
洗脱液由1mmol/l—10mmol/ltris-hcl,0.1mmol/l—1mmol/ledta组成,ph为8.0-8.5。
根据本发明所述的一种提取富含果胶类多糖植物dna的试剂盒,其进一步的技术方案是:
所述去糖缓冲液由200mmol/ltris-hcl,250mmol/lnacl,50mmol/ledta,1%β-巯基乙醇组成;
裂解液由3%ctab,100mmol/ltris-hcl,25mmol/ledta,1.5mol/lnacl,1%β-巯基乙醇组成;
抽提液:氯仿与异戊醇的体积比为24:1;
过柱缓冲液由5mol/l盐酸胍,50mmol/ltris-hcl,10mmol/ledta组成,ph为6.5;
去蛋白液由5mol/l盐酸胍,20mmol/ltris-hcl,38%乙醇组成,ph为6.5;
漂洗液由20mmol/lnacl,20mmol/ltris-hcl,75%乙醇组成,ph为7.5;
洗脱液由10mmol/ltris-hcl,1mmol/ledta组成,ph为8.5。
根据本发明所述的一种提取富含果胶类多糖植物dna的试剂盒,其进一步的技术方案是:去糖缓冲液和裂解液中的tris-hcl缓冲液和edta溶液的ph值为8.0-8.5。
根据本发明所述的一种提取富含果胶类多糖植物dna的试剂盒,其进一步的技术方案是:β-巯基乙醇在去糖缓冲液和裂解液使用时加入。
根据本发明所述的一种提取富含果胶类多糖植物dna的试剂盒,其进一步的技术方案是:所述dna吸附柱为硅胶膜吸附柱。
一种提取富含果胶类多糖植物dna的方法,依次包括以下步骤:
(1)样品处理:将新鲜植物样品研碎,收集到离心管中备用;
(2)去多糖:向离心管中加入去糖缓冲液和β-巯基乙醇混合均匀,离心,弃上清液,收集沉淀;
(3)裂解:向沉淀中加入裂解液、rnasea和β-巯基乙醇混合均匀,离心,收集上清液;
(4)去蛋白:向上清液中加入等体积的抽提液,颠倒混匀,离心,取上清,得到dna粗提液;
(5)向粗提液中加入等体积的过柱缓冲液,颠倒混匀;将dna吸附柱放入收集管中,取部分混合液加入吸附柱中静置,离心,弃滤液;再将剩余的混合液加入吸附柱中静置,离心,弃滤液;
(6)dna纯化:先向上述吸附柱中加入去蛋白液来清洗吸附柱,离心倒掉废液;再加入漂洗液,离心倒掉废液;
(7)回收dna:将上述吸附柱转移至新的离心管中,然后加入预热的洗脱液,先静置,再离心,即得dna样品。
根据本发明所述的一种提取富含果胶类多糖植物dna的方法,其进一步的技术方案是:步骤(1)中研磨时加入液氮。
根据本发明所述的一种提取富含果胶类多糖植物dna的方法,其进一步的技术方案是:步骤(2)中去糖缓冲液要在4℃预冷后加入,混合均匀后,将溶液放入4℃冰箱10min。
根据本发明所述的一种提取富含果胶类多糖植物dna的方法,其进一步的技术方案是:步骤(3)中裂解液要在65℃下预热后加入,且混合均匀后,在65℃温浴40min。
本发明的原理:顽拗植物含有大量的、种类繁多的次生物质,如多糖、多酚、单宁等等,这些次生物质在dna提取的过程中易与dna共沉淀,形成黏稠的胶状物难以溶解或产生褐变,影响dna的质量、得率以及抑制后续实验如限制性酶切和pcr反应中酶的活性。植物材料经研磨之后,其细胞壁已破碎,果胶类多糖已释放出来,此时加入去糖缓冲液溶解多糖及其它次生代谢物,再通过低速离心,弃上清可去除多糖等杂质。酚类物质经氧化后易与dna共价结合引起褐变,使dna失活;为了有效去除酚类,在去糖缓冲液和ctab提取缓冲液中均加入β-巯基乙醇,防止酚氧化,使之被有效的去除。过柱缓冲液提供了一个高盐低ph值的环境,有利于硅基质与dna的结合,提高dna的得率。漂洗液含75%的酒精可以对硅胶柱脱盐。洗脱液为低盐高ph溶液,能将硅胶膜上的dna洗脱。
与现有技术相比,本发明的技术方案具有如下优点:
1.一种提取富含果胶类多糖植物dna的试剂盒及方法,主要对富含多糖、多酚等大量次生代谢物的植物dna进行高效提取,使得提取的dna质量高。该法具有成本低、操作简便快捷、高质高效、适用性广等特点。
2.本发明在去糖缓冲液和裂解液中添加抗氧化剂β-巯基乙醇,能够有效地防止溶液中酚氧化成醌,避免了在去多糖和裂解过程中次生质褐化。
3.本发明采取了在用裂解液裂解细胞膜前加入去糖缓冲液,用以洗去植物中绝大部分的次生代谢产物,防止其与dna形成复合体一起被沉淀,避免dna被多糖包埋而难以溶解、致使dna溶液黏稠度高。通过添加去糖缓冲液,去除可能产生干扰的物质,提高提取的dna质量和得率。
4.本发明采用硅胶膜吸附柱,该吸附柱具有孔径小和特异性吸附核酸的特点,能够将溶液中剩余的糖类等物质过滤。并且利用硅基质与dna在不同盐离子浓度和ph条件下的结合程度不同,通过对吸附柱的漂洗、洗脱,从而达到分离、纯化dna的目的。
附图说明
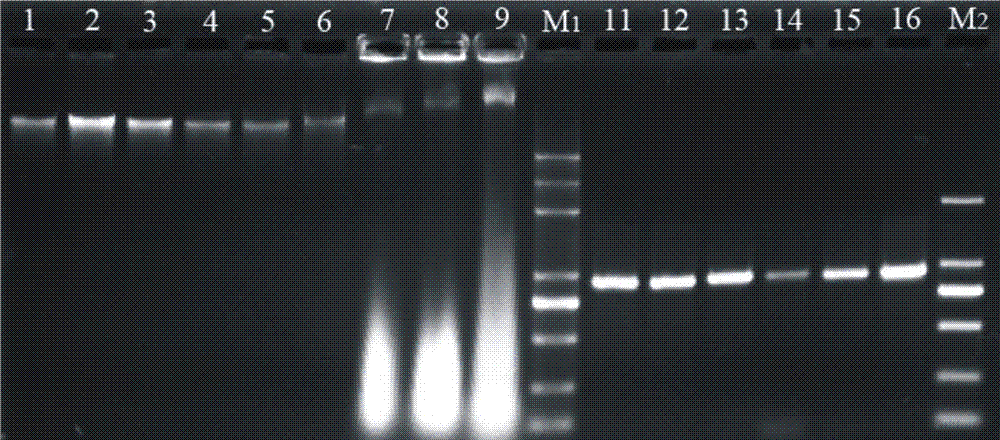
图1显示的是pcr检测结果和电泳结果。
图中:柑橘-1、11,石斛-2、12,葡萄-3、13,无花果-4、14,芦荟-5、15,黄秋葵-6、16,sds法提取的黄秋葵-7,ctab法提取的黄秋葵-8,高盐低ph值法提取的黄秋葵-9,markeral5000-m1,markerdl2000dnaladder-m2。
具体实施方式
为使本发明目的、技术方案和优点更加清楚,下面对本发明实施方式中的技术方案进行清楚、完整地描述,显然,所描述的实施方式是本发明的一部分实施方式,而不是全部的实施方式。基于本发明中的实施方式,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施方式,都属于本发明保护的范围。因此,以下提供的本发明的实施方式的详细描述并非旨在限制要求保护的本发明的范围,而是仅仅表示本发明的选定实施方式。
实施例1:
黄秋葵是已知的含果胶类多糖及多酚特别高的植物之一,由于传统的缓冲液与黏稠的多糖结合易形成难溶的胶状物,干扰dna的提取和纯化。本发明针对此问题,结合本发明的中所述试剂盒改进了提取方法,成功提取了高质量的黄秋葵基因组dna。具体步骤如下:
(1)取0.2g左右新鲜的黄秋葵幼叶置于研钵中,加入液氮将其研磨成细末,并迅速收集到2.0ml离心管中。
(2)向离心管中加入1.5ml经4℃预冷的去糖缓冲液和15μlβ-巯基乙醇,混匀后置于4℃冰箱10min,期间颠倒混匀1次。用9000rpm离心8min,弃上清,收集沉淀。
(3)向沉淀中加入1ml经65℃预热的裂解液,再加入5μlrnasea(10mg.ml-1)和10μlβ-巯基乙醇,充分混匀,65℃温浴40min,每隔10min轻摇一次,使样品充分悬浮在提取缓冲液中。用10000rpm离心5min,转移上清至新的2.0ml离心管中。
(4)向上清液中加入等体积抽提液,轻轻颠倒混匀10min,室温下12500rpm离心15min,取上清。
(5)转移上清至新的离心管,加入等体积的过柱缓冲液,轻轻颠倒混匀。
(6)将吸附柱放入收集管中,取700μl混合液加入吸附柱中,静止2min,12000rpm离心1min,倒掉收集管中的废液。
(7)将吸附柱放回收集管中,将剩余的混合液加入吸附柱中,静止2min,12000rpm离心1min,倒掉收集管中的废液。
(8)向吸附柱加入650μl去蛋白液,12000rpm离心1min,倒掉收集管中的废液。
(9)将吸附柱放回收集管中,向吸附柱中加入700μl漂洗液,12000rpm离心1min,倒掉收集管中的废液。重复步骤(9)一次。
(10)将吸附柱放回收集管中,12000rpm空管离心2min,去除吸附柱上的剩余液体。
(11)将吸附柱转移至新的1.5ml离心管中,打开吸附柱盖,待吸附柱残留的乙醇挥发尽后,向膜中央滴加65℃预热的洗脱液50μl,室温放置5min,12000rpm离心1min;再将离心所得溶液重新加回吸附柱膜中央,12000rpm离心1min,即得黄秋葵dna样品。
实施例2:
柑橘、芦荟、石斛、无花果、葡萄是含果胶类多糖或其它次生代谢物特别高的植物,使用本发明的方法提取基因组dna,步骤如下:
(1)样品处理:
a.柑橘、无花果、葡萄:取幼叶,分别加液氮研磨备用;
b.芦荟:去刺后,加液氮研磨备用;
c.石斛:取茎部,加液氮研磨备用;
分别取上述a-c各植物样品0.2g,将其分别放入2.0ml离心管中备用。
其余步骤同实施例1中(2)-(11)依次进行,收集到各植物dna样品。
pcr检测:
将上述实施例中的dna样品进行pcr检测。根据叶绿体成熟酶k(matk)基因序列,设计通用引物,引物序列为:
matk-f:5’-cgatcaattcattcaatatttg-3’
matk-r:5’-caagatcgtgttctttcagc-3’
pcr扩增体系为:10×pcrbuffer2.5μl,dntp(10mmol·l-1)0.5μl,模板dna20ng,引物(10μmol·l-1)各0.5μl,ex-taqdna聚合酶(5u·μl-1,takara)0.2μl,加ddh2o补足至25μl。
pcr扩增程序为:94℃预变性5min,94℃变性45s,58℃退火30s,72℃延伸50s,32个循环后72℃延伸5min,4℃保存。
如图1所示,采用本发明的方法提取的dna均能得到电泳可见的基因组。用matk通用引物能成功扩增上述实施例中的柑橘(11)、石斛(12)、葡萄(13)、无花果(14)、芦荟(15)和黄秋葵(16)的叶绿体成熟酶k(matk)基因。表明本发明的提取方法适合多糖类植物基因组的提取,并且提取的样品都能达到良好的检测效果,该法具有广泛的适用性。
琼脂糖凝胶电泳分析:
将上述实施例中的基因组dna样品及pcr扩增产物经琼脂糖凝胶电泳检测。并将用本发明的方法与实验室常见的sds、ctab、高盐低ph法所提取的黄秋葵基因组dna进行对比。
如图1所示,结果表明:实施例1中的黄秋葵dna样品(6)与传统方法获得的黄秋葵dna(7)、(8)、(9)比较,采用本发明的方法提取的dna(6)电泳条带清晰、整齐、无降解、完整性好,无多糖、蛋白质及酚类物质污染。而运用传统方法提取的dna(7)、(8)、(9)均较差,电泳条带暗、模糊、弥散,点样孔有杂质残留,说明提取的dna有多糖、蛋白质以及其他次生物质的污染。实施例2中获得的柑橘(1)、石斛(2)、葡萄(3)、无花果(4)、芦荟(5),其dna电泳条带亮度均很高且条带清晰整齐,点样孔无杂质残留,说明该法获得的dna产量高、无降解、完整性好,纯度高。
由此可见,本发明的方法适用于黄秋葵、石斛、芦荟、葡萄、无花果等多种富含多糖植物基因组dna的提取,并且提取的基因组dna质量高。
以上仅是本发明的优选实施方式,应当指出的是,上述优选实施方式不应视为对本发明的限制,本发明的保护范围应当以权利要求所限定的范围为准。对于本技术领域的普通技术人员来说,在不脱离本发明的精神范围内,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!