阳离子聚乙烯胺线形高分子作为转基因载体的应用的制作方法
本发明属于高分子化学及生物材料
技术领域:
,具体涉及一种阳离子聚乙烯胺线形高分子的应用。
背景技术:
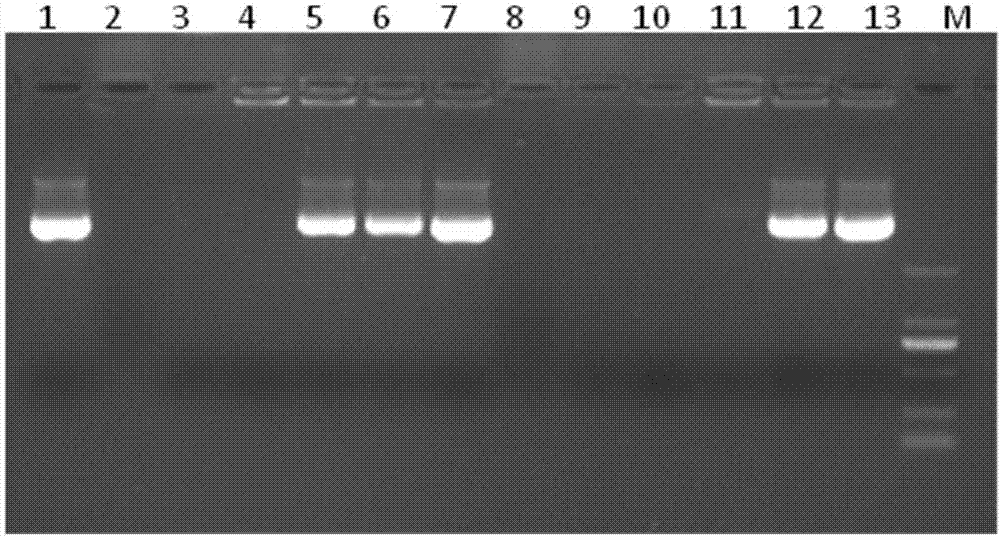
:基因治疗作为一种新型的治疗手段,已经在癌症、艾滋病、骨质疏松症等重大疾病的治疗中显示出巨大的应用潜力。但由于缺乏安全高效的基因载体,基因治疗还未在临床上有实质性进展。基因治疗是指借助基因载体将外源正常的基因导入靶细胞,用于纠正或者补偿因基因缺陷或者异常引起的疾病,从而达到治疗的目的。然而,裸露的dna一般以舒展的线形螺旋形式存在,体积松散,并且dna分子本身为带负电的阴离子,进入细胞时会与细胞膜外层的阴离子之间产生静电排斥作用。这些不利因素都使得dna分子在不借助其它技术手段的情况下,无法独立穿过细胞膜,即使有少量的dna能够进入细胞膜,进入细胞后也很容易被核酸酶所降解。因此,基因载体的开发在基因治疗的过程中起着至关重要的作用。基因载体包括病毒载体和非病毒载体两类。病毒载体是一种高效的转染试剂,能够高效地将外源的dna或rna转入细胞,但是它存在一些明显的缺陷,如免疫原性、致癌性,基因的大小容易受到病毒所容纳的大小限制、不能大量生产、同时存在变异的可能性,安全性差。因此,病毒载体在应用中受到了极大的限制。与病毒载体相比,结构易于修饰的非病毒载体完全克服病毒载体的上述缺点。非病毒载体包括阳离子脂质体、阳离子聚合物、金属纳米粒子以及多肽等。其中高分子聚合物具有安全性高、免疫性低、结构易于修饰以及转染效率高等特点,因此,近些年来高分子聚合物成为了具有良好应用前景的非病毒基因载体。线形高分子是一类人工合成的化合物,具有可控的分子量和尺寸,良好的单分散性,和表面易于多官能团修饰等特点。通常,聚阳离子型高分子可以与dna/sirna结合后形成复合物,将dna或rna转运至细胞内。而且在运输过程中,可以保护dna或rna免受核酸酶的降解。聚阳离子型高分子内部存在大量的三级胺起到“质子海绵”的作用,可促进核酸复合物内涵体逃逸,并进入细胞质高效的转录、翻译以及表达等。但是,目前市售的可用于核酸递送的聚阳离子型高分子价格昂贵,而且转染效率低,极大的限制了聚阳离子型高分子的应用。因此,寻找价格低廉、转染效率高的转基因载体是解决这些问题的关键。技术实现要素:为了解决上述问题,本发明提供了一种阳离子聚乙烯胺线形高分子作为转基因载体的应用。本发明的一个目的是解决至少上述问题和/或缺陷,并提供至少后面将说明的优点。本发明发现了阳离子聚乙烯胺线形高分子(商品名为xelorextmrs1100)新的应用领域,其在核酸递送方面具有重要的开发潜力,有望开发为安全、高效以及低毒的基因转染试剂。本发明所用阳离子聚乙烯胺线形高分子成本较低,材料易得,可获得细胞毒性低,同时具备高转染效率的转基因载体,可以开发为一类新型的转基因材料,并具有商业化的潜力。为了实现根据本发明的这些目的和其它优点,提供了一种阳离子聚乙烯胺线形高分子在转基因载体中的用途,所述阳离子聚乙烯胺线形高分子用作核酸分子输送载体。目前的阳离子型高分子转基因载体,价格昂贵,细胞毒性大,而且转染效果不理想。本发明式(i)基于聚乙烯胺的线形高分子载体,能够安全高效地将基因运输到细胞中。本材料具有价格低廉,细胞毒性低以及转染效率高等优点。优选的是,所述阳离子聚乙烯胺线形高分子的结构式(i)如下:本发明采用的线形高分子,原料廉价易得,转染过程中对细胞的毒性小,能高效的进行基因转染,是兼具低廉、安全、高效等优点的转基因载体。优选的是,x/(x+y)=0.5~1。优选的是,所述核酸分子为dna或者sirna。本发明利用式(i)所示高分子转基因载体输送核酸,即基于聚乙烯胺线形高分子线形基因载体与核酸在室温孵育后形成稳定的核酸复合物,再与细胞共孵育,完成基因转染过程。本发明中基因载体不仅具有良好生物相容性,而且具有高效的基因转染效率。优选的是,所述阳离子聚乙烯胺线形高分子需经过透析法纯化过程后,才能用作核酸分子输送载体。采取透析法纯化步骤以去除原料中水溶性杂质,这些杂质对细胞具有毒害作用。优选的是,所述透析法纯化过程为:将所述阳离子聚乙烯胺线形高分子配制成质量分数为10%的水溶液,再以水为透析介质,所述水溶液经mwco8-14kd透析袋透析72h,冷冻干燥后备用。所述mwco8-14kd透析袋的透过分子量<10000,该透析袋的型号是根据本发明基因载体的分子量,以及小分子杂质的分子量来选择。本发明选择该型号透析袋的目为:小分子杂质分子量小于10000可以透过透析袋,但是基因载体分子量大于10000,所以在透析过程中不会透过。这样经透析后,本发明所述基因载体得到纯化,经冷冻干燥后,可用于基因递送。本发明的有益效果:1、本发明中基因载体不仅具有良好生物相容性,而且具有高效的基因转染效率。2、本发明通过基因转染实验,发现在优化的条件下对egfpdna的转染中,转染效率要高于商业化的转染试剂pei(polyethylenimine);本发明转基因载体转染效率虽低于商业化的转染试剂lipofectamine2000,但细胞毒性较lipofectamine2000更低;在优化条件下对si-egfp的转染中,转染效率要高于商业化的转染试剂pei和lipofectamine2000。3、本发明通过细胞毒性实验,发现本发明中的转基因载体细胞毒性低,在所测试的浓度下,细胞成活率大于85%,具有良好的生物相容性。4、本发明提供的转基因载体,所需原料廉价易得,在细胞转染中,细胞毒性低,转染效率高,可作为一种兼具安全、高效、价格低廉等优点的转基因载体。本发明的其它优点、目标和特征将部分通过下面的说明体现,部分还将通过对本发明的研究和实践而为本领域的技术人员所理解。附图说明图1为本发明所述的转基因载体与dna复合物的琼脂糖凝胶电泳试验结果示意图;图2为本发明所述的转基因载体与dna的复合物在hek293细胞中的细胞毒性图;图3是本发明所述的转基因载体与pegfp-c2质粒复合物在hek293细胞中的转染效果图;图4本发明所述的转基因载体与sirna的复合物在hek293-egfp细胞中的细胞毒性;图5是本发明所述的转基因载体与egfp的sirna复合物在hek293-egfp细胞中的转染效果图。具体实施方式下面结合附图对本发明做进一步的详细说明,以令本领域技术人员参照说明书文字能够据以实施。应当理解,本文所使用的诸如“具有”、“包含”以及“包括”术语并不配出一个或多个其它元件或其组合的存在或添加。<实例1>一种阳离子聚乙烯胺线形高分子作为转基因载体,所述线形高分子转基因载体的结构式(i)如下:式(i)中,x/(x+y)=0.5~1。其原料商品名为xelorextmrs1100。对实施例1中的线形高分子转基因载体原料(xelorextmrs1100)进行了如下方面的纯化:以水为透析介质,xelorextmrs1100水溶液(浓度为10%)经mwco8-14kd透析袋(透过分子量<10000)透析72h,以去除原料中对细胞有毒害作用的小分子。透析后,冷冻干燥。所得粉末用三蒸水重新溶解,配制为适当浓度的储备液,待用。对实施例1中的线形高分子转基因载体进行如下方面的检测:(1)上述线形高分子转基因载体与dna复合物的琼脂糖凝胶电泳试验a、转基因载体与dna复合物的制备室温下,在pe管里分别加入转基因载体和2μgdna。以商业化的转染试剂pei作为阳性对照。其中转基因载体(xelorextmrs1100)/pei与dna的质量比分别为0.1:1,0.2:1,0.5:1,1:1,1:2,1:5。然后,加入相应体积的超纯水,使反应液的最终体积保持在10μl。室温下孵育20min后,加入1μl的10×loadingbuffer上样缓冲液终止反应。其中,dna为egfp表达质粒(pegfp-c2)。b、复合物的琼脂糖凝胶电泳试验分别取上述制备的转基因载体与dna复合物,加入凝胶上的加样孔内。盖上电泳盖,电压100v条件下电泳30min后停止,取出凝胶,在凝胶电泳成相系统中曝光采样。如图1所示,利用琼脂糖凝胶电泳实验,我们观察了转基因载体与dna的作用情况。转基因载体在1:1对dna产生明显的凝聚效果(见图1中标4处的条带),所有dna都滞留在上样孔。pei(聚乙酰亚胺)在0.5:1浓度下即对dna产生明显凝聚效果(见图1中标11处的条带),但仍有部分dna自上样孔泳动至凝胶中,可观察到较弱的条带。由于xelorextmrs1100的平均分子量约为pei的3倍,说明xelorextmrs1100在更小的摩尔比下(转基因载体:dna)即可对dna产生明显凝聚效果。图1为本发明所述的转基因载体与dna复合物的琼脂糖凝胶电泳试验结果示意图;其中,在图1中1-13及m具体代表如表1所示:数字/字母转基因载体/pei与dna的质量比1pegfp-c2plasmid2plasmid+xelorextmrs1100(1:5,w/w)3plasmid+xelorextmrs1100(1:2,w/w)4plasmid+xelorextmrs1100(1:1,w/w)5plasmid+xelorextmrs1100(1:0.5,w/w)6plasmid+xelorextmrs1100(1:0.2,w/w)7plasmid+xelorextmrs1100(1:0.1,w/w)8plasmid+pei(1:5,w/w)9plasmid+pei(1:2,w/w)10plasmid+pei(1:1,w/w)11plasmid+pei(1:0.5,w/w)12plasmid+pei(1:0.2,w/w)13plasmid+pei(1:0.1,w/w)mdnamarkerdl2000注:plasmid质粒;dnamarker名称为dl2000(2)转基因载体细胞毒性试验a、转基因载体与dna复合物的制备室温下,在pe管里分别加入转基因载体,以商品化转染试剂pei和lipofectamine2000作为阳性对照。其中转基因载体与dna的质量比分别为1:1,2:1,5:1;lipofectamine2000与dna的质量比为2:1(为使用lipofectamine2000作为转染试剂时的推荐比例);pei与dna的质量比为1:1。每孔dna的转染量为500ng。将dna与转基因载体混匀后,室温孵育20min。再加入适量体积的opti-memtm培养基,使反应液的最终体积保持在150μl。b、细胞毒性试验用胰酶消化收取对数生长期的hek293细胞将大约每孔7×104个细胞种入24孔板中,于37℃含5%co2的培养箱培养24h,使细胞的生长至70%-80%的融合。弃去孔内原有培养基,加入450μlopti-memtm培养基,在每孔中分别滴加上述配好的不同浓度的转基因载体与dna复合物50μl,每个浓度设置三个平行孔;采用不含转基因载体的opti-memtm培养基作为空白对照,采用商业化lipofectamine2000/pei作为阳性对照。48h后,向每孔加入50μlmtt溶液(5mg/ml),4h后吸出上清,生成的紫蓝色结晶用500μl二甲基亚砜溶解,于摇床上震荡10min后用酶标仪测定每一孔在490nm处的吸光度值(a490)。按如下公式计算细胞存活率(%)=[a490test-空白]/[a490control-空白]×100。如图2所示,经过在hek293细胞中测定转基因载体的细胞毒性,发现转基因载体的细胞毒性都比较低。所有浓度下,细胞的成活率都在85%以上,高于商业化的转基因载体lipofectamine2000。除5:1浓度下,转基因载体的细胞毒性与pei相当外,其余较低浓度的细胞存活率均好于pei。其中,图2中的横坐标具体表示如表2所示:注:plasmid质粒;p为统计学上的一个数值,用来判断两实验组间是否有显著性差异的。(3)转基因载体与pegfp-c2质粒的复合物体外转染试验a、转基因载体与pegfp-c2质粒复合物的制备室温下,在pe管里分别加入转基因载体,以商品化转染试剂pei和lipofectamine2000作为阳性对照。其中转基因载体与dna的质量比分别为1:1,2:1,5:1;lipofectamine2000与dna的质量比为2:1(为使用lipofectamine2000作为转染试剂时的推荐比例);pei与dna的质量比为1:1。每孔dna的转染量为500ng。将dna与转基因载体混匀后,室温孵育20min。再加入适量体积的opti-memtm,使反应液的最终体积保持在150μl。b、体外转染试验用胰酶消化收取对数生长期的hek293细胞将大约每孔7×104个细胞种入24孔细胞培养板,于37℃含5%co2的培养箱培养24h,使细胞的生长至70%-80%的融合。弃去孔内原有培养基,在每孔中分别加入加入450μlopti-memtm培养基后,在每孔中分别滴加配好的不同浓度的转基因载体与dna复合物50μl,每个浓度设置三个平行孔;采用不含转基因载体的opti-memtm培养基作为空白对照,采用商业化lipofectamine2000/pei作为阳性对照。48h后,于倒置荧光显微镜下观察egfp表达情况。如图3所示:通过细胞转染实验可以得出:在hek293细胞的转染中,转基因载体的转染效率要略高于pei,但远远低于lipofectamine2000。图3是本发明所述的转基因载体与pegfp-c2质粒复合物在hek293细胞中的转染效果图,在图3中标识具体代表如表3所示:注:plasmid质粒;<实例2>一种阳离子聚乙烯胺线形高分子作为转基因载体,所述线形高分子转基因载体的结构式(i)如下:式(i)中,x/(x+y)=0.5~1。其原料商品名为xelorextmrs1100。对实施例2中的线形高分子转基因载体原料(xelorextmrs1100)进行了如下方面的纯化:以水为透析介质,xelorextmrs1100水溶液(浓度为10%)经mwco8-14kd透析袋(透过分子量<10000)透析72h,以去除原料中对细胞有毒害作用的小分子。透析后,冷冻干燥。所得粉末用三蒸水重新溶解,配制为适当浓度的储备液,待用。对实施例2中的线形高分子转基因载体进行如下方面的检测:(1)转基因载体细胞毒性实验a、转基因载体与sirna复合物的制备室温下,在pe管里分别加入转基因载体,以商品化转染试剂pei和lipofectamine2000作为阳性对照。其中转基因载体与sirna的质量比分别为1:1,2:1,5:1;lipofectamine2000与sirna的质量比为2:1(为使用lipofectamine2000作为转染试剂时的推荐比例);pei与sirna的质量比为1:1。每孔sirna的转染浓度为100nm。将sirna与转基因载体混匀后,室温孵育20min。再加入适量体积的opti-memtm培养基,使反应液的最终体积保持在150μl。b、细胞毒性实验用胰酶消化收取对数生长期的hek293-egfp细胞将大约每孔7×104个细胞种入24孔板中,于37℃含5%co2的培养箱培养24h,使细胞的生长至70%-80%的融合。弃去孔内原有培养基,加入450μlopti-memtm培养基,在每孔中分别滴加上述配好的不同浓度的转基因载体与sirna复合物50μl,每个浓度设置三个平行孔;采用不含转基因载体的opti-memtm培养基作为空白对照,采用商业化lipofectamine2000/pei作为阳性对照。48h后,向每孔加入50μlmtt溶液(5mg/ml),4h后吸出上清,生成的紫蓝色结晶用500μl二甲基亚砜溶解,于摇床上震荡10min后用酶标仪测定每一孔在490nm处的吸光度值(a490)。按如下公式计算细胞存活率(%)=[a490test-空白]/[a490control-空白]×100。如图4所示,经过在hek293-egfp细胞中测定转基因载体的细胞毒性,发现转基因载体的细胞毒性都比较低。所有浓度下,细胞的成活率都在85%以上,与商品化转染试剂lipofectamine2000/pei相当。其中,图4为本发明所述的转基因载体与sirna的复合物在hek293-egfp细胞中的细胞毒性,其中横坐标的标识具体见表4:(2)转基因载体与si-egfp的复合物体外转染实验a、转基因载体与si-egfprna复合物的制备方法同<实例1>中“(2)转基因载体细胞毒性实验”中所述的方法进行转基因载体与si-egfp质粒复合物的制备。b、体外转染实验用胰酶消化收取对数生长期的hek293-egfp细胞将大约每孔7×104个细胞种入24孔细胞培养板,于37℃含5%co2的培养箱培养24h,使细胞的生长至70%-80%的融合。弃去孔内原有培养基,在每孔中分别加入加入450μlopti-memtm培养基后,在每孔中分别滴加配好的不同浓度的转基因载体与sirna复合物50μl,每个浓度设置三个平行孔;采用不含转基因载体的opti-memtm培养基作为空白对照,采用商业化lipofectamine2000/pei作为阳性对照。48h后,于倒置荧光显微镜下观察egfp表达情况。如图5所示,通过细胞转染实验可以得出:在hek293-egfp细胞的转染中,转基因载体的转染效率远高于商品化转染试剂lipofectamine2000/pei。其中,图5是本发明所述的转基因载体与egfp的sirna复合物在hek293-egfp细胞中的转染效果图。在图5中标识具体代表如表5所示:标识物质及其比例blankopti-memtm培养基1100(1:1)siegfp+xelorextmrs1100(1:1,w/w)1100(1:2)siegfp+xelorextmrs1100(1:2,w/w)1100(1:5)siegfp+xelorextmrs1100(1:5,w/w)sirna100nm/well,egfp的sirnapeisiegfp+pei(1:1,w/w)lipo2000siegfp+lipofectamine2000(1:2,w/w)mockxelorextm1100(2.66μg/ml)另外,mtt溶液为常规配制方法:可以称取mtt0.5克,溶于100ml的磷酸缓冲液(pbs)或无酚红的培养基中,用0.22μm滤膜过滤以除去溶液里的细菌,放4℃避光保存即可。在配制和保存的过程中,容器最好用铝箔纸包住。综上所述,本发明中的转基因载体细胞毒性较低,可用于dna及rna的细胞内递送。特别适合于sirna的转染。其制备方法简单、成熟、易于掌控,且原料的价格低廉。尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用。它完全可以被适用于各种适合本发明的领域。对于熟悉本领域的人员而言,可容易地实现另外的修改。因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的图例。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1