一种能识别多种环境内分泌干扰物的体外快速检测方法与流程
本发明属于水生毒理学领域,具体涉及一种能识别多种环境内分泌干扰物的体外快速检测方法。
背景技术:
无脊椎动物具有与脊椎动物不同的内分泌系统,因其生命周期短、繁殖力强和/或变态发育毒性终点易识别等特性在环境内分泌干扰物(edcs)识别中具有重要作用。其中摇蚊慢性毒性测试、摇蚊全生命周期测试等活体(invivo)测试方法已被oecd确定为第四或第五级别edcs识别方法。尽管这些活体测试方法能够充分证明化学物质对无脊椎生物的内分泌干扰效应,但羽化率、羽化时间、繁殖率、性别比等毒性终点响应晚(10d以后)、工作量大,无法满足大量化学物质内分泌干扰毒性的筛选需求。此外,上述测试终点均为个体或种群的终极危害响应,无法从分子水平揭示受试物质可能的内分泌干扰作用机理。
体外实验技术测试成本低、时间短,且便于在分子水平揭示致毒作用机理,适用于大量化学物质的edcs初级筛查,目前已有大量脊椎动物体外测试方法被oecd确定为第二或第三级别edcs识别方法,如爪蛙胚胎甲状腺信号系统测试、鱼类繁殖筛选实验等。edcs无脊椎动物体外测试方法目前尚未形成。据欧盟委员会2018年对edcs危害数据最新评估结果,化学物质对无脊椎动物内分泌干扰效应数据的缺失已影响edcs筛查评估进程,以无脊椎动物为对象的内分泌干扰性测试方法开发已列入优先研究领域。
摇蚊(chironomidae,non-bitingmidges),属昆虫纲双翅目长角亚目摇蚊科,是淡水水域中底栖动物的主要类群之一。作为试验材料,摇蚊唾腺在多线染色体变异、细胞凋亡等方面已经具有长期的研究基础,生物学信息丰富。但在edcs识别方面尚无尝试和探索。蜕皮激素作用通路是昆虫内分泌作用的重要途径之一。其中ecr、usp是昆虫蜕皮激素受体,起到控制生物基本发育和生理途径的转录因子的作用,且只有当ecr和usp(超气门蛋白)形成异源二聚体才能与mh(类固醇激素在血浆循环中转运到其靶器官,并在进入细胞后发挥作用,作为该核受体的配体并改变基因转录)在细胞核内形成转录复合体从而调节蜕皮激素下游应答基因的转录水平,其中e74即是蜕皮激素调节通路的早期响应基因的代表。三者的表达情况可以较好地表征蜕皮激素信号通路对外源性物质的响应情况。目前蜕皮激素受体ecr和usp、蜕皮激素调节因子e74已经广泛应用于外源性物质对果蝇、蜜蜂、家蚕等昆虫的内分泌干扰性研究。然而由于不同物种基因差异性,上述研究中的昆虫激素受体无法直接作为摇蚊敏感内分泌干扰性标志物,相关测试方法不适用于摇蚊。
技术实现要素:
本发明的目的是克服现有摇蚊内分泌干扰毒性测试方法的缺陷,提供一种能识别多种环境内分泌干扰物的体外快速检测方法。为了达到上述目的,本发明采用如下技术方案:
一种能识别多种环境内分泌干扰物的伸展摇蚊唾腺离体检测方法包含:步骤1,唾腺获取和预处理;步骤2,离体染毒和样本收集;步骤3,分子标志物ecr、usp、e74表达量测定;步骤4,数据统计与显著性分析。具体如下:
1.唾腺获取和预处理
将摇蚊放入20l左右玻璃缸中,加入除氯自来水,并用纱网罩盖在缸上,温和曝气。初期幼虫(孵化后10天内)每只每天喂食0.25-0.5mg鱼食,孵化10天后每只每天0.5-1.0mg鱼食。每周换水一次。收集新产卵块,孵化后取四龄幼虫并分离出唾腺。双手各持一枚解剖针,用左手解剖针压住幼虫中部,用右手解剖针自幼虫口沟后切断头部,体内各器官便从出口处挤出,一对唾腺也随之而出,唾腺肉眼看为半透明棒状腺体。迅速剥离唾腺周围的脂肪体,在实验开始前用试验介质昆虫培养基冲洗唾腺15分钟,昆虫培养基采用schneider昆虫培养基,配方如下。
表1schneider昆虫培养基配方
schneider昆虫培养基配制方法:
(1)用900ml组织培养级水重悬26.2g,轻轻地不断搅动使粉末完全溶解。不加热。
(2)加入0.4g碳酸氢钠或5.3ml7.5%碳酸氢钠溶液。搅动至完全溶解。
(3)用1nnaoh调节ph至9.2±0.2。这时溶液会变浑浊。用1nhcl调节ph至6.7±0.2,这时溶液会变清澈。
(4)加入0.6g无水氯化钙。慢慢搅动以避免沉淀生成。
(5)定容至1l。
(6)将ph调低0.1-0.3,鉴于过滤过程中ph趋于上升。
(7)调节渗透压,对于鳞翅类细胞系,最适渗透压为340–360mosm/kgh2o。加入0.4gkcl或0.3gnacl到1l培养基中可以提高10mosm/kgh2o。加入27.8ml水到1l培养基中可以降低渗透压10mosm/kgh2o。
(8)用0.22μm或更小的滤膜过滤培养基。加入无菌的添加剂。分装到无菌容器中。
(9)静止避光保存在2-8℃冰箱中。可以保存1年。
2.离体染毒和样本收集
来自同一只幼虫的一对唾腺,一只用于处理组,另一只用于相应的对照组。至少设置5个浓度处理组,每个处理组至少6个平行,每个平行5只唾腺。将分离出的唾腺置入用schneider昆虫培养基配制的受试物水溶液中,暴露3h,分别在1h和3h取3个平行测试蜕皮激素受体基因ecr和usp、早期响应基因e74表达量。
3.分子标志物ecr、usp、e74表达量测定
提取总rna,利用分光光度计检测rna的浓度和纯度;将提取的摇蚊总rna反转录成cdna,根据标志物基因序列设计并合成相应的引物序列并进行荧光定量pcr。具体如下:
3.1引物扩增
ecr、usp、e74的引物序列分别为:
表2用于荧光定量pcr的伸展摇蚊的引物序列
3.2总rna提取、质量鉴定和目标基因rt-pcr扩增
使用试剂盒提取唾腺中总rna,利用分光光度计检测rna的浓度和纯度;使用试剂盒(trizol,invitrogen,carlsbad,ca,usa)将提取的摇蚊总rna反转录成cdna,根据表1中的引物序列进行荧光定量pcr(rt-pcr),计算对照组和处理组中分子标志物ecr、usp、e74的表达量。
4.数据统计与显著性分析
以gapdh、actinβ为内参,计算处理组中分子标志物ecr、usp、e74的表达量;以对照组中来自同一个体的唾腺的目标基因表达量为参照,计算处理组中ecr、usp、e74的相对表达量,采用统计学方法计算显著影响分子标志物的表达量的最低浓度noec或10%效应浓度ec10。
能够诱导产生与空白对照相比显著差异的受试物质可判定其对摇蚊具有相应的内分泌干扰作用。具体地,如果能同时引起ecr、usp和e74表达量变化,表明受试物能干扰蜕皮激素的作用;如果能引起ecr或e74中一种标志物表达量显著变化,表明受试物可能会干扰蜕皮激素的作用。
本发明基于摇蚊唾腺离体(体外)染毒的激素调节通路基因测试技术,耗时短、方法简单,检测灵敏度不低于现有摇蚊内分泌干扰性测试标准方法,测试结果便于揭示受试物质影响摇蚊内分泌系统的内在机理。
附图说明
图1暴露于bpf1h后摇蚊唾腺中分子标志物ecr、usp、e74的相对表达量。
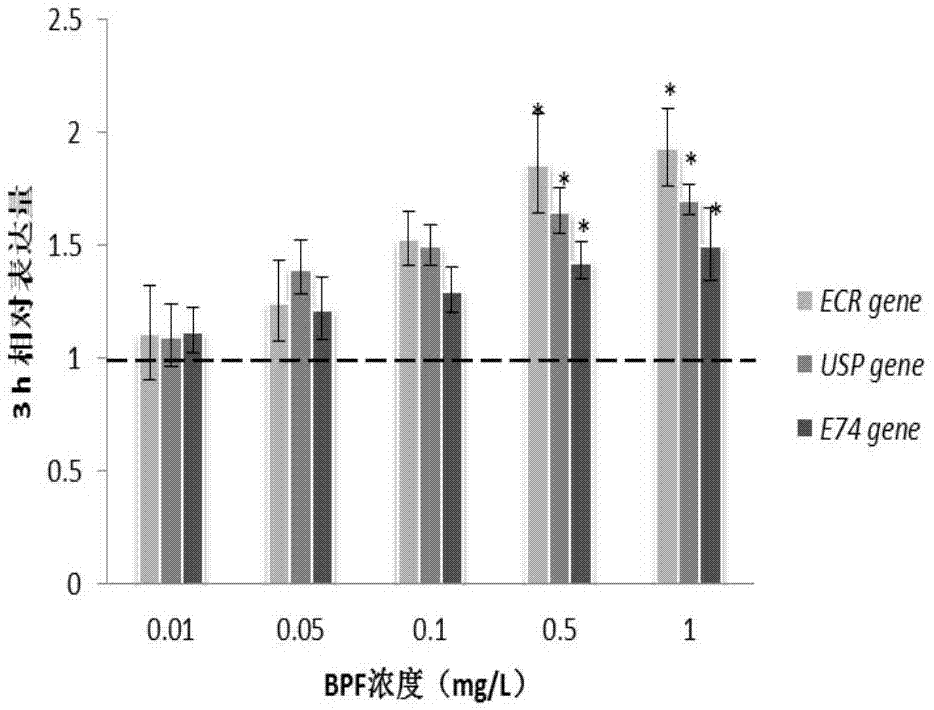
图2暴露于bpf3h后摇蚊唾腺中分子标志物ecr、usp、e74的相对表达量。
图3暴露于bpa1h后摇蚊唾腺中分子标志物ecr、usp、e74的相对表达量。
图4暴露于bpa3h后摇蚊唾腺中分子标志物ecr、usp、e74的相对表达量;(注:内参基因选取甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,gapdh));黑色的虚线表示空白对照组的基因表达量为1;*表示显著性水平p<0.05。)
具体实施方式:
以下结合附图对本发明做进一步详细说明。
本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
下述的实施例中所使用的实验方法无特殊说明均为常规方法。下述的实施例中所使用的实验试剂耗材等无特殊说明均可从商业用途购买。
实施例1
按照本方法开展bpf对摇蚊唾腺中分子标志物ecr、usp、e74表达情况的剂量-效应和时间-效应影响,筛选内分泌干扰物,并以bpa作为阳性对照。
伸展摇蚊(chironomustentans)在实验条件为光:暗=16:8h,温度23±1℃,光照强度800~1000lux,湿度为85%下驯养并用于试验。收集新产卵块,孵化后取四龄幼虫并分离出唾腺。双手各持一枚解剖针,用左手解剖针压住幼虫中部,用右手解剖针自幼虫口沟后切断头部,体内各器管便从出口处挤出,一对唾腺也随之而出,唾腺肉眼看为半透明棒状腺体。迅速剥离唾腺周围的脂肪体,在实验开始前用schneider昆虫培养基(sigma-aldrich)冲洗唾腺15分钟。
高浓度储备液用schneider昆虫培养基稀释后得到受试物溶液。bpf、bpa的浓度均设置为0.01、0.05、0.1、0.5、1mg/l,每一个浓度均对应一个不含受试物的空白对照组,用以计算分子标志物的相对表达量。来自同一只幼虫的一对唾腺,一只用于处理组,另一只用于相应的对照组。空白对照组和浓度组均为6个平行,每个平行5只唾腺。将分离出的唾腺置入受试物水溶液中,暴露3h,分别在1h和3h取3个平行测试蜕皮激素受体基因ecr和usp、早期响应基因e74表达量。
总rna提取、质量鉴定和目标基因rt-pcr扩增:使用试剂盒(trizol,invitrogen,carlsbad,ca,usa)提取总rna,利用分光光度计检测rna的浓度和纯度;使用试剂盒(hifi-mmlvcdna第一链合成试剂盒;康为世纪)将提取的摇蚊总rna反转录成cdna,根据表1中的引物序列进行荧光定量pcr(rt-pcr)。以空白对照组为参照,计算处理组中分子标志物ecr、usp、e74的表达量,采用dunnett-ttest(p<0.05)检验处理组与空白对照组的差异是否显著。能够诱导产生与空白对照相比显著差异的受试物质可判定其对摇蚊具有相应的内分泌干扰作用。具体地,如果能同时引起ecr、usp和e74表达量变化,表明受试物能干扰蜕皮激素的作用;如果能引起ecr或e74中一种标志物表达量显著变化,表明受试物可能会干扰蜕皮激素的作用。
如图1、图2所示,在bpf处理组中,暴露1h后,相比空白对照(表达量=1)而言,仅ecr基因(0.5mg/l和1mg/lbpf)显著上升,其它基因的相对表达量无显著变化。暴露3h后,相比空白对照(表达量=1)而言,三种分子标志物表达量均显著上升,并呈现剂量-效应关系(见表3),表明bpf能干扰蜕皮激素的基因调节过程。从1h到3h表达量变化来看,ecr基因对外源内分泌干扰物的响应较其它两种分子标志物更快。
如图3、图4所示,在bpa处理组中,暴露1h后,相比空白对照(表达量=1)而言,三种基因的表达量均无显著变化。暴露3h后,三种分子标志物表达量均显著上升,并呈现剂量-效应关系(见表3),表明bpf能干扰蜕皮激素的基因调节过程。ecr和e74基因的表达量在0.5和1mg/l显著上升,usp基因表达量在1mg/l显著上升,验证了3种分子标志物对bpa这种内分泌干扰物响应的敏感性。
综上所述,本实施例以摇蚊唾腺中3种分子标志物(ecr、usp、e74)的相对表达量为毒性终点,以内分泌干扰物bpa作为阳性对照,证实了bpf对摇蚊的内分泌干扰效应,并结果显示本方法耗时短-3h,方法简单-样本处理、mrna提取方便快捷,检测灵敏度高-在受试物浓度仅为0.5mg/l时便有响应。
表3三种分子标志物与受试物浓度间的剂量-效应关系
注:数据使用excel2010中拟合。y-分子标志物相对表达量,x-受试物浓度(mg/l)以10为底的对数(log10),r2-拟合优度。
实施例2:
oecdtg233方法(水体加标法摇蚊全生命周期实验)测试bpf对摇蚊的内分泌干扰性,验证摇蚊唾腺分子标志物筛查内分泌干扰物的准确性。
(1)水-沉积物系统
制备水-沉积物系统方法主要参考《化学品测试方法-生物系统效应卷》(第二版)以及oecd化学品测试导则,选取粉末状的泥炭,用磨土机细(颗粒大小≤1mm),并放置烘箱中烘干,加入适量去离子水并放置在室温下用搅拌机搅拌2-3d,用caco3调节ph至6.5±0.5。然后加入高岭土和石英砂和适量的去离子水混合均匀。整个体系的组分分配如下:(干重)泥炭(4%~5%),(干重)高岭土(20%),(干重)石英砂(75%,粒径在50~200μm)。每个烧杯(500ml)中的沉积物均为100g,倒入培养基(350ml上覆水),最终水份含量为50,水-沉积物体系中水层:沉积物层高度比=4:1。将该体系放置在实验条件下沉淀7d后开始进行实验。
(2)水体加标法全生命周期实验
bpf设置空白对照组、0.05、0.1、0.5、1和5mg/l浓度组。每个浓度8个平行,每个平行的烧杯中20只一龄幼虫。
实验开始前3-4d从培育缸中取出摇蚊新卵串放置呈有培养基的六孔板中,在摇蚊卵孵化出来后用胶头滴管将第一代幼虫(p代)随机加入各烧杯中,烧杯中含有沉积物-水系统。在将幼虫放入容器的同时停止曝气,并保持24h。加入第一代第一龄期幼虫48h后,将受试物加标到上覆层水柱中,再次提供轻微曝气。加入受试物时需将少量的受试物贮备液注入水表面以下的水柱中,然后小心地对上覆水层进行搅拌混合,避免搅动沉积物。加入受试物后,暴露正式开始。等到p代摇蚊羽化后,每天都将羽化出的摇蚊吸出并按照不同浓度放置在新的烧杯中(每个烧杯中有1/4的受试溶液)。且每日记录羽化数量和产卵数量,并将产出卵串吸出放置六孔板中待孵化出一龄期幼虫(即子代幼虫f1),再将f1代加入新的水-沉积物体系中进行第二代摇蚊全生命周期实验。
(4)数据分析
羽化率、发育率、性别比和繁殖力用单因素方差分析(dunnett’stests,anova,spss19.0),确定空白组与受试物处理组的差异显著性。
(5)结果
在全生命周期试验中,用超高效液相色谱法分析了水体和沉积物中bpf的分布情况,受试物随着时间的增加,在水-沉积物体系中的总体浓度是呈现下降的趋势,说明可能在会环境中降解但是时间较长,速度较为缓慢。根据oecd导则,通过对理论添加浓度进行时间加权平均计算,得到水体中的bpf时间加权平均浓度为0.0241、0.0427、0.285、0.496和2.43mg/l,所以摇蚊全生命周期毒性试验中bpf浓度全由时间加权平均浓度表示。
5.1羽化率
本案例主要测试了两代摇蚊(亲代:p代;子代:f1代)暴露于bpf不同浓度下的个体指标的变化。bpf浓度为0.496mg/l时,p代总羽化率显著下降,说明此浓度严重抑制了摇蚊的正常羽化。同样浓度的暴露也影响了其子代f1代的羽化率,在0.285mg/lbpf及其更高浓度的影响下,处理组的羽化率与对照组相比显著下降,f1代雄性最低羽化率为15%;可见,bpf对f1代摇蚊的羽化率影响较为明显。
5.2发育率
浓度为0.496mg/l的bpf显著提高了p代总发育率,2.430mg/l时p代雌性和总体发育率均显者上升,但对雄性的发育率无显著影响;对于f1代,0.285mg/l及以上浓度显著提高了雌性的发育率,对雄性无显著影响,表明bpf提高了雌性发育速度。
5.3雌雄比
bpf对摇蚊p代雌性比在统计学上无显著差异,而对f1代的雌性比有显著影响,暴露于2.43mg/lbpf的浓度下时,雌性比(1.40)明显偏离对照组雌性比(ck:0.90)。所以,bpf能够干扰摇蚊子代的性别分化,抑制摇蚊的雄激素效应,促使摇蚊向雌性的方向发展,从而影响摇蚊的繁殖生长。
5.4繁殖力
与空白对照相比,摇蚊两代的繁殖力在bpf的影响下没有显著的变化。
5.5bpf对摇蚊内分泌干扰效应毒性总结
通过水体加标法的全生命周期实验,bpf对伸展摇蚊全生命周期的四个指标的响应情况汇总于表4。bpf对p代雄性和总体羽化率的noec分别0.496mg/l和0.285mg/l,对p代的雌性和总体发育率noec均为0.285mg/l,雌雄比noec为0.496mg/l,对繁殖力无显著的影响;对f1代,雌雄羽化率noec为0.285mg/l,总体羽化率noec为0.0427mg/l,雌性和总体发育率noec分别为0.0427mg/l和0.285mg/l,雌雄比noec为0.496mg/l,对繁殖力无显著影响。
伸展摇蚊全生命周期实验结果证实了bpf对摇蚊羽化、雌雄比例、发育有干扰作用,即对伸展摇蚊有内分泌干扰效应。与实施案例1的结果一致,表明了本发明的科学性和准确性;响应灵敏度(bpf的48h-loec为0.5mg/l,详见实施例1)与oecdtg233方法相当(本案例中bpf对四种检测指标的综合loec为0.285mg/l);此外,本发明方法暴露时间和操作步骤远少于oecdtg233方法,且便于揭示受试物质影响摇蚊内分泌系统的内在机理。
表4.bpf对伸展摇蚊四种检测指标的响应
注:↑表示该指标与对照组(ck和solck)相比显著增加;↓表示该指标与对照组(ck和solck)相比显著降低;表中的数字表示受试物浓度,单位是mg/l
实施例3:
按照本方法开展bpf对幼虫中分子标志物ecr、usp、e74表达的影响,验证验证摇蚊唾腺体外检测技术筛查内分泌干扰物相对于幼虫响应的敏感性。
从培育的摇蚊中选取新卵串6个,每个卵串分开培育直至发育成四龄期幼虫,从3个卵串中分别取出幼虫用于实验,bpf浓度为0.05、0.1、0.5、1和5mg/l,同时设置一组不含受试物的空白对照组,每个浓度8个平行。每个卵串中的幼虫对应一组实验(一组实验即包括空白对照组和浓度处理组)。暴露24h和48h后取出每个烧杯中存活的摇蚊测定分子标志物的表达量。
总rna的提取、质量鉴定和目标基因rt-pcr扩增方法与卵中分子标志物影响实验相同。
24h时,与空白对照组相比,bpf对e74、usp基因的表达量无显著影响,仅在5mg/l时显著降低ecr基因的表达量。48h时,1mg/l及以上浓度处理组ecr和e74表达量显著上升,usp基因在5mg/l时显著上升,表明bpf在较高浓度(1mg/l及以上)及下影响摇蚊幼虫的蜕皮激素调节作用。
因此,根据摇蚊幼虫中分子标志物测定的结果,bpf基于三种分子标志物ecr、usp、e74表达量的loec值分别为1、1、0.5mg/l,此结果高于本发明实施案例1中的loec值(0.5、0.5、0.5mg/l),具体对比结果见表5,表明本发明的检测灵敏度高于现有摇蚊内分泌干扰性测试标准方法。
表5.摇蚊卵和幼虫三种检测指标对bpf响应的对比
注:↑表示该指标与对照组相比显著增加;↓表示该指标与对照组相比显著降低;表中的数字表示受试物浓度,单位是mg/l。
- 还没有人留言评论。精彩留言会获得点赞!