蛋白序列12G12及其用途的制作方法
本发明涉及基因序列领域,尤其是涉及蛋白序列12g12及其用途。
背景技术:
axl受体是酪氨酸蛋白激酶家族的成员之一,被认为是肿瘤治疗的潜在靶标。在许多的肿瘤患者中,axl的所激活的细胞信号通路通常与促进病灶转移、肿瘤抗药性以及病程恶化有关。并且在多种实体瘤和白血病癌细胞中发现其高表达,其表达水平与疾病进程及愈后好坏成正相关。因此,axl可以作为肿瘤治疗的重要靶标,通过寻找axl抑制剂为肿瘤治疗寻找新的治疗途径是有重要意义的。
目前,公开报道或是在研的axl抑制剂大概分为两类:1.axl小分子抑制剂,其主要代表为r428,已经开展非小细胞肺癌、黑色素瘤及急性髓性白血病的临床研究。2.axl抗体及抗体类似物,如genetech公司的yw327.6s2单抗,astellaspharma公司的asp2215其为axl-fc融合蛋白为抗体类似物,还有斯坦福大学研发的axl-fc的突变体myd1。这两类axl的抑制剂都有其各自缺点:1.axl小分子抑制剂其特异性较差,因此在抑制axl该靶标时其对其他类似靶标也会产生抑制,负作用较多。2.axl抗体及抗体类似物,其为糖蛋白,因此在生产过程中主要用哺乳动物细胞进行表达,生产工艺复杂,质控及生产成本高。
技术实现要素:
本发明的目的在于提供一种具有生产方便及效率高,具有axl抑制剂功能的蛋白序列12g12。
为实现上述目的,本发明提供一种蛋白序列,所述序列如seqidno:1所示。
本发明还提供所述蛋白序列对应的核酸序列,所述序列如seqidno:2所示。
本发明还提供一株表达载体,含有所述蛋白的重组载体。
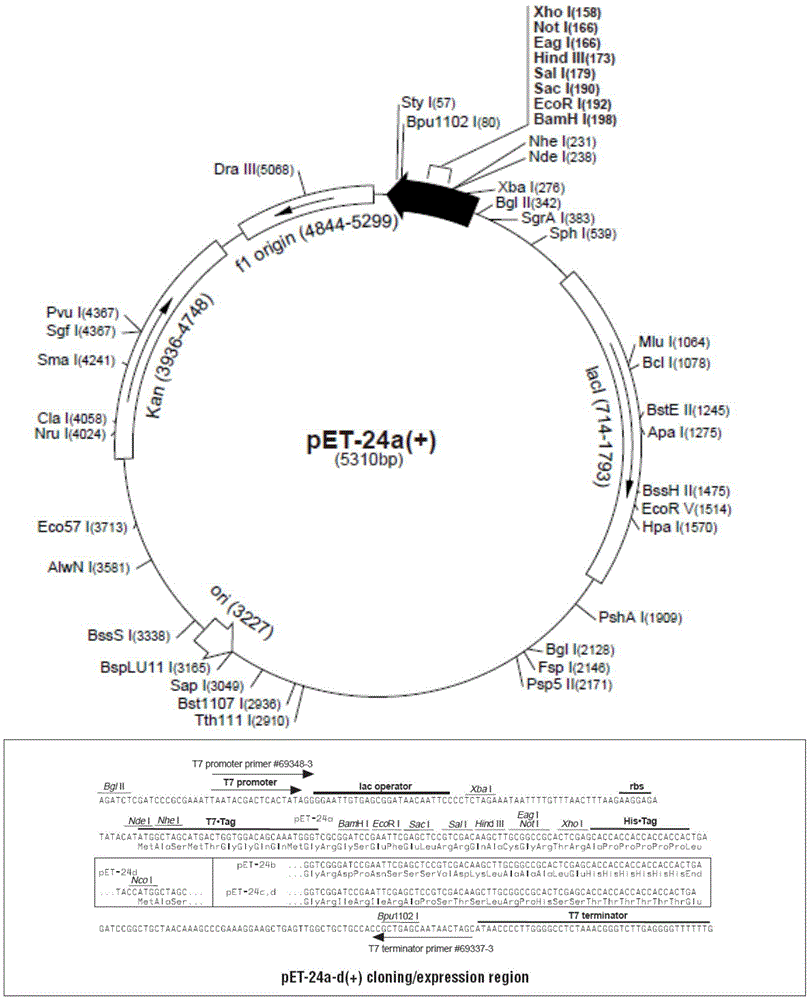
进一步,所述重组载体的载体为pet-24a。
本发明还提供一种所述蛋白序列的制备方法,其特征在于,步骤为,
将seqidno:2连接到pet-24a载体上,构建好的表达载体转入到dh5α中进行扩增,提取表达载体转入bl21构建表达菌株,通过抗性筛选选择阳性克隆,进行菌株扩增,将获得的菌株培养扩增,当od600值达到0.6-0.9时,加入iptg诱导表达12-20h,收集菌体进行菌体破碎;离心收集上清,上清经镍柱亲和层析即制备得到seqidno:1所示蛋白。
本发明还提供所述蛋白序列用于axl抑制剂的用途。
本发明还提供所述蛋白序列具有在a549细胞中抑制axl磷酸化的用途。
本发明还提供所述蛋白序列具有在mda-mb-231细胞中抑制axl磷酸化的用途。
本发明还提供所述蛋白序列具有抑制肿瘤细胞活性的用途。
本发明的申请人合成了一段蛋白(命名为12g12),其具有axl抑制剂的功能,其分子结构稳定,分子量较小,93aa,约为10kd,非糖蛋白可以进行原核表达,在ecoli系统中可进行可溶性表达且表达量较高,大大降低了生产工艺的复杂程度和成本。
nvspprrarvtdatettitiswrtktetitgfqvdavpangqtpiqrtitatisgytitglqpgtdykiylytlngygvgtvrsspvvidastseqidno:1;
其对应的核酸序列为:
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccattaccattagctggcgcaccaaaaccgagaccattaccggctttcaggtggatgccgtgccggcaaatggtcagaccccgattcagcgtaccattaccgccaccatcagcggttataccattaccggtctgcagccgggcaccgactacaagatctacctgtacaccctgaacggctatggtgttggtaccgtgcgcagcagcccggtggtgattgatgccagcacc
seqidno:2。
蛋白合成的技术路线:
将人工合成的12g12的dna序列(seqidno:2)连接到pet-24a载体上,构建好的表达载体转入到dh5α中进行扩增,提取表达载体转入bl21构建表达菌株,通过抗性筛选选择阳性克隆,进行菌株扩增,将获得的菌株在37℃培养扩增,当od600值达到0.6-0.9时,加入iptg诱导,25℃低温表达16h,收集菌体进行菌体破碎。离心收集上清,上清经镍柱亲和层析可获得90%以上的目标蛋白。
有益效果:本发明所述蛋白能与癌症治疗靶标axl结合,并抑制其下游信号通路,从而抑制肿瘤细胞活性,并在细胞水平上得以证明。同时其对应的dna序列利于在ecoli系统中进行可溶性表达。既克服了axl小分子抑制剂特异性差,又克服了axl抗体类抑制剂生产工艺复杂,生产质控成本高的缺点,为寻找axl抑制剂提供了新的方向。
附图说明:
图1是pet-24a载体图谱;
图2是12g12菌体表达的细胞上清的sds-page结果图;
图3是经镍柱纯化后12g12菌体表达的细胞上清的sds-page结果图;
图4是12g12洗脱纯化后的sds-page结果图;
图5是12g12体外活性测定结果图;
图6是12g12在a549-luc细胞中抑制axl磷酸化实验结果图;
图7是12g12在mda-mb-231-luc细胞中抑制axl磷酸化实验结果图。
具体实施方式
下面详细描述本发明的实施例,所述实施例的示例旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
蛋白的活性测定:
axl为是酪氨酸蛋白激酶家族的成员,其活性是通过形成二聚体或是其配体gas6蛋白与其结合并使自身磷酸化后导致下游信号通路的激活,并发挥生物学效应。因此要检测蛋白12g12是否具有抑制axl的活性方法。通过检测蛋白能否抑制axl的磷酸化从而导致下游信号通路的活性丧失来作为体外活性实验判定的依据。具体实验操作通过wb(westernblot)来验证axl磷酸化的蛋白量,来比较抑制活性的强弱,期间引入axl的磷酸化小分子抑制剂r428作为阳性对照,以此来判断模型是否构建成功。
具体技术流程如图所示:通过facs(流式细胞仪)从候选的转移肿瘤细胞系中筛选出axl高表达的细胞系用于活性细胞试验模型的构建,并通过将候选的细胞模型分别与三类蛋白与阳性对照和阴性对照共培养并加入配体gas6共刺激,之后弃上清,收集细胞破碎后进行wb试验,平行比较paxl(磷酸化的axl蛋白)的表达差异。
实施例1:pet-24a/12g12表达菌株的构建
将12g12的蛋白序列(seqidno:1)转化为dna序列并经优化(选择ecoli系统常用的密码子,同时平衡gc碱基的分布,使其分布均匀,降低二级结构形成的概率等)后的序列(seqidno:2),在seqidno:2前后两端分别加入ndei(catatg)和xhoi(ctcgag)双酶切位点后人工合成seqidno:3(给苏州金唯智生物科技有限公司公司),合成后的序列seqidno:3双酶切(ndei和xhoi)后连接到同样双酶切的pet-24a载体上,转入dh5α菌体扩增并提质粒,获得表达载体。
再将表达载体转化bl21,通过kanamycin筛选阳性菌株,获得表达菌株。获得的菌体小量表达结果如图2所示。其中泳道1为分子标准蛋白,泳道2为12g12菌体表达的细胞上清。从图2的sds-page电泳图可知,在12g12菌体表达的细胞上清中在10-15kd分子量内有目的蛋白表达,目的蛋白分子量与理论值一致(10.8kd)。构建好的表达菌株冻存到-80℃冰箱备用。
实施例2:12g12表达菌株扩大培养及蛋白纯化
将实施例1所得表达菌株通过以下步骤进行菌株的复苏,种子扩大及iptg诱导发酵及纯化最终得到纯度>90%以上的目的蛋白,纯化后蛋白sds-page结果详见图3。其中泳道1为纯化后的12g12蛋白,泳道2为分子标准蛋白。从sds-page电泳图可知在12g12菌体表达的细胞上清,经镍柱纯化后目的蛋白纯度达到90%以上。
(1)将冻存于-80℃的目的甘油菌用lb液体培养基稀释10万倍,涂布于带有50μg/mlkan的琼脂板上(或者用灭菌枪头刮取甘油菌,划线于琼脂板上),在37℃恒温箱中倒置培养过夜(约16h);
(2)挑取单菌落接种于50mllb含50μg/mlkan液体培养基中(37℃,180rpm条件下振荡过夜培养(约16h);
(3)将4ml小摇种子菌液接种于400ml(1:100)含50μg/mlkanlb液体培养基中,37℃,250rpm条件下振荡培养至od600达到0.7-0.8时;
(4)立即加入1m的iptg至终浓度为0.5mm(1:2000),在25℃,180rpm条件下振荡培养16h;
(5)收集菌液,4℃,5500rpm离心10min,弃上清;
(6)加入1/20(若包涵体较多可适当扩大比例)培养体积的pbsbuffer(ph7.4)重悬菌体;
(7)均质机破碎重悬菌液:清洗管道后用在2-8℃环境下,压力(1000-1400bar)反复破碎3h;
(8)收集破碎液,4℃,10000rpm离心20min后回收上清;
(9)蛋白纯化:向上清液中加入0.1%的tritonx-100和10mm的imidazole,混匀后,过镍柱,冲平后,最终用50mm的imidazol洗脱目的蛋白(12g12洗脱纯化后的sds-page结果如图4所示)。其中泳道1为分子蛋白marker,泳道2为穿透tritonx-100+10mm咪唑所得,泳道3为50mm咪唑洗脱所得。从sds-page电泳图可知12g12菌体表达的细胞上清,大部分杂蛋白在tritonx-100+10mm咪唑的条件下不予镍柱结合穿透流出(如泳道2),而目的蛋白带有his标签与镍柱结合从而达到分离的目的,并在50mm咪唑条件下洗脱,12g12的纯度达到90%以上(如泳道3)。
实施例3:12g12体外活性测定
1.facs筛选并验证axl高表达细胞株
通过相关文献调研,申请人选择了axl高表达的候选细胞系:a549-luc、mda-mb-231-luc、skov3、nci-h1975-luc,并通过facs进行验证,具体试验方案如下:
1)细胞样品制备:用2ml圆底ep管收集1×106个细胞;800rpm离心5min;弃上清,加入1ml无菌pbs洗细胞沉淀;800rpm离心5min;弃上清,加入100μl无菌pbs重悬细胞;将细胞悬液转入96孔圆底板。
2)一抗(anti-axl抗体)孵育:向细胞悬液中加入anti-axl抗体,4℃孵育60min。
3)清洗anti-axl抗体:将96孔圆底板按2000rpm×3min离心,弃上清;加入200μlpbs洗去未结合的一抗,离心2000rpm×3min,弃上清。
4)二抗(pegoatanti-mouseigg)孵育:加入相应体积的二抗,吹打重悬,4℃避光孵育1小时;离心机2000g,3分钟,离心;去上清,用200μlpbs清洗重悬,重复三遍。
5)上机检测,检测结果如5所示:a549-luc、mda-mb-231-luc、skov3三株细胞中axl高表达。如图5所示横坐标fl2-h表示的是在该通道下所检测的荧光信号值大小,纵坐标表示的细胞数,由于检测原理是将细胞与抗axl抗体孵育后(对照组未加入抗体孵育)然后上机,当细胞上结合的axl抗体越多所检测的荧光信号值越大,图中的两个峰值表示的在不同荧光信号下的细胞数。例如图5的(a)所示,靠近零点即左边的峰为skov3-control表示为未与axl抗体孵育的skov3的细胞信号值的范围在100-101,中位数为4.72,并将该范围内的荧光信号的细胞读值判定为axl-(即axl不表达的细胞),图像右边的峰为skov3与axl抗体孵育后上机检测的图,从图中可知大部分的细胞荧光信号强度在102-104,中位数为334,并按照两条横线的范围分别对skov3的信号值进行积分,axl-荧光信号范围内的细胞数占skov3总细胞数比例为0.521%,axl+荧光信号范围内的细胞数占skov3总细胞数比例为99.5%。由此可知skov3为axl高表达细胞株。同理判定a549-luc(b)、mda-mb-231-luc为axl高表达(c),nci-h1975-luc(d)为axl低表达或不表达细胞株。
2.axl抑制剂在a549细胞中抑制axl磷酸化实验结果
将a549细胞复苏后在完全培养基(f-12k+10%fbs+0.8μg/mlpuromycin)中培养1-2天使细胞汇合度达到70-80%。移除培养基,用pbs清洗细胞,并加入无血清培养基(f-12k)饥饿培养过夜,收集细胞,加入含不同抑制剂浓度的培养基重悬细胞并在37℃下孵育3h,收集细胞进行westernblot(wb)实验(一抗选用r&d公司的humanphospho-axl(y779)antibody)。结果见图6的12g12在a549-luc细胞中抑制axl磷酸化实验结果图。inhibitorcnoc.表示抑制剂与细胞共孵育的浓度,paxl表示axl磷酸化的蛋白量,totalaxl表示axl总蛋白量,β-actin表示β-肌动蛋白表达量(系统内参);nc表示细胞未与抑制剂共孵育,pc-r428为axl小分子抑制剂在此作为阳性对照,12g12为目的蛋白,底下的0、33.3、50、100为抑制剂浓度单位为μm。从图中可知β-actin在各抑制剂浓度下蛋白表达量一致,说明用于wb的细胞量和基础状态一致;totalaxl在r428和12g12的各种浓度下蛋白表达量一致,表明r428和12g12不影响a549-luc细胞中axl的表达;通过比较paxl在不同抑制剂浓度下表达量可知:pc-r428,50μm条件下可以抑制a549-luc中paxl的表达,在100μm条件下几乎完全抑制;12g12,在33.3、50、100μm条件下都能不同程度的抑制a549-luc中paxl的表达,且在50、100μm条件下完全抑制paxl的表达。
综上所述,从图6的wb结果中可以看出axl抑制剂(12g12)以及阳性对照pc-r428分别以33.3,50,100μm的浓度进行实验,通过paxl表达量可知,pc-r428在100μm完全抑制a549-luc细胞中axl的磷酸化,所以细胞模型构建可靠;因此可以表明12g12在33.3,50,100μm的浓度下可以抑制a549-luc细胞中axl的磷酸化其中50和100μm条件下完全抑制其磷酸化;从而为其在体内活性试验中去验证12g12抑制肿瘤细胞a549-luc的转移及抗药性提供可靠依据。
3.axl抑制剂在mda-mb-231细胞中抑制axl磷酸化实验结果
将mda-mb-231细胞复苏后在完全培养基(rpmi1640+10%fbs)中培养1-2天使细胞汇合度达到70-80%。移除培养基,用pbs清洗细胞,并加入无血清培养基(rpmi1640)饥饿培养过夜,收集细胞,加入含不同抑制剂浓度的培养基重悬细胞并在37℃下孵育3h,之后加入终浓度为2μg/ml的gas6共刺激30min后收集细胞进行westernblot(wb)实验。结果见图7的12g12在mda-mb-231-luc细胞中抑制axl磷酸化实验结果图。其中:inhibitorcnoc.表示抑制剂与细胞共孵育的浓度,paxl表示axl磷酸化的蛋白量,totalaxl表示axl总蛋白量,β-actin表示β-肌动蛋白表达量(系统内参);nc表示细胞未与抑制剂共孵育,pc-r428为axl小分子抑制剂在此作为阳性对照,12g12为目的蛋白,底下的0、33.3、50、100为抑制剂浓度单位为μm。从图中可知β-actin在各抑制剂浓度下蛋白表达量一致,说明用于wb试验的细胞量和基础状态一致;totalaxl在r428的各种浓度下蛋白表达量一致,表明r428不影响a549-luc细胞中axl的表达,但是totalaxl在12g12各暴露浓度下存在一定的表达量降低,说明12g12可以部分抑制a549-luc细胞中axl的表达;通过比较paxl在不同抑制剂浓度下表达量可知:pc-r428,50μm条件下可以抑制mda-mb-231-luc中paxl的表达,在100μm条件下几乎完全抑制;12g12在100μm条件下能够部分抑制mda-mb-231-luc中paxl的表达。
综上所述,从图7的wb结果中可以看出axl抑制剂(12g12)以及阳性对照pc-r428分别以33.3,50,100μm的浓度进行实验,通过paxl表达量可知,r428在50,100μm完全抑制细胞mda-mb-231-luc的磷酸化,所以细胞模型构建可靠;因此可以表明12g12在33.3,50,100μm的各浓度下可以抑制axl的表达且在100μm可以部分抑制mda-mb-231-luc对axl的磷酸化;从而为其在体内活性试验中去验证12g12抑制肿瘤细胞mda-mb-231-luc的转移及抗药性提供可靠依据。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
sequencelisting
<110>未名生物医药有限公司
<120>蛋白序列12g12及其用途
<130>wmsm-18003-cni
<160>2
<170>patentinversion3.5
<210>1
<211>93
<212>prt
<213>人工合成
<400>1
asnvalserproproargargalaargvalthraspalathrgluthr
thrilethrilesertrpargthrlysthrgluthrilethrglyphe
glnvalaspalavalproalaasnglyglnthrproileglnargthr
ilethralathrileserglytyrthrilethrglyleuglnprogly
thrasptyrlysiletyrleutyrthrleuasnglytyrglyvalgly
thrvalargserserprovalvalileaspalaserthr
<210>2
<211>279
<212>dna
<213>人工合成
<400>2
aatgtgagcccgccgcgtcgtgcacgtgttaccgatgccaccgaaaccaccattaccatt60
agctggcgcaccaaaaccgagaccattaccggctttcaggtggatgccgtgccggcaaat120
ggtcagaccccgattcagcgtaccattaccgccaccatcagcggttataccattaccggt180
ctgcagccgggcaccgactacaagatctacctgtacaccctgaacggctatggtgttggt240
accgtgcgcagcagcccggtggtgattgatgccagcacc279
- 还没有人留言评论。精彩留言会获得点赞!