一种刺梨多糖及其制备方法与应用与流程
本发明涉及刺梨多糖,具体涉及一种具有调节肠道微生态的刺梨多糖及其制备方法与应用,属于保健食品领域。
背景技术:
刺梨(roseroxburghiitratt)又名文先果、送春归,是蔷薇科蔷薇属落叶灌木,其果实富含黄酮、多糖、维生素、超氧化物歧化酶和有机酸等营养元素,具有很高的营养价值。刺梨作为具有地域特色的药食两用植物,也被人们当作中药食用。传统医学主要以刺梨根、叶以及果实等入药,用于消食健脾、止泻、解暑等功效,对于治疗积食腹胀、高血脂、肠炎、高血压、夜盲症、维生素c缺乏症等疾病都有一定的效果,其中《本草纲目拾遗》、《黔书》等对其药理作用均有详实的记载,它同时也被《贵州省中药材、民族药材质量标准》收录。近些年随着众多专家对刺梨的深入研究,刺梨的药食两用价值逐渐被相关研究所证实,目前发现刺梨具有增强免疫、抗辐照、抗癌、降血脂、降血糖、助消化以及抗氧化等功能,许多与刺梨相关的食品和药品等也出现在人们的生活中。
现代药理学研究已证明植物多糖具有多种生物活性,包括抗氧化、抗癌、抗炎,降血压、降血糖、降血脂、增强免疫等功能,而且作用途径具有多靶点、多效应、多层次等特点,植物多糖在食品、药品以及保健品等领域的应用也越来越广泛。刺梨多糖作为刺梨果实中的重要功能成分之一,近些年来也得到了广泛的研究。
中国发明专利cn201010550315.5公开了一种刺梨多糖的电离辐射防护新用途,该专利通过水提醇沉的方法,制备刺梨粗多糖,以电离辐射后的v79细胞和60coγ射线照射的昆明小鼠为研究对象,说明刺梨多糖具有电离辐射防护的药用活性。中国发明专利cn200510110737.x公开了刺梨多糖的新作用,该专利报道了刺梨多糖在治疗神经干细胞损伤中的新功能。然而有关刺梨多糖调节肠道微生物,促进肠道健康的研究未见报道。
双歧杆菌和乳酸菌作为肠道微生态中的有益菌,在维护机体健康方面有着重要的作用,这些有益菌和宿主形成共生关系,会分泌乳酸和短链脂肪酸等有益健康因子,参与机体的免疫、营养吸收、消化和保护等过程。特别是双歧杆菌作为肠道中的优势菌群之一,其定植黏附在人的肠上皮细胞,可以抑制肠道中有害微生物的生长,能激活宿主的肠黏膜免疫系统,调理和改善炎症性肠病,也具有预防结肠癌等作用。
中国发明专利cn201610545612.8公开了一种制备具有肠道益生功能的茯砖茶茶多糖的方法,该专利通过水提法,sevage法脱蛋白以及deaesepharosefastflow柱层析得到一种茯砖茶茶多糖,经过体外厌氧发酵实验,结果表明茯砖茶茶多糖可以特异性的刺梨乳酸菌、双歧杆菌以及发酵液中菌群总数的增加。中国发明专利cn201610545612.8公开了一种专一性增殖肠道双歧杆菌的益生元,该益生元为乳糖-n-二糖,半乳糖-n-二糖,或含有乳糖-n-二糖,半乳糖-n-二糖的寡糖或多糖或糖或糖类衍生物,都具有促进肠道双歧杆菌增殖的作用。
刺梨多糖作为刺梨中的主要功能成分之一,来源广泛,由多种单糖组成,具有较好水溶性和稳定性,可以用于液体、固态、粉末、片剂、冲剂,胶囊,口服液等保健品中,具有较好的市场应用价值。
技术实现要素:
本发明所要解决的技术问题在于对刺梨中的一种多糖进行有效分离和纯化,并对其结构进行分析和其作为益生元的潜力进行研究,提供一种安全可靠且具有促进肠道健康作用,且具有降血糖作用的刺梨多糖及其制备方法。
本发明以刺梨果实为研究对象,分离纯化出一种酸性多糖,并系统研究其结构特征和益生元作用。本发明制备的刺梨多糖纯度高,分子量均一,与现有的刺梨多糖不同,经过体外发酵实验,刺梨多糖可以促进乙酸、丙酸和丁酸等短链脂肪酸的生成,促进乳酸菌和双歧杆菌有益菌的生长,可以作为益生元,同时刺梨多糖可以抑制α-葡萄糖甘酶活性,可以用于肠道疾病和糖尿病的辅助治疗健康食品或药物中。
本发明目的通过以下技术方案实现:
一种刺梨多糖的制备方法,包括以下步骤:
1)原料预处理:将刺梨鲜果清洗,干燥,粉碎;以g和ml分别为质量和体积单位,将刺梨干粉和乙醇按照固液质量体积比1:4~1:6混合,于60~80℃加热回流2~4h,过滤得到残留物,重复加热回流和过滤,残留物干燥;
2)提取:以g和ml分别为质量和体积单位,将经预处理的刺梨干粉按料液质量体积比为1:15~1:35与水混合,于温度为55~95℃下浸提,浸提时间为1.5~3.5h,浸提次数为1~4次;离心分离得到刺梨多糖提取液,减压浓缩到原体积的1/3~1/6,得到刺梨多糖的浓缩液;
3)脱蛋白:采用sevag法对刺梨多糖浓缩液进行脱蛋白处理,多糖浓缩液与sevag试剂的体积比为3:1~5:1,振荡20~40min,离心后保留上层糖液;
4)脱色:将步骤3)中脱蛋白后的刺梨多糖提取液减压浓缩到原体积的1/2~1/4,加入大孔树脂,进行脱色处理;浓缩液与大孔树脂的体积比为6~8:1,温度为30~40℃,时间为8~12h,过滤后得到脱色后的多糖滤液;
5)醇沉:将步骤4)中浓缩液加入无水乙醇,调节乙醇的最终体积浓度为65~80%,在0~5℃中静置24~48h,离心得到刺梨多糖沉淀,冷冻干燥后得到刺梨粗多糖;
6)分离纯化:将步骤5)中的刺梨粗多糖加水配成15~25mg/ml溶液,采用离子交换柱层析对刺梨粗多糖进行分离纯化,依次用水和nacl溶液进行梯度洗脱,控制洗脱液流速为0.5~1.5ml/min,每管收集2.5~7.5ml,分管收集,苯酚硫酸法检测多糖,测定490nm下的吸光度,绘制洗脱曲线,收集同一洗脱峰下的洗脱液,合并后进行浓缩透析,再经过冷冻干燥处理,得到刺梨多糖。
为进一步实现本发明目的,优选地,刺梨鲜果清洗后干燥为鼓风干燥,干燥温度低于65℃;所述粉碎后过40-60目筛;所述重复加热回流和过滤的次数为2~5次;所述残留物干燥的温度为45~65℃,时间为24~72h。
优选地,步骤2)所述的离心分离的离心力4000~8000g,离心时间5~15min。
优选地,,所述的离心后保留上层糖液的离心力4000~8000g,离心处理的时间为10~20min;步骤3)重复振荡和离心处理10~25次。
优选地,步骤5)中,所述的离心得到刺梨多糖沉淀的离心力4000~8000g,离心时间为10~20min。
优选地,步骤6)中,所述的离子交换柱层析所用填料为deae-sepharosefastflow、deae-52cellulose、cm-sepharosefastflow、sp-sepharosefastflow或sepharosexl。
优选地,步骤6)中,所述浓缩透析是用截留分子量为1000-5000da的透析袋透析,透析时间为24-48h,透析的温度为0~5℃。
优选地,所述sevag试剂的氯仿和正丁醇体积比为3:1~6:1;所述的大孔树脂为ab-8、大孔树脂d101或聚酰胺树脂;所述的nacl溶液的浓度为0.1~0.5mol/l。
一种刺梨多糖,由上述的制备方法制得,所述刺梨多糖主要由葡萄糖、半乳糖、阿拉伯糖、木糖和岩藻糖组成;以摩尔百分比计,所述刺梨多糖的糖苷键包括20%~40%的(1→5)-阿拉伯糖,20%~30%的(1→6)-半乳糖,2%~10%的(1→4)-葡萄糖,10%~20%的(1→3,4)-岩藻糖,还包括1~2%的端基-木糖和2~4%的(1→3,6)-甘露糖;
所述刺梨多糖具有肠道益生功能,增加肠道中双歧杆菌和乳酸菌的数量,降低肠道ph,促进肠道中短链脂肪酸的生成;
所述刺梨多糖具有抑制α-葡萄糖甘酶活性功能。
所述刺梨多糖的均值分子量为67.2kda;
本发明制得的刺梨多糖具有调节肠道ph值,促进肠道中双歧杆菌和乳酸菌的增殖生长。所述的刺梨多糖可以作为益生元,应用到相关保健食品的开发。所述的刺梨多糖在刺梨多糖口服液、刺梨多糖益生元胶囊、刺梨多糖益生元含片制备中的应用。
与现有技术相比,本发明具有如下效果和优点:
1)本发明提取的刺梨多糖为一种新型多糖,分子量均一,结构明确。本发明得到的刺梨多糖均值分子量为67.2kda,该多糖由葡萄糖、半乳糖、阿拉伯糖、木糖、岩藻糖等组成,主要糖苷键分别有20%~40%的(1→5)-阿拉伯糖,20%~30%的(1→6)-半乳糖,2%~10%的(1→4)-葡萄糖,10%~20%的(1→3,4)-岩藻糖。同时,还包括少部分端基-木糖和(1→3,6)-甘露糖。现有技术中杨江涛等分离出一种刺梨多糖组分rrtp-1,其分子量为3200da,单糖组成为鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖和葡萄糖等组成[杨江涛、杨娟、谢红等,刺梨多糖粗品与纯品体外抗氧化作用,食品工业科技,2008,02]。chen等纯化分离出一种刺梨多糖rrtp1-1,分子量为97.58kda,其单糖组成主要为葡萄糖,其糖苷键组成主要为(1→6)-α-d-葡萄糖[chen,g.kan,j.characterizationofanovelpolysaccharideisolatedfromrosaroxburghiitrattfruitandassessmentofitsantioxidantinvitroandinvivo.internationaljournalofbiologicalmacromolecules,2018,107]。本发明制备的刺梨多糖与已知报道的刺梨多糖的分子量,单糖组成等均不相同,糖苷键组成也完全区别于现有已知的刺梨多糖,可以确定为一种新型刺梨多糖,其糖苷键主要组成为(1→5)和(1→6)糖苷键,存在较多的侧链和分支结构,这些结构的存在,可以使刺梨多糖避免被淀粉酶等消化酶分解,最后进入人体的大肠发酵分解,发挥益生元的作用。
2)本发明制备的刺梨多糖其单糖组成由葡萄糖、半乳糖、阿拉伯糖、木糖、岩藻糖等组成,单糖组成多样,不需要多种益生元的复配,刺梨多糖中存在的多种单糖均可以参与肠道微生物的代谢过程产生短链脂肪酸。
3)本发明得到的刺梨多糖作为新型刺梨多糖,具有新的功能,可以作为益生元,增加肠道中双歧杆菌和乳酸菌的数量,调节肠道ph,促进肠道中乙酸、丙酸和丁酸等短链脂肪酸的生成,可以开发为调节肠道菌群结构的保健品。
4)大多数商业用的益生元多为寡糖,如低聚果糖、低聚半乳糖等,用多糖制备益生元尚未见报道,本发明制备的刺梨多糖是从刺梨果实中分离出来,来源广泛,而且本发明制得刺梨多糖具有抑制α-葡萄糖甘酶活性的作用。相比于其他低聚糖,刺梨多糖同时还具有降糖活性,多种功能之间相互协同,具有更好的开发成益生元产品的优势。
5)刺梨作为一种水果,色素含量较高,本发明采用大孔树脂对多糖浓缩液进行动态吸附,并结合deae-sepharosefastflow柱层析进行脱色,两个操作步骤相结合,达到理想的脱色效果,避免了采用传统静态吸附过程繁琐,耗时长,处理过程多糖损耗高的缺点。本发明得到的刺梨多糖纯度在90%以上,蛋白质含量小于4%。另外,纯化分离多糖过程中,采用deae-sepharosefastflow柱,并结合蒸馏水和氯化钠溶液梯度洗脱,本发明与其它公开的纯化技术相比,无需再经葡聚糖凝胶柱进一步分离,就能得到分子量均一的刺梨多糖。
6)本发明制备方法制备的多糖产率高,工艺简单易行,并且适合大规模的工业化生产;该方法同样适用于从刺梨果渣中提取多糖,可以提高刺梨的综合利用率,避免浪费,提高刺梨的附加值,具有广阔的市场应用前景。
附图说明
图1为实施例1刺梨粗多糖deae-sepharose柱洗脱曲线图。
图2为实施例1产品的离子色谱图。
图3为实施例1产品的gpc谱图。
图4为实施例1产品的红外光谱图。
图5为实施例1产品随发酵时间增加体系ph值的变化。
图6为实施例1产品随发酵时间增加体系碳水化合物含量的变化。
图7为实施例1产品随发酵时间增加体系中乙酸含量的变化图。
图8为实施例1产品随发酵时间增加体系中丙酸含量的变化图。
图9为实施例1产品随发酵时间增加体系中正丁酸含量的变化图。
图10为实施例1产品随发酵时间增加体系中异丁酸含量的变化图。
图11为实施例1产品随发酵时间增加体系中正戊酸含量的变化图。
图12为实施例1产品随发酵时间增加体系中异戊酸含量的变化图。
图13为实施例1产品随发酵时间增加体系中总短链脂肪酸含量的变化图。
图14为实施例1产品随发酵时间增加体系中双歧杆菌含量的变化。
图15为实施例1产品随发酵时间增加体系中乳酸菌含量的变化。
图16为实施例1产品对α-葡萄糖甘酶抑制效果。
具体实施方式
为更好地理解本发明,下面结合实施例对本发明做进一步的说明,但本发明的实施方式不限于此。
实施例1:
一种刺梨多糖的制备方法,包括以下步骤:
(1)原料预处理:将刺梨鲜果清洗放入托盘中,在60℃鼓风干燥箱中干燥48h。粉碎,过40目筛,按照刺梨干粉和95%乙醇(v/v)配成固液比1:6g/ml,于70℃水浴锅中加热回流4h,过滤得到残留物,加热回流和过滤重复4次,将脱脂后的刺梨干粉放入45℃的鼓风干燥箱中干燥48h。
(2)将处理后的刺梨干粉150g,加入蒸馏水进行热水浸提,浸提温度95℃,时间3h,料液比1:30(质量和体积的单位分别为g和ml),浸提次数为2次;离心力5000g,离心10min,收集上清液于55℃下旋转蒸发浓缩至原体积的1/4,得到刺梨多糖的浓缩液。
(3)在步骤(2)刺梨多糖的浓缩液中加入sevag试剂,sevag试剂由体积比4:1的氯仿与正丁醇组成,控制刺梨多糖的浓缩液与sevag试剂的体积比为3:1,振荡30min,离心分离上层糖液,离心力5000g,离心时间为10min,振荡和离心过程重复操作12次,直至肉眼观察无蛋白残留,减压浓缩到原体积的1/3。
(4)在步骤(3)脱蛋白后的糖液中加入大孔树脂ab-8,进行静态吸附色素处理,使多糖浓缩液与大孔树脂的体积比为6:1,温度37℃,在摇床上振荡处理10h,过滤得到滤液。
(5)在步骤(4)脱色后的滤液中加入无水乙醇,边加入乙醇边搅拌,使乙醇的体积浓度达到70%,4℃下静置24h,离心力5000g,离心10min得到下层的多糖沉淀,冷冻干燥48h,得到水溶性刺梨粗多糖,经称量计算刺梨粗多糖的产率为3.57%(以刺梨原料干粉重量计)。
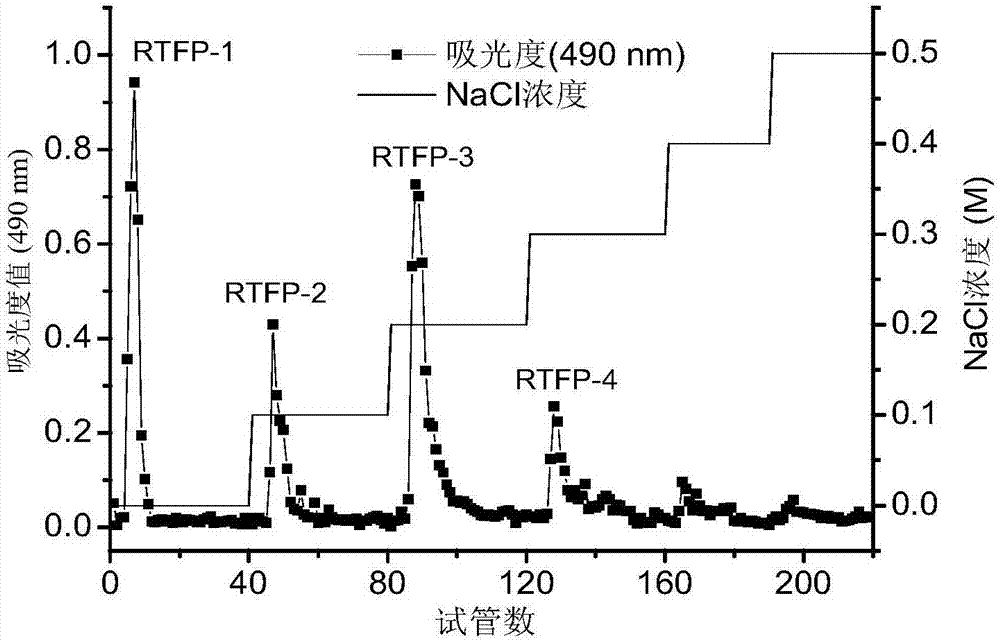
(6)纯化:将水溶性刺梨粗多糖用蒸馏水溶解,配制成终浓度为20mg/ml的多糖溶液,上样于deae-sepharosefastflow柱,上样量体积与柱体积比为1:4,先后用蒸馏水,0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行梯度洗脱,洗脱液流速为1.0ml/min,每管收集5ml,苯酚硫酸法检测多糖,测定490nm下的吸光度,绘制洗脱曲线(图1),收集洗脱液。其中用蒸馏水洗脱的组分命名为rtfp-1,用0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行洗脱组分分别命名为rtfp-2、rtfp-3和rtfp-4。
将rtfp-3组分于4℃环境中透析48h,然后对rtfp-3组分进行真空冷冻干燥得到纯化后的刺梨多糖成品。刺梨多糖离子交换柱层析洗脱曲线如图1所示。其中rtfp-3组分得率最高,rtfp-1、rtfp-2和rtfp-4分别次之。rtfp-1、rtfp-2和rtfp-4组分的特性与rtfp-3组分基本相同。
实施例2:
一种刺梨多糖的制备方法,包括以下步骤:
(1)原料预处理:将刺梨鲜果清洗放入托盘中,在60℃鼓风干燥箱中干燥48h。粉碎,过50目筛,按照刺梨干粉和95%乙醇(v/v)配成固液比1:5g/ml,于75℃水浴锅中加热回流3h,过滤得到残留物,加热回流和过滤重复3次,将脱脂后的刺梨干粉放入55℃的鼓风干燥箱中干燥36h。
(2)取(1)中处理后的刺梨干粉150g,加入蒸馏水进行热水浸提,浸提温度95℃,时间2h,料液比1:20,浸提次数为3次;离心力8000g,离心5min,收集上清液于45℃下旋转蒸发浓缩至原体积的1/3。
(3)在(2)的浓缩液中加入sevag试剂,sevag试剂组成为氯仿与正丁醇的体积比为4:1,使最终浓缩液与sevag试剂的体积比为5:1,振荡20min,离心分离上层糖液,离心力8000g,离心时间为5min,脱蛋白过程重复操作15次,直至肉眼观察无蛋白残留,减压浓缩到原体积的1/4。
(4)在(3)脱蛋白后的糖液中加入大孔树脂ab-8,进行静态吸附色素处理,使多糖浓缩液与大孔树脂的体积比为4:1,温度37℃,在摇床上振荡处理8h,过滤得到滤液。
(5)在(4)脱色后的滤液中加入无水乙醇,边加入乙醇边搅拌,使乙醇的体积浓度达到60%,4℃下静置24h,离心力5000g,离心10min得到下层的多糖沉淀,冷冻干燥48h,得到水溶性刺梨粗多糖,经称量计算刺梨粗多糖的产率为3.57%(以刺梨原料干粉重量计)。
(6)纯化:将粗多糖用蒸馏水溶解,配制成终浓度为15mg/ml溶液,上样于deae-sepharosefastflow柱,上样量体积与柱体积比为1:4,先后用蒸馏水,0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行梯度洗脱,洗脱液流速为1.0ml/min,每管收集5ml,苯酚硫酸法检测多糖,测定490nm下的吸光度,绘制洗脱曲线,收集洗脱液。其中用蒸馏水洗脱的组分命名为rtfp-1,用0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行洗脱组分分别命名为rtfp-2、rtfp-3和rtfp-4。将rtfp-3组分于4℃环境中透析48h,然后对rtfp-3组分进行真空冷冻干燥得到纯化后的刺梨多糖成品。刺梨多糖离子交换柱层析洗脱曲线同实施例1相似。本实施例rtfp-2和rtfp-4组分和rtfp-3组分特性基本相同。
实施例3:
一种刺梨多糖的制备方法,包括以下步骤:
(1)原料预处理:将刺梨鲜果清洗放入托盘中,在60℃鼓风干燥箱中干燥48h。粉碎,过60目筛,按照刺梨干粉和95%乙醇(v/v)配成固液比1:4g/ml,于80℃水浴锅中加热回流2h,过滤得到残留物,加热回流和过滤重复2次,将脱脂后的刺梨干粉放入65℃的鼓风干燥箱中干燥24h。
(2)取(1)中处理后的刺梨干粉150g,加入蒸馏水进行热水浸提,浸提温度95℃,时间3.5h,料液比1:35,浸提次数为1次;离心力4000g,离心15min,收集上清液于65℃下旋转蒸发浓缩至原体积的1/5。
(3)在(2)的浓缩液中加入sevag试剂,sevag试剂组成为氯仿与正丁醇的体积比为4:1,使最终浓缩液与sevag试剂的体积比为3:1,振荡10min,离心分离上层糖液,离心力4000g,离心时间为20min,脱蛋白过程重复操作10次,直至肉眼观察无蛋白残留,减压浓缩到原体积的1/2。
(4)在(3)脱蛋白后的糖液中加入大孔树脂ab-8,进行静态吸附色素处理,使多糖浓缩液与大孔树脂的体积比为8:1,温度37℃,在摇床上振荡处理12h,过滤得到滤液。
(5)在(4)脱色后的滤液中加入无水乙醇,边加入乙醇边搅拌,使乙醇的体积浓度达到80%,4℃下静置24h,离心力5000g,离心10min得到下层的多糖沉淀,冷冻干燥48h,得到水溶性刺梨粗多糖,经称量计算刺梨粗多糖的产率为3.57%(以刺梨原料干粉重量计)。
(6)纯化:将粗多糖用蒸馏水溶解,配制成终浓度为25mg/ml的多糖溶液,上样于deae-sepharosefastflow柱,上样量体积与柱体积比为1:4,先后用蒸馏水,0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行梯度洗脱,洗脱液流速为1.0ml/min,每管收集5ml,苯酚硫酸法检测多糖,测定490nm下的吸光度,绘制洗脱曲线,收集洗脱液。其中用蒸馏水洗脱的组分命名为rtfp-1,用0.1mol/l,0.2mol/l,0.3mol/l的氯化钠溶液进行洗脱组分分别命名为rtfp-2、rtfp-3和rtfp-4。本发明主要报道rtfp-3组分,将rtfp-3组分于4℃环境中透析48h,然后对rtfp-3组分进行真空冷冻干燥得到纯化后的刺梨多糖成品。刺梨多糖离子交换柱层析洗脱曲线同实施例1相似。本实施例rtfp-2和rtfp-4组分和rtfp-3组分特性基本相同。
按以上实施例1制得的刺梨多糖通过以下方法进行结构鉴定和活性分析,实施例2和3的结果与实施例1相似。
实施例4刺梨多糖的单糖组成分析
采用离子交换色谱测定刺梨多糖的单糖组成。称取5mg样品于5ml安培瓶中,加入5ml的三氟乙酸(2m),酒精喷灯封口密封,置于105℃下水解6h,50℃条件下减压蒸干,并加入适量的甲醇重复操作3次,保证完全去除过量的三氟乙酸,然后将残留物超声溶解,用50ml容量瓶定容,过0.22μm尼龙滤膜进行色谱分析。离子色谱检测条件为:采用离子色谱仪(ics3000,美国戴安公司)进行检测,使用carbopacpa20分析柱(3×150mm),检测器为安培电化学检测器;柱温:30℃;流速:0.5ml/min;进样量:20μl流动相:10%20mmnaoh和90%超纯水(0-16min),10%20mmnaoh,20%500mmch3coona和70%超纯水。称取各种单糖标准品(鼠李糖、木糖、葡萄糖、半乳糖、甘露糖、岩藻糖,阿拉伯糖,葡萄糖醛酸和半乳糖醛酸),分别溶于蒸馏水中,按照上述离子色谱方法进行色谱分析,根据标准品的保留时间,可以确定多糖样品中的单糖组成,并根据各单糖的峰面积及单糖的摩尔质量计算出样品单糖的摩尔百分比。
图2为刺梨多糖rtfp-3的离子交换色谱可知,该刺梨多糖主要由阿拉伯糖,半乳糖,葡萄糖,甘露糖,木糖以及岩藻糖组成,摩尔百分比含量分别为37.2%,35.1%,9.02%,0.15%,0.17%和18.3%,表明该多糖为杂多糖,其主链可能由阿拉伯糖基或半乳糖基组成。
实施例5分子量的测定
多糖样品的分子量采用hp-gpc进行检测,采用美国安捷伦公司的凝胶渗透色谱仪,色谱柱为tsk-g5000pwxl和tsk-g3000pwxl串联柱,流动相为0.02mol/l磷酸盐缓冲溶液;流速为0.6mol/l;柱温为45℃,检测器为2414型示差折光检测器。
如附图3gpc图谱所示,根据标准曲线计算得刺梨多糖的平均分子量为67.2kda。
实施例6刺梨多糖的红外光谱分析
取2mg刺梨多糖rtfp-3与适量干燥的kbr粉末混合均匀,在玛瑙研钵中研磨均匀后取少量混合物压片,制成约1mm厚的透明薄片。把压成的薄片放入ft-ir(傅里叶红外变换光谱仪,型号为vector33,德国bruker公司)中,在400-4000cm-1区间进行扫描,采集样品的红外吸收光谱图。
如附图4所示,多糖样品在3456cm-1附近有一个强而宽的峰,这是属于-oh的特征吸收振动峰;在2929cm-1附近的吸收峰是属于c–h的吸收振动特征峰,这些特征峰的出现可以初步判定该物质属于多糖类化合物;此外,在1744cm-1附近的吸收峰属于乙酰基团或者羧酸脂化合物中的c=o伸缩振动吸收峰,表明该多糖含有糖醛酸;1411和1326cm-1附近的吸收峰是属于-oh的变形振动吸收峰;1240cm-1附近的吸收峰是属于o–c–o伸缩振动吸收峰;1020cm-1附近的吸收峰是属于吡喃糖环的特征振动吸收峰;843cm-1附近的吸收峰表明rtfp-3中存在α-构型的葡萄糖单元。
实施例7多糖甲基化分析
准确称取15mg刺梨多糖,放入20ml具塞试管中,然后向试管中加入4ml用分子筛干燥过的dmso,超声处理使多糖完全溶解,在氮气保护下向其中加入200mg干燥的naoh粉末。继续超声处理60min,使naoh粉末大部分溶解,直至反应体系颜色变成淡黄色,即停止反应。然后在氮气保护下往反应体系中加入3ml碘甲烷,在干燥、透风和避光的环境中静置反应12h。待反应结束后,向试管中加入4ml蒸馏水,停止反应,混合均匀分层后,弃掉上层溶液保留下层溶液,继续加蒸馏水重复操作3次,至溶液中的dmso完全除去。然后,加入4ml氯仿萃取甲基化的多糖,重复加入氯仿萃取5次,合并氯仿萃取液进行旋蒸浓缩后,将浓缩液装入透析袋透析48h,之后冷冻干燥,以上过程重复3次直至多糖完全甲基化。将完全甲基化的多糖放入安培瓶中,加入5ml三氟乙酸后密封处理,在105℃下水解6h。待水解完成后,旋干水解液。用色谱纯甲醇洗涤水解物,反复操作3次去除过量的三氟乙酸。将旋干后的酸水解产物溶解于3ml蒸馏水中,调节溶液为碱性后向其中加入20mg硼氢化钠,混合均匀。室温,轻微振荡,反应12h。反应结束后,用醋酸调节溶液ph值至7,即无气泡产生,旋干反应液。用色谱纯甲醇进行清洗,反复操作3次。随后向其中加入4ml醋酸吡啶(1:1,v/v),在90℃下反应30min,轻微振荡。反应结束后,加入2ml蒸馏水终止反应。接着加入2ml二氯甲烷萃取,充分振荡后静置,重复萃取两次,合并二氯甲烷相。在有机相中加入无水硫酸钠,吸掉多余的水分。用0.22μm的有机滤膜滤过滤后,取样进行gc-ms分析。
gc-ms分析条件:采用安捷伦7890a气相色谱仪进行检测,配备hp-5ms(30m×0.25mm×0.25μm)毛细管柱,以高纯氦气为载气,流速为1ml/min;进样量为1μl,分流比为10:1,进样口温度为250℃。升温程序为:初始温度为150℃,保持2min,然后以10℃/min升温速度升至180℃,保持2min,以15℃/min升温速度升至260℃,保持5min。离子源为电子轰击离子源,离子源温度为250℃,碰撞能量为70ev,质量范围为:m/z33-500。
结果表明:刺梨多糖主要以(1→5)-阿拉伯糖(33.21%),(1→6)-半乳糖(35.72%),和(1→3,4)-岩藻糖(17.22%)糖苷键组成。同时,还包括少部分的端基木糖(1.01%),(1→3,6)-甘露糖(2.42%),(1→4)-葡萄糖(4.27%)和端基葡萄糖(6.15%)糖苷键。
实施例8刺梨多糖(rtfp-3)对肠道的益生功能
采用体外厌氧培养的方法,1l菌群生长培养基包括5g胰蛋白胨,4.5g酵母提取物,4.5gnacl,4.5gkcl,5g葡萄糖,4g黏蛋白,0.69gmgso4·h2o,0.8gl-半胱氨酸hcl·h2o,0.5gkh2po4,0.5gk2hpo4,3g酪蛋白,1.5gnahco3,0.4g胆酸盐,0.005gfeso4·7h2o,0.08gcacl2,1ml吐温80,和4ml树脂天青溶液(0.025%w/v)作为指示剂。培养基在121℃条件下灭菌30min。取120g健康人体粪便混合物,用1l磷酸缓冲溶液均质过滤得到发酵的菌液。然后将40%的发酵菌液、40%的生长培养基和20%的多糖溶液混合均匀,在10%h2,10%co2,和80%n2组成的厌氧培养箱中振荡培养。以蒸馏水代替多糖溶液作为空白对照组。在不同时间点取样,测培养基的ph值,碳水化合物含量,短链脂肪酸的组成和菌群组成。
如图5所示,在发酵初始点(0h),多糖组和空白组两者的ph值无明显差异,随着发酵时间的增加,多糖组和空白组两者培养基的ph值都出现明显的下降,其中多糖组培养基的ph值下降更加明显。这是因为多糖的存在促进相关产酸微生物的生长,包括乳酸菌和双歧杆菌等的生长,ph值的降低可以有效抑制肠道有害菌的增殖。
如图6所示,在发酵24h后,空白组的碳水化合物消耗量达到平衡,无明显的变化,消耗量为45.25%。在整个发酵过程中,多糖组碳水化合物的消耗量呈逐渐上升趋势,当发酵时间为48h时,碳水化合物的消耗量为60.74%。结果表明多糖组有更多的碳水化合物参与到发酵过程中,刺梨多糖可以刺激微生物的生长,使培养基中的碳水化合物消耗量增加。
结果如图7-图13所示,多糖组培养基中乙酸、丙酸、正丁酸、异丁酸、正戊酸、异戊酸以及总脂肪酸含量都要显著高于空白组,特别是乙酸、丙酸和丁酸的含量增加更为明显。这表明刺梨多糖可以促进肠道中短链脂肪酸等益生因子的产生,有显著的促进肠道健康的作用。
如图14和图15所示,双歧杆菌和乳酸菌作为典型的肠道有益菌,常用来评价益生元的效果。多糖组和空白组经过发酵后,培养液中的双歧杆菌和乳酸菌含量都有显著增加。但刺梨多糖组的增加趋势更加明显,在发酵终点48h时,多糖组培养基中双歧杆菌的量是空白组的1.43倍,乳酸菌的含量是空白组的2.18倍。表明刺梨多糖可以有效的促进肠道中双歧杆菌和乳酸菌的生长,可以作为促进肠道健康的益生元,具有作为开发成保健品的潜力。
实施例9刺梨多糖对α-葡萄糖甘酶的抑制作用
所有样品溶液均由ph=6.9磷酸盐缓冲液(0.1m)配制。α-葡萄糖甘酶(终浓度为0.5u/ml),对硝基苯α-d-吡喃葡萄糖苷(ppng终浓度为5mm),刺梨多糖终浓度(0.5~7mg/ml)。将100μl的α-葡萄糖甘酶溶液与100μl多糖溶液混合均匀,在37℃条件下孵育10min,然后向混合溶液中加入100μlppng溶液启动反应,混匀后在37℃条件下孵育20min,最后向反应液中加入1ml碳酸钠溶液(1m)停止反应后,于405nm波长处测定吸光度值。按下列公式计算多糖样品对α-葡萄糖苷酶的抑制率:
α-葡萄糖苷酶抑制率(%)=[1-(asample-acontrol-1)/acontrol-2]×100
公式中asample是刺梨多糖,酶和ppng混合液的吸光度值,acontrol-1是缓冲溶液代替酶溶液后混合物的吸光度值,acontrol-2是缓冲溶液代替样品溶液的吸光度值,本实验用阿卡波糖作为阳性对照。以样品浓度为横坐标,抑制率为纵坐标,绘制抑制曲线,由该曲线计算多糖样品对α-葡萄糖甘酶的半数抑制率。测试结果如图16所示,随着刺梨多糖rtfp-3浓度的升高,对α-葡萄糖甘酶的抑制率也逐渐升高,刺梨多糖对α-葡萄糖甘酶的半数抑制率(ic50)为4.15mg/ml,而同等条件下阿卡波糖对α-葡萄糖甘酶的半数抑制率为2.82mg/ml,表明刺梨多糖可以抑制α-葡萄糖甘酶的活性,但效果要弱于阿卡波糖。
实施例10刺梨多糖口服液的制备
取刺梨多糖溶于无菌超纯水,配制成1mg/ml的多糖溶液,以刺梨多糖计,加入5.0%的蔗糖,3.0%的蜂蜜,0.2%的柠檬酸,0.15%的苯甲酸钠混合均匀后,至溶液澄清无沉淀,罐装于棕色玻璃瓶中,每支10ml,经紫外灭菌处理,即制得刺梨多糖口服液。功能与主治:肠道益生功能,改善肠道微生物组成。用于便秘、腹泻等肠道疾病的辅助治疗。
实施例11刺梨多糖益生元胶囊的制备
取刺梨多糖溶于无菌超纯水,辅料糊精的添加量为50%左右(以刺梨多糖含量计),调节物料相对密度为1.2~1.5,进行喷雾干燥(进风温度为160℃,出风温度为80℃),料液流量700l/h。灭菌后,装入0号胶囊,每粒胶囊可装量0.35g,服用剂量定为每日一次,每次2粒。功能与主治:肠道益生功能,改善肠道微生物组成。用于便秘、腹泻等肠道疾病的辅助治疗。
实施例12刺梨多糖益生元含片的制备
按照刺梨多糖粉44%,蔗糖粉54%,柠檬酸1%的配方混配物料,调整湿度制成软料,过20目筛造粒。再将造好的粒过40目筛后干燥,干燥温度60~70℃、干燥时间为3~4h;然后将1%硬脂酸镁和适量的薄荷脑加入整粒混匀后,用三角形冲模压片机,压片成形;片剂放在紫外线下照射15~20min,然后及时包装。每片质量为1g,一次3片,每日3次。功能与主治:肠道益生功能,改善肠道微生物组成。用于便秘、腹泻等肠道疾病的辅助治疗。
实施例仅用来进一步解释本发明,并非对本发明作任何形式上的限制,在不脱离本发明技术特征的情况下,利用本发明所揭示技术内容所作出局部更动或修饰的等效变换,均仍属于本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!