一种牡蛎来源的ACE抑制及抗肿瘤活性肽的制作方法
本发明属于海洋生物小分子活性肽领域,具体涉及一种牡蛎来源的小分子ace抑制及抗乳腺肿瘤活性肽。
背景技术:
血管紧张素转化酶(ace)可以将血管紧张素ⅰ水解成血管紧张素ⅱ,促使血管进一步收缩,导致血压升高,ace也可通过作用于肾上腺皮质而促进醛固酮的分泌,ace还可以催化具有降压作用的缓激肽水解而使其失去活性。因此,抑制体内ace活性就可以达到降低或者控制血压的目的。血管紧张素转化酶抑制剂是临床上常用的抗高血压药物,如卡托普利、阿拉普利(alacepril)、赖诺普利等,但是此类化学合成药物在临床应用中出现较多副作用,因此食源性的ace抑制肽就由于其生理活性高和毒副作用小等优势而成为研究的热点。
牡蛎,属牡蛎科或燕蛤科,双壳类软体动物,是一种高蛋白、低脂肪、容易消化且营养丰富的食品,食用价值较高,受广大群众喜爱,自古以来牡蛎也是一味中药,具有平肝潜阳、重镇安神、软坚散结、收敛固涩等功效,现代药理研究也表明牡蛎具有提高性功能、强肝解毒、恢复疲劳、增强免疫等众多功效,应用价值较大。
干牡蛎中蛋白质高达45%~57%,属优质的海洋蛋白,利用生物酶解技术制备肽类产品,拓展牡蛎的应用领域并提高其附加值,具有很大的经济价值和社会意义。目前已有众多发明专利报道了利用牡蛎蛋白生产多种不同功能的牡蛎肽,如201710037653.0,201410180185.9,201510727850.6,201711324805.1,201710897189.2等,但是这些产品均是活性肽的混合物,仅有专利200610155824.1报道了一种牡蛎ace抑制肽,其氨基酸序列为vvypwtqrt。
技术实现要素:
本发明针对上述存在问题、现状及发展前景,提供一种牡蛎来源的ace抑制及抗肿瘤活性肽,该活性肽具有ace抑制活性及抗乳腺癌活性,分子量小,活性高、易于分离纯化,制备工艺简单,可用于高血压及乳腺等相关疾病的保健及治疗,在食品、保健品及医药生物领域有广阔的应用前景。
本发明为实现上述目的所采取的技术方案为:一种牡蛎来源的ace抑制及抗肿瘤活性肽,其特征在于,所述活性肽其氨基酸序列为lys-tyr-pro-leu-pro-arg。
以所述活性肽序列为核心,任何对其进行的相应的调整或修饰。
所述对其进行相应的调整或修饰后的应用包括对活性肽进行进一步的降压药物设计:
第一位的氨基酸lys可被ala、cys、asp、glu、phe、gly、his、ile、leu、met、asn中的任一氨基酸所替代,替代后的小分子肽均具有潜在的降压作用。
所述活性肽具有ace抑制活性及抗乳腺癌细胞增殖的活性,可应用于制备具有调节血压及抗乳腺癌作用的功能性食品、保健品及药物方面。
所述活性肽的分离纯化方法,包括以下步骤:
s1、牡蛎酶解低聚肽的制备
牡蛎干样品处理后,加入15~20倍质量体积的水制成匀浆液置于酶解罐中,然后加入牡蛎质量的2~5%的复合蛋白酶,在40~50℃下酶解4小时,酶反应ph值控制在8.0~9.0,酶解结束后升温至80~90℃灭酶10分钟,得到牡蛎蛋白酶解液,将蛋白酶解液8000转/分钟离心10分钟,去除颗粒状物质,然后采用膜分离技术进行分离,截留分子量为3000da,过膜液喷雾干燥得牡蛎小分子肽粉;
s2、小分子活性肽的分离纯化
将s1中的小分子活性肽粗品加水溶解,配制成浓度为100mg/ml的溶液,采用葡聚糖凝胶sephadexlh-20柱色谱分进行分离纯化,流动相为30%甲醇,流速为0.3~0.5ml/min,洗脱液280nm测定吸光度,根据吸光度值收集所需峰;
采用高效液相色谱进一步纯化,色谱条件如下:c18色谱柱,流动相a为含体积百分数0.05~0.1%三氟乙酸水,流动相b为乙腈,梯度洗脱条件为:0~15min,3%b,15~20min,3%~10%b,20~30min,10%b~20%b,30~40min,20%b~35%b,流速为1.0ml/min,检测波长为220或280nm,收集保留时间在17分钟的色谱峰,浓缩后冷冻干燥得小分子活性肽;
s3、纯度及氨基酸序列测定
收集的小分子肽经液相色谱检测为单一峰,利用高效液相色谱-质谱测定结构,其氨基酸序列为:lys-tyr-pro-leu-pro-arg,其分子量为746.40da。
进行ace抑制活性及抗乳腺肿瘤活性测定,结果显示该小分子肽具有较强的ace抑制活性,且对人乳腺癌细胞增殖具有明显抑制作用。ace抑制肽构效关系表明一级氨基酸序列中含有大量疏水性氨基酸,以及n端存在碱性氨基酸时,ace抑制活性较高,此活性肽的结构与构效关系的结论相一致。
所述步骤s1中的复合蛋白酶的质量配比为:中性蛋白酶:木瓜蛋白酶:风味蛋白酶=(2~4):(3~5):(3~5)。
所述步骤s3中的葡聚糖凝胶sephadexlh-20柱内径为3.0cm,柱长100cm。
所述c18色谱柱内径为4.6mm,柱长250mm,粒度5µm。
本发明的有益效果:
(1)本发明在前期对牡蛎低聚肽进行高效液相色谱-质谱分析鉴定和利用在线数据库进行活性筛选的基础,获得高活性小分子肽,在此基础上利sephadexlh-20凝胶柱层析及高效液相色谱等分离技术对此活性肽进行分离纯化,验证其活性,最终获得一个高ace抑制及抗癌活性肽,其氨基酸序列为:lys-tyr-pro-leu-pro-arg,经在线数据库biopep及erop-moscow检索,所述序列为新的小分子活性肽。
(2)该活性肽的分子量小,活性高,分离纯化步骤简单,易于获得,属食源性的活性肽,长期食用达到预防、控制、缓解和辅助治疗高血压的目的,可用于开发治疗高血压的相关保健品或者药物,该小分子肽具有抗乳腺癌活性,可应用于乳腺癌症相关疾病的保健、治疗及相关产品的开发。在食品、保健品及医药领域等有广阔的应用前景。
(3)在此基础上,对此ace抑制活性肽进行计算机辅助药物设计,发现众多具有潜在活性的降压肽,后续可进一步进行活性的验证及相关的产品的研究开发。
附图说明
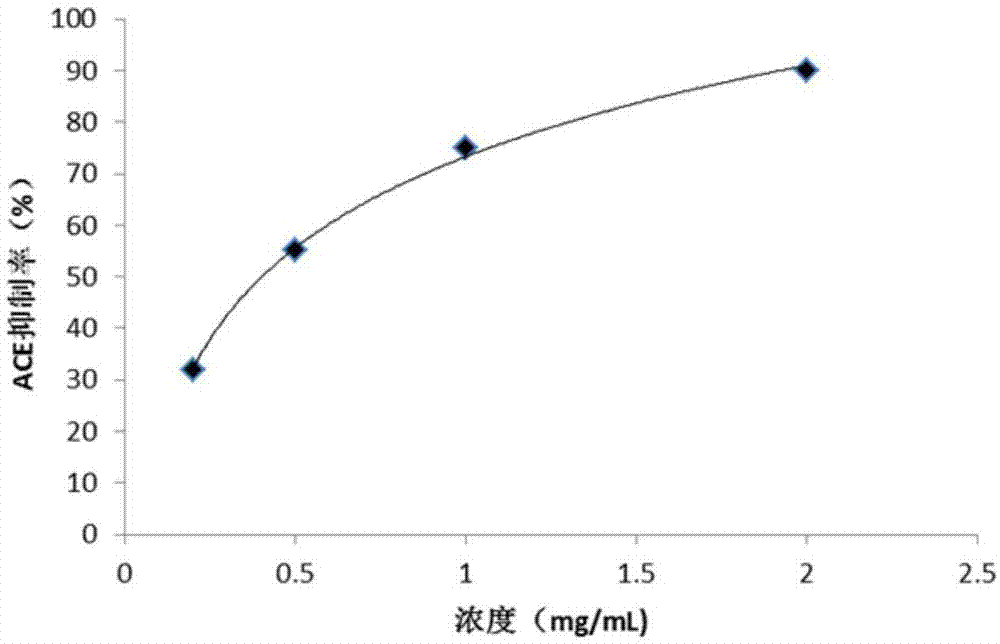
图1为本发明小分子活性肽的ace抑制活性图。
图2为本发明小分子活性肽对人乳腺癌细胞增值的抑制活性图。
具体实施方式
下面结合附图与实施例对本发明进一步说明,但本发明不局限于具体实施例。
实施例1
一种牡蛎来源的ace抑制及抗肿瘤活性肽,所述活性肽其氨基酸序列为lys-tyr-pro-leu-pro-arg。
以所述活性肽序列为核心,任何对其进行的相应的调整或修饰。
所述对其进行相应的调整或修饰后的应用包括对活性肽进行进一步的降压药物设计:
第一位的氨基酸lys可被ala、cys、asp、glu、phe、gly、his、ile、leu、met、asn中的任一氨基酸所替代,替代后的小分子肽均具有潜在的降压作用。
实施例2
如图1所示,实施例1中所述牡蛎来源的ace抑制及抗肿瘤活性肽的分离纯化方法,包括以下步骤:s1、牡蛎酶解小分子肽粉的制备:
牡蛎干500g加入适量水浸泡,浸泡后清洗脱盐分,将脱盐后的牡蛎干加水匀浆制成匀浆液置于酶解罐中,牡蛎干与水的质量体积比为1:15,加入15g的复合蛋白酶制剂,该蛋白酶配比为:中性蛋白酶:木瓜蛋白酶:风味蛋白酶=2:3:3,在40℃下酶解4小时,酶反应ph值控制在8.5,酶解结束后升温至80℃灭酶10分钟,得到牡蛎蛋白酶解液,将蛋白酶解液8000转/分钟离心10分钟,去除颗粒状物质,然后采用膜分离技术进行分离,截留分子量为3000da,过膜液喷雾干燥得牡蛎小分子肽粉。
s2、小分子活性肽的分离纯化:
将s1中的牡蛎小分子活性肽粗品加水溶解,配制成100mg/ml,采用葡聚糖凝胶sephadexlh-20柱色谱(3.0×100cm)分进行分离纯化,流动相为30%甲醇,流速为0.3ml/min,洗脱液280nm测定吸光度,根据吸光度值收集所需峰。
采用高效液相色谱进一步纯化,色谱条件如下:依利特c18色谱柱(4.6mm×250mm,5µm),流动相a为0.1%三氟乙酸水(v/v),流动相b为乙腈,梯度洗脱条件为:0~15min,3%b,15~20min,3%~10%b,20~30min,10%b~20%b,30~40min,20%b~35%b,流速为1.0ml/min,检测波长为280nm,收集保留时间在17分钟左右的色谱峰,浓缩后冷冻干燥得小分子活性肽。
s3、纯度及结构测定:收集的小分子肽经液相色谱检测为单一峰,利用高效液相色谱-质谱测定结构,其氨基酸序列为:lys-tyr-pro-leu-pro-arg,其分子量为746.40da。
ace抑制活性测定:
预先把冷冻干燥后的小分子活性肽用蒸馏水配制成浓度为5mg/ml的溶液,依次稀释成浓度为2mg/ml、1mg/ml、0.5mg/ml、0.2mg/ml溶液。水浴锅温度调至37℃,在0.5mlep管中加入5μl不同浓度的小分子活性肽溶液和15μlace(60mu/ml),同时用超纯水做空白,保温5min后,加入25μlhhl(7.6mmol/l),反应25min,最后加10μl10%三氟乙酸水溶液(v/v)用来终止反应,反应液用高效液相色谱进行检测,
色谱检测条件如下:
色谱柱:大连依利特hypersilbdsc18色谱柱,检测波长为228nm,进样量30μl,流速1ml/min;流动相为30%甲醇(含0.1%三氟乙酸tfa和0.05%冰醋酸,ph为3-3.3),柱温:25℃。
ace活性的抑制率计算公式是:
ace抑制率/%=(空白峰面积-样品峰面积)/空白峰面积×100
实验结果见图1,通过计算得到该小分子活性肽的ic50为0.39mg/ml,表明具有较强的ace抑制活性。
抗肿瘤活性测定:
采用人乳腺癌mcf-7细胞株中进行mtt实验,筛选活性肽的抗癌效果。
具体实验过程如下:取对数生长期mcf-7细胞,以每孔1000-10000个接种于96孔培养板中,每孔100μl,在37℃、5%co2条件下继续培养,至细胞单层铺满96孔平底板,然后加入不同浓度的小分子肽溶液作用于细胞,每孔100μl,每个浓度设5个复孔,对照组不加药物,5%co2,37℃孵育24-48小时,每孔加入20μl浓度为5mg/ml的mtt溶液,继续培养4h,4h后终止培养,小心吸去上清液,每孔加入150μl二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪在570nm处测量各孔的吸光度值,计算不同浓度小分子肽对细胞的生长抑制率。
细胞抑制率=(对照组a570-实验组a570)/对照组a570×100%
实验结果见图2,结果表明,该小分子活性肽具有明显的抑制人乳腺癌细胞增殖的作用,ic50为0.21mg/ml。
实施例3
本实施例中所述的牡蛎来源的ace抑制及抗肿瘤活性肽的分离纯化方法的各步骤均与实施例2中相同,不同点为:
(1)步骤s1中,牡蛎干样品处理后,加入17.5倍质量体积的水制成匀浆液置于酶解罐中,然后加入牡蛎质量的2%的复合蛋白酶,复合蛋白酶的质量配比为:中性蛋白酶:木瓜蛋白酶:风味蛋白酶=3:4:4,在45℃下酶解4小时,酶反应ph值控制在8.0,酶解结束后升温至85℃灭酶10分钟,得到牡蛎蛋白酶解液;
(2)步骤s2中流动相为30%甲醇,流速为0.4ml/min;
(3)步骤s2中流动相a为含体积百分数0.75%三氟乙酸水;
(4)步骤s2中检测波长为220nm。
实施例4
本实施例中所述的牡蛎来源的ace抑制及抗肿瘤活性肽的分离纯化方法的各步骤均与实施例2中相同,不同点为:
(1)步骤s1中,牡蛎干样品处理后,加入20倍质量体积的水制成匀浆液置于酶解罐中,然后加入牡蛎质量的5%的复合蛋白酶,复合蛋白酶的质量配比为:中性蛋白酶:木瓜蛋白酶:风味蛋白酶=4:5:5,在50℃下酶解4小时,酶反应ph值控制在9.0,酶解结束后升温至90℃灭酶10分钟,得到牡蛎蛋白酶解液;
(2)步骤s2中流动相为30%甲醇,流速为0.5ml/min;
(3)步骤s2中流动相a为含体积百分数0.05%三氟乙酸水。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明披露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
序列表
sequencelisting
<110>大连深蓝肽科技研发有限公司
<120>一种牡蛎来源的ace抑制及抗肿瘤活性肽
<130>0004s
<160>1
<170>patentinversion3.5
<210>1
<211>6
<212>prt
<213>crassostreagigas
<400>1
lystyrproleuproarg
15
sequencelisting
<110>大连深蓝肽科技研发有限公司
<120>一种牡蛎来源的ace抑制及抗肿瘤活性肽
<130>0004s
<160>1
<170>patentinversion3.5
<210>1
<211>6
<212>prt
<213>crassostreagigas
<400>1
lystyrproleuproarg
15
- 还没有人留言评论。精彩留言会获得点赞!