一种干细胞药物筛选方法与流程
本发明涉及一种干细胞药物筛选方法。
背景技术:
干细胞是一种具有自我复制和多向分化潜能的原始细胞,是机体的起源细胞,是形成人体各种组织器官的源泉。干细胞具有低毒性(或无毒性)、无免疫原性、多项分化等多种优势,具有非常广阔的应用前景。目前,干细胞多用于疾病治疗,但其除了在疾病治疗领域有研究价值外,在药物评价方面也会有突破性的应用价值。
药品作为一种特殊商品,关乎人类的生命。我国药企众多,药品品种数量庞大,根据《2017年度食品药品监管统计年报》显示,截止2017年11月,全国药企4376家,全年产值5000多亿元,随着市场竞争激烈,药企投入巨资研发新药,我国每年约研发60000多种新药,国家鼓励社会力量参与药品评价服务。
传统新药评价往往需要经过实验室研究、动物实验(临床药物毒理实验)、临床试验研究和新药检测期四个阶段,该种评价方式存在耗资大、周期长、阳性率低等弊端,且存在从动物研究直接到临床试验研究的风险。据统计,在美国一种新药从开始研发到获得批准,平均需要8.5年,花费数亿美元,而每5000种候选药物中,只有5种能够进入临床试验,最终只有1种药物能够被获准上市。面对如此耗时耗力耗财的项目,一种有效的药物筛选体制迫切需要。目前,国内尚未有类似的药物筛选平台。此平台的建立将加快医药行业的发展,对提高人们生活水平,造福人类健康具有十分重要的现实意义。
技术实现要素:
本发明为了解决上述现有技术的不足,提供一种干细胞药物筛选方法。该方法评价方式简单、便捷、高效。
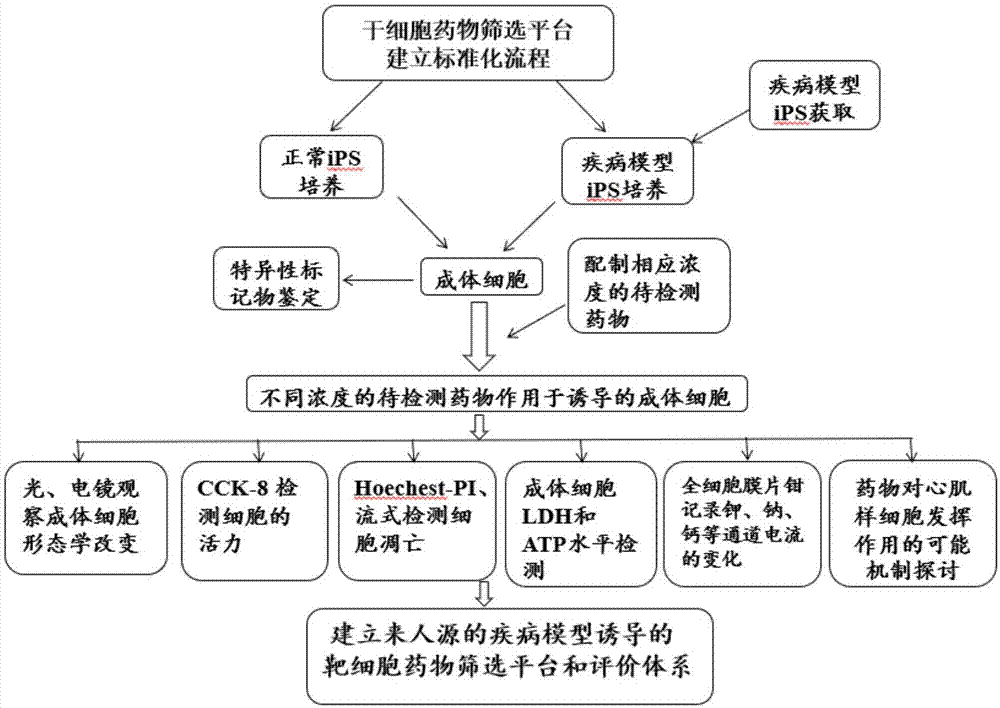
本发明一种干细胞药物筛选方法,步骤包括:
(1)将疾病模型的多能型诱导干细胞进行培养,再诱导成疾病成体细胞;
(2)将正常模型的多能型诱导干细胞进行培养,再诱导成正常成体细胞;
(3)将诱导产生的疾病成体细胞加入配制好的不同浓度的筛选药物共同培养;检测不同时间点经筛选药物培养的疾病成体细胞在细胞形态、细胞活力、细胞增值凋亡能力、细胞ldh和atp水平、相应基因蛋白表达、电生理上的变化情况,分析药物对经筛选药物培养的疾病成体细胞的作用;
(4)将诱导产生的正常成体细胞加入配制好的不同浓度的筛选药物共同培养;检测不同时间点经筛选药物培养的正常成体细胞在细胞形态、细胞活力、细胞增值凋亡能力、细胞ldh和atp水平、相应基因蛋白表达、电生理上的变化情况,分析药物对经筛选药物培养的正常成体细胞毒性作用;
若药物对正常成体细胞无毒性作用,对疾病成体细胞有治疗作用,则该药物被筛选出;
若药物对正常成体细胞无毒性作用,对疾病成体细胞无治疗作用,则该药物不被筛选出;
若药物对正常成体细胞有毒性作用,对疾病成体细胞有治疗作用,则该药物需要进一步研究,根据结果决定是否能进入后期筛选;
若药物对正常成体细胞有毒性作用,对疾病成体细胞无治疗作用,则该药物不被筛选出。
进一步的,步骤(2)中筛选药物的配置,具体为:根据所需检测的药物的理化特性,将药物进行溶解,配成用于细胞的药物浓度梯度,滤菌后4℃储存备用,同时配对照样。
进一步的,所述药物指治疗该疾病的所测药物。
有益效果:
本发明将疾病模型的多能型诱导干细胞转化为药物直接作用的具有疾病特征的人源的靶细胞,在靶细胞上进行药物筛选,既减少了耗资,缩短了周期,降低了干扰因素,又解决了从实验室研究到动物实验阶段的有效性差异。本发明将疾病模型的ips进行培养,诱导分化成相应的疾病靶细胞,对靶细胞进行鉴定后,将治疗该疾病的待测药物培养靶细胞,分析药物作用后,靶细胞在细胞形态、细胞增值凋亡能力、乳酸脱氢酶(ldh)和atp试剂盒检测成体细胞ldh和atp水平、相应基因蛋白表达、电生理等的变化情况,分析药物对靶细胞的作用。在细胞水平上,对药物的作用进行评价,既减少了耗资,缩短了周期,降低了干扰因素,又解决了从实验室研究到动物实验阶段的有效性差异。
运用人干细胞进行的药物筛选与作用机制研究具有干扰因素少、耗资少、周期短、解决了从实验室研究到动物实验阶段的有效性差异。对于传统药物的应用困难及传统新药评价体系的不足,干细胞药物筛选平台将在新药开发与药效、毒性评估等领域给予全新的解决方案,并颠覆传统新药评价体系,形成新型评价体系,不仅提高新药筛选率,而且全面衡量新药的作用及机制,对于新药的评价及开发老药新用的新途径具有重大意义。
附图说明
图1为本发明实施例1中干细胞药物筛选方法的流程图。
具体实施方式
本发明将疾病模型的多能型诱导干细胞转化为药物直接作用的具有疾病特征的人源的靶细胞,在靶细胞的基础进行药物筛选,评价药物的药效及作用机制。
实施例1
1.疾病模型ips培养
1.1复苏:
将人疾病模型的ips细胞冻存管从液氮中取出,置于37℃水浴中使之迅速融解,取出后拿到超净台内用75%酒精擦拭冻存管旋口处及外壁,防止污染。
用1ml移液器轻柔地将冻存管内液体转移到15ml离心管中。
在上述离心管内逐滴加入温育好的4mlhips无饲养层完全培养液,一边加一边晃动离心管。
离心1000rpm,5min。
将上清丢弃,轻弹离心管底部使细胞团松散。
加入1mlhips无饲养层复苏培养液,非常轻柔地吹打2-3次。不可过度吹打,避免细胞被分散成单细胞。
将铺过基质胶的培养皿从培养箱取出,吸掉多余的液体,加入复苏培养液3ml。
将离心管内的细胞悬液转移到皿内,使细胞铺散均匀,置37℃,5%co2培养箱内培养。
24h后,换新鲜的hips无饲养层完全培养液。每天换液。
本申请的所述疾病为所有的可诱导成多能型诱导干细胞的疾病,疾病模型的多能型诱导干细胞可例如帕金森疾病模型ips、血友病模型ips、老年痴呆模型ips。
1.2传代:
将所需的所有试剂均在37℃水浴温热。
将培养皿内的培养液弃掉,用dpbs漂洗2遍,弃掉。
加入2mlhips无饲养层消化液。
37℃孵育3-5分钟,期间注意观察,直到每个克隆的边缘都向中心卷起。
将hips无饲养层消化液吸掉,轻轻地加入2mlhips无饲养层完全培养液,用1ml移液器吹打皿底或用无菌的细胞刮使细胞脱落。避免吹打过度。
将细胞转移至15ml离心管,并再次加入3mhips无饲养层完全培养液将培养皿冲洗一次,收集到离心管内。
离心1000rpm,5min。
将上清丢弃,轻弹离心管底部使细胞团松散。
加入2mlhips无饲养层完全培养液,非常轻柔地吹打2-3次。不可过度吹打,避免细胞被分散成单细胞。
将细胞分到预铺了基质胶的培养皿内培养。
每天换液,4-5天传代一次,传代比例为1:2-1:6。当出现下列任何一种情况时,需要进行传代:细胞汇合度达到90%;干细胞克隆过大,中央细胞生长不良;克隆有开始分化的迹象。
1.3冷冻:
hips无饲养层冻存液4℃保存,不需要预热。
在离心管内加入2ml细胞冻存液,轻轻吹打,避免过度吹打。
将细胞悬液分装到贴好标签的冻存管内,每管0.5ml。
将冻存管放入程序降温仪,置-80℃。24h后,冻存管转入液氮保存。
2.疾病模型ips诱导成疾病成体细胞及鉴定
2.1疾病模型ips诱导成疾病成体细胞
诱导方法根据诱导成相应的成体细胞而定。具体根据疾病的发病细胞来诱导,例如帕金森ips,诱导成导致帕金森的多巴胺神经元细胞。
2.2疾病成体细胞鉴定
采用特异性免疫荧光法,鉴定相应成体细胞的相应特异性表达蛋白。
2.2.1形态学观察:倒置显微镜下,密切观察细胞的生长情况及形态学改变;透射电镜条件下,观察成体细胞超微结构的变化;活细胞工作站动态观察转化过程
2.2.2免疫组织化学方法检测成体细胞特异性蛋白的表达情况;
用pbs清洗标本3次,每次5min;
用固定液(甲醛:丙酮=1:3)固定30min;
用pbs清洗3次,每次5min;
将一抗以1:300比例稀释,4℃孵育2h(稀释倍数根据抗体说明书而定);用pbs清洗3次,每次5min;
将标本在fitc标记的二抗(二抗:pbs=1:200)溶液中避光孵育1h(以下操作均避光进行)(稀释倍数根据抗体说明书而定);
pbs清洗3次,每次5min;
荧光显微镜下观察结果。
3.筛选药物配制
根据所需检测的药物的理化特性,将药物进行溶解,配成用于细胞的药物浓度梯度,滤菌后4℃储存备用,同时配对照样。
所述药物指治疗该疾病的所测药物,可以是中药西药,可以是液体状、片剂、喷剂均可以。
4.药物培养诱导的疾病成体细胞
4.1药物对成体细胞生长情况的影响
将诱导产生的成体细胞加入不同浓度的药物共同培养,观察不同时间点,细胞的形态,并采集图像。分别在细胞加药培养后12小时,24小时,48小时,72小时,每孔中加入10μl的cck-8试剂溶液,混匀后在37℃、5%co2培养箱内继续培养3h,之后于酶标仪450nm波长处测od值。计算细胞的存活率=(实验组od值/对照组od值)×100%。
4.2药物对成体细胞超微结构的影响
用刮刀沿同一个方向刮下成体细胞,收集入1.5mlep管中,2%戊二醛固定15min后,以2000r/min离心15min后弃上清。4℃固定过夜,用含1%oso4的0.1mol/l甲次砷酸钠/盐酸缓冲液固定30min,乙醇梯度脱水,60℃放置48h,超薄切片后用电子显微镜观察细胞内线粒体等细胞器的改变。
4.3成体细胞凋亡情况检测
hoechst-pi染色:用不同浓度的研究药物培养成体细胞,生长24小时,48小时,72小时,5天后,弃去培养基,pbs冲洗,加入hoechst及pi染色液,经pbs洗涤后,荧光显微镜下观察,计算凋亡细胞比率。
流式检测细胞凋亡:用不含edta的胰酶消化细胞,经pbs洗涤后,收集细胞加入annexinv-fitc混匀后,加入propidiumiodide混匀;室温、避光,反应后通过流式细胞仪进行检测。
凋亡相关蛋白因子的检测:将各组成体细胞裂解提取蛋白,通过蛋白免疫印迹方法检测凋亡相应的相关基因的相关凋亡通路的表达。
4.4乳酸脱氢酶(ldh)和atp试剂盒检测成体细胞ldh和atp水平:
将处于对数生长期的细胞,离心,收集细胞上清液,按照试剂说明书检测培养液中ldh含量;向收集的细胞中加入裂解液,4℃12000r/min离心5min,收集上清,用atp检测试剂盒检测细胞内atp的水平。
4.5全细胞膜片钳记录钾、钠、钙等通道电流的变化
实验在25℃左右进行,将细胞上清液缓慢倒出,加入细胞外液,配合使用对应的电极内液。显微镜下选取目标细胞,设定到电流钳模式给予一定时间和强度的电流描记各细胞组全细胞动作电位的变化。设定到电压钳模式给予一定时间和强度的电压刺激描记各组钾、钠、钙等通道电流的变化。
4.6药物对相应成体细胞发挥作用的机制
pcr检测成体细胞相应基因的表达情况,westernblot检测成体细胞相应蛋白的表达情况,探讨研究药物对其相应成体细胞在自噬及能力代谢过程中可能发挥的作用。
4.6.1rt-pcr检测基因表达
4.6.1.1.总rna提取
按照takaraminibestuniversalrnaextractionkit试剂盒说明书提取总rna,步骤如下:
(1)细胞的裂解:①离心收集细胞于1.5mlep管中;②1×pbs洗涤1次,③加入350μl裂解液(bufferrl:50×dtt=50:1)吹打混匀。
(2)裂解液室温静置2min,;
(3)将裂解液转移至gdnaeraserspincolumn中,gdnaeraserspincolumn安放于2mlcollectiontube上,12000rpm离心1min后,弃去gdnaeraserspincolumn,保留2mlcollectiontube中的滤液;
(4)加入等体积70%乙醇(现用现配),混合均匀;
(5)将混合液全部转移到rnaspincolumn中,(每次加入不要超过600μl)。12000rpm离心1min弃液;
(6)加500μlbufferrwa至rnaspincolumn中,12000rpm离心1min后,弃液;
(7)将600μlbufferrwb沿管壁四周加入至rnaspincolumn中,12000rpm离心1min弃液(bufferrwb已加入指定体积的100%乙醇);
(8)重复步骤(7);
(9)将rnaspincolumn重置于2mlcollectiontube上,12000rpm离心2min;
(10)将rnaspincolumn转移至新的1.5mlrnasefreecolletiontubes上,并在rnaspincolumn的膜中央处,加入50~200μlrnasefreedh2o,室温静置5min;
(11)12000rpm离心2min,洗脱rna;
(12)用nanodrop分光光度仪测定总rna的含量。
(13)-80℃保存。
4.6.1.2.rna反转录
将提取的rna用
(1)冰上配制反转录反应体系(10μl),见表1。
表1逆转录的反应体系液配制
反应体系需充分混匀后,瞬时离心。
(2)逆转录的反应条件:35℃,15min;85℃,5s;4℃,∞;
(3)合成的cdna于-20℃保存。
4.6.1.3.rt-pcr
于appliedbiosystems7500fastrt-pcr仪上用
(1)冰上配制反应体系如下(表2):
表2rt-pcr反应体系液配制
试剂加完后,充分混匀,瞬时离心。
(2)扩增的热循环条件(两步法pcr扩增程序):
stage1:预变性
reps:1
95℃,30s
stage2:pcr反应
reps:40
95℃,5s
60℃,10s
72℃,10s
dissociationstage
每份样品做3个复孔,取平均ct值进行计算。
(3)结果计算:
△ct=待测样品目的基因ct值-待测样品内参的ct值;
△△ct=处理后△ct-处理前△ct
2-△△ct=2-(处理后△ct-处理前△ct)
4.6.2蛋白印迹(western-blot)对蛋白表达的定量检测
4.6.2.1.蛋白提取
(1)将受试物处理后的mescs用胰酶消化后,离心收集细胞于1.5mlep管中;
(2)pbs清洗一次;
(3)加入30μl裂解液(裂解液:pmsf=50:1),放于冰上;
(4)用超声细胞破碎仪将细胞样品破碎,共3次,每次5s;
(5)冰浴30min;
(6)4℃,12000rpm离心15min;
(7)小心吸取上清液,-80℃保存。
4.6.2.2.蛋白浓度测定
bca法测定蛋白浓度,步骤如下:
(1)蛋白标准品的准备:(根据试剂盒说明书配制)①取0.8ml标准配制液加入到一管蛋白标准(20mgbsa)中,充分溶解后即配成25mg/ml的蛋白标准液,于-20℃保存。②取适量的蛋白标准液,用pbs稀释得0.5mg/ml的终浓度,于-20℃可长期保存。
(2)bca工作液的配制:试剂a:试剂b=50:1,充分混匀,现用现配。
(3)蛋白浓度检测:
①在96孔板中,按表4配制蛋白检测试剂液,每个浓度做2个复孔。
②混匀后,37℃孵育30min。
③用酶标仪测定a562处的吸光度
④根据标准曲线和使用样品量计算出样品蛋白浓度。
表4蛋白浓度检测试剂配制
4.6.2.3.试剂配制
(1)分离胶缓冲液(1.5mol/ltris-hcl,ph=8.8):称取12.1gtris溶于100ml烧杯中;加入80ml去离子水,充分搅拌溶解;加入浓盐酸调ph值为8.8;将溶液定容至100ml;高温高压灭菌后,室温保存。
(2)浓缩胶缓冲液(1.0mol/ltris-hcl,ph=6.8):称取24.24gtris溶于320ml去离子水,充分搅拌溶解;加入浓盐酸调ph值为6.8;将溶液定容至400ml;4℃保存。
(3)30%丙烯酰胺溶液:29.2g丙烯酰胺与0.8g亚甲基双丙烯酰胺溶于去离子水中,定容至100ml,4℃避光保存。
(4)10%过硫酰胺(aps,现用现配):10gaps溶于100ml去离子水中,充分混匀后,-20℃冻存,少量4℃保存1周。
(5)10%sds:4gsds溶于40ml蒸馏水中,完全溶解后,室温保存。
(6)10×ttbs:量取100ml1.0mol/ltris(ph=7.4)、87.75gnacl、20mltween-20,加入800ml去离子水充分溶解后,定容至1000ml,室温保存。
(7)10×电极缓冲液:称取15.1gtris、72g甘氨酸、5gsds溶于80ml去离子水中,充分溶解后,定容至100ml,室温保存。
(8)10×转印缓冲液:称取30.2gtris、144g甘氨酸,溶于800ml去离子水中,充分溶解后,定容至1000ml,室温保存。
(9)1×转印缓冲液:100ml10×转印缓冲液,700ml去离子水,200ml甲醇(最后加入),混匀后室温保存。
(10)封闭液(5%脱脂奶粉,现用现配):2.5g脱脂奶粉溶解于50ml1×ttbs中,充分溶解后,室温保存。
4.6.2.4.sds-聚丙烯酰胺凝胶制备
(1)模具准备:用胶条将配套的两块玻璃板边缘密封后,固定于电泳架上,准备灌注凝胶。
(2)制备并灌注18%分离胶:在100ml的烧杯中,加入1.3ml去离子水、2.5ml1.0mol/l分离胶、6ml30%丙烯酰胺、100μl10%sds、100μl10%aps、10μltemed,充分混匀后,立即注入到模具中至5.5cm高为止,后加入去离子水进行水封。在分离胶凝固时,凝胶层与水封层间会出现明显的线性界限(约60-90min),此时可吸弃水封层,准备注入浓缩层。
(3)制备并灌注浓缩胶:在50ml的烧杯中,加入2.9ml去离子水、1.25ml0.5mol/l浓缩胶、0.75ml30%丙烯酰胺、50μl10%sds、50μl10%aps、5μltemed,充分混匀后,立即注入到模具腔中分离胶的上方,至注满模具为止,将样品梳小心插入到浓缩胶中。约40-60min后,浓缩胶凝固完成。去除模具玻璃板边缘的胶条,重新固定后,将电泳架移入电泳槽中,小心的拔取样品梳,立即向电泳槽中加入电泳缓冲液(淹没加样孔),准备上样。
4.6.2.5.蛋白样品处理及加样
按测得的蛋白浓度,将蛋白样品调至相同的浓度,取10μl的样品与2.5μl5×loadingbuffer混匀后,100℃煮沸5min,瞬时离心后,将全部样品和marker各取10μl加入到样品孔内,准备电泳。
4.6.2.6.电泳
将电泳槽与电泳仪电源连接,接通电源,以60v电压电泳,样品进入分离胶后marker出现条带时(约2h),电压改为120v电泳,至电泳指示剂移到分离胶下缘时(约3~4h),停止电泳,准备转膜。
4.6.2.7.转膜
取8cm×5cmpvdf膜,先于甲醇中润洗下后,同滤纸、海绵一起浸泡于转膜缓冲液中;取出凝胶,去除上方浓缩胶及下方电泳指示剂,浸泡于转膜缓冲液中;按夹心法,从下至上依次为:海绵、滤纸×3、凝胶、pvdf膜、滤纸×3、海绵,操作时要注意去除夹层内的气泡;夹层固定于转膜架后,盖上盖子,接通电源,100v进行湿转,约2~3h。
4.6.2.8.染膜
(1)封闭:将pvdf膜用5%脱脂奶粉于室温封闭2h。
(2)一抗孵育:将抗体用5%脱脂奶粉按1:1000的比例稀释,对pvdf膜进行摇床孵育,4℃过夜。
(3)洗膜:1×ttbs洗涤pvdf膜3次,5min/次。
(4)二抗孵育:将抗兔二抗用1×ttbs按1:800比例稀释,对pvdf膜进行摇床孵育,室温2h。
(5)洗膜:1×ttbs洗涤pvdf膜3次,10min/次。
4.6.2.9.显像
在膜上加上supersignalwestfemtotrialkit(thermo)化学发光底物系统,于凝胶图像处理系统进行显像,保存结果。采用质谱方法全面分析研究药物对疾病模型对的ips源的成体细胞作用的具体机制。
5人正常模型的ips细胞培养、诱导成正常成体细胞、药物培养诱导的正常成体细胞
人正常模型的ips细胞培养、诱导成正常成体细胞、药物培养诱导的正常成体细胞的方法分别药物培养诱导的疾病成体细胞同实施例1中人疾病模型的ips细胞培养、疾病模型ips诱导成疾病成体细胞以及。不同之处仅在于,将人疾病模型的ips细胞替换成人正常模型的ips细胞。
6结果分析
将治疗药物对正常成体细胞和疾病成体细胞的各项研究数据分别进行统计分析。
7结果判断
若治疗药物对正常成体细胞无毒性作用,对疾病成体细胞有治疗作用,则该药物被筛选出;
若治疗药物对正常成体细胞无毒性作用,对疾病成体细胞无治疗作用,则该药物不被筛选出;
若治疗药物对正常成体细胞有毒性作用,对疾病成体细胞有治疗作用,则该药物需要进一步研究,根据结果决定是否能进入后期筛选;
若治疗药物对正常成体细胞有毒性作用,对疾病成体细胞无治疗作用,则该药物不被筛选出。
本发明可用其他的不违背本发明的精神或主要特征的具体形式来概述。因此,无论从哪一点来看,本发明的上述实施方案都只能认为是对本发明的说明而不能限制本发明,权利要求书指出了本发明的范围,而上述的说明并未指出本发明的范围,因此,在与本发明的权利要求书相当的含义和范围内的任何改变,都应认为是包括在本发明的权利要求书的范围内。
- 还没有人留言评论。精彩留言会获得点赞!