一种血浆人免疫球蛋白的制备方法与流程
本发明涉及生物制品生产技术领域,特别是涉及一种血浆人免疫球蛋白的制备方法,具体涉及一种血浆来源的去除人凝血因子xi(fxi)及活化的人凝血因子xi(fxia)的高安全性人免疫球蛋白的生产工艺。
背景技术:
血浆来源的人免疫球蛋白制品主要成分为免疫球蛋白g(immunoglobuling,igg),分子量150kda,在血浆中的含量6.6~14.5g/l。其主要适应症是对抗体缺乏的补充和自身免疫疾患的免疫调节。对预防和治疗病毒和细菌感染疾病也有较好效果。人免疫球蛋白制品在根本上不同于普通药物,普通药物只有一种或几种活性,而免疫球蛋白含有多种抗体,可以通过抗体补充和对免疫系统进行调剂,对多种疾病进行特异性治疗。在药典中规定生产人免疫球蛋白,每批最少应由1000名以上健康献血员的血浆混合,其目的就是要达到广泛的抗体谱。由此可见人血浆来源的免疫球蛋白制品与现在流行的重组抗体药物有明显不同,其实现的治疗效果也是重组抗体所不能替代的。
现在人血浆来源的免疫球蛋白制品主要通过低温乙醇沉淀法制备,通过多年的工艺改进,已经解决了iga杂质、多聚体等问题。给药剂型也由原来的肌肉注射、冻干制剂改进为静脉注射、皮下给药。但是人血浆包含有复杂的成分,通过有限的纯化步骤制备的免疫球蛋白,药典规定其纯度>95%即符合标准。剩余5%的成分虽然也是人血浆中含有的成分,但是在纯化过程中会产生某些成分的富集或变化,如包含fxi等凝血因子激活、多聚体形成,从而可能引起患者的用药不良反应。
随着人免疫球蛋白制品在市场上供给量的不断增加,逐渐解决了患者原来的无药可用情况,全球使用免疫球蛋白的人均给药量也呈上升趋势。由杂质引发的严重不良反应也开始逐渐显现。2013年美国fda的wcbp报告中汇总了从1970年以来免疫球蛋白用药相关的致栓不良反应tae(thromboticadverseevents,属于严重不良反应),尤其是2010-2012年间,octagam、omriggam(ammannemetal,intravenousimmuneglobulinandthromboembolicadverseeventsinpatientswithhematologicmalignancy[j].blood.2016jan14;127(2):200-7.)、vivaglobin、hepagamb等免疫球蛋白制品在使用过程中出现的严重血栓及产品召回事件(funkmbetal,thromboemboliceventsassociatedwithimmunoglobulintreatment[j].voxsang.2013jul;105(1):54-64.)。fda强制要求在美国上市的免疫球蛋白产品的包装盒上需在显著位置标明使用该产品有引起血栓的风险。在随后的研究中发现,免疫球蛋白制品中活化的人凝血因子xi(fxia)是引起血栓风险的主要原因。在已报道的文献中发现fxi和fxia可与igg共沉淀及共纯化(boumabnetal,humanbloodcoagulationfactorxi.purification,properties,andmechanismofactivationbyactivatedfactorxii[j].biolchem.1977sep25;252(18):6432-7.),以现有使用最广泛的低温乙醇工艺很难完全去除ivig制品中的fxi和fxia。而fxi可以在多种因素下激活,甚至包括fxia存在下的自激活(hodhetal,abindingsiteforheparinintheapple3domainoffactorxi[j].jbiolchem.1998jun26;273(26):16382-90.)。因此在使用含微量fxi和fxia的免疫球蛋白制品后,相当于增加了病人体内fxi和fxia的水平,扰乱了病人体内的凝血因子平衡,从而增加了发生血栓的风险。
国外包括baxter及csl等血液制品公司分别报道了其免疫球蛋白制品生产工艺中fxi和fxia残留的研究。其中报道了辛酸-层析生产工艺中辛酸沉淀工艺可以去除制品中99.9%的fxi和fxia,且成品中未检出fxi和fxia(m.komendaetal,assessmentoftheabilityoftheprivigenpurificationprocesstodepletethrombogenicfactorxiafromplasma[j].voxsanguinis.2014,107,26-36.)。但均未提到低温乙醇工艺详细的fxi和fxia去除步骤。有研究表明,低温乙醇工艺生产的fii沉淀的溶解液中,fxi和fxia的含量仍为血浆初始含量的2%,成品中fxi和fxia的残留含量也由于批间差异,有所不同。而中国药典中低温乙醇工艺生产的免疫球蛋白成品并未对fxi和fxia提出质量控制。因此控制并解决低温乙醇生产工艺生产的成品中fxi和fxia残留,是免疫球蛋白生产急需关注的问题。
技术实现要素:
本发明就是针对上述存在的缺陷而提供一种血浆人免疫球蛋白的制备方法。通过本发明生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
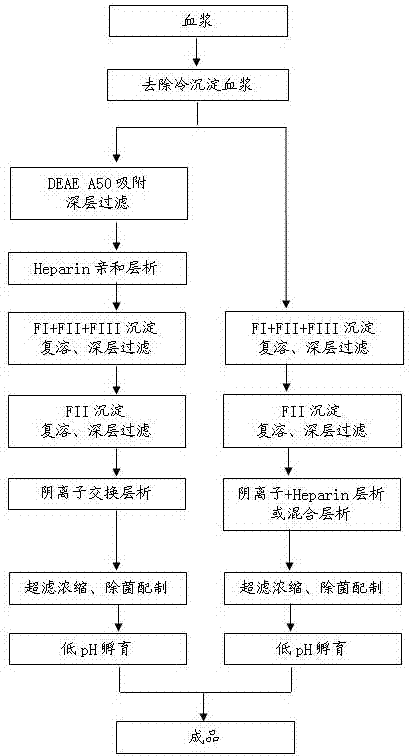
本发明的一种血浆人免疫球蛋白的制备方法技术方案为,一种血浆人免疫球蛋白的制备方法,其特征在于,采用的方法步骤如下:
(1)血浆去除冷沉淀;
(2)经过deaesephadexa50凝胶吸附的血浆经杂质吸附,进行heparin亲和层析进入下一步处理;未进行sephadexa50凝胶吸附的血浆直接进入下一步处理;
(3)fi+fii+fiii沉淀,杂质吸附,复溶;
(4)fii沉淀,杂质吸附,复溶;
(5)复溶后fii上清经杂质吸附,层析;
(6)超滤浓缩,除菌配制;
(7)低ph孵育。
步骤(2)具体为:去除冷沉淀的血浆,如果进行人凝血酶原复合物(pcc)的生产,需进行deaesephadexa50凝胶吸附;
deaesephadexa50凝胶吸附后的血浆经过杂质吸附及0.2μm的滤芯过滤后进行heparin亲和层析,收集流穿和洗涤的血浆,进行下一步处理。
如果去除冷沉淀的血浆不需进行deaesephadexa50凝胶吸附,因凝血因子ii、vii、ix、x未去除,进行杂质吸附时会导致因子激活,产生血浆凝固风险,达不到层析过滤精度血浆则不能进行heparin亲和层析。因此去除冷沉淀的血浆直接进行后续低温乙醇沉淀工艺步骤处理。
步骤(2)中的杂质吸附,采用带强阳离子电荷,如zetapluszb系列(30~120)的吸附材质;使用注射用水对吸附材质进行清洗,再用含100~200mnacl,10~50mmna2hpo4,ph6.5~7.5的溶液对吸附材质进行清洗,用量为50~150l/m2;冲洗完成后排干设备内的溶液并用压缩空气吹干吸附材质,用于杂质吸附。
步骤(2)中,所述heparin亲和层析,通过装填有heparin配基的亲和凝胶的层析柱进行固定床亲和层析,杂质吸附后的血浆通过0.2μm的滤芯过滤上样,上样完成后再用平衡液将层析柱中未吸附的其他血浆成分洗涤干净;收集流穿液和洗涤液进入下一步人免疫球蛋白的生产;
每次上样量为20~30个柱床体积;所述的平衡液:含磷酸氢二钠10~30mmol/l、氯化钠0.3~0.6mol/l,ph6.50~7.50;所述的洗脱液:含磷酸氢二钠10~30mmol/l、氯化钠1.5~2.5mol/l,ph6.50~7.50;平衡、上样和洗脱线流速60cm/h~300cm/h;柱再生:分别用0.1mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
所述heparin配基的亲和凝胶,为captoheparin、heparinsepharosefastflow、toyopearlaf-heparinhc-650f中的一种。
步骤(5)中的杂质吸附,采用带强阳离子电荷,如zetapluszb系列(30~120)的吸附材质;使用注射用水对吸附材质进行清洗,再用含5~15mmna2hpo4,ph6.5~7.5的溶液对吸附材质进行清洗,用量为50~150l/m2;冲洗完成后排干设备内的溶液并用压缩空气吹干吸附材质,用于杂质吸附。
步骤(5)具体步骤如下:
经deaesephadexa50凝胶吸附的血浆制备的fii上清,经过杂质吸附,通过0.2μm的滤芯过滤后进行阴离子交换层析,收集流穿和洗涤的上清液,进行下一步处理;
所述的阴离子交换层析,通过装填有阴离子凝胶的层析柱进行固定床离子交换层析,制品通过0.2μm的滤芯过滤上样,用平衡液将层析柱中的制品洗涤干净;收集流穿液和洗涤液进行下一步人免疫球蛋白的生产;每次上样量控制为20~50个柱床体积;所述的平衡液:含磷酸氢二钠5~15mmol/l,ph6.50~7.50;所述的洗脱液:含磷酸氢二钠5~100mmol/l、氯化钠1.5~2.5mol/l,ph6.50~7.50;平衡、上样和洗脱线流速60cm/h~300cm/h;柱再生:分别用0.3mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
所述的阴离子凝胶,为sepharosefastflow、captoq、fractogel®emdtmae中的一种。
步骤(5)具体步骤如下:
未经deaesephadexa50凝胶吸附的血浆制备的fii上清,经过杂质吸附,通过0.2μm的滤芯过滤进行阴离子交换层析和heparin亲和凝胶层析;收集流穿和洗涤的上清液,进行下一步处理;
所述的阴离子交换层析和heparin亲和层析,通过装填混合有阴离子凝胶和heparin亲和凝胶的层析柱进行固定床层析;heparin亲和凝胶与离子交换凝胶混合体积比例为1:500~1:10;制品通过0.2μm的滤芯过滤上样,用平衡液将层析柱中的制品洗涤干净;收集流穿液和洗涤液进行下一步人免疫球蛋白的生产;每次上样量控制为20~50个柱床体积;所述的平衡液:含磷酸氢二钠5~15mmol/l,ph6.50~7.50;所述的洗脱液:含磷酸氢二钠5~100mmol/l、氯化钠1.5~2.5mol/l,ph6.50~7.50;平衡、上样和洗脱线流速60cm/h~300cm/h;柱再生:分别用0.1~0.3mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存;
所述的heparin亲和凝胶,为captoheparin、heparinsepharosefastflow、toyopearlaf-heparinhc-650f中的一种。
步骤(5)具体步骤如下:
未经deaesephadexa50凝胶吸附的血浆制备的fii上清,经过杂质吸附,通过0.2μm的滤芯过滤进行阴离子交换层析和heparin亲和凝胶层析;收集流穿和洗涤的上清液,进行下一步处理;
所述的阴离子交换层析和heparin亲和层析,使制品依次通过装填有阴离子凝胶和heparin亲和凝胶的两根层析柱进行固定床层析;上述heparin亲和凝胶与离子交换凝胶使用体积比例为1:500~1:10。离子交换层析和heparin亲和层析步骤也可以调整先后顺序。
本发明的有益效果为:(1)deaesephadexa50凝胶吸附后的血浆直接进行heparin亲和层析进行fxi和fxia的去除,其原理为凝胶中结合在基架上的heparin配基捕获血浆中的fxi和fxia以及抗凝血酶iii(atiii),fxi在heparin的作用下激活为fxia,而富集在凝胶中的atiii在heparin的作用下将其快速灭活。而未进行a50吸附的血浆,经多步处理后,fii沉淀溶解液中fxi和fxia的含量较血浆初始含量有明显减少。采用少量heparin亲和层析凝胶即可直接去除fii溶解液中的fxi和fxia。
(2)通过研究表明,带有正电荷的吸附材质对fxi和fxia的单步去除率也可达50%以上,因此,通过在heparin亲和层析前均对制品采用了强正电荷的zetapluszb系列(30~120)过滤材质,降低了heparin亲和凝胶负荷,节省了凝胶成本。
(3)生产工艺中,所有的层析均采用制品流穿工艺,使凝胶载量均用于对杂质的吸附,也大大节省了凝胶成本。同时,根据生产工艺的安排,无论是进行a50吸附的血浆还是未进行a50吸附的血浆进行的fxi和fxia的去除处理,均不影响整个免疫球蛋白的生产工艺总时间。
(4)通过该工艺生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。
(5)通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
附图说明:
图1所示为本发明方法的整体工艺流程图。
具体实施方式:
为了更好地理解本发明,下面用具体实例来详细说明本发明的技术方案,但是本发明并不局限于此。
实施例1
(1)血浆去除冷沉淀。
(2)进行deaesephadexa50凝胶吸附。收集流穿血浆和洗涤液,为a50吸附后的血浆。洗脱液用于制备pcc产品。
zetaplus60zb吸附材质经过注射用水清洗,再用含100mmnacl,20mmna2hpo4,ph6.5的溶液清洗,用量为50l/m2;冲洗完成后进行排干并用压缩空气吹干吸附材质,然后对a50凝胶吸附后的血浆进行杂质吸附。
血浆通过0.2μm的滤芯过滤后,通过装填有captoheparin的亲和凝胶的层析柱进行固定床亲和层析。层析柱用含磷酸氢二钠10mmol/l、氯化钠0.3mol/l,ph6.50的平衡液处理完毕,每次上样量控制为30个柱床体积;用平衡液将层析柱中未吸附的其他血浆成分洗涤干净;用含磷酸氢二钠10mmol/l、氯化钠1.5mol/l,ph6.50洗脱液进行洗脱。平衡、上样和洗脱线流速150cm/h。收集层析流穿液和洗涤液,进行下一步人免疫球蛋白产品的生产。收集层析洗脱液,用于制备atiii产品。柱再生:分别用0.1mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
(3)fi+fii+fiii沉淀,杂质吸附,复溶。
(4)fii沉淀,杂质吸附,复溶。
(5)zetaplus90zb吸附材质经过注射用水清洗,再用含5mmna2hpo4,ph6.5的溶液清洗,用量为150l/m2;冲洗完成后进行排干并用压缩空气吹干吸附材质,然后对deaesephadexa50凝胶吸附后的血浆制备的fii复溶后上清进行杂质吸附。
杂质吸附后的上清液,通过0.2μm的滤芯过滤,使用装填有deaesepharosefastflow凝胶的层析柱进行固定床离子交换层析。层析柱用含磷酸氢二钠5mmol/l,ph6.50的平衡液处理完毕,每次上样量控制为50个柱床体积;用的平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠5mmol/l、氯化钠1.5mol/l,ph7.0;平衡、上样和洗脱线流速60cm/h;收集流穿液和洗涤液,进行下一步人免疫球蛋白的生产。柱再生:分别用0.3mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
(6)层析流穿液和洗涤液进行超滤浓缩,除菌配制.
(7)低ph孵育。均为经典低温乙醇工艺参数。
该工艺可以同时实现三种产品(pcc、atiii和igg)的生产,同时可以有效去除人免疫球蛋白制品中的fxi和fxia及其他杂质。
通过该工艺生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。
通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
实施例2
(1)血浆去除冷沉淀。
(2)未进行a50凝胶吸附的血浆直接进入下一步(3)处理。
(3)fi+fii+fiii沉淀,杂质吸附,复溶。
(4)fii沉淀,杂质吸附,复溶。
(5)采用zetaplus30zb和60zb吸附材质叠加使用;使用注射用水对吸附材质进行清洗,再用含5mmna2hpo4,ph6.5的溶液对吸附材质进行清洗,用量为50l/m2;冲洗完成后排干设备内的溶液并用压缩空气吹干吸附材质,然后对未经a50凝胶吸附的血浆制备的fii复溶后上清进行杂质吸附。
杂质吸附后的上清液,,通过0.2μm的滤芯过滤,使用装填混合有fractogel®emdtmae凝胶和captoheparin亲和凝胶的层析柱进行固定床层析。captoheparin凝胶和fractogel®emdtmae凝胶装柱混合体积比例为1:500。层析柱用含磷酸氢二钠5mmol/l,ph6.50的平衡液处理完毕,每次上样量控制为50个柱床体积;再用平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠100mmol/l、氯化钠2.5mol/l,ph6.50的洗脱液洗脱杂质;平衡、上样和洗脱线流速100cm/h;收集流穿液和洗涤液,进行下一步人免疫球蛋白的生产。柱再生:分别用0.1mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
(6)超滤浓缩,除菌配制.
(7)低ph孵育。均为经典低温乙醇工艺参数。
该工艺可以可以有效去除人免疫球蛋白制品中的fxi和fxia及其他杂质。
通过该工艺生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。
通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
实施例3
(1)血浆去除冷沉淀。
(2)未进行a50凝胶吸附的血浆直接进入下一步(3)处理。
(3)fi+fii+fiii沉淀,杂质吸附,复溶。
(4)fii沉淀,杂质吸附,复溶。
(5)zetaplus30zb和zetaplus90zb吸附材质叠加使用;用注射用水清洗,再用含15mmna2hpo4,ph7.5的溶液进行清洗,用量为50l/m2;冲洗完成后排干设备内的溶液并用压缩空气吹干吸附材质,然后对未经a50凝胶吸附的血浆制备的fii复溶后上清进行杂质吸附。
杂质吸附后的上清液,通过0.2μm的滤芯过滤上样,使用装填有deaesepharosefastflow凝胶的层析柱进行固定床层析。层析柱用含磷酸氢二钠10mmol/l,ph7.50的平衡液处理完毕,每次上样量控制为50个柱床体积;用平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠50mmol/l、氯化钠1.5mol/l,ph7.50的洗脱液洗脱杂质;平衡、上样和洗脱线流速100cm/h;收集流穿液和洗涤液,进行下一步heparin亲和层析处理。柱再生:分别用0.3mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
deaesepharosefastflow凝胶层析的流穿和洗涤液,通过装填有toyopearlaf-heparinhc-650f凝胶的层析柱进行固定床层析。层析柱用含磷酸氢二钠10mmol/l,ph7.50的平衡液处理完毕,制品通过0.2μm的滤芯过滤上样,用平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠50mmol/l、氯化钠1.5mol/l,ph7.50的洗脱液洗脱杂质;平衡、上样和洗脱线流速300cm/h;收集流穿液和洗涤液,进行下一步人免疫球蛋白的生产。柱再生:分别用0.3mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
toyopearlaf-heparinhc-650f凝胶和deaesepharosefastflow凝胶装柱体积比例为1:10。
(6)超滤浓缩,除菌配制.
(7)低ph孵育。均为经典低温乙醇工艺参数。
该工艺可以可以有效去除人免疫球蛋白制品中的fxi和fxia及其他杂质。
通过该工艺生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。
通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
实施例4
(1)血浆去除冷沉淀。
(2)未进行a50凝胶吸附的血浆直接进入下一步(3)处理。
(3)fi+fii+fiii沉淀,杂质吸附,复溶。
(4)fii沉淀,杂质吸附,复溶。
(5)zetaplus120zb吸附材质用注射用水进行清洗,再用含10mmna2hpo4,ph7.0的溶液进行清洗,用量为100l/m2;冲洗完成后排干设备内的溶液并用压缩空气吹干吸附材质,然后对未经a50凝胶吸附的血浆制备的fii复溶后上清进行杂质吸附。
杂质吸附后的上清液,通过0.2μm的滤芯过滤,使用装填有toyopearlaf-heparinhc-650f凝胶的层析柱进行固定床层析。层析柱用含磷酸氢二钠5mmol/l,ph6.50的平衡液处理完毕,每次上样量控制为20个柱床体积;用平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠5mmol/l、氯化钠2.0mol/l,ph6.50的洗脱液洗脱杂质;平衡、上样和洗脱线流速300cm/h;收集流穿液和洗涤液,进行下一步deaesepharosefastflow凝胶层析。柱再生:分别用0.1mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
toyopearlaf-heparinhc-650f凝胶层析的流穿和洗涤液,通过装填有captoq凝胶的层析柱进行固定床层析。层析柱用含磷酸氢二钠5mmol/l,ph6.50的平衡液处理完毕,制品通过0.2μm的滤芯过滤上样,用平衡液将层析柱中的制品洗涤干净;用含磷酸氢二钠5mmol/l、氯化钠2.0mol/l,ph6.50的洗脱液洗脱杂质;平衡、上样和洗脱线流速100cm/h;收集流穿液和洗涤液,进行下一步人免疫球蛋白的生产。柱再生:分别用0.1mol/l氢氧化钠、洗脱液、注射用水进行处理;柱保存:20%乙醇溶液保存。
toyopearlaf-heparinhc-650f凝胶和captoq凝胶装柱体积比例为1:500。
(6)超滤浓缩,除菌配制.
(7)低ph孵育。均为经典低温乙醇工艺参数。
该工艺可以可以有效去除人免疫球蛋白制品中的fxi和fxia及其他杂质。
通过该工艺生产的免疫球蛋白制品,纯度≥99%,凝血因子均未检出,使用heparin亲和层析可能产生的heparin配基脱落也未检出。
通过naptt和发色底物法检测,最终igg制品中fxi和fxia含量均在检测限以下,判定为未检出。
- 还没有人留言评论。精彩留言会获得点赞!