SPRR3和/或TMPRSS11D作为骨性关节炎诊治标志物的用途的制作方法
本发明涉及本发明涉及生物医药领域,具体涉及sprr3和/或tmprss11d作为骨性关节炎诊治标志物的用途。
背景技术:
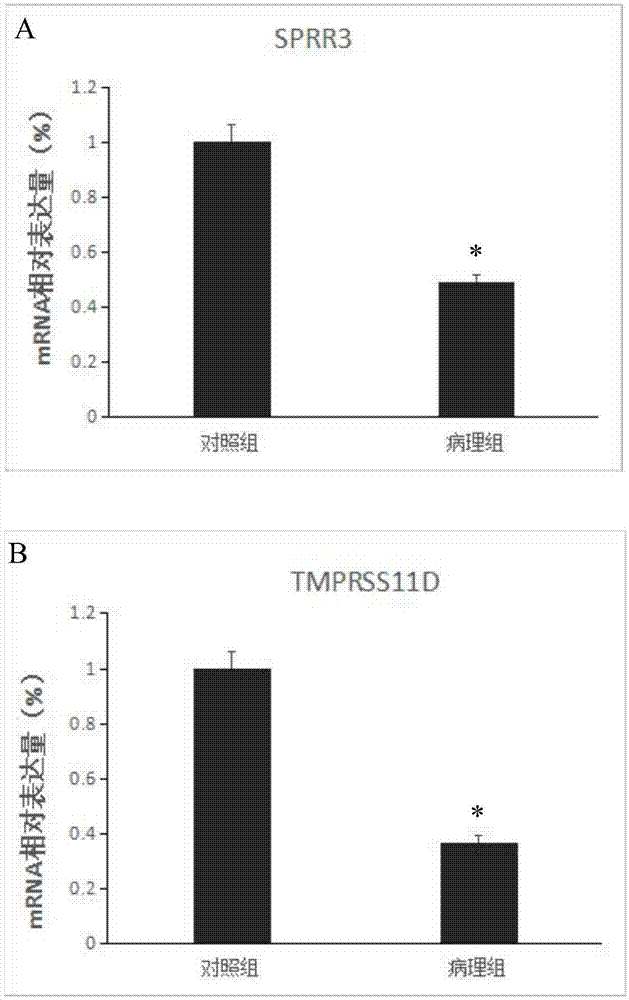
:骨性关节炎(osteoarthritis,oa)是中老年人最常见的疾病之一,由于人群预期寿命的延长,骨性关节炎的发病率也明显增高,尤其是肥胖的老年人群,60岁以上人群中,50%以上在x线上有骨性关节炎表现。其常见病理改变为软骨下骨硬化、关节周围骨赘形成、慢性滑膜炎,其引起的疼痛、功能障碍严重影响患者的生活质量。虽然近些年来世界各地的学者在oa的病因、发病机理、治疗方面进行了大量的研究,但是对于其确切的发病机制还没有完全明确,治疗方面也没有寻找到有效方法对骨性关节炎的发病进程进行预防或延缓。目前治疗上主要是通过各种方法达到止痛、保持和改善关节功能的目的,早期骨性关节炎的治疗方法包括:教育、合理的功能锻炼及限制负重;物理治疗;应用非幽体类消炎镇痛药,但这些治疗方法却不能真正有效延缓骨性关节炎关节软骨的退变,不能改变骨性关节炎的自然病程。待病程发展到晚期骨性关节炎后,治疗上只能通过人工关节置换达到止痛、改善关节功能的目的。但是,由于晚期骨性关节炎患者年龄高且多伴发高血压、糖尿病等心脑血管疾病,关节置换手术风险大,手术相关并发症发生率高,严重影响老年患者的身心健康;此外,人工关节置换费用高昂,给社会、家庭带来巨大的经济负担。因此,明确骨性关节炎的发病机制,寻找新的骨性关节的诊断标志物以及药物靶点已成为医学上亟待解决的问题。技术实现要素:本发明的目的在于提供一种用于骨性关节炎诊断的工具,所述工具包括能够检测sprr3和/或tmprss11d基因表达量的试剂。优选的,所述工具包括能够定量sprr3和/或tmprss11d基因mrna的试剂,和/或能够定量sprr3和/或tmprss11d蛋白的试剂。优选的,所述能够定量sprr3和/或tmprss11d基因mrna的试剂包括实时定量pcr中使用的特异扩增sprr3基因引物序列如seqidno.1-2所示,和/或特异扩增tmprss11d基因引物序列如seqidno.3-4所示;所述能够定量sprr3和/或tmprss11d蛋白的试剂包括特异性结合sprr3和/或tmprss11d蛋白的抗体。优选的,所述骨性关节炎诊断的工具包括但不限于芯片、试剂盒、试纸、或高通量测序平台;高通量测序平台是一种特殊的诊断骨性关节炎的工具,随着高通量测序技术的发展,对一个人的基因表达谱的构建将成为十分便捷的工作。通过对比疾病患者和正常人群的基因表达谱,容易分析出哪个基因的异常与疾病相关。因此,在高通量测序中获知sprr3和/或tmprss11d基因的异常与骨性关节炎相关也属于sprr3和/或tmprss11d的用途,同样在本发明的保护范围之内。进一步地,本发明提供了检测sprr3和/或tmprss11d的试剂在制备骨性关节炎的诊断试剂盒中的应用。优选的,所述试剂盒包括检测sprr3和/或tmprss11d基因表达量的试剂。优选的,所述试剂盒包括能够定量sprr3和/或tmprss11d基因mrna的试剂,或能够定量sprr3和/或tmprss11d蛋白的试剂。优选的,所述能够定量sprr3和/或tmprss11d基因mrna的试剂包括实时定量pcr中使用的特异扩增sprr3和/或tmprss11d基因的引物。优选的,所述特异扩增sprr3基因的引物序列如seqidno.1-2所示,特异扩增tmprss11d基因引物序列如seqidno.3-4所示。优选的,所述能够定量sprr3和/或tmprss11d蛋白的试剂包括特异性结合sprr3和/或tmprss11d蛋白的抗体及其片段。优选的,所述抗体或其片段可以是单克隆的或多克隆的。抗体片段指保留抗体对抗原的结合活性的抗体一部分(部分片段)或含有抗体一部分的肽。抗体片段可以包括f(ab′)2、fab′、fab、单链fv(scfv)、二硫化物键合的fv(dsfv)或其聚合物、二聚化v区(双抗体)、或含有cdr的肽。进一步地,本发明还提供了sprr3和/或tmprss11d基因或其表达产物在制备治疗骨性关节炎的药物中的应用。有益效果本发明首次发现并证实sprr3和/或tmprss11d基因表达与骨性关节炎发生的密切相关性,该相关性的提出为骨性关节炎的诊断与治疗提供了新的途径。本发明提供一种新的分子标志物sprr3和tmprss11d,该标志物用于制备骨性关节炎诊断试剂盒、制剂、芯片或者药物中的用途。附图说明图1利用qpcr检测sprr3(图1a)和tmprss11d(图1b)基因在骨性关节炎患者和正常人中的表达差异;图2利用免疫印迹检测sprr3(图2a)和tmprss11d(图2b)蛋白在骨性关节炎患者和正常人中的表达差异。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例1样本收集取2016年10月到2018年5月期间在医院骨科就诊骨性关节炎患者,病例组共收集8例,对照来源于同时期骨科住院的其他疾病患者,收集共4例。获取所有研究对象的滑膜组织样本,编号后置-80℃低温冰箱保存。病例组均符合膝关节oa诊断标准,进行膝关节人工关节置换术患者;对照组为半月板损伤及交叉韧带损伤进行关节镜手术治疗的患者。实施例2高通量测序及分析对组织进行rna提取,rna提取后琼脂糖凝胶电泳,从电泳结果可以初步判定提取的rna样品质量合格与否,是否可以用于进一步的转录组分析。进而通过nanodrop1000分光光度计检测rna样品的提取情况,rna-seq测序的样品要求:od260/od280为1.8-2.2。测序平台为illumina公司的hiseq2500高通量测序平台,进行高通量转录组深度测序,测序后,运用fast-qc软件对测序数据的质量进行整体评估,包括碱基的质量值分布,质量值的位置分布,gc含量,pcrduplication含量,kmer的frequency等。在差异基因表达分析时,根据得到的fpkm值,采用国际公认算法ebseq进行差异筛选。其中,筛选时,log2fc>1或<-1,fdr<0.05。为了更好的理解差异表达基因的功能,发明人对差异表达基因进行了geneontology和信号通路分析,并对差异表达基因进行功能注释和蛋白质互相作用网络分析,鉴于以上数据分析的结果,结合文献发明人筛选了与骨关节炎相关的差异表达基因sprr3和tmprss11d。实施例3实时荧光定量pcr验证骨性关节炎患者滑膜组织sprr3和tmprss11d基因表达情况通过荧光定量pcr验证上述8例骨性关节炎患者及4例对照者滑膜组织sprr3和tmprss11d基因表达水平。1、骨性关节炎患者及对照的滑膜组织总rna的提取采用reagent(invitrogen,货号15596-018)进行样本rna提取,实验操作按产品说明书进行,具体操作如下:收集样本后冻存于液氮,取出后把组织放入已预冷的研钵中进行研磨,待组织样本成粉末状后:①加入trizol,室温保存5分钟;②加氯仿0.2ml,用力振荡离心管,充分混匀,室温下放置5分钟-10分钟;③12000rpm高速离心15分钟后吸取上层水相(吸70%)到另一新离心管管中,注意不要吸到两层水相之间的蛋白物质。移入新管,加入等体积的-20℃预冷异丙醇,充分颠倒混匀,置于冰上10分钟;④12000rpm高速离15分钟后小心弃掉上清液,按1ml/mltrizol的比例加入75%depc乙醇洗漆沉淀(4℃保存),洗漆沉淀物,振荡混合,4℃下12000rpm高速离心5分钟;⑤弃去乙醇液体,室温下放置5分钟以充分晾干沉淀,加入depc处理过的水溶解沉淀;⑥用nanodrop2000紫外分光光度计测量rna纯度及浓度,冻存于-80℃。rna质量判定标准:rna样本的od260/od280值为1.7-2.2之间;总rna电泳图谱有清晰的28s、18s条带;70℃水浴保温1小时后的电泳图谱与水浴保温前的图谱无明显差异。2、逆转录合成cdna采用iiireversetranscriptase(invitrogen,货号18080-044)进行cdna反转录,实验操作按产品说明书进行,获得的cdna保存放-20℃冰箱备用。3、real-timepcr用abi7500型荧光定量pcr仪,采用2-△△ct法进行数据的相对定量分析。引物设计:采用在线引物设计软件,基因序列参照ncbi:nm_001097589.1(sprr3)和nm_004262.2(tmprss11d),内参选gapdh,引物设计后由invitrogen公司合成。sprr3扩增引物序列:上游引物:gatcccagaggctgaacacc(seqidno.1);下游引物:aggtggtggggtaaaggtct(seqidno.2);tmprss11d扩增引物序列:上游引物:taggccagcacgtgtaactt(seqidno.3);下游引物:gagctatggtgactgccagg(seqidno.4);gapdh扩增引物序列:上游引物:ggagcgagatccctccaaaat(seqidno.5);下游引物:ggctgttgtcatacttctcatgg(seqidno.6)。反应体系:用powergreenpcrmastermix(invitrogen,货号4367659)进行扩增,实验操作按产品说明书进行。pcr反应体系:2×mix10μl;浓度为10μm的上游引物和下游引物各0.5μl;模板2μl;灭菌蒸馏水补平至25μl;扩增程序为:95℃5min,(95℃15sec,60℃45s)×40个循环。样品real-timepcr检测:将各样品cdna倍稀释后取2μl作模板,分别用目的基因引物和内参基因引物进行扩增。4、统计方法所有数据以平均值±标准差显示。方差分析多组数据组间差异,p<0.05为有统计学差异。5、结果结果显示,与对照组相比,sprr3和tmprss11d基因在骨性关节炎滑膜组织中的表达下调(如图1a、b所示),差异具有统计学意义(p<0.05)。以上结果验证了高通量转录组表达数据的整合分析sprr3和tmprss11d基因在骨性关节炎患者滑膜组织中低表达的结果。实施例4westernblot验证骨性关节炎患者滑膜组织sprr3和tmprss11d蛋白表达情况进一步验证上述8例骨性关节炎患者及4例对照者滑膜组织sprr3和tmprss11d蛋白表达情况。1、ripa裂解液(beyotime)进行蛋白质样品制备,操作步骤如下:将组织样本自冰箱取出,用滤纸擦拭组织上的pbs溶液,称取重量,并将组织置于机械组织匀浆器中,1:10组织比裂解液的重量体积比例加入相应体积的裂解液进行匀浆,10000-14000g离心3-5分钟,取上清液,按1:1加入样品缓冲液强力混匀后置于100度的水浴箱水浴加热3-5分钟,10000g离心10分钟,取上清液,将其转入另一洁净的试管中。2、westernblot采用康为世纪微量bca蛋白定量试剂盒(货号:cw2011),具体步骤见其说明书。然后,进行sds-聚丙烯酰胺凝胶电泳(sds-page)以及蛋白质印迹,具体步骤如下:所述sds-聚丙烯酰胺凝胶电泳:1)蛋白质样品变性:a)根据bca蛋白质浓度测定结果,每个凝胶加样孔中加入相同质量的总蛋白提取物。按照每1微升蛋白样品加入0.25微升蛋白上样缓冲液的比例,混合蛋白样品和蛋白上样缓冲液(5x)。b)100℃或沸水浴加热3-5分钟,以充分变性蛋白。c)冷却到室温后,直接上样到sds-page胶加样孔内即可。2)胶板制备:采用bio-rad公司的微型垂直板电泳装置制备0.75mm厚的凝胶,照说明书安装好玻璃板后,先在小烧杯中配制5ml10%的分离胶,配方如下:表1分离胶配方组分用量30%丙烯酰胺溶液1.7mltris-hcl(1.5m,ph8.8)1.3ml10%sds0.05ml10%ap0.05mltemed0.002ml灭菌ddh2o补充至5ml混匀后立即灌胶,然后加1ml蒸馏水覆盖,室温下放置约30min待胶聚合后,用蒸馏水洗2-3次,再用滤纸吸干。然后制备2ml5%的浓缩胶,配方如下:表2浓缩胶配方组分用量30%丙烯酰胺溶液0.33mltris-hcl(1.0m,ph6.8)0.25ml10%sds0.02ml10%ap0.02mltemed0.002ml灭菌ddh2o补充至2ml混匀后立即灌胶,插入样品梳,避免产生气泡,待胶凝固后,取出样品梳,后用蒸馏水和1x蛋白电泳缓冲液先后冲洗样品孔。3)上样及电泳将凝胶板装在电泳装置上,内槽中加满1x蛋白电泳缓冲液,外槽中1x蛋白电泳缓冲液应超过铂丝,按顺序上样。在末端泳道中加入蛋白质质量标准蛋白梯度。电泳时蓝色染料到达胶的底端处附近即可停止电泳。所述蛋白质印迹:①预先用转印缓冲液浸泡nc膜、滤纸、海绵垫。sds-page结束后取出凝胶,去除浓缩胶,在tris/甘氨酸缓冲液中漂洗数秒,然后置于转印缓冲液中浸泡15-30min。打开电转印夹,每侧垫上一块专用的用转印缓冲液浸泡透的海棉垫,再各放一块转印液浸透的滤纸,滤纸与海棉垫大小相同或与nc膜,凝胶大小相同均可,将凝胶平放在阴极侧滤纸上,最后将nc膜平放在凝胶上,去除气泡,夹好电转印夹。在电泳槽加满电转印液,插入电转印夹,将电泳槽放入冰箱内(电转印液之前要放入冰箱内预冷),连接好电极,接通电流,转印夹的nc膜应对电泳槽的正极。②封闭:用1xtbs漂洗一次。加入含5%的无脂奶粉tbs封闭缓冲液,置于振荡培养箱中进行封闭;③一抗杂交:弃封闭液,加入用一抗(anti-sprr3antibody(ab124095);anti-tmprss11dantibody(ab127031))稀释液稀释的一抗杂交溶液,置于4℃杂交过夜,第二天在振荡培养箱中进行杂交;④回收一抗杂交液,用tbst洗膜3次;⑤弃tbst,加入用封闭缓冲液稀释的二抗(goatanti-rabbitigg,hrpconjugated,cw0103)杂交溶液,置于振荡培养箱中进行杂交;⑥弃二抗溶液,用tbst洗膜3次;⑦ecl化学发光及图像采集和分析:按照高灵敏度化学发光检测试剂盒(康为世纪货号cw0049b),具体步骤参照说明书。⑧以β-actin作为内参进行数据标准化,以正常人作为参照样本,观察骨性关节炎尿液样本中sprr3和tmprss11d蛋白的相对表达水平。3、统计分析将蛋白条带的灰度值使用imagej软件进行分析,以β-actin为内参,将目的白条带的灰度值进行归一化处理。结果数据都是以平均值±标准差的方式来表示,采用spss13.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当p<0.05时具有统计学意义。4、结果结果显示,与对照组相比,骨性关节炎患者中sprr3和tmprss11d蛋白在骨性关节炎组中的表达下调(如图2a、b所示),差异具有统计学意义(p<0.05)。与实时荧光定量pcr实验结果具有一致性。本发明采用高通量测序筛选出骨性关节炎相关基因sprr3和tmprss11d,结合分子生物学实验证实了sprr3和tmprss11d是骨性关节炎诊治标志物。实施例5骨性关节炎检测试剂盒的组装试剂盒一:骨性关节炎检测试剂盒:基于实时荧光定量pcr对sprr3和tmprss11d基因表达水平检测。组装本发明所述的用于骨性关节炎检测试剂盒,所述试剂盒包括特异扩增sprr3和tmprss11d的引物对如seqidno:1-4所示,和特异扩增内参基因(gapdh)的引物对如seqidno:5和seqidno:6所示;还包括sybrgreen聚合酶链式反应体系,如pcr缓冲液、sybrgreen荧光染料、dntps。所述pcr缓冲液的成分为25mmkcl,2.5mmmgcl2,200mm(nh4)2so4。通过对引物浓度和退火温度的优化,最终确定反应体系如表3所示:表3pcr反应体系组分加入量sybrgreen聚合酶链式反应体系12.5μl上游引物(10μm)0.5μl下游引物(10μm)0.5μl模板cdna2.0μl加入灭菌蒸馏水至25μl最佳反应条件为:95℃预变性5min,(95℃变性15sec,60℃退火45sec,72℃延伸35sec)×40个循环,72℃延伸15min。试剂盒二:骨性关节炎检测试剂盒:基于elisa法对sprr3和tmprss11d蛋白表达水平检测。下述以elisa双夹心法为例组装检测骨性关节炎的elisa试剂盒:1.elisa实验中常规试剂:包被缓冲液(ph9.6的碳酸盐缓冲液):na2co31.59g,nahco32.93g,加蒸馏水至1l。洗涤缓冲液(ph7.4):8.0gnacl;0.2gkh2po4;2.9gna2hpo4·12h2o;0.2gkcl;0.5ml0.05%吐温-20,加ddh2o至1l。稀释液:牛血清白蛋白(bsa)0.1g加洗涤缓冲液至100ml;本发明试剂盒使用的抗人sprr3和tmprss11d蛋白鼠源单克隆抗体,抗sprr3和tmprss11d兔多克隆抗体均可以商业购买或自行制备,所述制备方法是所属
技术领域:
人员已知的。蛋白标准品sprr3和tmprss11d为人源重组蛋白均购自abcam公司。2.酶标板的包被:所述的抗sprr3和tmprss11d鼠源单克隆抗体包被的酶标板通过如下方法制备:用ph9.6的碳酸盐包被缓冲液将纯化后抗sprr3和tmprss11d单克隆抗体稀释成目的浓度0.63μg/ml;将稀释好的抗体溶液混匀后加入微孔中,100μl/孔,4℃过夜;洗板3次,200μl/孔;加入3%bsa封闭液,300μl/孔,4℃过夜;洗板3次,200μl/孔;-20℃保存。3.酶标抗体的制备:取抗sprr3和tmprss11d蛋白兔源多克隆抗体,分别与hrp进行偶联,得到酶标记抗体。取一定量的酶标记抗体加入到稀释液中,充分混匀,使其终浓度为2μg/ml(可根据具体的条件而定),2-8℃避光保存。4.试剂盒的组装:检测骨性关节炎的elisa试剂盒具体包括以下组分:1)sprr3和tmprss11d蛋白标准品;2)sprr3和tmprss11d单克隆抗体包被的酶标板;3)酶标抗体-hrp标记抗sprr3和tmprss11d多克隆抗体;4)稀释液;5)洗涤缓冲液;6)tmb;7)终止液;8)封板膜;5.该试剂盒的使用方法如下:(1)推荐绘制标准曲线sprr3和tmprss11d标准品浓度梯度为900pg/ml,600pg/ml,300pg/ml,150pg/ml,75pg/ml;(2)分别设空白孔(空白对照孔不加样品及酶标试剂,其余各步操作相同)、待测样品孔,在酶标板上待测样品孔中先加样品稀释液40μl,然后再加待测样品10μl(样品最终稀释度为5倍)。加样将样品加于酶标板孔底部,尽量不触及孔壁,轻轻晃动混匀;(3)用封板膜封板后置37℃温育30分钟;(4)小心揭掉封板膜,弃去液体,甩干,每孔加满洗涤液,静置30秒后弃去,如此重复5次,拍干;(5)每孔加入酶标试剂50μl;(6)温育,洗涤,步骤同上;(7)每孔先加入tmb底物溶液a50μl,再加入tmb底物溶液b50μl,轻轻震荡混匀,37℃避光显色15分钟;(8)每孔加终止液50μl,终止反应;(9)以空白孔调零,450nm波长依序测量各孔的吸光度(od值),计算各样本中蛋白含量。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>北京致成生物医学科技有限公司<120>sprr3和/或tmprss11d作为骨性关节炎诊治标志物的用途<130>p18068<160>6<170>siposequencelisting1.0<210>1<211>20<212>dna<213>人工序列(artificialsequence)<400>1gatcccagaggctgaacacc20<210>2<211>20<212>dna<213>人工序列(artificialsequence)<400>2aggtggtggggtaaaggtct20<210>3<211>20<212>dna<213>人工序列(artificialsequence)<400>3taggccagcacgtgtaactt20<210>4<211>20<212>dna<213>人工序列(artificialsequence)<400>4gagctatggtgactgccagg20<210>5<211>21<212>dna<213>人工序列(artificialsequence)<400>5ggagcgagatccctccaaaat21<210>6<211>23<212>dna<213>人工序列(artificialsequence)<400>6ggctgttgtcatacttctcatgg23当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1