一种青少年特发性脊柱侧凸的lncRNA标志物lncAIS及其应用的制作方法
本发明涉及生物医药
技术领域:
,具体涉及一种与青少年特发性脊柱侧凸(ais)检测和预后相关的lncrna标志物及其应用。
背景技术:
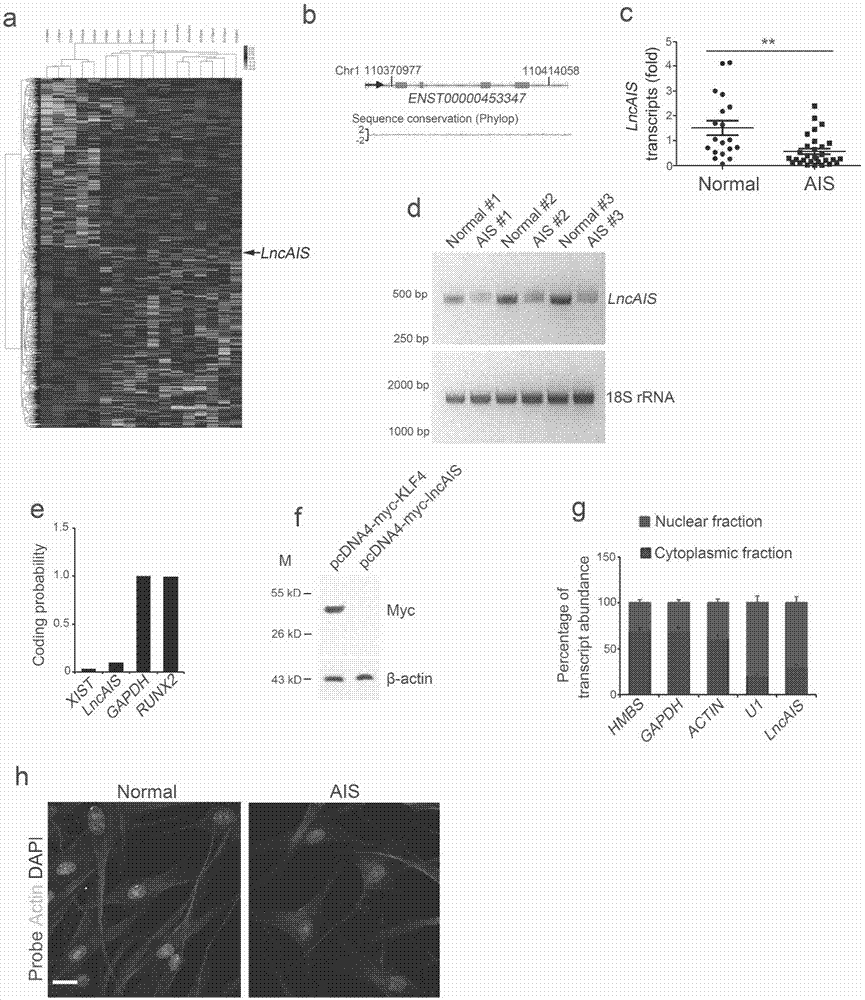
:青少年特发性脊柱侧凸(adolescentidiopathicscoliosis,ais)是一种复杂的脊柱三维畸形,主要发生在青春期生长期间10至16岁的女孩中。脊柱侧弯进展可能出现外观畸形、后背疼痛、功能障碍,严重者将出现心肺功能受限等生理功能问题,不同程度影响社会活动。流行性病学调查结果显示在青少年中全球ais发病率约为2-4%,其中约为10%被诊断患有ais的人需要治疗。目前ais的治疗包括支具疗法和外科手术矫正;其中全时支撑疗法可能导致背部疼痛和心理障碍,而使用椎弓根螺钉仪器的矫正手术不可避免地会导致严重的手术创伤,螺钉位置不良时甚至造成永久性的灾难性神经或血管受伤。如果能够尽早检测出ais发病及其进展的风险,就可能及时采取合适的治疗方案,减少治疗延迟带来的痛苦和不便。在ais的病因和发病机制上的新进展,如探索ais发病的分子机制,将有可能为ais检测以及进展预测和治疗提供更便利的方法。研究表明,与性别和年龄匹配的对照组相比,ais患者的骨骼生长异常,并且骨矿物质密度(bmd)持续下降。1982年burner等人首次报道了ais患者的骨量减少。大约三分之一的ais患者bmd较差。据报道,低bmd是ais女孩曲线进展的关键预后因素。有人认为骨量减少可能是导致ais脊柱畸形的主要因素。许多研究证实,ais患者的bmd降低了27%~38%。此外,对骨骼成熟的纵向随访显示,超过80%的ais女孩持续存在骨量减少,提示骨量减少可能是ais患者骨代谢的终身系统异常。间充质干细胞(msc)存在于所有哺乳动物器官的基质中,可分化为成骨细胞、脂肪细胞和软骨细胞。此外,msc在膜内和软骨内骨形成中都是必不可少的。我们以前证实了ais患者骨髓(bm)的msc显示出降低的成骨分化能力。park等人的研究进一步证实了我们的研究结果。我们和其他人的研究表明,ais患者的msc在成骨细胞、软骨细胞和脂肪细胞的发育过程中发生异常分化,鉴于间充质干细胞(msc)在骨形成和再吸收中的功能特征,我们推测msc的异常成骨分化与ais的发病机理有关。然而,在ais患者中是如何对msc进行异常调节的仍然是难以捉摸的。非编码rna(ncrna)被称为生命体中“暗物质”,ncrna所占全基因组的比例与生物种间的复杂等级有着密切的相关性。ncrna在发育和基因表达中发挥的复杂精确的调控功能解释了基因组的复杂性,同时也为人们从基因表达调控网络的维度来认识生命体的复杂性开启新的天地。越来越多的证据表明,一系列重大疾病的发生发展与非编码rna调控失衡相关。长链非编码rna(lncrna)最近被认为是一类基因的超过200个核苷酸(nt)的转录物,其不具备蛋白质编码能力。在各种物种中lncrna保守性较低,但与蛋白质编码基因相比更具组织特异性。研究表明,lncrna在基因调控和其他细胞过程中发挥着广泛的作用。lncrna参与各种生物过程,包括染色质修饰、转录调控、印记和核转运。lncrna通过多种机制发挥其功能,包括共转录调节、基因表达的调节,核或细胞质复合物的支架,以及与其他rna的配对。我们最近报道了几种lncrna参与肝癌干细胞的自我更新维持。最近的研究报道,几种lncrna调节它们各自的邻近蛋白质编码基因,在中内胚层分化和心脏发育中发挥关键作用。然而,lncrna在ais发病机理中的生物学作用尚不清楚。综上所述,为了提供ais检测以及进展预测和治疗的便利方法,本发明探索了间充质干细胞(msc)中lncrna与青少年特发性脊柱侧凸(ais)的发病机制的关联。技术实现要素:本发明的目的在于提供一种检测青少年特发性脊柱侧凸(ais)的lncrna标志物lncais(基因符号:enst00000453347);本发明还提供了所述lncrna标志物lncais在制备青少年特发性脊柱侧凸(ais)的检测、预后、预防或治疗产品中的应用。本发明的目的还在于提供检测、预后、预防或治疗青少年特发性脊柱侧凸(ais)的产品。本发明的发明人在对青少年特发性脊柱侧凸(ais)的相关研究中发现,所述lncrna标志物lncais在ais患者的骨髓间充质干细胞(bm-msc)中表达下调。本发明的实验证明了lncais能促进bm-msc启动成骨分化。本发明一个方面提供lncrna标志物lncais在制备调控骨髓间充质干细胞成骨分化的生物制剂中的应用。在本发明上述应用的一些实施方案中,用表达shlncais的慢病毒感染骨髓间充质干细胞所产生的lncais下调抑制成骨分化和骨形成,所述shlncais基因的核苷酸序列如以下seqidno:4-6中任一个所示(seqidno:4:ttcctaatcctgctccag;seqidno:5:atagacatctggtttctgg;seqidno:6:ttaggacatagacatctg)。在本发明上述应用的另一些实施方案中,用过表达lncais的慢病毒感染骨髓间充质干细胞所产生的lncais上调促进成骨分化和骨形成。如本文所用,术语“表达下调”或“下调”是指例如对于特定核苷酸序列如特定lncrna序列,其序列量的测量表明,例如与对照如正常个体相比,在从ais患者或具有ais风险的个体分离的生物样品如bm-msc中,该序列的表达水平降低。反之,“表达上调”或“上调”是指例如对于特定核苷酸序列如特定lncrna序列,其序列量的测量表明,例如与对照如与正常个体相比,在ais患者或具有ais风险的个体分离的生物样品如bm-msc中,该序列的表达水平增加。本发明的一个方面提供了用于青少年特发性脊柱侧凸(ais)检测和预后的试剂盒,所述包含试剂盒特异性扩增所述lncrna标志物lncais的cdna引物对和说明书,所述引物对为正向引物seqidno:7(5’-tccctgagaaaaacctcc-3’)和反向引物seqidno:8(5’-agagaaaatcacccatgc-3’)。所述试剂盒还可以包括pcr反应常用试剂,如逆转录酶、缓冲液、dntps、mgcl2、depc水和taq酶等;还可以含有标准品和/或对照品。在本发明中,“预后”是指ais患者在通过手术、药物治疗或其组合处理等抑制或缓解ais发展的过程或结果。预后可以是通过手术、药物治疗或其组合处理抑制或缓解ais发展后1、2、3、4、5、6、7、8年或更久时的生机状态。预后可以通过检测标志物来评估,所述标志物为一个或多个基因。预后评估可以这样进行:根据标志物的有或无,或者升高或降低,确定患者的预后是否良好,或者确定良好预后或不良预后的概率。本发明的另一个方面提供了lncais或其激动剂或类似物在制备预防和/或治疗青少年特发性脊柱侧凸(ais)的生物制剂中的应用。在本发明的一些实施方案中,所述应用包括将lncais或其模拟物或具有其生物活性的类似物与载体结合后和药物可接受的辅料复配制成药物组合物,任选地所述药物组合物还包含预防或治疗ais的其他药剂。本发明的又一个方面提供了一种预防和/或治疗青少年特发性脊柱侧凸(ais)的药物组合物,所述药物组合物包含有效量的lncais或具有其生物活性的类似物,以及药学上可接受的载体,任选地所述药物组合物还包含预防或治疗ais的其他药剂。如本发明所用,术语“个体”、“对象”或“患者”包括但不限于人和其他灵长类(例如黑猩猩以及其他猿和猴类)。在一些实施方式中,所述对象或患者是人。在本发明中,术语“lncais(ensembl基因组数据库基因符号:enst00000453347)”是指具有目前国际共用核酸数据库genebank中该基因所示原始序列的lncrna,其包括天然的或合成来源的lncrna。lncais类似物是指所述lncrna经取代、缺失或添加一个或几个核苷酸,或经过生物学化学修饰后仍具有生物活性的衍生物或变体形式。本发明的lncais激动剂或类似物的有效剂量可以随给药的模式和待治疗疾病的严重程度等进行相应的调整。优选的有效量的可以由本领域普通技术人员综合各因素来确定。所述因素包括但不限于:lncais激动剂或类似物的药代动力学参数、受治疗患者的健康状况、体重、给药途径等。在本发明的一些实施方案中,与lncais结合的载体可以为本领域常用的适于lncrna在宿主细胞中表达的载体种类如脂质体、壳聚糖或慢病毒表达载体,所述药物可接受的辅料包括在药物使用中但不引起明显副作用的各种赋形剂、稀释剂和佐剂,包括但不限于:纯化水、生理盐水、缓冲液、葡萄糖、水、甘油、甘露醇、乙醇、表面活性剂和盐如氯化钠、edta钠等。本发明的药物组合物可以包括经典的药物配制品。可以通过任意常规途径施用根据本发明的药物组合物,只要靶组织通过该途径可以获得即可。在本发明的一些实施方案中,所述药物组合物的形式适合于:直接裸lncrna注射法、脂质体包裹rna直接注射法、繁殖缺陷细菌携带质粒dna法或复制缺陷腺病毒携带目的dna法等。在本发明的一些实施方案中,所述表达载体为慢病毒表达载体,优选地,所述慢病毒表达载体可以为psicor或pwpxl,优选为psicor质粒,并同时应用pmd2.g及pspax2载体包装病毒。在本发明的一些实施方案中,所述药物组合物还任选地包含一种或多种其他对治疗ais有效的药物,这些药物是本领域技术人员所熟知的。本发明的药物组合物可以与其他治疗手段联合施用,用于ais的预防和/或治疗。有益效果:本发明人发现lncais是涉及青少年特发性脊柱侧凸(ais)进展的关键lncrna,lncais在ais患者的骨髓间充质干细胞(bm-msc)中下调,因此可将lncais用于制备检测、预后、预防或治疗ais的产品。本发明提供的用于ais检测和预后的试剂盒能够用于早期检测ais风险或疾病状态,本发明提供的预防和/或治疗ais的药物组合物包含lncais激动剂或类似物作为活性成分,可用于针对ais的基因治疗、药物治疗等临床应用。附图说明图1中a至h所示的结果证明了lncais在ais患者的bm-msc中下调。具体地,图1a所示为通过对健康供体和ais患者的bm-msc进行了微阵列分析,得到的差异表达的lncrna的聚类分析图,其中lncais是ais患者的bm-msc中最受下调的lncrna。图1b显示lncais位于人的1号染色体上,其被鉴定为保守基因座。图1c所示为通过实时qpcr对正常健康供体(normal)和ais患者的bm-msc中lncais转录物进行比较,结果表明在ais患者来源bm-msc中lncais显著下调。图1d所示为通过northern印迹对正常健康供体(normal)和ais患者的bm-msc中的lncais表达进行比较,结果表明ais患者的bm-msc中lncais下调。图1e所示为通过编码能力评估工具(cpat)分析,lncais无编码潜力,其中xist转录物用作非编码基因对照,gapdh和runx2用作编码基因对照。图1f所示为采用pcdna4-myc-his质粒进行的外翻译测定结果表明,lncais不产生任何可检测的肽,其中klf4用作编码蛋白质对照。图1g所示的bm-msc细胞分级分离测定结果表明,lncais主要分布在人bm-msc的细胞核中,其中hmbsrna、actinrna和gapdhrna作为细胞质基因表达的阳性对照,u1rna充当核基因表达的阳性对照。图1h所示的rna荧光原位杂交(rna-fish)测定结果表明,相对于正常健康供体(normal),ais患者的bm-msc中lncais下调,其中红色:lncais探针(probe);绿色:肌动蛋白(actin);细胞核由dapi复染。图2中a至i所示的结果证明了lncais敲低抑制成骨分化和骨形成。具体地,图2a所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc的lncais转录物比较,使用慢病毒介导的短发夹rna(shrna)在正常健康供体bm-msc中敲低lncais,lncais转录物明显降低。图2b所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞增殖比较,结果表明shlncais处理的bm-msc细胞中lncais消耗抑制bm-msc的增殖。图2c所示为通过伤口愈合测定法,分别测量shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞迁移,结果表明lncais敲低不影响bm-msc的迁移能力。图2d所示为采用hoechst33342/pi双染色和流式细胞术,分析shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞凋亡,结果表明shlncais处理的bm-msc细胞中lncais消耗不显著改变细胞凋亡。图2e所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc中的自我更新相关基因(nanog、pou5f1和sox2)的表达水平比较,结果表明lncais消耗显著抑制bm-msc中自我更新相关基因的表达水平。图2f所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc中的成骨分化基因(alpl、bsp、runx2、lpl和ppar)的表达水平比较,结果表明lncais消耗显著下调成骨分化基因的表达水平。图2g所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc中的alp染色比较,结果表明lncais敲低显著抑制成骨分化。图2h所示为shlncaisbm-msc与shctrl(加扰对照)bm-msc中的vonkossa染色比较,结果表明lncais敲低使矿物质沉积减少。图2i所示为通过在nod/scid小鼠中使用异位骨形成模型,对shlncaisbm-msc与shctrl(加扰对照)bm-msc的体外成骨分化和体内异位骨形成进行比较,其中通过fastgreen染色测量骨基质形成,并通过alcianblue染色测量骨成熟度;结果表明lncais敲低抑制体外成骨分化和体内异位骨形成。图3中a至i所示的结果证明了lncais过表达促进成骨分化和骨形成。具体地,图3a显示通过慢病毒在正常(normal)bm-msc中过表达lncais显著增加了其细胞增殖。图3b和3c显示通过慢病毒在正常bm-msc中过表达lncais增强了自我更新相关基因(nanog、pou5f1和sox2)(图3b)和成骨分化基因(alpl、bsp、runx2、lpl和ppar)(图3c)的表达水平。图3d所示为,与成体分化期间的载体转染的bm-msc相比,lncais过表达增加了成骨标志物基因如骨桥蛋白(opn)、col1a1和ibsp的蛋白水平。图3e和3f所示为alp染色(图3e)和vonkossa染色(图3f)结果表明,lncais过表达增强bm-msc的成骨分化。图3g所示为通过nod/scid小鼠体内异位骨形成模型显示,lncais过表达的正常bm-msc(normal+oelncais)显著增加小鼠移植物中类骨质的数量和大小。图3h和3i所示为通过慢病毒感染在ais患者的bm-msc中实施lncais表达,结果表明在ais患者的bm-msc中过表达lncais(ais+oelncais)也可以将自我更新相关基因(nanog、pou5f1和sox2)(图3h)和成骨分化基因(alpl、bsp、runx2、lpl和ppar)(图3i)的表达水平挽救至正常水平。图3j和3k所示的alp染色(图3j)和vonkossa染色(图3k)结果表明,在ais患者的bm-msc中强制的lncais表达(ais+oelncais)也恢复了成骨分化能力。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。以下为本发明实施例所用材料和一般性方法抗体和试剂抗β-肌动蛋白(克隆ac-74)的抗体来自sigma-aldrich(st.louis,usa)。针对myc(克隆9e10)的抗体来自santacruzbiotechnology(santacruz,usa)。针对col1a1(ba0325)、ibsp(ba2329)和opn(pa1432)的抗体来自boster(中国武汉)。与alexa-594缀合的二抗购自molecularprobesinc(eugene,usa)。链霉亲和素珠来自sigma-aldrich(st.louis,usa)。蛋白质a/g珠来自santacruzbiotechnology(santacruz,usa)。碱性磷酸酶检测试剂盒购自millipore(millerica,usa)。superreal预混合加qpcr缓冲液来自tiangenbiotech(中国北京)。oricellbm-msc成骨分化试剂盒来自cyagen(huxma-90021,中国)。vonkossa染色试剂盒来自genmedscientifics(中国上海)。细胞计数试剂盒-8(cck-8)来自dojindo(kumamoto,japan)。fastgreen染色试剂盒和alcianblue染色试剂盒来自xinhualvyuanbiotechnology(中国北京)。本发明的探针、引物和shlncais基因序列表1:用于rnafish的lncais(11-228nt)探针序列lncais探针探针序列序列编号lncais探针#15’-ctttccctgagaaaaacctcc-3’seqidno:1lncais探针#25’-aggattaggaagcctcctgc-3’seqidno:2lncais探针#35’-cgcttctctcttctactgtcc-3’seqidno:3表2:用于lncais敲低的shlncais基因序列基因基因序列序列编号shlncais#15’-ttcctaatcctgctccag-3’seqidno:4shlncais#25’-atagacatctggtttctgg-3’seqidno:5shlncais#35’-ttaggacatagacatctg-3’seqidno:6表3:qrt-pcr分析中用于cdna扩增的引物序列患者和样本从42名ais患者(平均年龄14.5岁,范围12-17岁)和25名健康供体(平均年龄14.9岁,范围12-17岁)获得骨髓(bm)抽吸物。在ais组中,所有患者都接受了全面的临床和放射学检查,以排除脊柱侧凸的其他原因并确定ais的诊断。在对照组中,25名年龄和性别匹配的受试者中的每一个经体格检查具有直脊柱和正常的向前弯曲测试。进入研究时,他们被证实没有任何相关的医学疾病或脊柱畸形。该研究经中国医学科学院伦理委员会和北京协和医院批准。在进入研究之前,从所有受试者及其父母获得书面知情同意书。细胞分离、培养和成骨分化测定从ais患者和健康供体收集人骨髓组织。所有实验均按照中国医学科学院伦理委员会和北京协和医院批准的程序进行。如下文(zhuangq,maow,xup,lih,sunz,lis,etal.identificationofdifferentialgenesexpressionprofilesandpathwaysofbonemarrowmesenchymalstemcellsofadolescentidiopathicscoliosispatientsbymicroarrayandintegratedgenenetworkanalysis.spine2016,41(10):840-855)所述分离和培养人bm-msc。用补充有10%fbs和100u/ml青霉素和100mg/ml链霉素的dmem培养人293t细胞。使用标准方案在293t细胞中产生慢病毒。使用lipofectin(invitrogen)进行转染。对于shrna敲低和过表达实验,将靶序列构建到psicor质粒中。慢病毒由293t细胞产生。筛选3种shrna构建体中最有效的shrna用于以下实验。在每个测定中使用三个独立的敲低细胞系进行生物学重复。进行至少四次独立实验作为生物学重复。用于lncais敲低的shlncais基因序列如以上表2中seqidno:4-6所示。为了诱导成骨分化,将第三代bm-msc接种在六孔板中,并根据制造商的方案用成骨诱导培养基处理。培养基每3天更换一次。伤口愈合试验将培养皿用0.1%明胶(v/v)在37℃下涂覆1小时。将1×106个bm-msc细胞铺板以产生汇合的单层。培养细胞以完全粘附和扩散。通过用p200移液管尖端手动刮擦细胞单层来产生伤口。使用参考点标记获取第一图像。将细胞在组织培养箱中培养24小时。通过匹配第一图像的拍摄区域来获取第二图像。编码潜力分析根据制造商的说明,通过编码潜力评估工具(cpat)在http://lilab.research.bcm.edu/cpat/的网站上分析lncais的编码潜力。xist转录物用作非编码基因对照。gapdh和runx2用作编码基因对照。细胞分级分离分析根据制造商的说明书,使用ne-per核和细胞质提取试剂盒(pierce)裂解bm-msc,然后进行核和细胞质分级分离。使用trizolreagent(invitrogen)提取rna,然后用rneasy试剂盒(qiagen,valencia,ca,usa)纯化。通过m-mlv逆转录酶(promega)和qrt-pcr分析进行逆转录。hmbsrna、actinrna和gapdhrna作为细胞质基因表达的阳性对照。u1rna充当核基因表达的阳性对照。alp和vonkossa染色根据制造商的方案,使用alp染色试剂盒监测alp染色。根据制造商的方案,使用vonkossa染色试剂盒监测矿物沉积。用nikoneclipseti显微镜(nikon,japan)获得图像。通过imagej量化矿物沉积的颜色强度。northern印迹用trizol从bm-msc提取总rna。将来自每个样品的10μgrna进行甲醛变性琼脂糖电泳,然后用20×ssc缓冲液(3.0mnacl和0.3m柠檬酸钠,ph7.0)转移至带正电荷的nc膜。将膜进行uv交联,并与通过体外转录产生的生物素标记的rna探针如incais(11-228nt)探针一起温育。根据制造商的说明书,用hrp-缀合的链霉亲和素检测生物素信号用于cheniluminescent核酸检测模块。rnafish根据biosearchtechnologies的方案产生荧光缀合的lncais探针。用于rnafish的lncais(11-228nt)探针组序列如以上表1中seqidno:1-3所示。将bm-msc与dna探针组杂交,然后用指定的抗体染色。用olympusfv1200激光扫描共聚焦显微镜(olympus,japan)获得图像。微阵列分析根据制造商的说明书,使用trizolreagent(invitrogen)从bmmsc提取rna,然后用rneasy试剂盒(qiagen,valencia,ca,usa)纯化。使用one-cycletargetlabelingandcontrolreagents(affymetrix,santaclara,ca,usa)产生cdna,并用genechipwt标记试剂盒(affymetrix,santaclara,ca,usa)产生crna。将生物素标记的片段化(≤200nt)crna,在45℃下与affymetrixgenechiphumantranscriptarray2.0(affymetrix)杂交16小时。在affymetrixfluidicsstation450中洗涤并染色genechip。使用安装在scanner30007g中的genechipcommandconsole(agcc)扫描genechips。使用affymetrix默认分析设置和全局缩放作为归一化方法,使用robustmultichipanalysis(rma)算法分析数据。给出的值是log2rma信号强度。微阵列数据以登录号(gse110359)保存在geo中。rna敲低试验用生物素rna标记混合物(roche)在体外获得生物素标记的lncais全长(有义)和反义rna,然后与从bm-msc分离的核提取物一起温育。通过链霉亲和素珠拉下(pulldown)rna结合蛋白。用sds-page分离下拉组分,然后进行银染色。通过ltqorbitrapxl质谱法分析由lncais富集的差异条带或用指定的抗体进行免疫印迹。rna免疫沉淀(rip)测定bm-msc用1%甲醛处理,然后用不含rnase的ripa缓冲液(50mmtris-hcl[ph7.4],150mmnacl,0.5%脱氧胆酸钠,0.1%sds,5mmedta,2mmpmsf,20mg/ml抑肽酶,20mg/ml亮抑酶肽,10mg/ml胃蛋白酶抑制剂a,150mm苯甲脒,1%nonidetp-40和rnase抑制剂)溶解。将样品在冰上超声处理并离心。将上清液预先清除并与指定的抗体一起温育,然后进行蛋白a/g珠免疫沉淀。从洗脱液中提取总rna。通过qpcr分析lncais富集。用于cdna扩增的引物序列列于以上表3中。染色质免疫沉淀(chip)测定根据标准方案(upstate)进行定量chip。将从固定在1%甲醛中的bm-msc(2×106)剪切的染色质(超声处理至200-500bp)与4μg抗体一起在4℃温育过夜,然后用鲑鱼精子dna/蛋白质琼脂糖珠进行免疫沉淀。在洗涤、洗脱和交联反转后,纯化来自每个chip样品和相应输入样品的dna,并使用qpcr分析。用于cdna扩增的引物序列列于以上表3中。体内异位骨形成将总共2×106个人bm-msc与约100mg湿润的ha/tcp陶瓷粉末(nationalengineeringresearchcenterforbiomaterials,chengdu,china)在37℃下孵育过夜。将细胞皮下植入8周龄nod/scid小鼠的背部表面。8周后收获植入物,在4%多聚甲醛中固定,在10%edta中脱钙,包埋在石蜡中,然后切片并染色。通过快速绿色染色将骨质组织染成绿色。通过阿尔新蓝染色将软骨组织染成蓝色以指示骨成熟。统计分析在本发明中使用未配对的学生t检验作为统计分析。使用microsoftexcel或spss13进行统计学计算。当p<0.05时,p值显著。实施例实施例1:鉴定lncais是在ais患者骨髓间充质干细胞(bm-msc)中下调的显著差异表达的lncrna为了鉴定青少年特发性脊柱侧凸(ais)中涉及的关键lncrna,我们对来自5个健康供体和12个ais患者的bm-msc进行了微阵列分析。在正常bm-msc与ais患者的bm-msc中有1483个lncrna显示差异表达,其中718个上调,765个下调,如图1a所示。在ais患者的bm-msc中下调幅度最大的lncrna中,我们专注于我们称为lncais(基因符号:enst00000453347)的未被表征的lncrna。lncais位于人的1号染色体上,包含4个外显子,是全长476nt的转录物。lncais被鉴定为保守基因座,如图1b所示。按照常规操作进行实时qpcr,分析正常健康供体的bm-msc和ais患者的bm-msc中的lncais转录物,扩增lncais的cdna引物如上述表3中seqidno:7-8所示。bm-msc来自20个健康供体和30个ais患者。将相对基因表达倍数标准化为内源性β-肌动蛋白,并计数为平均值±s.d。**,p<0.01。结果证实与来自健康供体的bm-msc相比,在ais患者来源bm-msc中lncais显著下调,如图1c所示。通过northern印迹检测正常健康供体的bm-msc和ais患者的bm-msc中的lncais表达。将217nt的lncais(11-228nt)的探针(其序列如以上表1中seqidno:1-3所示)标记,用于northern印迹分析。分别从指定的正常健康供体bm-msc和ais患者的bm-msc中提取rna,将18srrna(1482-1725nt)用作上样对照。bm-msc来自3个健康供体和3个ais患者。如图1d所示,northern印迹进一步验证了,ais患者的bm-msc中lncais下调,图中显示仅有lncais一个转录物。通过编码能力评估工具(cpat)分析显示,lncais无编码潜力;其中xist转录物用作非编码基因对照,gapdh和runx2用作编码基因对照,如图1e所示。将lncais转录物克隆到pcdna4-myc-his质粒,并转染到293t细胞中48小时。用抗-myc抗体通过免疫印迹,分析myc-融合蛋白的表达。klf4用作编码蛋白质对照。体外翻译测定表明,lncais不产生任何可检测的肽,如图1f所示。先将bm-msc裂解,再进行核和细胞质分级分离和rna提取,然后进行qrt-pcr分析。hmbsrna、actinrna和gapdhrna作为细胞质基因表达的阳性对照。u1rna充当核基因表达的阳性对照。n:核级分。c:细胞质级分。用于qrt-pcr分析中cdna扩增的各引物对列举于以上表3中。数据来自使用源自3个健康供体的bm-msc的三个独立实验。细胞分级分离测定结果表明,lncais主要分布在人bm-msc的细胞核中,如图1g所示。通过rna荧光原位杂交(rna-fish)测定在bm-msc中观察lncais,然后进行免疫荧光染色。红色:lncais探针;绿色:肌动蛋白;细胞核由dapi复染。比例尺,20μm。lncais探针序列如以上表1中seqidno:1-3所示。观察了超过100个典型细胞。rna荧光原位杂交(rna-fish)进一步验证了,在ais患者的bm-msc中lncais下调,以及lncais在细胞核中的分布,如图1h所示。总之,我们揭示了lncais在正常人bm-msc中高度表达,而在ais患者bm-msc中显著下调。实施例2:lncais敲低抑制成骨分化和骨形成为了探索lncais在ais发病机制中的生理作用,我们使用慢病毒介导的短发夹rna(shrna)在健康正常bm-msc中敲低lncais(用于lncais敲低的shlncais基因序列如以上表2中seqidno:4-6所示),并通过实时定量pcr确认敲低效率,如图2a所示。用表达shlncais的慢病毒感染正常bm-msc并在msc培养基中培养3天,然后用实时qpcr检测lncais的mrna水平。用于cdna扩增的引物序列如以上表3中所示。将相对基因表达倍数变化标准化为内源性β-肌动蛋白,并计数为平均值±s.d。**,p<0.01。数据来自使用源自3个健康供体的bm-msc的三个独立实验。通过细胞计数试剂盒-8(cck-8)测定法,测定shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞增殖。每孔接种1×103个人bm-msc,接种后24小时加载cck-8试剂。每2天测量od450。将吸光度变化计算为平均值±s.d。**,p<0.01。数据来自使用源自3个健康供体的bm-msc的三个独立实验。如图2b所示,我们发现,与加扰对照(shctrl)处理的bm-msc细胞相比,shlncais处理的bm-msc细胞中的lncais消耗抑制bm-msc的增殖。通过伤口愈合测定法,分别测量shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞迁移。数据来自使用源自3个健康供体的bm-msc的三个独立实验。比例尺,10μm。如图2c所示,伤口愈合测定结果表明,lncais敲低不影响bm-msc的迁移能力。通过采用hoechst33342/pi双染色,然后流式细胞术,分析shlncaisbm-msc与shctrl(加扰对照)bm-msc的细胞凋亡。数据代表使用源自3个健康供体的bm-msc的三个独立实验。如图2d所示,与shctrl处理的bm-msc相比,shlncais处理的bm-msc细胞中的lncais消耗不显著改变细胞凋亡。在msc维持培养基中培养bm-msc。通过实时qpcr在指定的bm-msc中评估自我更新相关基因的表达水平。用于qpcr中cdna扩增的各引物对列举于以上表3中。将相对基因表达倍数变化标准化为内源性β-肌动蛋白,并计数为平均值±s.d。**,p<0.01。数据代表使用源自3个健康供体的bm-msc的三个独立实验。如图2e所示,当细胞在msc维持培养基中培养时,lncais消耗显著抑制bm-msc中自我更新相关基因(nanog、pou5f1和sox2)的表达水平。将bm-msc在oricellmsc成骨分化培养基中培养6天。通过实时qpcr在指定的bm-msc中评估成骨分化基因的表达水平。用于qpcr中cdna扩增的各引物对列举于以上表3中。将相对基因表达倍数变化标准化为内源性β-肌动蛋白,并计数为平均值±s.d。**,p<0.01。数据代表使用源自3个健康供体的bm-msc的三个独立实验。如图2f所示,当细胞在成骨分化培养基中培养时,lncais消耗显著下调成骨分化基因(alpl、bsp、runx2、lpl和ppar)的表达水平。将bm-msc在oricellmsc成骨分化培养基中培养6天诱导成骨分化,在成骨分化的第6天进行碱性磷酸酶(alp)染色。比例尺,10μm。如图2g所示,通过alp染色确定lncais敲低显著抑制成骨分化。将bm-msc在oricellmsc成骨分化培养基中培养6天诱导成骨分化,进行vonkossa染色以检测第12天的矿物质沉积。比例尺,10μm。通过imagej量化矿物沉积的颜色强度。将强度变化计算为平均值±s.d。**,p<0.01。如图2h所示,通过vonkossa染色确定lncais敲低使矿物质沉积减少。为了进一步确定lncais在体内的作用,我们在nod/scid小鼠中使用了异位骨形成模型。将指定的bm-msc植入nod/scid小鼠中。植入8周后,通过fastgreen染色测量骨基质形成。黑色箭头表示上图中的骨形成。通过imagej量化骨样区域。将阳性染色区域计为平均值±s.d。**,p<0.01。通过alcianblue染色测量骨成熟度。每组n=6只小鼠。bm-msc来自3个健康供体。比例尺,50μm。将shctrl或shlncais感染的bm-msc与羟基磷灰石/磷酸三钙(ha/tcp)骨架一起孵育,并皮下植入nod/scid小鼠中8周。如图2i所示,我们观察到shctrl感染的bm-msc可以在小鼠移植物中形成大量的类骨质,而shlncais感染的bm-msc在小鼠移植物中形成较少的类骨质。因此,lncais敲低抑制体外成骨分化和体内异位骨形成。实施例3:lncais过表达促进成骨分化和骨形成我们通过慢病毒在正常bm-msc中过表达lncais,首先将靶序列构建到psicor质粒中,并同时应用pmd2.g及pspax2载体包装病毒,然后再感染目标bm-msc。lncais过表达(oelncais)显著增加正常bm-msc的细胞增殖(图3a)。一致地,lncais过表达增强了自我更新相关基因(nanog、pou5f1和sox2)和成骨分化基因(alpl、bsp、runx2、lpl和ppar)的表达水平(图3b,3c)。此外,与成体分化期间的载体转染的bm-msc相比,lncais过表达还增加了成骨标志物基因如骨桥蛋白(opn)、col1a1和ibsp(图3d)的蛋白质水平。因此,通过alp染色(图3e)和vonkossa染色(图3f)lncais过表达增强bm-msc的成骨分化。最后,通过nod/scid小鼠体内异位骨形成模型,lncais过表达的bm-msc显著增加小鼠移植物中类骨质的数量和大小(图3g)。为了确定lncais在ais病理过程中的作用,我们通过慢病毒感染在ais患者的bm-msc中实施lncais表达。值得注意的是,在ais患者的bm-msc中过表达lncais也可以将自我更新相关基因(nanog、pou5f1和sox2)和成骨分化基因(alpl、bsp、runx2、lpl和ppar)的表达水平挽救至正常水平(图3h,3i)。重要的是,ais患者的bm-msc中强制的lncais表达也恢复了成骨分化能力(图3j,3k)。总之,lncais促进bm-msc启动成骨分化。虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>中国医学科学院北京协和医院<120>一种青少年特发性脊柱侧凸的lncrna标志物lncais及其应用<130>p18102<160>32<170>siposequencelisting1.0<210>1<211>21<212>dna<213>人工序列(artificialsequence)<400>1ctttccctgagaaaaacctcc21<210>2<211>20<212>dna<213>人工序列(artificialsequence)<400>2aggattaggaagcctcctgc20<210>3<211>21<212>dna<213>人工序列(artificialsequence)<400>3cgcttctctcttctactgtcc21<210>4<211>18<212>dna<213>人工序列(artificialsequence)<400>4ttcctaatcctgctccag18<210>5<211>19<212>dna<213>人工序列(artificialsequence)<400>5atagacatctggtttctgg19<210>6<211>18<212>dna<213>人工序列(artificialsequence)<400>6ttaggacatagacatctg18<210>7<211>18<212>dna<213>人工序列(artificialsequence)<400>7tccctgagaaaaacctcc18<210>8<211>18<212>dna<213>人工序列(artificialsequence)<400>8agagaaaatcacccatgc18<210>9<211>30<212>dna<213>人工序列(artificialsequence)<400>9tgacggggtcacccacactgtgcccatcta30<210>10<211>30<212>dna<213>人工序列(artificialsequence)<400>10ctagaagcatttgcggtggacgatggaggg30<210>11<211>24<212>dna<213>人工序列(artificialsequence)<400>11gcagttaagttcaggagcttcagg24<210>12<211>24<212>dna<213>人工序列(artificialsequence)<400>12gaagcacggttgtatgtgcaagtg24<210>13<211>20<212>dna<213>人工序列(artificialsequence)<400>13atgagggtgattcgagtggg20<210>14<211>21<212>dna<213>人工序列(artificialsequence)<400>14ttgtctcccgtggtggacata21<210>15<211>23<212>dna<213>人工序列(artificialsequence)<400>15cttacccacgattctccatctgt23<210>16<211>21<212>dna<213>人工序列(artificialsequence)<400>16ccgttgtcttgtcaatcaggc21<210>17<211>20<212>dna<213>人工序列(artificialsequence)<400>17caaaggcaaacaacccactt20<210>18<211>20<212>dna<213>人工序列(artificialsequence)<400>18tctgctggaggctgaggtat20<210>19<211>25<212>dna<213>人工序列(artificialsequence)<400>19cttgctgcagaagtgggtggaggaa25<210>20<211>21<212>dna<213>人工序列(artificialsequence)<400>20ctgcagtgtgggtttcgggca21<210>21<211>21<212>dna<213>人工序列(artificialsequence)<400>21gccgagtggaaacttttgtcg21<210>22<211>22<212>dna<213>人工序列(artificialsequence)<400>22ggcagcgtgtacttatccttct22<210>23<211>21<212>dna<213>人工序列(artificialsequence)<400>23aacatcagggacattgacgtg21<210>24<211>23<212>dna<213>人工序列(artificialsequence)<400>24gtatctcggtttgaagctcttcc23<210>25<211>21<212>dna<213>人工序列(artificialsequence)<400>25cactggagccaatgcagaaga21<210>26<211>21<212>dna<213>人工序列(artificialsequence)<400>26tggtggggttgtaggttcaaa21<210>27<211>20<212>dna<213>人工序列(artificialsequence)<400>27ccgcctcagtgatttagggc20<210>28<211>23<212>dna<213>人工序列(artificialsequence)<400>28gggtctgtaatctgactctgtcc23<210>29<211>21<212>dna<213>人工序列(artificialsequence)<400>29tcattcccggagtagcagagt21<210>30<211>19<212>dna<213>人工序列(artificialsequence)<400>30ggccacaagttttggcacc19<210>31<211>22<212>dna<213>人工序列(artificialsequence)<400>31agcctgcgaaagccttttggtg22<210>32<211>23<212>dna<213>人工序列(artificialsequence)<400>32ggcttcacattcagcaaacctgg23当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1