一种烟草蛋白激酶基因NtCIPK25-1及其克隆方法与应用与流程
本发明属于遗传工程技术领域,具体涉及一种烟草蛋白激酶基因ntcipk25-1及其克隆方法与应用。
背景技术:
ca2+在真核生物信号转导中被称为第二信使,ca2+信号传导是植物接收外界胁迫后将信息传递给体内的重要方式之一。在植物体内主要有三种接收ca2+信号的感受器:钙调素(cam)、钙依赖性蛋白激酶(cdpks)和钙调素b类似蛋白家族(cbl)。cipk(cbl-interactingproteinkinase)蛋白是植物特有的ser/thr蛋白激酶,属于植物snrk3蛋白激酶亚家族。cipks是cbl特异性的靶蛋白激酶,cbl-cipks相互作用形成的网络系统接到了一系列植物对外界非生物胁迫刺激的响应。如,干旱、高盐、aba等。cipks结构上主要包含两大结构域:n端激酶结构域(pkc)和c端调节结构域。c端调节结构域是cipks特有的结构,并且在cipk家族中相当保守。c端调节结构域为cbl特异接合的naf结构域和能与pp2c相互作用的ppi结构域。这2个结构域的结构特性使得cipks成为一个连接cbl蛋白和pp2c蛋白传导信号途径的重要分子开关,从而能更好地发挥其信号调控作用。
钾元素是植物必须的大量元素,低钾环境下cbl-cipk复合体在这一过程中的作用已经被逐渐发现。拟南芥cipk23突变后表现对低钾胁迫敏感。进一步研究发现,cbl1/cbl9-cipk23复合体调控钾离子通道akt1的活性。钾被认为是烟草的品质元素,钾含量是评价烟叶品质优劣的重要指标之一。烟叶钾含量提高可以改善烟叶的组织结构,使烟叶结构细腻,而且还能提高烟叶外观色泽,使烟叶呈深橘黄色,香气足,吃味好,富有弹性和韧性,填充性增强。另外钾还可以增强烟叶糖类、色素类、芳香类物质的合成积累。烟草中还未见cipks蛋白基因的相关报道,克隆烟草cipk基因,理解cipks对烟草钾含量的调控,进而培育高质量烟叶具有重要意义。
技术实现要素:
本发明的第一目的在于提供一种烟草蛋白激酶基因ntcipk25-1;第二目的在于提供所述的烟草蛋白激酶基因ntcipk25-1的克隆方法;第三目的在于提供所述的烟草蛋白激酶基因ntcipk25-1的应用。
本发明的第一目的是这样实现的,所述的烟草蛋白激酶基因ntcipk25-1的核苷酸序列如seqidno:1所示。
本发明的第二目的是这样实现的,包括以下步骤:
a、烟草叶片cdna合成:提取烟草根部组织rna,反转录得到第一链cdna;
b、ntcipk25-1基因的pcr扩增:以烟草叶片cdna为模板,根据ntcipk25-1基因序列设计引物,进行pcr扩增,回收和纯化pcr扩增产物;
c、纯化产物与载体链接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
本发明的第三目的是这样实现的,所述的烟草蛋白激酶基因ntcipk25-1在调控烟草钾含量的转基因烟草植株中的应用。
本发明还提供一种所述烟草蛋白激酶基因ntcipk25-1的重组载体。
本发明还提供提供一种所述烟草蛋白激酶基因ntcipk25-1的表达盒。
本发明还提供一种所述烟草蛋白激酶基因ntcipk25-1的转基因细胞系。
本发明还提供一种所述烟草蛋白激酶基因ntcipk25-1的重组菌。
本发明还提供一种利用crsipr/cas9编辑技术对烟草ntcipk25-1基因进行功能鉴定的方法,具体包括以下步骤:
(1)构建crispr/cas9载体
a、根据ntskor1基因组序列设计crispr/cas9靶位点(pam),即ggtacgagaaacatcatattcgg,该靶位点位于第一外显子。
b、靶位点引物设计
根据a设计的靶位点合成靶位点引物:
p1:5’-attgggtacgagaaacatcatatt-3’,
p2:5’-aaacaatatgatgtttctcgtacc-3’;
其中p1灰色区域为靶位点tgg前的20个核苷酸,p2中灰色区域为p1灰色区域的反向互补序列。
c、在靶位点两侧设计编辑材料的检测引物,
cipk25df:5’-atctaagcagcggattgacg-3’,
cipk25dr:5’-agcagagagagagagacctga-3’,扩增长度534bp。
d、制备dsdna
将步骤b中设计合成的引物通过退火形成互补dnaoligo,具体步骤如下:
反应体系50μl,包括sdf20μl,sdr20μl,10×annealingbuffer5μl,灭菌双蒸水5μl。退火程序为:95℃,5min;90℃,1min;80℃,1min;70℃,1min;60℃,1min;50℃,1min;40℃,1min;30℃,1min;20℃,1min;10℃,1min。
e、酶切phse401载体,并与步骤d所制备dsdna进行连接。
利用bsai酶对phse401载体进行酶切,酶切体系50μl,包括:质粒5μl,10×buffer5μl,bsai2μl,灭菌双蒸水38μl。37℃酶切1h。
酶切后对酶切产物进行电泳检测分析,可见1200bp和11520bp两个条带,回收11520bp的酶切产物备用;
利用t4dna连接酶将所回收的大片段酶切产物与步骤d所制备dsdna进行连接,连接时20μl体系进行:所回收载体酶切产物3μl,退火所形成dsdna产物10μl,t4dnabuffer2μl,t4dna连接酶1μl,灭菌双蒸水4μl。16℃过夜连接;
f、测序验证
将步骤e中连接产物转化大肠杆菌,筛选阳性克隆(phse401载体抗性为kan)并进行菌落pcr检测,
菌落pcr检测时,所用引物设计:
u6-26pf:5’-tgtcccaggattagaatgattaggc-3’;
p2:5’-aaacaatatgatgtttctcgtacc-3’;
对菌落pcr检测验证正确的阳性克隆菌株培养扩增后进一步进行测序分析,测序时所用引物为:
u6-26p-f:5’-tgtcccaggattagaatgattaggc-3’。
对测序结果进行分析,选择构建正确的克隆(phse401-ntcipk25)保存备用。
(2)农杆菌转化
从-80℃冰箱中取出农杆菌感受态细胞(c58c1),放置冰上溶解后加入载体phse401-ntcipk254μl;液氮速冻1分钟,转入37℃水浴5分钟,再冰浴2分钟,向混合物中加入1mllb液体培养基,28℃、220rpm培养3~4小时;培养物涂布于含有卡那霉素100mg/l和利福平25mg/l的lb固体培养基上,28℃倒置培养2~3天,可见含有目标载体的农杆菌克隆。
(3)烟草转化
a、挑取含有目标载体的农杆菌克隆,在含有那霉素和利福平的lb平板上划线,28℃培养2~3天;刮取划线菌斑接菌于含有那霉素和利福平的ms培养基中,28℃,220rpm震荡培养,菌液浓度达到od=0.5~0.8时进行侵染;
b、将烟草叶片置于500ml广口瓶中,加入适量75%乙醇,漂洗1min;弃乙醇,加入0.1%的hgcl2溶液,置摇床上室温振荡15~30分钟;弃溶液,用无菌水冲洗6遍;
c、将叶片取出,用无菌吸水纸洗去表面液体,取无菌叶片用剪刀切成1cm×1cm的小片,将切成小片的烟草叶片放入含目标载体的无菌ms液体培养基悬浮菌液中,静置15~20min;取出烟草叶片,用无菌滤纸吸去多余菌液,于含有6-ba(0.02mg/l)、naa(2mg/l)的ms培养基中25℃暗培养两天;将烟草叶片转入分化培养基中,切口接触培养基,分化培养基为含有6-ba(0.5mg/l)、naa(0.1mg/l)、潮霉素(20mg/l)、头孢霉素(500mg/l)的ms培养基,每2~3周继代一次,切口处逐渐形成愈伤组织,最后分化出芽;
d、将长至3~5cm的芽切下,转入ms培养基诱导生根,生根后的转基因植株由生根培养基中取出,用自来水洗净培养基,移植于灭菌的营养土中。
(4)测序筛选编辑材料
t0代转基因苗生长1周左右,选取20株烟苗取叶片并利用dneasyplantminikit(qiagen)提取dna,利用步骤(1)c中设计的引物cipk25df/ntcipk25dr进行扩增,扩增产物纯化后利用正向引物测序。对测序结果分析,获得一株多1个碱基的编辑材料(图4)。种植该编辑材料t1代通过测序筛选编辑纯合单株收种获得t2代。
(5)编辑材料钾含量
温室盆栽种植编辑纯合材料ntcipk25-1-cp及对照。每株按5g纯氮使用烟草专用复合肥(氮﹕磷﹕钾=10﹕10﹕15),分5次施入。现蕾期取中部叶(9-11位叶),杀青后检测钾含量。结果见图5,编辑材料叶片钾含量比对照都显著降低。
本发明利用同源克隆技术从烟草中得到一个烟草蛋白激酶基因ntcipk25-1,利用crispr/cas9编辑技术对ntcipk25-1进行功能验证,结果表明ntcipk25-1基因功能缺失后烟叶钾离子含量显著降低。烟草中ntcipk25-1基因的鉴定还未见报道,该基因的鉴定为通过调控基因的表达调控烟草钾含量提供了新基因。
附图说明
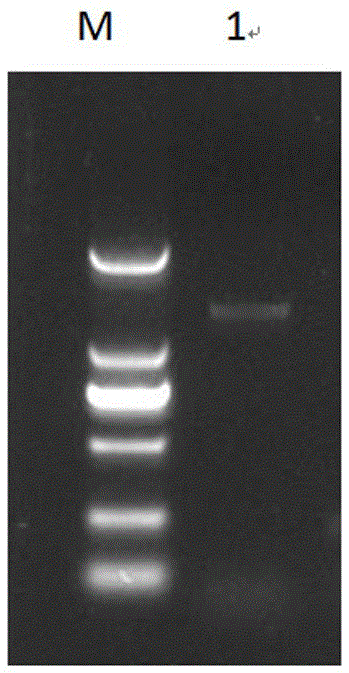
图1为利用引物对ntcipk25-1f/ntcipk25-1r扩增ntcipk25-1基因cds产物的琼脂糖凝胶电泳图,扩增产物大小约为1350bp,m:dl2000,1:ntcipk25-1cdspcr产物;
图2为ntcipk25-1基因组织特异性表达分析结果,ntcipk25-1基因在叶部表达量最高,根部次之,茎部最低;
图3为ntcipk25-1蛋白与拟南芥atntcipk25蛋白序列比对,其中s_tkc为预测的丝氨酸/苏氨酸蛋白激酶区,cipk_c为c端调节结构域;
图4为crispr/cas9编辑ntcipk25-1基因材料编辑靶位点测序结果,其中;cp为编辑材料序列,wild为野生型序列,pam为编辑靶位点,编辑材料比野生型多1个碱基a。
图5为ntcipk25-1基因编辑材料与对照中部烟叶钾含量比较,ntcipk25-1-cp为编辑材料,ck为对照。ntcipk25-1-cp钾含量比对照降低18.31%。
具体实施方式
下面结合实施例和附图对本发明作进一步的说明,但不以任何方式对本发明加以限制,基于本发明教导所作的任何变换或替换,均属于本发明的保护范围。
本发明所述的烟草蛋白激酶基因ntcipk25-1的核苷酸序列如seqidno:1所示。
所述的烟草蛋白激酶基因ntcipk25-1编码的氨基酸序列如seqidno:2所示。
本发明所述的烟草蛋白激酶基因ntcipk25-1的克隆方法,包括以下步骤:
a、烟草叶片cdna合成:提取烟草根部组织rna,反转录得到第一链cdna;
b、ntcipk25-1基因的pcr扩增:以烟草叶片cdna为模板,根据ntcipk25-1基因序列设计引物,进行pcr扩增,回收和纯化pcr扩增产物;
c、纯化产物与载体链接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
b步骤中所述的引物为:
ntcipk25-1f:5’-atgaaagacccaatgaatcaatcaaac-3’
ntcipk25-1r:5’-ttagtctctgccatcattctcacc-3’
b步骤中所述的pcr反应体系是50μl,包括:200ngcdna,5×phusionhf反应缓冲液10μl,10mmdntp1μl,2u的phusion®high-fidelitydnapolymerase,10μm的正反向引物各1μl,补水至50μl。
b步骤中所述的pcr扩增的反应条件是:98℃,30秒;98℃,7秒;59℃,20秒;72℃,30秒;35个循环;72℃延伸7分钟。
本发明所述的烟草蛋白激酶基因ntcipk25-1的应用为所述的烟草蛋白激酶基因ntcipk25-1在调控烟草钾含量的转基因烟草植株中的应用。
含有权利要求1或2所述的烟草蛋白激酶基因ntcipk25-1的重组载体。
含有权利要求1或2所述的烟草蛋白激酶基因ntcipk25-1的表达盒。
含有权利要求1或2所述的烟草蛋白激酶基因ntcipk25-1的转基因细胞系或重组菌。
下面以具体实施案例对本发明做进一步说明:
实施例1
烟草蛋白激酶基因ntcipk25-1的克隆
a、根据拟南芥atntcipk25基因的蛋白序列(aed93402.1)搜索ncbi数据库得到烟草中同源基因ntcipk25-1序列,利用此序列设计基因克隆引物:
正向引物:ntcipk25-1f:5’-atgaaagacccaatgaatcaatcaaac-3’
反向引物:ntcipk25-1r:5’-ttagtctctgccatcattctcacc-3’
b、提取烟草根部组织rna,反转录得到第一链cdna;
c、以反转录得到的第一链cdna作为模板,用引物ntcipk25-1f/ntcipk25-1r进行pcr扩增,pcr产物经琼脂糖凝胶电泳分离后回收并纯化(图1);
d、纯化产物与载体连接,连接体系与过程如下:4μl纯化产物、1μlsaltsolution、1μlpcr®-bluntⅱ-topo(invitrogen)混匀,25℃,水浴30min;将连接好的载体通过热激转化大肠杆菌dh5a,加液体培养基振荡培养后涂布至含100mg/l卡那霉素的lb平板上过夜培养,挑取菌落进行菌液培养,质粒提取和pcr检测,筛选阳性克隆,对阳性克隆进行测序。
实施例2
烟草ntcipk25-1基因组织特异性表达分析
a、种植栽培烟草云烟87,旺长期提取根、茎、叶片rna,反转录得到第一链cdna。
b、根据ntcipk25-1基因序列设计qrt-pcr引物
qf:5’-tatatcagcaatgtcttcagga-3’,
qr:5’-gaattccttagcagattcaatct-3’。
以烟草actin基因作为内参,actin-f:ctgaggtccttttccaacca和actin-rtacccgggaacatggtagag。以根、茎、叶片cdna为模板进行荧光定量pcr,反应在rochelightcycler480上利用lightcycler480sybrgreenimaster进行,20µl体系含有10µllightcycler480sybrgreenimaster(2×),正反引物各1µl(10µmol/l),cdna1µl(反转录产物稀释4倍),7µl灭菌蒸馏水。反应程序如下:95℃预变性5min;95℃变性20s,60℃退火15s,72℃延伸15s,45个循环。荧光定量pcr结果采用2-△△ct方法计算ntcipk25-1基因的相对表达量。每个处理设3个生物学重复,由excel软件绘制柱状图(图2)。结果表明,ntcipk25-1基因在叶部表达量最高,根部次之,茎部最低。
实施例3
烟草ntcipk25-1基因编码蛋白保守域分析
将ntcipk25-1蛋白与拟南芥atntcipk25蛋白进行多序列比对(图3)。ntcipk25-1具有cipk蛋白保守结构域,如跨膜区丝氨酸/苏氨酸蛋白激酶区s_tkc,c端调节结构域cipk_c,且ntcipk25-1蛋白与拟南芥atntcipk25蛋白同源性较高。
实施例4
利用crsipr/cas9编辑技术对烟草ntcipk25-1基因进行功能鉴定
(1)构建crispr/cas9载体
a、根据ntskor1基因组序列设计crispr/cas9靶位点(pam),即ggtacgagaaacatcatattcgg,该靶位点位于第一外显子。
b、靶位点引物设计
根据a设计的靶位点合成靶位点引物:
p1:5’-attgggtacgagaaacatcatattcgg-3’,
p2:5’-aaacaatatgatgtttctcgtacc-3’;
其中p1灰色区域为靶位点tgg前的20个核苷酸,p2中灰色区域为p1灰色区域的反向互补序列。
c、在靶位点两侧设计编辑材料的检测引物,
ntcipk25df:5’-ccatctcacccatgtctcctt-3’,
ntcipk25dr:5’-tccctatagcaaccttagcga-3’,扩增长度534bp。
d、制备dsdna
将步骤b中设计合成的引物通过退火形成互补dnaoligo,具体步骤如下:
反应体系50μl,包括sdf20μl,sdr20μl,10×annealingbuffer5μl,灭菌双蒸水5μl。退火程序为:95℃,5min;90℃,1min;80℃,1min;70℃,1min;60℃,1min;50℃,1min;40℃,1min;30℃,1min;20℃,1min;10℃,1min。
e、酶切phse401载体,并与步骤d所制备dsdna进行连接。
利用bsai酶对phse401载体进行酶切,酶切体系50μl,包括:质粒5μl,10×buffer5μl,bsai2μl,灭菌双蒸水38μl。37℃酶切1h。
酶切后对酶切产物进行电泳检测分析,可见1200bp和11520bp两个条带,回收11520bp的酶切产物备用;
利用t4dna连接酶将所回收的大片段酶切产物与步骤d所制备dsdna进行连接,连接时20μl体系进行:所回收载体酶切产物3μl,退火所形成dsdna产物10μl,t4dnabuffer2μl,t4dna连接酶1μl,灭菌双蒸水4μl。16℃过夜连接;
f、测序验证
将步骤e中连接产物转化大肠杆菌,筛选阳性克隆(phse401载体抗性为kan)并进行菌落pcr检测,
菌落pcr检测时,所用引物设计:
u6-26pf:5’-tgtcccaggattagaatgattaggc-3’;
p2:5’-aaacaatatgatgtttctcgtacc-3’;
对菌落pcr检测验证正确的阳性克隆菌株培养扩增后进一步进行测序分析,测序时所用引物为:
u6-26p-f:5’-tgtcccaggattagaatgattaggc-3’。
对测序结果进行分析,选择构建正确的克隆(phse401-ntcipk25)保存备用。
(2)农杆菌转化
从-80℃冰箱中取出农杆菌感受态细胞(c58c1),放置冰上溶解后加入载体phse401-ntcipk254μl;液氮速冻1分钟,转入37℃水浴5分钟,再冰浴2分钟,向混合物中加入1mllb液体培养基,28℃、220rpm培养3~4小时;培养物涂布于含有卡那霉素100mg/l和利福平25mg/l的lb固体培养基上,28℃倒置培养2~3天,可见含有目标载体的农杆菌克隆。
(3)烟草转化
a、挑取含有目标载体的农杆菌克隆,在含有那霉素和利福平的lb平板上划线,28℃培养2~3天;刮取划线菌斑接菌于含有那霉素和利福平的ms培养基中,28℃,220rpm震荡培养,菌液浓度达到od=0.5~0.8时进行侵染;
b、将烟草叶片置于500ml广口瓶中,加入适量75%乙醇,漂洗1min;弃乙醇,加入0.1%的hgcl2溶液,置摇床上室温振荡15~30分钟;弃溶液,用无菌水冲洗6遍;
c、将叶片取出,用无菌吸水纸洗去表面液体,取无菌叶片用剪刀切成1cm×1cm的小片,将切成小片的烟草叶片放入含目标载体的无菌ms液体培养基悬浮菌液中,静置15~20min;取出烟草叶片,用无菌滤纸吸去多余菌液,于含有6-ba(0.02mg/l)、naa(2mg/l)的ms培养基中25℃暗培养两天;将烟草叶片转入分化培养基中,切口接触培养基,分化培养基为含有6-ba(0.5mg/l)、naa(0.1mg/l)、潮霉素(20mg/l)、头孢霉素(500mg/l)的ms培养基,每2~3周继代一次,切口处逐渐形成愈伤组织,最后分化出芽;
d、将长至3~5cm的芽切下,转入ms培养基诱导生根,生根后的转基因植株由生根培养基中取出,用自来水洗净培养基,移植于灭菌的营养土中。
(4)测序筛选编辑材料
t0代转基因苗生长1周左右,选取20株烟苗取叶片并利用dneasyplantminikit(qiagen)提取dna,利用步骤(1)c中设计的引物ntcipk25df/ntcipk25dr进行扩增,扩增产物纯化后利用正向引物测序。对测序结果分析,获得一株多一个碱基a的编辑材料(图4)。种植该编辑材料t1代通过测序筛选编辑纯合单株收种获得t2代。
(5)编辑材料钾含量
温室盆栽种植编辑纯合材料ntcipk25-1-cp及对照。每株按5g纯氮使用烟草专用复合肥(氮﹕磷﹕钾=10﹕10﹕15),分5次施入。现蕾期取中部叶(9-11位叶),杀青后检测钾含量。结果见图5,编辑材料叶片钾含量比对照都显著降低。
sequencelisting
<110>云南省烟草农业科学研究院
<120>一种烟草蛋白激酶基因ntcipk25-1及其克隆方法与应用
<130>2018
<160>10
<170>patentinversion3.3
<210>1
<211>1350
<212>dna
<213>ntcipk25-1核苷酸序列
<400>1
atgaaagacccaatgaatcaatcaaaccaagaaaccgaccatatgatggacggtacgaga60
aacatcatattcggaaaatacgagatgggtaggcttttaggtcaaggaacatttgcaaag120
gtttattatggcagaaacatcaaaacctcagagagtgttgctattaaagtaatcaacaaa180
gaccatgttaaaagagaaggtttaatggagcaaatcattcgagaaatttcaatcatgaga240
ttagttcgacatcctaacatagttgaactcaaagaagttatggctacaaagcaaaaaatc300
tttgttgttatggaatatgttaaaggtggtgagcttttcgctaaggttgctatagggaaa360
cttaaggaagatgtagcaagaaaatattttcagcaattaataagtgctgttgatttttgc420
catagccgtggtgtatttcatcgtgatttgaagcctgaaaatttgcttctcgacgaaaat480
gagaatttaaaggtttcagattttgggctttcagctttatcggagcaattaaggaatgat540
ggtttgttacatacacagtgtggaactccagcttatgttgcacctgaagttctaaggaaa600
aaaggatatgatggagcaaaatcagatatttggtcttgtggggtaattttatatgttctt660
ttagctggttttttaccatttcaacatgaaaatatgatgaaaatgtataggaaagttttt720
aaagctgagtatgagtttccaccttggttttctcctgaagcaaagaagctaatttcaaag780
cttttagtggctgatccagaaaaaagaatttcaatttctgctataatgagagttccttgg840
atattaaaagattttagtagatcaaattctttttcaagtgaagaaaatggtgataagaaa900
aatggtagcacagagcagatagacttgggaaataggtcaaaatcaggtccacctttttat960
aatgcatttgaatttatatcagcaatgtcttcaggatttgatttgtcaagtctttttgaa1020
agtaagaggaaatctggttcaatgttcacatctaaatcctcagcttcaacaatcatgtca1080
aagttagaatctttagccaagaaaatgaattttaagattgaatctgctaaggaattcaag1140
gtgaaaatgcaaggaacatccgaggggcgaaaaggtaaattatcagtaatggcagaagtg1200
tttgaagttgcaccagaagtggctgttgttgaattctctaaatctgctggagacactttt1260
gagtataggaaattgtgtgaggaagatatacggccttctctcaaagacattgtttggaca1320
tggcaaggtgagaatgatggcagagactaa1350
<210>2
<211>449
<212>prt
<213>ntcipk25-1氨基酸序列
<400>2
metlysaspprometasnglnserasnglngluthrasphismetmet
151015
aspglythrargasnileilepheglylystyrglumetglyargleu
202530
leuglyglnglythrphealalysvaltyrtyrglyargasnilelys
354045
thrsergluservalalailelysvalileasnlysasphisvallys
505560
arggluglyleumetgluglnileilearggluileserilemetarg
65707580
leuvalarghisproasnilevalgluleulysgluvalmetalathr
859095
lysglnlysilephevalvalmetglutyrvallysglyglygluleu
100105110
phealalysvalalaileglylysleulysgluaspvalalaarglys
115120125
tyrpheglnglnleuileseralavalaspphecyshisserarggly
130135140
valphehisargaspleulysprogluasnleuleuleuaspgluasn
145150155160
gluasnleulysvalserasppheglyleuseralaleuserglugln
165170175
leuargasnaspglyleuleuhisthrglncysglythrproalatyr
180185190
valalaprogluvalleuarglyslysglytyraspglyalalysser
195200205
aspiletrpsercysglyvalileleutyrvalleuleualaglyphe
210215220
leupropheglnhisgluasnmetmetlysmettyrarglysvalphe
225230235240
lysalaglutyrglupheproprotrppheserproglualalyslys
245250255
leuileserlysleuleuvalalaaspproglulysargileserile
260265270
seralailemetargvalprotrpileleulysasppheserargser
275280285
asnserpheserserglugluasnglyasplyslysasnglyserthr
290295300
gluglnileaspleuglyasnargserlysserglyproprophetyr
305310315320
asnalapheglupheileseralametserserglypheaspleuser
325330335
serleuphegluserlysarglysserglysermetphethrserlys
340345350
serseralaserthrilemetserlysleugluserleualalyslys
355360365
metasnphelysilegluseralalysgluphelysvallysmetgln
370375380
glythrsergluglyarglysglylysleuservalmetalagluval
385390395400
phegluvalalaprogluvalalavalvalglupheserlysserala
405410415
glyaspthrpheglutyrarglysleucysglugluaspileargpro
420425430
serleulysaspilevaltrpthrtrpglnglygluasnaspglyarg
435440445
asp
<210>3
<211>27
<212>dna
<213>ntcipk25-1f
<400>3
atgaaagacccaatgaatcaatcaaac27
<210>4
<211>24
<212>dna
<213>ntcipk25-1r
<400>4
ttagtctctgccatcattctcacc24
<210>5
<211>22
<212>dna
<213>qf
<400>5
tatatcagcaatgtcttcagga22
<210>6
<211>23
<212>dna
<213>qr
<400>6
gaattccttagcagattcaatct23
<210>7
<211>27
<212>dna
<213>p1
<400>7
attgggtacgagaaacatcatattcgg27
<210>8
<211>24
<212>dna
<213>p2
<400>8
aaacaatatgatgtttctcgtacc24
<210>9
<211>21
<212>dna
<213>ntcipk25df
<400>9
ccatctcacccatgtctcctt21
<210>10
<211>21
<212>dna
<213>ntcipk25dr
<400>10
tccctatagcaaccttagcga21
- 还没有人留言评论。精彩留言会获得点赞!