一种高效降解组胺的新多铜氧化酶的制作方法
本发明涉及一种高效降解组胺的新多铜氧化酶,属于分子生物学技术领域。
背景技术:
生物胺是一类具有生物活性的小分子碱性化合物,广泛存在于发酵食品以及含酒精的发酵饮料中,主要由相应的氨基酸通过微生物的脱羧作用形成,或由醛、酮类物质在氨基酸转氨酶作用下产生。人体摄入过量的外源生物胺后,会产生头痛、恶心、心悸、呼吸紊乱等过敏反应,严重时甚至危及生命,而且多种生物胺共同存在会加强生物胺的毒性作用。食品中常见的生物胺主要包括腐胺、尸胺、精胺、亚精胺、酪胺、苯乙胺和组胺,其中酪胺和组胺的含量最高,对人体的潜在危害最大。
控制和减少发酵产品中的生物胺,目前主要有三种方法:1、控制原料;2、控制发酵体系中产生物胺的微生物;3、酶法降解。前两种方法有一定的局限性,比如会影响某些高蛋白食品的风味,提高设备和能耗费用。而第三种方法通过向发酵食品中添加生物胺降解酶,不造成食品营养物质损失,不产生新的毒性物质。现有的生物胺降解酶包括胺氧化酶和胺脱氢酶,这两种酶存在三个问题:1、降解的生物胺类型少,降解组胺的效率较低;2、最适ph偏中性,不适合应用于酸性发酵食品中;3、活性容易收到某些药物或者化合物的抑制。
多铜氧化酶(multicopperoxidase,mco)是一类含铜氧化酶家族,其中部分多铜氧化酶能将生物胺催化生成对应的醛、氨和水,达到降解生物胺的目的。目前还没有报道过在酸性含盐的环境中能够高效降解生物胺,尤其是组胺的多铜氧化酶。因此,找到一种高效降解组胺的新型多铜氧化酶,对于降低酸性发酵食品中的生物胺尤为重要。
技术实现要素:
本发明的提供了一种来源于发酵乳杆菌(lactobacillusfermentum)的新型多铜氧化酶,可用于降解生物胺,尤其是组胺。
本发明的第一个目的是提供一种多铜氧化酶,其含有seqidno.1所示的氨基酸序列。
本发明的第二个目的是提供编码所述多铜氧化酶的基因。
在本发明的一种实施方式中,所述编码多铜氧化酶的基因含有seqidno.2所示的核苷酸序列。
本发明的第三个目的是提供一种基因工程菌,表达所述多铜氧化酶。
在本发明的一种实施方式中,所述基因工程菌以细菌或真菌细胞为宿主。
在本发明的一种实施方式中,所述基因工程菌以大肠杆菌bl21为宿主。
在本发明的一种实施方式中,所述基因工程菌以pet系列质粒为表达载体。
在本发明的一种实施方式中,所述基因工程菌以pet-28a为表达载体。
本发明的第四个目的是提供所述基因工程菌的构建方法,是将编码所述多铜氧化酶的基因与载体连接,转化至大肠杆菌细胞中。
在本发明的一种实施方式中,所述方法是将seqidno.2所示的序列与pet-28a连接,转化至大肠杆菌bl21中。
本发明的第五个目的是提供一种多铜氧化酶的生产方法,所述方法是将所述基因工程菌接种至培养基中,于16~20℃培养16~24h,收集菌体细胞,破碎细胞获得酶液。
在本发明的一种实施方式中,所述方法将所述基因工程菌接种至tb培养基中,培养至od600为0.6~0.8时,加入iptg以及铜离子诱导。
在本发明的一种实施方式中,所述方法将所述基因工程菌接种至tb培养基中,培养至od600为0.6~0.8时,加入终浓度为0.5~1mm的iptg以及0.5~1mm的铜离子诱导。
本发明的第六个目的是提供所述多铜氧化酶在降解生物胺方面的应用。
在本发明的一种实施方式中,所述应用包括降低发酵食品中的生物胺含量。
在本发明的一种实施方式中,所述应用具体是在食品领域降低酱油中生物胺方面的应用。
在本发明的一种实施方式中,所述应用是将所述多铜氧化酶添加至酱油中,降解酱油中的生物胺。
在本发明的一种实施方式中,所述生物胺包括色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、精胺、亚精胺中的至少一种。
本发明还要求保护含有所述多铜氧化酶的制剂。
有益效果:本发明提供了一种新的多铜氧化酶,该酶的最适ph为3.5,最适温度为50℃,铜离子能够促进酶活提高,使酶活提高3倍。本发明将发酵乳杆菌来源的多铜氧化酶在大肠杆菌中异源表达,获得的多铜氧化酶重组酶具有较强的降解生物胺的性能,能够在24h内降解色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺,在总胺约720mg/l的体系中生物胺降解率达42%,其中降解组胺效果最好,24h内组胺降解率达到82%,具有重要的工业应用潜力。
附图说明
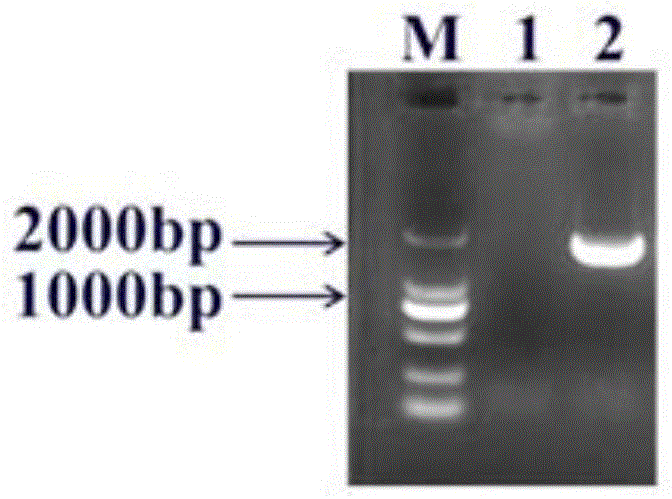
图1为l.fermentum中多铜氧化酶基因的验证图;其中,mmarker;1阴性对照;2l.fermentum中多铜氧化酶基因;
图2为温度对多铜氧化酶(简写为mcof酶)活性的影响;
图3为温度对mcof稳定性的影响;
图4为ph对mcof酶活性的影响;
图5为ph对mcof稳定性的影响;
图6为不同金属离子对mcof酶活的影响;
图7为不同浓度铜离子对mcof酶活的影响;
图8为mcof对不同浓度(w/v,g/100ml)nacl的耐受性;
图9为mcof对不同浓度(v/v,ml/100ml)乙醇的耐受性;
图10为mcof的lineweaver-burk双倒数图。
实施例1
根据ncbi中lactobacillusfermentumstrain47-7genome(genbank登录号为:nz_cp017712.1)中的多铜氧化酶的基因序列,设计引物,以本研究室保藏的发酵乳杆菌(lactobacillusfermentum)基因组为模板,扩增多铜氧化酶基因。扩增所需的引物如下:
上游:atgaatgaaccagttttcgattc
下游:ctacatgtgcatccccatctt
pcr反应程序:95℃预变性3min;95℃下变性30s,55℃下退火30s,72℃下延伸1min30s,34个循环;72℃下延伸10min,4℃下保温。
扩增结束后由1%进行琼脂糖凝胶电泳验证,如图1所示,扩增获得大小为1500bp左右的基因片段,与目的基因大小一致,表明l.fermentum中含有多铜氧化酶基因,将pcr产物纯化测序,测序结果如seqidno.2所示。
实施例2
(1)载体构建:将实施例1获得的基因和pet-28a采用限制性内切酶ecori、hindiii双酶切,在37℃金属浴中反应45min。酶切后的基因片段和质粒经过回收纯化后,按摩尔比4~10:1的比例混合,通过solutioni连接酶进行连接反应,于16℃金属浴中连接过夜。
(2)重组菌的构建:向大肠杆菌jm109感受态细胞中加入5μl步骤(1)制备的连接产物,均匀混合后于冰中静置30min。42℃水浴90s后立即取出于冰中放置2-5min。加入700μllb培养基于37℃,200r·min-1振荡培养1h。4000r·min-1离心2min,弃去大部分上清液,留100μl左右上清液重悬菌体。菌液均匀涂布于含有卡那霉素的平板,置于37℃培养箱中过夜培养。次日挑取单菌落,通过菌落pcr筛选阳性转化子。酶切并测序验证。挑选测序正确的重组质粒转化至大肠杆菌bl21感受态细胞中,获得重组菌,命名为pet-28a-mcof/bl21。
(3)粗酶液的制备:将重组菌pet-28a-mcof/bl21接种到lb培养基中,于37℃、220r/min条件下过夜培养。将种子液按1%的接种量转接到tb培养基中,于37℃、220r/min条件下培养至od600为0.6~0.8,加入终浓度为1mm的cu2+并且加入终浓度为0.1mm的iptg,20℃振荡培养20h。将所得发酵液于4℃、8000r/min离心15min,收集菌体沉淀物,用20mmol·l-1ph7.0的磷酸盐缓冲溶液将菌体洗涤2遍,再用磷酸盐缓冲液将菌体重悬。
以野生菌(lactobacillusfermentum)作为对照,将lactobacillusfermentum接种到mrs培养基中,于37℃静置培养18~24h。将种子液按1%的接种量转接到mrs培养基中,于37℃静置培养24h接种到mrs培养基中,于37℃静置培养18~24h,收集菌体。
将菌体悬液置于冰水浴上,利用超声波破碎菌体细胞,超声波功率为35%、振2s停4s,直至溶液清亮为止。将破碎液于4℃、10000r·min-1离心30min,收集上清即为所需粗酶液,粗酶液的酶活为484.2u/l,与野生菌(原始的发酵乳杆菌)相比提高了258倍左右。
(4)粗酶液的制备:将实施例1经超声波破碎后得粗酶液,过0.45μl滤膜备用。蛋白的纯化:在5ml/min的流速下用5~10倍柱体积的去离子水清洗镍柱;在5ml/min的流速下加入约8~10倍柱体积的bindingbuffer,使镍柱平衡;在1ml/min的流速下上样;在5ml/min的流速下加入约8~10倍柱体积的bindingbuffer,使镍柱平衡;在5ml/min的流速下用不同梯度浓度含咪唑的磷酸缓冲液洗脱镍柱,洗脱液用离心管收集,经sda-page检测确定洗脱条件,得到纯蛋白。经测序,获得seqidno.1所示的氨基酸序列。
实施例3
(1)温度对酶活性及稳定性的影响
将纯化得到的多铜氧化酶与底物分别在不同的温度条件下(25、35、40、45、50、55、60、70、80℃)反应测定酶活,以最高的酶活为100%,计算各温度下的相对酶活确定酶的最适反应温度。
将纯化后的酶液在各温度条件下温浴,每隔3h取适量酶液与底物在最适反应温度下反应,测定不同温度条件对酶活稳定性的影响。
如图2所示,mcof在温度为30~60℃时,酶活可达50%以上,在温度为50℃时,相对酶活达100%;如图3所示,mcof在低于55℃时,保温3h以后,酶活仍能保持30%以上。
(2)ph对酶活性及稳定性的影响
在酶的最适温度条件下,采用可见光吸收测定法测定酶在不同ph条件下的酶活,确定最适反应ph。所述不同ph条件分别是:①50mmol/lhac-naac缓冲液、ph2.5~5.0,②50mmol/l磷酸盐缓冲液ph5.5~7.0,③50mmol/ltris-hcl缓冲液,ph7.5~8.5。
将纯化后的多铜氧化酶分别保存在上述三种ph件下,每隔3h取适量酶液,与底物在最适温度下反应,以0h测得的酶活为100%,测定不同ph条件对酶活稳定性的影响。
如图4~5所示,mcof的最适ph为3.5,在ph3~4下放置3h,酶活保持45%以上。
(3)金属离子对酶活的影响
将酶液与终浓度为1mmol/l的金属离子缓冲液混合,在温度稳定条件下保温10min,测定酶活力。以未添加金属离子测得酶活为100%,确定金属离子对酶活力的影响。
如图6所示,与未添加金属离子的酶相比,cu2+能够明显的促进酶活,使酶活提高2.8倍,fe2+抑制酶活的效果最明显,使酶活降低为未加金属离子的酶的57%。如图7所示,在添加了0.1~1mm的cu2+后,酶活随着cu2+浓度的增加而增加,当cu2+浓度为0.1mm时,相对酶活为98%;cu2+浓度为0.3mm时,相对酶活为127%;当cu2+浓度为0.5mm时,相对酶活为171%;当cu2+浓度为0.7mm时,相对酶活为208%;当cu2+浓度为1mm时,相对酶活为296%。在添加了1~8mm的cu2+后,酶活随着cu2+浓度的增加而降低,当cu2+浓度为2mm时,相对酶活为106%;当cu2+浓度为4mm时,相对酶活为44%,超过4mm的cu2+会抑制酶活。
(4)nacl对酶活稳定性的影响
将酶液在不同质量分数的nacl缓冲液中保温1h(对照组在同样条件下温浴),测定相应条件下的酶活,以对照(未添加nacl的酶液)测得酶活为100%,计算各nacl质量分数条件下相对酶活,确定nacl对酶活稳定性的影响。如图8所示,不同质量分数的nacl对酶的稳定性均有影响,其中18%的nacl对酶的稳定性影响最小,在含18%的nacl的缓冲液中放置1h,酶活依然能够保持40%。
(5)乙醇对多铜氧化酶酶活的影响
将酶液在不同体积分数的乙醇缓冲液中保温1h(对照组在同样条件下温浴),测定相应条件下的酶活,以对照测得酶活为100%,计算各乙醇条件下的相对酶活,确定乙醇对酶活稳定性的影响。
如图9所示,乙醇浓度越高,对酶的影响越大,在2.5%乙醇下(日式酱油中的乙醇浓度在2.5%左右)放置1h,酶活依然能够保持70%以上。
(6)酶反应动力学常数
在最适的ph条件下,加入不同浓度的abts(0.05~0.5mm),并在最适反应温度下,420nm处分别测定酶活,然后根据计算公式,计算得到km、vmax。
横截距=-1/km,纵截距=1/vmax
如图10所示,依据lineweaver-burk双倒数作图法计算得到该酶的km、vmax分别为1.30mmol/l,7.67×10-2mmol/(l·min)。
实施例5
将多铜氧化酶酶液以终浓100u/l加到各生物胺单胺体系,37℃反应48h,生物胺单胺体系中单胺终浓为50mg/l;对照组用磷酸盐缓冲液取代实验组中的粗酶液。在生物胺单胺体系中,mcow对生物胺的降解率:
mcof:组胺>50%>酪氨>腐胺>亚精胺>30%>苯乙胺>尸胺>色胺>10%
其中,对组胺降解效果最好,降解率达52%。
表1mcof对生物胺单胺体系中的生物胺的降解作用
实施例6
将多铜氧化酶酶液以终浓500u/l分别加到生物胺混合体系37℃反应24h,生物胺混合体系中生物胺的比例接近于酱油中的生物胺,其中,色胺20mg/l、苯乙胺150mg/l、腐胺50mg/l、尸胺50mg/l、亚精胺50mg/l、组胺200mg/l、酪氨200mg/l。对照组用磷酸盐缓冲液取代实验组中的粗酶液。生物胺降解结果如表2所示,其中组胺降解效果最好,24h内组胺降解率达到82%。
表2mcof在生物胺混合体系中对生物胺的降解作用
实施例7
将多铜氧化酶酶液以终浓500u/l加到酱油中,37℃反应24h,对照组用pbs缓冲液取代实验组中的粗酶液,生物胺降解结果如下表3所示,组胺降解的量最多。
表3mcof在酱油中的降解作用
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>广东珠江桥生物科技股份有限公司
江南大学
<120>一种高效降解组胺的新多铜氧化酶
<160>4
<170>patentinversion3.3
<210>1
<211>518
<212>prt
<213>人工序列
<400>1
metasngluprovalpheaspsertyrphetyraspgluglnalaphe
151015
asnleuhisaspalaalatyrlysproleulysalaalaglnalapro
202530
alathrproleuasnileproproleuleuthrproasplysvalasp
354045
glyaspaspvaltyrtyrthrvalthralaglnalaglyalathrgln
505560
leuleuproglyglulysthrlysthrtrpglypheasnalasermet
65707580
leuglyglnthrvalvalphegluargglylysthrtyrhismethis
859095
leuvalasnhisleuprogluvalthrthrphehistrphisglyleu
100105110
gluileproglyproilegluaspglyglycyshisalaprovaltyr
115120125
proglyglualaargaspvalthrphelysileileglnproalaala
130135140
thralatrpleuhisalahisprocysprogluthralatyrglnval
145150155160
trpglnglyleualathrmetalaileilehisaspglnglugluala
165170175
serleuproleuprohisthrtyrglyvalaspaspleuproleuile
180185190
leuglnaspargasnphehisalaglyasnglnpheasptyrargala
195200205
asptyraspproaspglyvalglnglyaspthralavalileasnala
210215220
thrvalasnprotyrpheaspvalthrthrglnargleuargleuarg
225230235240
ileleuasnglyserasnargargglutyrargleuhispheserasp
245250255
aspleuthrphethrglnileglyseraspleuserpheleuprohis
260265270
provallysleulyslysleumetthrthrcysalagluargglnglu
275280285
ilevalvalaspphealaglytyrglnproglyaspthrvalthrleu
290295300
tyrseraspaspserproleuvalglupheargilehisgluphethr
305310315320
proalaglyglugluleuprothrthrleuthrlysileasptyrpro
325330335
thrproaspproserleuprovallysglnvalvalmetserglymet
340345350
aspgluthrvalmetileaspglylyslyspheglnmetaspargile
355360365
asptyrthrmetprometglylyscysglnleutrpaspilethrasn
370375380
thrasnaspmetasnglyglymetilehisprophehismethisgly
385390395400
cysalaphegluilevalserargasnglyglngluprotyrprophe
405410415
gluhisglyleuasnaspthrvalalavalasnproglygluhisval
420425430
ileilelysvaltyrpheglnvalproglyvalphemettyrhiscys
435440445
hisileilegluhisgluaspglyglymetmetalaglnleulysval
450455460
valaspproalaalaproaspargglutyrhisleuleuasnhismet
465470475480
thrleumetglualaphealalysgluargglyvalthrmetaspglu
485490495
leutrpleuglyglymetaspsertyrlyslysmetglymethismet
500505510
hishishishishishis
515
<210>2
<211>1557
<212>dna
<213>人工序列
<400>2
atgaatgaaccagttttcgattcctacttttacgatgagcaagccttcaaccttcacgat60
gcggcctacaagccactgaaggcggctcaagcacccgcgacgcccctcaacattccgccc120
ctgttaaccccagacaaggtggacggcgacgacgtgtactacaccgttaccgcccaggcg180
ggggcaacccagctattgccgggggaaaagaccaagacctggggctttaacgcctcaatg240
ctggggcagacggtggtctttgagcgcggcaagacttaccacatgcacctggtcaaccac300
ctaccggaagtgacgaccttccactggcacggactagagattcccgggccaattgaagac360
ggcggctgccacgccccggtttacccgggcgaggcccgcgacgtgacctttaagatcatt420
cagccggccgccaccgcctggctccacgcccacccctgcccggaaacggcctaccaggtt480
tggcagggactggcgacgatggcgatcattcacgaccaagaagaagctagtttgcccctg540
ccgcacacttacggagttgatgacctgccgttgatcttgcaggaccgcaacttccacgcg600
ggcaaccagtttgattaccgggccgattacgaccctgatggcgtccagggtgacacggcg660
gtgattaacgccaccgtcaatccttactttgacgtcaccacccagcgcctgcggttgcga720
attttaaacggctctaaccgccgcgagtaccggctccacttctcggacgacttaaccttc780
acccaaattggctcggacctgagctttttgccccacccggtcaagttaaagaagctgatg840
actacctgtgccgagcgccaggagatcgtggtcgactttgccggctaccagccgggcgac900
acggttaccctgtactccgacgacagtccgctggtcgagttccggatccacgagtttacg960
ccggcaggagaggagttgcccaccaccctgaccaagattgattacccgaccccagacccg1020
agcctacccgtcaagcaggtggtgatgtctgggatggacgagacggtgatgattgacggc1080
aagaagttccagatggaccggatcgattacacgatgccgatgggcaagtgccagctttgg1140
gacattaccaacaccaacgacatgaatggcgggatgattcaccccttccacatgcacggc1200
tgcgcctttgagatcgtctcccgtaacggccaggaaccctacccgtttgaacacggactt1260
aacgacaccgtcgccgttaacccgggcgaacacgtcatcatcaaggtctacttccaagta1320
ccgggggtctttatgtaccattgtcacattatcgaacacgaagatggcgggatgatggcc1380
caactaaaggttgtcgacccggccgccccggaccgggagtaccacttgctcaaccatatg1440
accctgatggaggcctttgccaaggagcggggcgtcacgatggatgaactctggcttggt1500
gggatggactcctacaagaagatggggatgcacatgcatcatcaccaccaccactag1557
<210>3
<211>23
<212>dna
<213>人工序列
<400>3
atgaatgaaccagttttcgattc23
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
ctacatgtgcatccccatctt21
- 还没有人留言评论。精彩留言会获得点赞!