一种抗焦虑药物帕戈隆或帕秦克隆的制备方法与流程
本发明属于药物合成领域,具体涉及一种抗焦虑药物帕戈隆或帕秦克隆的制备方法。
背景技术:
异吲哚酮(γ-内酰胺)是一个较多见而又重要的母核,在很多具有生物活性的分子中都有所体现,如下图所示。
因α位是具有较强络合力的n原子,故利用苯甲酰胺中的氮原子作为导向原子,并且参与形成γ-内酰胺的研究已多有报道。李兴伟课题组最早在2010年尝试使用n-苯基取代的芳甲酰胺作为底物,与丙烯酸酯反应构建起异吲哚酮骨架(org.lett.,2010,12,5430)。反应中首先生成了heck产品中间体,进而发生迈克尔加成而环化。但底物中芳环若是呋喃、吲哚等杂环时不利于形成异吲哚酮产品,多是停留在了氧化heck反应产品上,且反应条件较为苛刻。反应式如下:
2014年,于金权课题组对以上反应进行了改良。他们使用了n-全氟取代苯基芳甲酰胺作为底物(chem.sci.,2015,6,1923),实际上就是增大酰胺中氮原子上取代基的拉电子能力,减弱酰胺键的异构化而增加其亲核性。这一工作虽然扩宽了底物类别,对于杂环如噻吩、呋喃、吡啶都有很好的适用性,且反应条件变得较为温和,但其底物的普适性仍不够广泛,且原料较为复杂,制备过程不够简单。
技术实现要素:
本发明提供了一种抗焦虑药物帕戈隆或帕秦克隆的制备方法,该制备方法通过该“一锅法”合成策略可以一步从苯甲醛作为原料制备药物帕戈隆和帕秦克隆。
一种抗焦虑药物帕戈隆或帕秦克隆的制备方法,包括如下步骤:
包括如下步骤:在铑催化剂和醋酸盐存在的条件下,苯甲醛与2-氨基吡啶类化合物在溶剂中发生反应,原位生成含导向基团的中间体;该中间体再在铑催化下与取代烯烃反应,反应完成后,经过后处理得到所述的抗焦虑药物,所述的抗焦虑药物为抗焦虑药物帕戈隆和帕秦克隆;
作为优选,所述的铑催化剂为[cp*rhcl2]2(cas:12354-85-7),用量为2.5mol%,该种铑催化剂对本发明中的底物的催化效率高。
作为优选,所述的醋酸盐为醋酸铜,用量为2eq。该醋酸盐起到氧化剂的作用,有助于铑催化剂在反应中的催化。
作为优选,以摩尔量计,苯甲醛、2-氨基吡啶类化合物和取代烯烃用量比为1:1.2~2:1.2~2。
作为优选,所述的溶剂为乙腈、水、甲醇、乙醇、dmf、dmso和thf中的至少一种,这些溶剂都为极性溶剂,有利于底物中c-h键的断裂,作为进一步的优选,所述的溶剂为乙腈。
作为优选,反应的温度为80~110℃,反应温度过高,会使得副反应增多,反应温度过低,会降低反应物的转化率,作为进一步的优选,反应的温度为80℃。
作为优选,反应的氛围为空气、氮气中的一种,在这些氛围中,均能使反应更好进行,具有较高产率,作为进一步的优选,反应的氛围为n2氛围。
本发明中,反应的时间可以通过tlc进行监测,在80℃下搅拌4~12小时反应能够发生完全。
为了提高反应的收率,可以先将苯甲醛类化合物、2-氨基吡啶类化合物、cu(oac)2和[cp*rhcl2]2加入schlenk瓶中,然后对其进行抽真空处理再通入氮气,操作三次后,再加入溶剂和取代烯烃。
同现有技术相比,本发明的有益效果体现在:该反应采用“一锅法”制备,操作简单。反应中可自生成高效导向基团。
所述的反应式如下:
推测该反应机理为:
首先,芳香醛与2-氨基吡啶发生缩合反应生成中间体a,在原位产生一个有效的新型导向基团。接着,自组装导向基与取代烯烃在金属铑(iii)催化下发生c-h活化、烯烃插入以及环内加成等反应,得到异吲哚酮衍生物。
附图说明
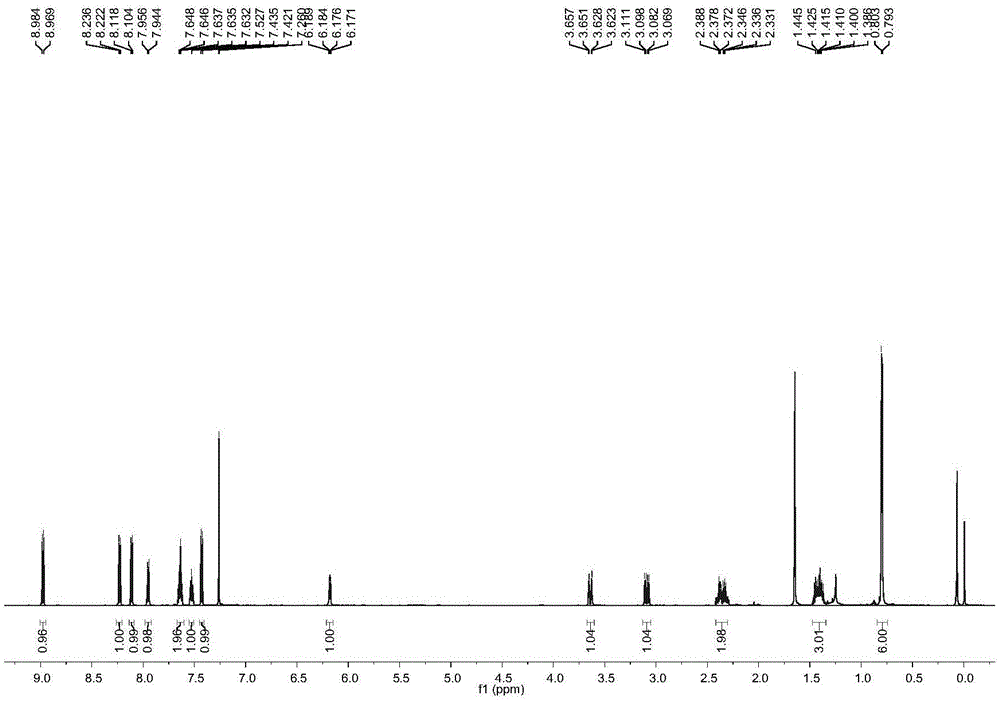
图1为实施例1制得的产物的1hnmr谱图;
图2为实施例1制得的产物的13cnmr谱图;
图3为实施例2制得的产物的1hnmr谱图;
图4为实施例2制得的产物的13cnmr谱图。
具体实施方式
实施例1
在25ml的schlenk瓶中,称入22mg(0.2mmol)对甲基苯甲醛(1.0eq),cu(oac)265mg(2.0eq),2-氨基1,8-二氮杂萘54mg(1.5eq),[cp*rhcl2]26mg(5%)。然后对其进行抽真空处理再通入氮气,操作三次后,加入2ml乙腈和不饱和羰基化合物50mg(2.0eq),在80℃下氮气氛围中恒温搅拌。约10h后tlc检测反应完毕,加入些许硅胶,蒸出溶剂,固化,固体上样,进行柱色谱分离。可以制备得到帕戈隆(cas:133737-32-3)总收率约15%。
产物核磁共振数据:1hnmr(cdcl3,600mhz),δ:8.98(d,j=9.0hz,1h),8.23(d,j=8.4hz,1h),8.11(d,j=8.4hz,1h),7.95(d,j=7.2hz,1h),7.67–7.60(m,2h),7.55–7.50(m,1h),7.43(d,j=8.4hz,1h),6.18(dd,j1=7.8hz,j2=3.0hz,1h),3.64(dd,j1=16.8hz,j2=3.6hz,1h),3.09(dd,j1=17.2hz,j2=7.8hz,1h),2.40–2.31(m,2h),1.46–1.37(m,3h),0.80(d,j=6.0hz,6h).
13cnmr(cdcl3,150mhz),δ:208.4,168.6,154.5,154.2,154.0,146.0,139.1,138.7,133.8,131.4,128.8,124.7,123.5,122.3,119.1,116.5,57.0,45.4,41.9,32.4,27.7,22.4。
实施例2
依据实施例1一样的步骤,更换为如下反应物,可以制备得到帕秦克隆,收率为20%。而如果首先制备反应中生成的中间体下酰胺(通过酰氯和胺缩合),既是通过如下第二个反应式可以以更高的效率得到帕秦克隆,产率可以达到68%。具体来讲,在25ml的schlenk瓶中,称入56.6mg(0.2mmol)酰胺(1.0eq),cu(oac)265mg(2.0eq),[cp*rhcl2]26mg(5%)。然后对其进行抽真空处理再通入氮气,操作三次后,加入2ml乙腈和不饱和酰胺化合物78mg(2.0eq),在80℃下氮气氛围中恒温搅拌。约10h后tlc检测反应完毕,加入些许硅胶,蒸出溶剂,固化,固体上样,进行柱色谱分离(乙酸乙酯与石油醚体积比例为1:1,tlc检测发现产品极性比不饱和酰胺稍微大一些)。
产物核磁共振数据:1hnmr(cdcl3,600mhz),δ:8.94(d,j=9.0hz,1h),8.20(d,j=9.0hz,1h),8.08(d,j=8.4hz,1h),7.91(d,j=7.8hz,1h),7.67(d,j=7.8hz,1h),7.62(t,j=7.2hz,1h),7.50(t,j=7.2hz,1h),7.38(d,j=7.8hz,1h),6.09(dd,j1=9.0hz,j2=3.0hz,1h),3.97–3.92(m,4h),3.85–3.77(m,2h),3.70(dd,j1=15.0hz,j2=3.0hz,1h),3.65–3.56(m,2h),2.74(dd,j1=14.4hz,j2=9.0hz,1h),1.71–1.52(m,4h).
13cnmr(cdcl3,150mhz),δ:168.6,167.8,154.3,154.1,153.9,145.7,139.0,138.7,133.6,131.1,128.8,124.5,123.9,122.1,119.0,116.3,106.9,64.5,57.8,44.0,40.0,36.9,35.6,34.9。
- 还没有人留言评论。精彩留言会获得点赞!