一种发根农杆菌诱导的大豆发状根与大豆花叶病毒病害系统的方法及其应用与流程
本发明属于大豆技术领域,涉及大豆对大豆花叶病毒(smv)抗性改良,具体涉及一种发根农杆菌诱导的大豆发状根与大豆花叶病毒(arishr-smv)病害系统的方法及其应用。
背景技术:
大豆是世界上重要的油料和蛋白作物,在其生长周期中,常常遭受多种病虫害的侵害。smv是一种危害较大的病毒性病害,严重影响大豆产量和品质。为便于研究,基于在不同鉴别寄主上的反应,smv被人为划分成多种株系,随后smv株系特异抗性位点被相应鉴定。然而,目前smv抗性基因仍未被克隆。
过去几十年,科研工作者发展了一些用于验证抗smv候选基因的方法。例如,通过粒子轰击或根癌农杆菌介导的遗传转化方法将靶标基因转入受体大豆,根据转基因植株的抗性评估表现,筛选抗smv功能基因。然而,大豆稳定遗传转化往往存在诸多问题:缺少合适的大豆基因型、转化效率较低、再生困难和耗时耗力,这些都阻碍了候选基因功能的快速筛选。
技术实现要素:
发明目的:针对现有技术存在的问题,本发明提供一种一种发根农杆菌诱导的大豆发状根与大豆花叶病毒(arishr-smv)病害系统的方法,经该方法可快速、有效的鉴定smv相关靶标基因功能,为分子标记辅助育种或转基因育种提供功能标记或基因。另外,本发明的方法亦可用于大豆种质对smv的抗性鉴定。
本发明还提供arishr-smv病害系统的方法中检测smv的特异引物和应用。
技术方案:为了实现上述目的,如本发明所述一种arishr-smv病害系统的方法,包括如下步骤:
(1)利用发根农杆菌侵染大豆子叶诱导愈伤组织:
1)发根农杆菌准备:取发根农杆菌甘油菌进行菌液培养;发根农杆菌优选为发根农杆菌k599;
2)大豆子叶外植体准备:将成熟、无破损的大豆种子盛于培养皿中,干燥器中氯气灭菌,除菌的大豆种子去除种皮于水琼脂上培养,收割大豆子叶用于发根农杆菌侵染;
3)发根农杆菌侵染大豆子叶:在大豆子叶背部近叶柄处切下切口,发根农杆菌滴加到子叶创伤处并进行暗培养,从创伤处长出的愈伤组织被用于smv接种;
(2)提纯大豆花叶病毒(smv)
1)smv在防虫温室内繁殖,繁殖寄主为大豆,在第一对真叶展开后接种,发病后2-3周内摘取病叶,进行smv提纯;
2)将收集的新鲜病叶加入缓冲液,研磨成匀浆,过滤并收集滤液;离心取上清,加入nacl,tritonx-100和peg搅拌后静置过夜;多次离心混合液并悬浮,获得smv病毒粒子备用;
(3)针刺大豆愈伤组织,接种纯化的smv粒子
将步骤(1)中发根农杆菌诱导的大豆愈伤组织刺伤,于创伤处滴加smv病毒粒子,继续培养;
(4)大豆发状根中smv含量检测
将从愈伤组织长出的大豆发状根切割回收,通过qrt-pcr或elisa对大豆发状根中smv含量进行检测。
作为优选,步骤(1)所述发根农杆菌用含乙酰丁香酮的mgcl2稀释,置于摇床上轻柔摇动后用于侵染大豆子叶。
作为优选,步骤(1)所述大豆种子经氯气除菌,无菌水浸泡过夜,于次日在超净台内去除其种皮,将其播种在水琼脂上培养。
作为优选,步骤(2)所述smv病毒粒子用磷酸缓冲液稀释至浓度为50-60μg/ml。
作为优选,步骤(3)所述发根农杆菌诱导的大豆愈伤组织经针刺后接种纯化的smv病毒粒子。
进一步地,步骤(4)通过qrt-pcr或elisa对大豆发状根中smv含量进行检测。
作为优选,步骤(4)所述qrt-pcr程序为预变性95℃30s;95℃5s,60℃34s,40个循环;95℃15s,60℃1min,95℃15s。
本发明所述的一种arishr-smv病害系统的方法中检测smv的特异引物,其特征在于,所述特异引物包括qrt-pcr检测smv特异上、下游引物,其序列如seqidno.1-2所示。
seqidno.1:5’-gaaagttgtagaagaaagcag-3’(上游引物);
seqidno.2:5’-acaaaggctcgcaccgatgc-3’(下游引物);
本发明所述的发根农杆菌诱导的大豆发状根与大豆花叶病毒病害系统的方法在大豆种质对smv的抗性鉴定中的应用。
本发明通常在smv接种后14d,从愈伤组织长出的大豆发状根被切割回收,通过qrt-pcr或elisa对发状根中的smv进行检测。qrt-pcr程序参照
本发明中采用的发根农杆菌为发根农杆菌k599由南京农业大学国家大豆改良中心提供,也可以使用其他野生型发根农杆菌;
大豆品种williams和nn1138-2(熊冬金,赵团结,盖钧镒.中国农业科学,2008(9):2589-2598.中国大豆育成品种亲本分析.)由南京农业大学国家大豆改良中心提供;大豆种子williams被用于发根农杆菌k599介导的大豆子叶转化;大豆品种nn1138-2被用于smv的繁殖;
smv株系:sc3、sc7、sc8、sc9、sc10、sc11、sc13、sc15和sc18,由南京农业大学国家大豆改良中心提供(李凯,智海剑.大豆科学,2016,35(4):525-530.大豆对大豆花叶病毒病抗性的研究进展.)。
有益效果:与现有技术相比,本发明具有如下优点:
本发明提供了一种arishr-smv病害系统的方法,使用本方法能够快速、有效的鉴定smv相关靶标基因功能,为分子标记辅助育种或转基因育种提供功能标记或基因,本发明的方法亦可用于大豆种质对smv的抗性鉴定。相对于通过稳定遗传转化获得转基因植株来验证smv相关基因的功能,本方法在所花时间上拥有绝对优势,适用于从事大豆抗smv科研、育种及生产的研究单位、公司和个人,应用范围相对较大。
本发明的arishr-smv病害系统的方法成功应用到9个smv株系;可快速、有效的鉴定smv相关靶标基因功能,为分子标记辅助育种或转基因育种提供功能标记或基因,具有较大应用潜力。
附图说明
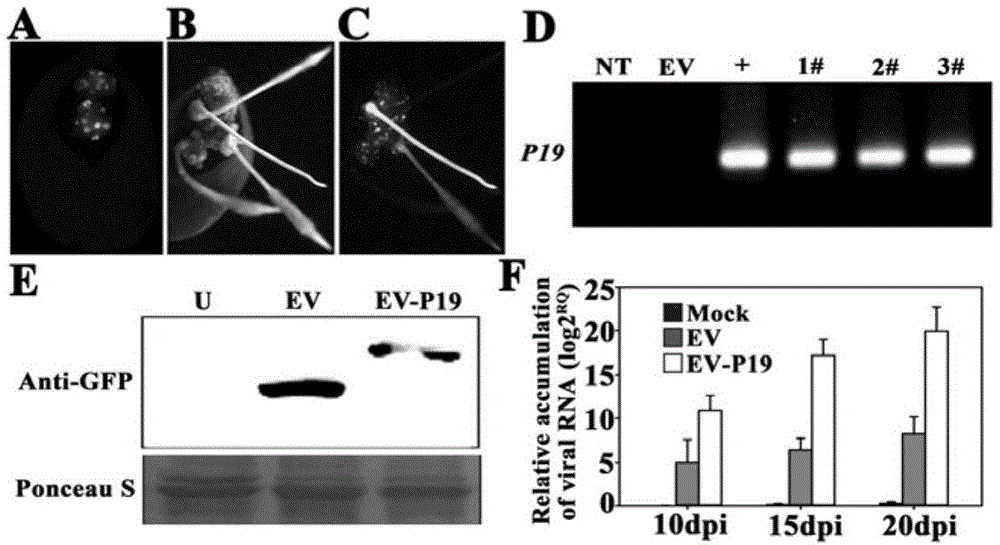
图1为番茄丛矮病毒p19基因在大豆发状根中的过表达促进了smv的侵染示意图;图1a为携带p19基因的发根农杆菌k599诱导大豆子叶形成黄白色愈伤组织(约10天)在体式荧光显微镜下观察绿色荧光蛋白表达,图1b和图1c分别为携带p19基因的发根农杆菌k599诱导大豆子叶形成的发状根在白光和荧光下成像,图1d为转p19基因发状根的基因组pcr,图1e为转p19基因发状根的westernblot,图1f为smv接种后10、15和20天,病毒核酸在发状根中的累积情况。
具体实施方式
以下结合附图和实施例对本发明作进一步说明。
实施例1
通过发根农杆菌诱导的大豆发状根与大豆花叶病毒(arishr-smv)病害系统的方法,多个smv株系侵染了大豆发状根:
(1)发根农杆菌k599侵染大豆子叶诱导愈伤组织:
1)发根农杆菌k599准备:取-80℃冰箱中冻存的发根农杆菌k599甘油菌,置于冰上解冻,超净台内用无菌接种环蘸取少量菌液,在无抗的lb固体培养基平板上划线,然后倒置于28℃培养箱中孵育48h;挑取单克隆于含有4ml无抗lb液体培养基中,在28℃,200rpm摇床上振荡培养24h,4000rpm离心5min收集菌体,弃上清;移液器吸取1ml10mmmgcl2对菌体沉淀轻柔悬浮,4000rpm离心5min收集菌体,弃上清;用100mmmgcl2(含终浓度150μm乙酰丁香酮)将菌液稀释至od600=0.5,置于22℃,45rpm摇床上轻柔摇动30min备用;
2)大豆子叶外植体准备:将成熟、无破损的williams大豆种子盛于塑料培养皿中,置于干燥器,利用氯气(3.5ml浓盐酸与100ml次氯酸钠溶液反应产生)进行灭菌6h,除菌的大豆种子无菌水浸泡过夜,于次日在超净台内去除其种皮,将其播种在0.7%(w/v,g/ml)水琼脂上,置于培养箱培养5d后(培养条件:25度,16h光照/8h黑暗光周期),收割大豆子叶用于发根农杆菌k599侵染,
3)发根农杆菌k599侵染大豆子叶:用手术刀在大豆子叶背部近叶柄处切下5mm直径的圆形切口,将切割好的子叶放于含有white固体培养基的培养皿中,吸取20μl准备好的发根农杆菌k599滴加到子叶创伤处,静置20min,封口膜封皿,于25℃培养箱中暗培养,经过10d培养,从创伤处长出的愈伤组织被用于smv接种。
(2)提纯大豆花叶病毒(smv)
1)将smv株系sc3、sc7、sc8、sc9、sc10、sc11、sc13、sc15和sc18在防虫温室内繁殖,繁殖寄主为大豆品种nn1138-2,在第一对真叶展开后接种,发病后2-3周内分别摘取病叶,进行smv提纯;
2)将收集的新鲜病叶置于磨样机内,加入预冷的0.5m磷酸缓冲液(含有1%β-巯基乙醇(v/v)和0.01medta,ph=7.5)匀浆(1g叶片组织加入2ml磷酸缓冲液),组织匀浆通过两层无菌纱布进行过滤,弃去残渣,收集滤液;
3)使用beckmanoptimaavantij25离心机对滤液进行离心,参数设置为4℃8500g离心20min,弃去沉淀,收集上清;
4)在上清液中依次加入以下三种试剂:nacl,tritonx-100,peg(mw6000),使其终浓度分别为0.1m,2.5%(w/v,g/ml)和6%(w/v,g/ml),将该混合物搅拌3h后静置于4℃冰箱内过夜;
5)使用beckmanoptimaavantij25离心机对混合液进行离心,参数设置为4℃8500g离心20min,弃去上清,收集沉淀;
6)用预冷的0.5m磷酸缓冲液(内含0.01mmgcl2和0.5m尿素,ph=7.5)对沉淀进行充分悬浮;
7)使用beckmanoptimaavantij25离心机对混合液进行离心,参数设置为4℃8500g离心20min,弃去沉淀,收集上清;
8)使用beckmanoptimal-80xp超速离心机对上清液进行离心,参数设置为4℃78000g离心1.5h,弃去上清,收集沉淀;
9)用预冷的0.5m磷酸缓冲液(内含0.01mmgcl2和0.5m尿素,ph=7.5)对沉淀进行再次充分悬浮,将产生的病毒悬浮液经30%(w/v,g/ml)蔗糖垫;
10)使用beckmanoptimal-80xp超速离心机对上清液进行离心,参数设置为4℃78000g离心1.5h,弃去上清,收集沉淀;
11)纯化的病毒在预冷的0.05m磷酸盐缓冲液(ph=7.0)中被重新悬浮,获得病毒制剂sc3、sc7、sc8、sc9、sc10、sc11、sc13、sc15和sc18等smv病毒粒子;
12)病毒制剂经一定倍数稀释后,测定吸光度,病毒制剂含量测定:
(3)针刺大豆愈伤组织,接种纯化的smv粒子
将步骤(1)中发根农杆菌k599诱导的大豆愈伤组织用无菌针头刺伤,紧接着分别吸取10μl50μg/mlsmv病毒粒子sc3、sc7、sc8、sc9、sc10、sc11、sc13、sc15和sc18,滴加于不同的大豆愈伤组织创伤处,然后将其放回white固体培养基上继续培养。
(4)大豆发状根中smv含量检测
在smv接种后14d,将从愈伤组织长出的大豆发状根分别切割回收,通过elisa对大豆发状根中smv含量进行检测。elisa所用的smv抗体购自acdinc.(cat#v094-r1),具体操作参照该试剂说明书。如表1所示,sc3、sc7、sc8、sc9、sc10、sc11、sc13、sc15和sc18分别接种愈伤组织,由这些愈伤组织生长的发状根均检测到了smv的存在,说明通过arishr-smv病害系统的方法,多种smv株系可以侵染大豆发状根。因此,这个arishr-smv病害系统的方法可被用于大豆种质对至少9个smv株系的抗性鉴定。
表1.发状根血清学测试及发状根汁液回接大豆试验
实施例2
p19功能在于促进了smv在大豆发状根中的累积
(1)发根农杆菌k599侵染大豆子叶诱导愈伤组织:
1)含有p19过表达载体的发根农杆菌k599准备:p19是来源于番茄丛矮病毒的基因,编码抑制植物基因沉默的蛋白,被称为基因沉默抑制子。取-80℃冰箱中冻存的含有p19过表达载体的发根农杆菌k599甘油菌,置于冰上解冻,超净台内用无菌接种环蘸取少量菌液,在卡那霉素抗性的lb固体培养基平板上划线,然后倒置于28℃培养箱中孵育48h;挑取单克隆于含有4ml卡那霉素抗性lb液体培养基中,在28℃,200rpm摇床上振荡培养24h,4000rpm离心5min收集菌体,弃上清;移液器吸取1ml10mmmgcl2对菌体沉淀轻柔悬浮,4000rpm离心5min收集菌体,弃上清;用100mmmgcl2(含终浓度150μm乙酰丁香酮)将菌液稀释至od600=0.5,置于22℃,45rpm摇床上轻柔摇动30min备用;
2)大豆子叶外植体准备:将成熟、无破损的williams大豆种子盛于塑料培养皿中,置于干燥器,利用氯气(3.5ml浓盐酸与100ml次氯酸钠溶液反应产生)进行灭菌6h,除菌的大豆种子无菌水浸泡过夜,于次日在超净台内去除其种皮,将其播种在0.7%(w/v,g/ml)水琼脂上,置于培养箱培养5d后(培养条件:25度,16h光照/8h黑暗光周期),收割大豆子叶用于发根农杆菌k599侵染。
3)含有p19过表达载体的发根农杆菌k599侵染大豆子叶:用手术刀在大豆子叶背部近叶柄处切下5mm直径的圆形切口,将切割好的子叶放于含有white固体培养基的培养皿中,吸取20μl准备好的含有p19过表达载体的发根农杆菌k599滴加到子叶创伤处,静置20min,封口膜封皿,于25℃培养箱中暗培养,经过10d培养,从创伤处长出的愈伤组织被用于smv接种,如图1a所示。
(2)提纯大豆花叶病毒(smv)
1)smv株系sc15在防虫温室内繁殖,繁殖寄主为大豆品种nn1138-2,在第一对真叶展开后接种,发病后2-3周内摘取病叶,进行smv提纯;
2)将收集的新鲜病叶置于磨样机内,加入预冷的0.5m磷酸缓冲液(含有1%β-巯基乙醇(v/v)和0.01medta,ph=7.5)匀浆(1g叶片组织加入2ml磷酸缓冲液),组织匀浆通过两层无菌纱布进行过滤,弃去残渣,收集滤液;
3)使用beckmanoptimaavantij25离心机对滤液进行离心,参数设置为4℃8500g离心20min,弃去沉淀,收集上清;
4)在上清液中依次加入以下三种试剂:nacl,tritonx-100,peg(mw6000),使其终浓度分别为0.1m,2.5%(w/v,g/ml)和6%(w/v,g/ml),将该混合物搅拌3h后静置于4℃冰箱内过夜;
5)使用beckmanoptimaavantij25离心机对混合液进行离心,参数设置为4℃8500g离心20min,弃去上清,收集沉淀;
6)用预冷的0.5m磷酸缓冲液(内含0.01mmgcl2和0.5m尿素,ph=7.5)对沉淀进行充分悬浮;
7)使用beckmanoptimaavantij25离心机对混合液进行离心,参数设置为4℃8500g离心20min,弃去沉淀,收集上清;
8)使用beckmanoptimal-80xp超速离心机对上清液进行离心,参数设置为4℃78000g离心1.5h,弃去上清,收集沉淀;
9)用预冷的0.5m磷酸缓冲液(内含0.01mmgcl2和0.5m尿素,ph=7.5)对沉淀进行再次充分悬浮,将产生的病毒悬浮液经30%(w/v,g/ml)蔗糖垫;
10)使用beckmanoptimal-80xp超速离心机对上清液进行离心,参数设置为4℃78000g离心1.5h,弃去上清,收集沉淀;
11)纯化的病毒在预冷的0.05m磷酸盐缓冲液(ph=7.0)中被重新悬浮,获得smvsc15病毒粒子;
12)病毒制剂经一定倍数稀释后,测定吸光度,病毒制剂含量测定:
(3)针刺大豆愈伤组织,接种纯化的smv粒子
将步骤(1)中含有p19过表达载体的发根农杆菌k599诱导的大豆愈伤组织(培养10天)在体式荧光显微镜下观察筛选(图1a),含有至少5个荧光点的愈伤组织用无菌针头刺伤,紧接着于创伤处滴加10μl50μg/mlsmv病毒粒子,然后将其放回white固体培养基中继续培养。
(4)p19转基因阳性发状根的鉴定
含有p19过表达载体的发根农杆菌k599诱导的大豆发状根(图1b),在体式荧光显微镜下观察筛选,发荧光的发状根被初步判定为p19转基因阳性发状根(图1c);进一步分别提取发状根基因组dna和总蛋白,通过基因组pcr(图1d)和westernblot(图1e)确定p19转基因阳性发状根。
(5)大豆发状根中smv含量检测
在smv接种后10d、15d、20d,从愈伤组织长出的阳性大豆发状根被分别切割回收,通过qrt-pcr对发状根中的smv进行检测。qrt-pcr检测smv特异引物:5’-gaaagttgtagaagaaagcag-3’(seqidno.1上游引物);5’-acaaaggctcgcaccgatgc-3’(seqidno.2下游引物);大豆内参引物:5’-gttgaaaagccaggggaca-3’(seqidno.3上游引物);5’-tcttaccccttgagcgtgg-3’(seqidno.4下游引物);qrt-pcr程序为预变性95℃30s;95℃5s,60℃34s,40个循环;95℃15s,60℃1min,95℃15s。如图1f所示,随着时间的延长,smv在发状根中的累积量逐渐增加。相对于对照,转p19基因的发状根中累积了更多的smv。上述结果说明arishr-smv病害系统的方法可被用于快速鉴定smv相关靶标基因的功能。
序列表
<110>南京农业大学
<120>一种发根农杆菌诱导的大豆发状根与大豆花叶病毒病害系统的方法及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>1
gaaagttgtagaagaaagcag21
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
acaaaggctcgcaccgatgc20
- 还没有人留言评论。精彩留言会获得点赞!