一种苯基丙酰胺类衍生物的盐及其制备方法与流程
本发明涉及4-氨基-1-((2r,5r,8r,14r)-2-(4-氨基丁基)-8-苄基-5-异丁基-4,7,10-三氧代-14-苯基-3,6,9,12-四氮杂十五-1-酰基)哌啶-4-羧酸的盐及其制备方法,以及其作为κ阿片样物质受体(kor受体)激动剂的用途和其在制备治疗和/或预防疼痛和疼痛相关疾病的药物中的用途。
背景技术:
阿片受体是一类重要的g蛋白偶联受体,是内源性阿片肽及阿片类药物结合的靶点,阿片受体激活后对神经系统免疫及内分泌系统具有调节作用,阿片类药物是目前最强且常用的中枢镇痛药。内源性阿片肽是哺乳动物体内天然生成的阿片样活性物质,目前已知的内源性阿片肽大致分为脑啡肽、内啡肽、强啡肽和新啡肽几类,中枢神经系统中存在其相应的阿片受体,即μ、δ、κ受体等。
κ阿片受体(κ-opioidreceptor,kor)由380个氨基酸组成,强啡肽是其内源性配体。在感觉神经元、背根神经节细胞和初级传入神经元末梢中均有表达,参与痛觉、神经内分泌、情感行为和认知等重要的生理活动。kor还与内向整流钾通道和n-型钙离子通道偶联。kor激动剂能够抑制(钙离子依赖性)外周感觉神经末梢伤害前和炎症前p物质的释放,这可能是其具有抗伤害感受和抗炎作用的原因。除了强啡肽,各种天然生物碱和合成的配体也可与kor结合。kor提供了天然的成瘾控制机制,因此,作为受体激动剂的药物具有药物成瘾治疗的潜力。
kor激动剂药物有阿西马朵林(asimadoline)、u-50488、纳洛酮(naloxone),公开的kor激动剂专利申请包括wo20071398、wo2008060552、wo09932510、wo2013184794、wo2014089019、wo2014184356和wo2015065867。
wo2017211272(申请号pct/cn2017/087328,申请日2017.06.06)中研究了一种kor激动剂化合物,该化合物对h-kor受体具有明显的激动作用、药代性质良好、且能够改善疼痛,具有更为突出的优势,其化合物结构如式(i)所示:
由于式(i)所示化合物的溶解度较低,为了进一步提高化合物的溶解度,我们对式(i)所示化合物进行了成盐研究,考察的盐包括钾盐、钠盐、铵盐、镁盐、钙盐等;通过成盐后产物的溶解度有了较大改善,并且考察盐的稳定性等问题,在治疼痛方面具有重要的研究意义。
技术实现要素:
本发明的技术方案如下:
本发明提供一种式(i)所示化合物4-氨基-1-((2r,5r,8r,14r)-2-(4-氨基丁基)-8-苄基-5-异丁基-4,7,10-三氧代-14-苯基-3,6,9,12-四氮杂十五-1-酰基)哌啶-4-羧酸的可药用的盐,
所述可药用的盐选自无机盐或有机盐,优选一价金属盐、二价金属盐或铵盐,更优选钾盐、钠盐、镁盐、钙盐或铵盐。
优选地,所述可药用的盐中式(i)所示化合物的酸根离子与阳离子的摩尔比选自1:1~1:5,优选1:1、1:2或1:3。
更优选地,
所述可药用的盐中式(i)所示化合物与钾的摩尔比优选1:1;
所述可药用的盐中式(i)所示化合物与钠的摩尔比优选1:1;
所述可药用的盐中式(i)所示化合物与铵的摩尔比优选1:1。
本发明还提供一种制备可药用的盐的方法,其特征在于,所述方法包括式(i)所示化合物与相应的碱成盐反应的步骤。
上述方案中,所述成盐反应在溶剂中进行,所述溶剂选自水、醇类溶剂、酮类溶剂、腈类溶剂、醇类溶剂与腈类溶剂的混合溶剂、醇类溶剂与水的混合溶剂、酮类溶剂与水的混合溶剂、腈类溶剂与水的混合溶剂、腈类溶剂与醇类溶剂和水的混合物溶剂、腈类溶剂与醇类溶剂和酮类溶剂的混合溶剂、腈类溶剂与醇类溶剂、水和酮类溶剂的混合溶剂;所述醇类溶剂优选甲醇、乙醇、异丙醇或正丁醇,所述酮类溶剂优选丙酮,所述腈类溶剂选自乙腈,
所述醇类溶剂与腈类溶剂的混合溶剂优选甲醇/乙腈、乙醇/乙腈的混合溶剂;
所述腈类溶剂与醇类溶剂和水的混合物溶剂优选乙腈/乙醇/水的混合溶剂,
所述腈类溶剂与醇类溶剂和酮类溶剂的混合溶剂优选乙腈/甲醇/丙酮的混合溶剂;
所述腈类溶剂与醇类溶剂、水和酮类溶剂的混合溶剂优选乙腈/甲醇/水/丙酮的混合溶剂。
本发明还提供一种式(ii)所示化合物的a晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在16.47、16.83、32.31、33.36、33.47、37.89和45.09处有特征峰,
优选地,所述a晶型在16.47、16.83、27.41、32.31、33.36、33.47、34.08、36.23、37.89、43.83、45.09和47.80处有特征峰。
更优选地,所述a晶型在16.47、16.83、27.41、32.31、33.36、33.47、34.08、36.23、36.67、37.89、40.25、41.33、43.83、45.09、47.21、47.80、51.04、51.48、55.20、55.74、56.87和57.21处有特征峰。
本发明还提供一种制备a晶型的方法,所述方法选自:
方法一、将式(ii)所示化合物加入溶剂中,析晶,过滤,干燥后即得目标a晶型;所述溶剂选自醇类溶剂、腈类溶剂、醇类溶剂与水的混合溶剂、腈类溶剂与水的混合溶剂、醇类溶剂与腈类溶剂和水的混合溶剂,所述醇类溶剂溶剂优选甲醇、乙醇、异丙醇或正丁醇,所述腈类溶剂溶剂选自乙腈,所述醇类溶剂与水的混合溶剂优选乙醇与水的混合溶剂,所述腈类溶剂与水的混合溶剂优选乙腈与水的混合溶剂,所述腈类溶剂与醇类溶剂和水的混合物溶剂优选乙腈/乙醇/水的混合溶剂;
方法二、将式(i)所示化合物与碱在一种溶剂或混合溶剂中反应,搅拌,析晶,过滤,干燥后即得目标a晶型;所述碱优选氢氧化钠;所述溶剂选自醇类溶剂、腈类溶剂、醇类溶剂与水的混合溶剂、腈类溶剂与水的混合溶剂、醇类溶剂与腈类溶剂和水的混合溶剂,所述醇类溶剂优选甲醇、乙醇、异丙醇或正丁醇,所述腈类溶剂选自乙腈,所述醇类溶剂与水的混合溶剂优选乙醇与水的混合溶剂,所述腈类溶剂与水的混合溶剂优选乙腈与水的混合溶剂,所述腈类溶剂与醇类溶剂和水的混合物溶剂优选乙腈/乙醇/水的混合溶剂;
所述析晶的方法选自室温析晶、冷却析晶、挥发溶剂析晶或加入晶种诱导析晶。
本发明还提供一种式(ii)所示化合物的b晶型,以衍射角2θ角度表示的x-射线粉末衍射图,在9.02、18.12、27.94、29.07、33.88和44.66处有特征峰。
优选地,所述b晶型在4.95、5.85、9.02、15.03、18.12、22.29、27.94、29.07、33.88、34.72、39.98和44.66处有特征峰。
更优选地,所述b晶型在4.95、5.85、9.02、15.03、18.12、22.29、26.13、26.80、27.94、29.07、30.59、32.23、33.88、34.72、35.78、36.84、39.98、42.17、43.99、44.66、45.48、46.35、48.36、51.24、52.49、53.21和55.33处有特征峰。
本发明还提供一种制备b晶型的方法,所述方法选自:
方法一、将式(ii)所示化合物加入溶剂中,析晶,过滤,干燥后即得目标b晶型;所述溶剂选自醇类溶剂、腈类溶剂、醇类溶剂与水的混合溶剂、腈类溶剂与水的混合溶剂、醇类溶剂与腈类溶剂和水的混合溶剂,所述醇类溶剂优选甲醇、乙醇、异丙醇或正丁醇,所述腈类溶剂选自乙腈,所述醇类溶剂与水的混合溶剂优选乙醇与水的混合溶剂,所述腈类溶剂与水的混合溶剂优选乙腈与水的混合溶剂,所述腈类溶剂与醇类溶剂和水的混合物溶剂优选乙腈/乙醇/水的混合溶剂;
方法二、将式(i)所示化合物与碱在一种溶剂或混合溶剂中反应,搅拌,析晶,过滤,干燥后即得目标b晶型;所述碱优选氢氧化钠;所述溶剂选自醇类溶剂、腈类溶剂、醇类溶剂与水的混合溶剂、腈类溶剂与水的混合溶剂、醇类溶剂与腈类溶剂和水的混合溶剂,所述醇类溶剂优选甲醇、乙醇、异丙醇或正丁醇,所述腈类溶剂选自乙腈,所述醇类溶剂与水的混合溶剂优选乙醇与水的混合溶剂,所述腈类溶剂与水的混合溶剂优选乙腈与水的混合溶剂,所述腈类溶剂与醇类溶剂和水的混合物溶剂优选乙腈/乙醇/水的混合溶剂;
在可选实施方案中,所述析晶的方法选自室温析晶、冷却析晶、挥发溶剂析晶或加入晶种诱导析晶。
本发明还提供一种药物组合物,含有选自上述方案中所述的盐、a晶型、b晶型中的一种,和任选和任选的药学上可接受的载体、稀释剂或赋形剂。
本发明还提供一种药物组合物,由前述方案中所述的盐、a晶型、b晶型中的一种,和任选的药学上可接受的载体、稀释剂或赋形剂制备而成。
本发明还提供一种制备药物组合物的方法,包括由上述方案中所述的a晶型、b晶型与任选的药学上可接受的载体、稀释剂或赋形剂混合的步骤。
本发明还涉及上述方案中所述的盐、a晶型、b晶型或药物组合物在制备预防和/或治疗κ阿片样物质受体激动剂介导的相关疾病的药物中的用途;所述疾病选自疼痛、炎症、瘙痒、水肿、低钠血症、低钾血症、肠梗阻、咳嗽和青光眼,优选疼痛;所述疼痛优选自神经性疼痛、躯干痛、内脏痛、皮肤痛、关节炎疼痛、肾结石疼痛、子宫痉挛、痛经、子宫内膜异位症、消化不良、外科手术后疼痛、医疗处理后疼痛、眼部疼痛、耳炎疼痛、爆发性癌症疼痛和gi紊乱相关的疼痛。
通过x-射线粉末衍射图谱(xrpd)对所得到式(ii)所示化合物的a晶型、b晶型进行结构测定、晶型研究。
本发明中所述的“x-射线粉末衍射图谱”为使用cu-kα辐射测量得到。
本发明中所述的“x-射线粉末衍射图谱或xrpd”是指根据布拉格公式2dsinθ=nλ(式中,λ为x射线的波长,
本发明中所述的“2θ或2θ角度”是指衍射角,θ为布拉格角,单位为°或度;每个特征峰2θ的误差范围为±0.30,可以为-0.30、-0.29、-0.28、-0.27、-0.26、-0.25、-0.24、-0.23、-0.22、-0.21、-0.20、-0.19、-0.18、-0.17、-0.16、-0.15、-0.14、-0.13、-0.12、-0.11、-0.10、-0.09、-0.08、-0.07、-0.06、-0.05、-0.04、-0.03、-0.02、-0.01、0.00、0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10、0.11、0.12、0.13、0.14、0.15、0.16、0.17、0.18、0.19、0.20、0.21、0.22、0.23、0.24、0.25、0.26、0.27、0.28、0.29、0.30,优选为±0.20。
晶型重结晶的方法没有特别限定,可以用通常的重结晶操作方法进行。例如,可以用原料式(i)所示化合物在有机溶剂中溶解后析晶,结晶完成后,经过滤干燥,即可得到所需要的结晶。
本发明析晶的方法有室温析晶、冷却析晶、挥发溶剂析晶、加入晶种诱导析晶等,所述冷却的温度选自40℃以下,优选-10℃至40℃,所述析晶过程中还可以搅拌。
本发明晶型制备方法中所用的起始原料可以是任意形式的式(ii)所示化合物或式(i)所示化合物,具体形式包括但不限于:无定型、任意晶型等。
发明详述
在本申请的说明书和权利要求书中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。然而,为了更好地理解本发明,下面提供了部分相关术语的定义和解释。另外,当本申请所提供的术语的定义和解释与本领域技术人员所通常理解的含义不一致时,以本申请所提供的术语的定义和解释为准。
本发明所述“卤代”是指被“卤素原子”取代,“卤素原子”是指氟原子、氯原子、溴原子、碘原子等。
本发明所述“c1-6烷基”表示直链或支链的含有1-6个碳原子的烷基,具体实例包括但不限于:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、2-甲基丁基、新戊基、1-乙基丙基、正己基、异己基、3-甲基戊基、2-甲基戊基、1-甲基戊基、3,3-二甲基丁基、2,2-二甲基丁基、1,1-二甲基丁基、1,2-二甲基丁基、1,3-二甲基丁基、2,3-二甲基丁基、2-乙基丁基、1,2-二甲基丙基等。
本发明所述的“酮类溶剂”是指羰基(-c(o)-)与两个烃基相连的化合物,根据分子中烃基的不同,酮可分为脂肪酮、脂环酮、芳香酮、饱和酮和不饱和酮,具体实例包括但不限于:丙酮、苯乙酮、甲基异丁基甲酮或甲基吡咯烷酮。
本发明所述的“醇类溶剂”是指一个或多个“羟基(oh)”取代“c1-6烷基”上的一个或多个氢原子所衍生的基团,所述“羟基”和“c1-6烷基”如前文所定义,具体实例包括但不限于:甲醇、乙醇、异丙醇、正丙醇、异戊醇或三氟乙醇。
本发明所述的“腈类溶剂”是指一个或多个“氰基(cn)”取代“c1-6烷基”上的一个或多个氢原子所衍生的基团,所述“氰基”和“c1-6烷基”如前文所定义,具体实例包括但不限于:乙腈或丙腈。
本发明所述的“混合溶剂”是指一种或多种不同种类的有机溶剂按照一定比例混合而成的溶剂,或一种或多种不同种类的有机溶剂与水按照一定比例混合而成的溶剂;所述混合溶剂优选为一种或多种醇类与水的混合溶剂、酮类与水的混合溶剂、腈类与水的混合溶剂、腈类与醇类和水的混合物溶剂、腈类与醇类和酮类的混合溶剂、腈类与醇类、水和酮类的混合溶剂;所述醇类、腈类、酮类如前文所定义;所述一定比例为0.05:1~1:0.05,优选为1:1、1:2、1:3、1:4、1:5、1:8、1:10、1:20、1:1、2:1、3:1、4:1、5:1、10:1、1:10。
本发明所述的“差示扫描量热分析或dsc”是指在样品升温或恒温过程中,测量样品与参考物之间的温度差、热流差,以表征所有与热效应有关的物理变化和化学变化,得到样品的相变信息。
本发明所述的“晶面间距或晶面间距(d值)”是指空间点阵选择3个不相平行的连结相邻两个点阵点的单位矢量a,b,c,它们将点阵划分成并置的平行六面体单位,称为晶面间距。空间点阵按照确定的平行六面体单位连线划分,获得一套直线网格,称为空间格子或晶格。点阵和晶格是分别用几何的点和线反映晶体结构的周期性,不同的晶面,其面间距(即相邻的两个平行晶面之间的距离)各不相同;单位为
本发明还涉及,包括式(i)所示的化合物的盐、a晶型、b晶型以及任选的一种或多种药用载体和/或稀释剂的药物制剂。所述药物制剂可以制成药学上可接受的任一剂型。例如,本发明的盐或药物制剂可以配制为片剂、胶囊剂、丸剂、颗粒剂、溶液剂、混悬剂、糖浆剂、注射剂(包括注射液、注射用无菌粉末与注射用浓溶液)、栓剂、吸入剂或喷雾剂。
此外,本发明的所述药物制剂还可以以任何合适的给药方式,例如口服、肠胃外、直肠、经肺或局部给药等方式施用于需要这种治疗的患者或受试者。当用于口服给药时,所述药物组合物可制成口服制剂,例如口服固体制剂,如片剂、胶囊剂、丸剂、颗粒剂等;或,口服液体制剂,如口服溶液剂、口服混悬剂、糖浆剂等。当制成口服制剂时,所述药物制剂还可包含适宜的填充剂、粘合剂、崩解剂、润滑剂等。当用于肠胃外给药时,所述药物制剂可制成注射剂,包括注射液、注射用无菌粉末与注射用浓溶液。当制成注射剂时,所述药物组合物可采用现有制药领域中的常规方法来进行生产。当配制注射剂时,所述药物制剂中可以不加入附加剂,也可根据药物的性质加入适宜的附加剂。当用于直肠给药时,所述药物制剂可制成栓剂等。用于经肺给药时,所述药物制剂可制成吸入剂或喷雾剂等。在某些优选的实施方案中,本发明的盐、a晶型、b晶型以治疗和/或预防有效量存在于药物制剂或药物中。在某些优选的实施方案中,本发明的盐、a晶型、b晶型以单位剂量的形式存在于药物制剂或药物中。
附图说明
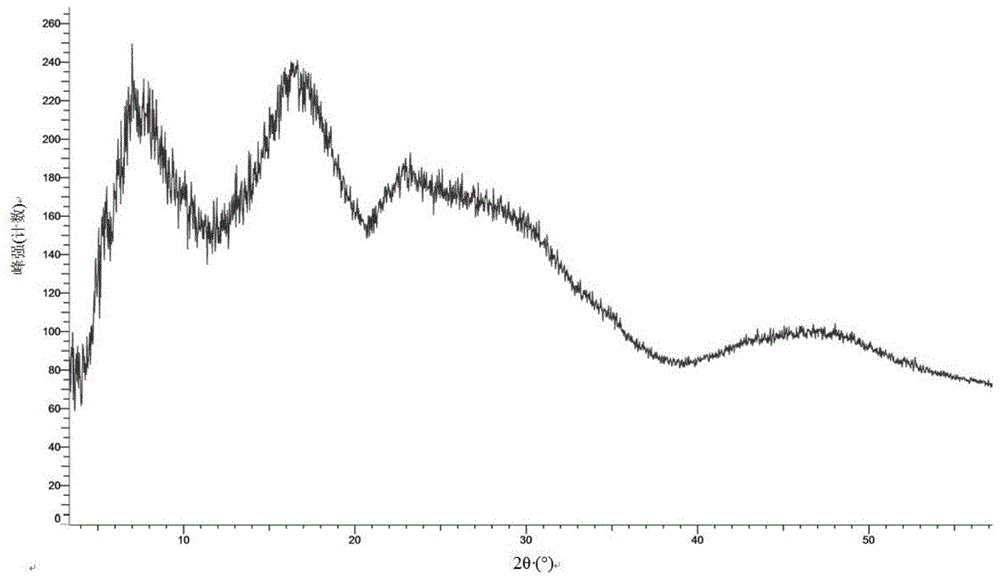
图1为式(ii)所示化合物无定型的x-射线粉末衍射图谱。
图2为式(ii)所示化合物a晶型的x-射线粉末衍射图谱。
图3为式(ii)所示化合物a晶型的偏振光图。
图4为式(ii)所示化合物b晶型的x-射线粉末衍射图谱。
具体实施方式
以下将结合实施例更详细地解释本发明,本发明的实施例仅用于说明本发明的技术方案,并非限定本发明的实质和范围。
实验所用仪器的测试条件:
化合物的结构是通过核磁共振(nmr)或/和质谱(ms)来确定的。nmr位移(δ)以10-6(ppm)的单位给出。nmr的测定是用brukeravance-400核磁仪,测定溶剂为氘代二甲基亚砜(dmso-d6)、氘代氯仿(cdcl3)、氘代甲醇(cd3od),内标为四甲基硅烷(tms)。
ms的测定用finniganlcqad(esi)质谱仪(生产商:thermo,型号:finniganlcqadvantagemax)。
hplc的测定使用安捷伦1200dad高压液相色谱仪(sunfirec18150×4.6mm色谱柱)和waters2695-2996高压液相色谱仪(giminic18150×4.6mm色谱柱)。
xrpd为x射线粉末衍射检测:测定使用rigakuultimaiv型号组合式多功能x射线衍射仪进行,具体采集信息:cu阳极(40kv,40ma),cu-kα1射线
对比例1、式(i)所示化合物的制备(可参考wo2017211272(申请号pct/cn2017/087328,申请日2017.06.06)中的方法)
4-氨基-1-((2r,5r,8r,14r)-2-(4-氨基丁基)-8-苄基-5-异丁基-4,7,10-三氧代-14-苯基-3,6,9,12-四氮杂十五-1-酰基)哌啶-4-羧酸式(i)
第一步
4-苄基1-叔丁基4-(((苄氧基)羰基)氨基)哌啶-1,4-二羧酸1b
将4-(((苄氧基)羰基)氨基)-1-(叔丁氧羰基)哌啶-4-羧酸1a(1.2g,0.0032mol,采用公知的方法“bioorganicmedicinalchemistryletters,2007,7(9),2448-2451”制备而得),苄溴(0.65g,0.0038mol),碳酸铯(2.1g,0.0064mol)溶于20mln,n-二甲基甲酰胺中,室温搅拌反应12小时。将反应液倒入水中,用乙酸乙酯萃取(30ml×3),合并有机相,用无水硫酸钠干燥,过滤,滤液减压浓缩后用薄层色谱法(以正己烷和乙酸乙酯为展开剂)纯化所得残余物,得到标题产物1b(800mg,产率:53%)。
第二步
4-(((苄氧基)羰基)氨基)哌啶-4-羧酸苄酯盐酸盐1c
将1b(800mg,1.71mmol)溶于2ml二氯甲烷中,加入2ml4m氯化氢的1,4-二氧六环溶液,室温搅拌反应4小时。反应液减压浓缩,得到粗品标题产物1c(800mg),产品不经纯化直接进行下一步反应。
第三步
(r)-1-(2-((((9h-芴-9-基)甲氧基)羰基)氨基)-6-((叔丁氧羰基)氨基)己酰基)-4-(((苄氧基)羰基)氨基)哌啶-4-羧酸苄酯1e
将粗品1c(800mg,1.97mmol)和(r)-2-((((9h-芴-9-基)甲氧基)羰基)氨基)-6-((叔丁氧羰基)氨基)己酸1d(926mg,1.97mmol,采用公知的方法“chemmedchem,2015,10(7),1232-1239”制备而得)溶于20mln,n-二甲基甲酰胺中,加入2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(1.12g,3.0mmol)和n,n-二异丙基乙胺(0.7ml,3.94mmol),室温搅拌反应12小时。反应液倒入2n柠檬酸溶液中,用乙酸乙酯萃取(30ml×3),合并有机相,用饱和碳酸氢钠溶液洗涤,无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品标题产物1e(1.6g),产品不经纯化直接进行下一步反应。
第四步
(r)-1-(2-氨基-6-((叔丁氧羰基)氨基)己酰基)-4-(((苄氧基)羰基)氨基)哌啶-4-羧酸苄酯1f
将粗品1e(1.6g,0.002mol)溶于10ml二氯甲烷中,加入10ml哌啶,室温搅拌反应2小时。反应液减压浓缩后用薄层色谱法(以二氯甲烷和甲醇为展开剂)纯化所得残余物,得到标题产物1f(900mg,产率:77%)。
第五步
(r)-2-((r)-2-(2-氯乙酰胺基)-3-苯基丙酰胺基)-4-甲基戊酸苄酯1i
将(r)-2-((r)-2-(2-氨基-3-苯基丙酰胺基)-4-甲基戊酸苄酯1g(500mg,1.36mmol,采用专利申请“us20110212882a1”公开的方法制备而得)和三乙胺(275mg,2.72mmol)溶于10ml二氯甲烷中,滴加入氯乙酰氯(230mg,2mmol),室温搅拌反应12小时。反应液倒入水中,用饱和氯化铵溶液洗涤,有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品标题产物1i(500mg),产品不经纯化直接进行下一步反应。
第六步
(r)-4-甲基-2-((r)-3-苯基-2-(2-(((r)-2-苯基丙基)氨基)乙酰胺基)丙酰胺基)戊酸苄酯1k
将粗品化合物1i(500mg,1.12mmol)和(r)-2-苯基丙-1-胺1j(228mg,1.68mmol,采用公知的方法“angewandtechemie,internationaledition,2003,42(39),4793-4795”制备而得)溶于10mln,n-二甲基甲酰胺中,加入碘化钾(372mg,2.24mmol)和碳酸钾(309mg,2.24mmol),升温至60℃搅拌反应12小时。反应液冷却至室温,加入水,用二氯甲烷萃取(30ml×3),合并有机相,用无水硫酸钠干燥,过滤,滤液减压浓缩,得到粗品标题产物1k(600mg),产品不经纯化直接进行下一步反应。
第七步
(9r,12r)-9-苄基-12-异丁基-2,2-二甲基-4,7,10-三氧代-5-((r)-2-苯基丙基)-3-氧杂-5,8,11-三氮杂十三-13-酸苄酯1l
将粗品化合物1k(600mg,1.1mmol)溶于20ml二氯甲烷中,加入二碳酸二叔丁酯(361mg,1.66mmol)和三乙胺(222mg,2.2mmol),室温搅拌反应12小时。反应液减压浓缩,用薄层色谱法(以二氯甲烷和甲醇为展开剂)纯化所得残余物,得到标题产物1l(580mg,产率:82%)。
第八步
(9r,12r)-9-苄基-12-异丁基-2,2-二甲基-4,7,10-三氧代-5-((r)-2-苯基丙基)-3-氧杂-5,8,11-三氮杂十三-13-甲酸1m
将化合物1l(580mg,0.9mmol)溶于10ml甲醇中,加入钯碳(60mg,催化量),加毕,氢气置换三次,室温搅拌反应12小时。反应液用硅藻土过滤,滤液减压浓缩,得到粗品标题产物1m(500mg),产品不经纯化直接进行下一步反应。
第九步
1-((9r,12r,15r)-9-苄基-15-(4-((叔丁氧羰基)氨基)丁基)-12-异丁基-2,2-二甲基-4,7,10,13-四氧代-5-((r)-2-苯基丙基)-3-氧杂-5,8,11,14-四氮杂十六-16-酰基)-4-(((苄氧基)羰基)氨基)哌啶-4-羧酸苄酯1n
将粗品化合物1m(365mg,0.66mmol),1f(393mg,0.66mmol),2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯(376mg,0.99mmol)和n,n-二异丙基乙胺(0.16ml,0.99mmol)溶于10mln,n-二甲基甲酰胺中,室温搅拌反应2小时。反应液减压浓缩,用薄层色谱法(以二氯甲烷和甲醇为展开剂)纯化所得残余物,得到标题产物1n(170mg,产率:23%)。
第十步
4-氨基-1-((9r,12r,15r)-9-苄基-15-(4-((叔丁氧羰基)氨基)丁基)-12-异丁基-2,2-二甲基-4,7,10,13-四氧代-5-((r)-2-苯基丙基)-3-氧杂-5,8,11,14-四氮杂十六-16-酰基)哌啶-4-羧酸1o
将化合物1n(80mg,0.0706mmol)溶于10ml甲醇中,加入钯碳(10mg,催化量),加毕,氢气置换三次,室温搅拌反应12小时。反应液用硅藻土过滤,滤液减压浓缩,得到粗品标题产物1o(60mg),产品不经纯化直接进行下一步反应。
第十一步
4-氨基-1-((2r,5r,8r,14r)-2-(4-氨基丁基)-8-苄基-5-异丁基-4,7,10-三氧代-14-苯基-3,6,9,12-四氮杂十五-1-酰基)哌啶-4-羧酸三氟醋酸盐1p
将粗品化合物1o(60mg,0.066mmol)溶于2ml二氯甲烷中,加入1ml4m氯化氢的1,4-二氧六环溶液,室温搅拌反应2小时。反应液减压浓缩后用高效液相色谱法纯化所得残余物,得到标题产物1p(30mg,产率:55.6%)。
msm/z(esi):708.6[m+1]
第十二步
4-氨基-1-((2r,5r,8r,14r)-2-(4-氨基丁基)-8-苄基-5-异丁基-4,7,10-三氧代-14-苯基-3,6,9,12-四氮杂十五-1-酰基)哌啶-4-羧酸1
将化合物1p(1g,0.95mmol)溶于10ml水中,冰浴冷却下,滴加入氨水至ph为7-8,搅拌反应0.5小时后,减压浓缩,用高效液相色谱法制备纯化,得到标题产物(600mg,产率:89%)。
msm/z(esi):708.6[m+1]
1h-nmr(400mhz,cd3od)δ7.32-7.18(m,10h),4.86-4.84(m,1h),4.61(dd,1h),4.40(dd,1h),3.86(brs.,1h),3.83-3.58(m,3h),3.24-3.03(m,3h),2.96-2.72(m,4h),2.61(dd,1h),2.52(dd,1h),2.19(brs.,2h),1.83-1.53(m,9h),1.44(d,2h),1.18(d,3h),0.96-0.90(m,6h).
测试例1
1、实验目的
本实验的目的是为了测试式(i)化合物对人源kor(h-kor)受体的激动作用,根据ec50大小评价化合物的体外活性。
2、h-kor活性的测试
2.1实验目的
本发明的化合物可以激活h-kor受体,从而降低细胞内camp的水平;第二信使camp进入细胞核与dna的cre相结合,可启动下游荧光素酶(luciferase)的表达,荧光素酶与其底物反应可发出荧光,通过测定荧光信号反映化合物的激动活性。
2.2实验方法
式(i)化合物激动h-kor影响下游camp水平变化的活性通过以下的方法进行测试。
2.2.1实验材料及仪器
1)实验仪器
1.酶标仪(pe,vector3)
2)实验材料
2.2.2实验步骤
1)hek293/kor/cre单克隆细胞株的获得
将人源kor/pcdna3.1(+)和cre/pgl4.29转入hek293细胞株,通过在培养基中加入g418和潮霉素(hygromycin),并在96孔细胞培养板中筛选出hek293/kor/cre单克隆细胞株。
2)式(i)化合物对h-kor激动作用实验
hek293/h-kor/cre单克隆细胞株在dmem/高葡萄糖培养基(10%fbs,1mg/mlg418,200μg/ml潮霉素,混匀)中培养,每3天传代一次。实验当天以新鲜细胞培养基制取细胞悬液,20,000细胞/孔铺96孔板(bd,#356692),5%二氧化碳37℃培养。第二天,先将式(i)化合物溶解在纯dmso中浓度为20mm,再用dmso配制成首个浓度200nm,并以3倍依次稀释成8个浓度,设置成空白和对照的孔加入90μldmso;用含10μmforskolin的dmem/高葡萄糖(sh30243.01b,hyclone)培养基稀释20倍。取出第一天接种的细胞培养板,每孔分别加入10μl稀释后药物或对照(0.5%dmso),轻轻振荡混匀,放置37℃培养4小时。在96孔细胞培养板中,每孔加入100μl荧光素酶检测液(promega,#e6110),室温放置5分钟,采用victor3.0测化学发光值。用graphpadprism软件根据化合物各浓度与相应的信号值计算化合物的ec50值。
2.3测试结果
式(i)化合物激动h-kor受体影响camp水平的ec50=1pm,该化合物对h-kor受体具有明显的激动作用。
药代动力学评价
测试例2、犬药代动力学测试
1、摘要
以beagle犬为受试动物,应用lc/ms/ms法测定了beagle犬静脉注射给予式(i)所示化合物后不同时刻血浆中的药物浓度。研究本发明化合物在beagle犬体内的药代动力学行为,评价其药动学特征。
2、试验方案
2.1试验药品
式(i)化合物
2.2试验动物
beagle犬雄性3只为1组,美迪西普亚医药科技(上海)有限公司提供,。
2.3药物配制
称取适量样品,加入100%生理盐水溶解。
2.4给药
beagle犬3只,雄性,为1组;禁食一夜后分别静脉注射给药,给药体积2ml/kg。
3、操作
静脉组于给药前及给药后5min,15min,0.5,1.0,2.0,4.0,8.0,12.0,24.0h由颈静脉采血1.0ml,置于肝素化试管中,3500rpm离心10min分离血浆,于-80℃保存。
用lc/ms/ms法测定静脉注射给药后beagle犬血浆中的待测化合物含量。
4、beagle犬药代动力学参数结果
式(i)化合物的beagle犬药代动力学参数如下:
结论:该化合物的beagle犬药代性质良好。
测试例3、kor激动剂治疗大鼠角叉菜胶诱导的炎性痛实验报告
1.实验目的
建立大鼠角叉菜胶炎性痛模型,评估kor激动剂对大鼠炎性痛的治疗作用。
2.实验方法和实验材料
2.1.实验动物和饲养条件
实验用wistar雄性大鼠,购自上海斯莱克实验动物有限公司(中国上海,合格证编号2015000513408,许可证scxk(沪)2012-0002,购入时150-180g,5只/笼饲养,12/12小时光/暗周期调节,温度23±1℃恒温,湿度50~60%,自由进食进水。动物购进后,进行适应性饲养7天以上开始实验。
2.2.实验药品
式(i)化合物;
λ-角叉菜胶(λ-carrageenan):批号为bcbp8978v,sigma产品。
0.9%氯化钠溶液(500ml:4.5g)
1%λ-角叉菜胶用生理盐水配置后搅拌过夜呈果冻状混悬液。
药物剂量均按碱基计算。
2.3.实验设计和实验方法
2.3.1.动物分组:
大鼠适应性饲养后,分组如下:
注:ns:配制角叉菜胶溶液时用的生理盐水;i.v.:静脉注射;s.c.:皮下注射。
2.3.2.实验方法[1]:
实验方法按照文献1中(kazunarinakao等)的方法进行改进。炎性痛实验在实验前将大鼠按照体重随机分组如下:空白对照组,模型组,0.1mg/kg组,0.3mg/kg组。每组大鼠8只。炎性痛造模采用1%角叉菜胶(100μl)对wistar大鼠足垫进行皮下注射。4h后对大鼠进行足底触痛测试评估其机械痛阈值,检测前30min分别给予单次尾静脉给药(1ml/kg),对照组和模型组给予相应的溶剂。
注:参考文献1,cj-023,423,anovel,potentandselectiveprostaglandinkorreceptorantagonistwithanti-hyperalgesicproperties[j].thejournalofpharmacologyandexperimentaltherapeutics,2007,322(2):686–694.
2.4.实验仪器
电子触觉测量仪(电子vonfrey):ugobasile,型号38450。
2.5.数据表达和统计学处理
实验数据表示为平均数(mean)±标准差(s.d.)。采用excel软件t检验进行统计比较。将模型组与空白对照组数据进行分析比较,是否存在显著数理统计意义,*p<0.05表示模型组与对照组比较具有显著性差异,**p<0.01表示模型组与对照组比较具有高度显著性差异。#p<0.05表示模型组与给药组比较具有显著性差异,##p<0.01表示模型组与给药组比较具有高度显著性差异。
3.结果:空白对照组大鼠触痛阈值为20g左右,模型组触痛阈值为7.6g,与空白对照组比较,模型组大鼠触痛阈值明显下降(p<0.01);与模型组比较,所有药物均能明显增加炎性大鼠的触痛阈值(p<0.01),0.1mg/kg、0.3mg/kg触痛阈值分别为13.7g、23.2g,依次增加幅度分别为79.5%和204.5%,具有明显的剂量依赖性。
4讨论
λ-角叉菜胶(carrageenan)是由水生植物鹿角菜中提取的胶体物质,具有过敏刺激作用。角叉菜胶单独实验即可诱发炎症,引起疼痛。本实验通过建立角叉菜胶炎性痛模型,观察大鼠给予kor激动剂后的触痛阈值变化情况,评价药物对亚急性炎性痛的镇痛作用及其作用强度。实验采用电子触痛仪测量大鼠对触痛的反应情况,电子触觉测量仪(e-vf)采用ugobasile原创设计,用于评估大、小鼠过敏症和触诱发痛。该设备可自动记录动物的受刺激时间和刺激强度。独特的三棱镜设计,使得实验时观察受试动物足底区域变得非常容易。测试过程中,设备可自行感应受试动物缩回受测爪,也可通过脚踏开关人为判断。定位更加集中,比较适用于局部疼痛和神经性疼痛测定。
5结论
受试药能改善大鼠炎性疼痛,且具有剂量依赖性。
实施例1、式(i)所示化合物的钠盐的制备
将式(i)所示化合物(525mg,0.74mmol),加入95%乙腈-水溶液(5.25ml),初步搅拌后向上述体系中加入420μl的浓度为78mg每毫升的氢氧化钠80%水-乙醇溶液(其中含有1.1摩尔当量的氢氧化钠),室温搅拌、过滤干燥后得到目标产物,该产物的x-射线粉末衍射谱图(xrpd图谱)见图1,可判断为无定型。
实施例2、式(i)所示化合物的钠盐的制备
将式(i)所示化合物(525mg,0.74mmol)加入95%乙腈-水溶液(5.25ml),初步搅拌后向上述体系中加入420μl的浓度为78mg每毫升的氢氧化钠80%水-乙醇溶液(其中含有1.1摩尔当量的氢氧化钠),将上述体系在50℃保温搅拌12h,过滤干燥得到目标产物。
实施例3、式(i)所示化合物的钾盐的制备
将式(i)所示化合物(525mg,0.74mmol)加入50%乙腈-甲醇溶液(5.25ml),初步搅拌后向上述体系中加入等摩尔的氢氧化钾溶液,室温条件下以300转每分钟条件下搅拌、过滤干燥得到目标产物。
实施例4、式(i)所示化合物的钾盐的制备
将式(i)所示化合物(525mg,0.74mmol)加入丙酮(5.25ml),初步搅拌后向上述体系中加入等摩尔的氢氧化钾溶液,室温条件下以300转每分钟条件搅拌、过滤干燥得到目标产物。
实施例5、式(ii)所示化合物a晶型的制备
将式(i)所示化合物(525mg,0.74mmol),加入95%乙腈-水溶液(5.25ml),初步搅拌后向上述体系中加入420μl的浓度为78mg每毫升的氢氧化钠80%水-乙醇溶液(其中含有1.1摩尔当量的氢氧化钠),然后在50℃下搅拌、晶体析出后过滤干燥得到目标产物。该结晶样品的x-射线粉末衍射谱图(xrpd图谱)见图2、偏振光图见图3,将此晶型定义为a晶型,其2θ特征峰位置如下表所示:
表1、a晶型特征峰
实施例6、式(ii)所示化合物b晶型的制备
将式(i)所示化合物(525mg,0.74mmol)加入95%乙腈-水溶液(5.25ml),初步搅拌后向上述体系中加入420μl的浓度为78mg每毫升的氢氧化钠80%水-乙醇溶液(其中含有1.1摩尔当量的氢氧化钠),将上述体系搅拌下缓慢升温至50℃后再缓慢降温至40℃后保温搅拌12h,过滤干燥得到目标产物。该结晶样品的x-射线粉末衍射谱图(xrpd图谱)见图4,将此晶型定义为b晶型,其2θ特征峰位置如下表所示:
表2、b晶型特征峰
实施例7、本发明晶型影响因素实验
将式(i)化合物的钠盐、钾盐的样品在加热(40℃、60℃)、光照(日光)、高湿(rh75%、rh95%)条件下考察样品的稳定性。取样考察期为14天。
实验结果:
表3、式(i)化合物钠盐和钾盐的影响因素实验结果
实验结论:
有上表数据可判断,高温与光照条件对盐的稳定性影响较大,其中,钠盐的稳定性较好,优于钾盐。
- 还没有人留言评论。精彩留言会获得点赞!