一种植物体内源肽的提取方法与流程
本发明属于植物体肽提取技术领域,特别涉及一种植物体内源肽的提取方法。
背景技术:
多肽通常是指由10~100个氨基酸分子脱水缩合而成的化合物.也有文献将2~10个氨基酸组成的肽称为寡肽,10~50个氨基酸组成的肽称为多肽,50个以上氨基酸组成的肽称为蛋白质。多肽种类繁多,几乎参与生物体的生长、发育、免疫、新陈代谢等各个环节。机体内存在的内源肽具有重要的功能,例如在人和动物中发现的肽具有促进免疫、调节激素、抗菌、抗病毒、降血压和降血脂等生物学功能。肽在植物的研究较少,目前发现的多肽在植物生长发育、生殖、共生互作和压力响应方面具有重要的功能。一方面,肽可以通过其抗菌特性直接和病原菌相互作用;另一方面,肽可以干扰信号分子或作为信号分子在植物细胞间信号传递中起到重要作用。尽管在植物中发现的肽越来越多,它们的功能也得到了初步解析,但是在基因预测和质谱分析中肽往往被忽略掉。
此外,植物内源多肽的获得是鉴定和研究内源多肽的基础,目前提取植物体内源肽的主要方法有两种:一种是酸提取法;另一种是酸提取缓冲液与植物蛋白酶抑制剂的混合物。但是这两种方法的通量都不高,而且近年来研究发现,加入蛋白酶抑制剂并不能很好的抑制植物体内蛋白酶的活性。因此,探究一种高效、快捷、重复性好的植物体内多肽的提取方法十分必要。
技术实现要素:
本发明的目的在于,针对目前植物体内多肽提取方面存在的上述问题,提供一种高效、快捷、重复性好,且通量较高的植物体内源肽的提取方法。
为了实现上述目的,本申请采用的技术方案为:
一种植物体内源肽的提取方法,包括如下步骤:
利用液氮将放置在研钵中的植物组织冰冻后,研磨成粉末,并将粉末置于离心管中,待用;
将装有粉末的离心管置于94.5℃~95.5℃的水浴中加热4min~5min后,待用;
再向装有粉末的离心管中加入溶解有蛋白酶抑制剂的tfa水溶液,且所述tfa水溶液中tfa的体积分数为1%;所述粉末与所述tfa水溶液的比例为1g:4ml~6ml,所述tfa水溶液与蛋白酶抑制剂的比例为1ml:4μl~6μl;然后再将离心管置于3℃~5℃的环境中孵育55min~65min,得到第一混合溶液,待用;
再将第一混合溶液在40w下超声裂解4min~5min,得到第二混合溶液,待用,其中每超声5.5s~6.5s停止超声7.5s~8.5s;
将所述第二混合溶液在3℃~5℃且9000r/min~11000r/min下离心18min~22min,得到上清液,待用;
将所述上清液过10kd的超滤管,得到的超滤液即为含有植物体内源肽的提取液;
将含有植物源内源肽的提取液脱盐处理后真空干燥,得到肽段。
进一步的,所述植物组织为植物叶片。
进一步的,所植物叶片为新鲜的玉米叶片。
与现有技术相比,本发明的有益效果是:本发明的方法在肽分离之前进行水浴加热,使植物蛋白变性失活,抑制蛋白酶降解,保持生理状态下的多肽,促进多肽释放溶解;且本发明方法操作简便,并且有效的保留植物体内天然长链肽,因此本发明的提取方法产率高,获得的肽段数目多,且肽段长度长。
附图说明
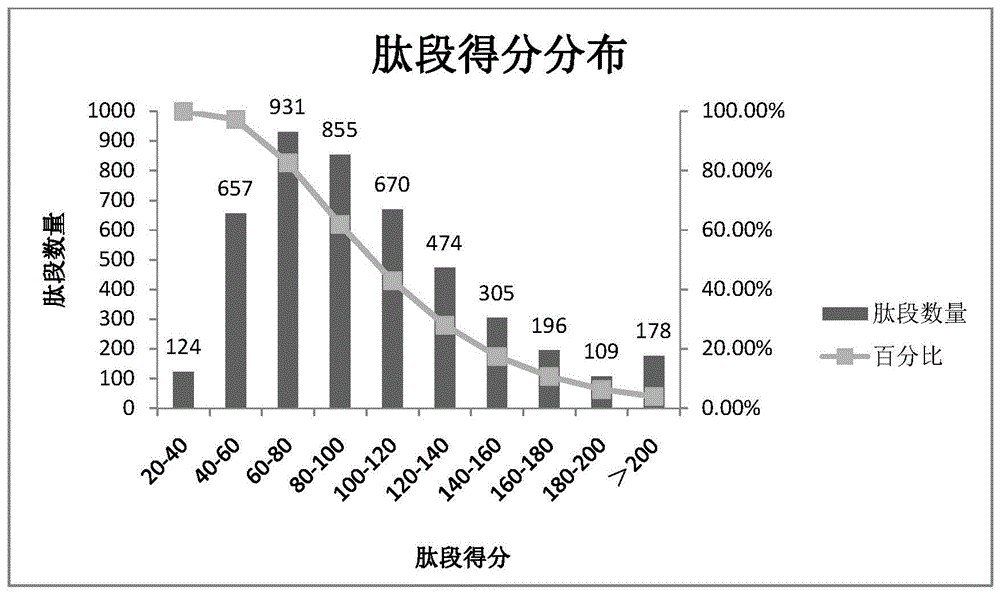
图1是本发明实施例1的肽段得分分布图;
图2是本发明实施例1的肽段长度分布图;
图3是本发明对比例1的肽段得分分布图;
图4是本发明对比例1的肽段长度分布图;
图5为本发明的实施例1与对比例1两种方法得到的肽段数量结果对比图。
具体实施方式
为了使本发明的技术手段、创作特征、达到目的与功效易于明白了解,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述。
非标记定量多肽组学近年来成为重要的质谱定量方法,按照其原理分,主要有两种。其中spectrumcounts类的非标记定量方法,发展比较早,也形成了多种算法进行定量,但是主要的原理都是根据ms2的鉴定结果作为定量的基础,各种方法的差别在于后期算法在大规模数据上的修正。第二种非标记定量方法的原理是以ms1为基础,计算每个肽段信号在lc-ms色谱上的积分,这个也是本申请的以下实施例中所采用maxquant算法的原理。
maxquant,是领先的蛋白质组学/多肽组学定性定量算法,现在已经渐渐成为蛋白质组学/多肽组学领域内的标准解决方案之一。采用maxquant中的labelfree算法对蛋白质组学/多肽组学数据进行非标记定量计算,也成为此算法的重要应用。maxquant既可以对silac标记的蛋白质组学/多肽组学数据进行分析,同时也可以对非稳定同位素标记的数据进行分析。其中的labelfreequantification(lfq)算法,简单的来说,首先是对每个lcms数据中的肽段信号进行识别并定量,然后使用内置的andromeda算法对所有肽段信号ms2进行数据库检索,完成定性工作,最后整合所有的定性定量数据,完成整个定量蛋白质组学/多肽组学数据工作。
现代生物质谱技术的发展几乎是和分辨率的提高同步的,其中orbitrap类的质谱技术现在已经成为高分辨率质谱的典型代表。maxquant算法只能和高分辨率质谱的蛋白质组学/多肽组学数据配合使用,本实验采用的最新一代的orbitrap质谱(q-exactive)采集lcms/ms数据。q-exactive能够达到定量和定性的完美结合,ms1和ms2的采集都是高分辨的,其中ms1的分辨率可以达到140,000(日常工作为70,000),更难得的是ms2的日常工作分辨率也可以达到17,500。ms2采用的hcd模式,没有所谓“三分之一”规则,可以完美展现ms2的全部信息。
以下实施例中采用的化学试剂,例如tfa(三氟乙酸)等均能够通过购买得到。其中tfa均购自上海阿拉丁生化科技有限公司。其他有机溶剂购自国药集团,为色谱级。
实施例1
一种植物体内源肽的提取方法,包括如下步骤:
利用液氮将放置在研钵中的植物组织冰冻后,研磨成粉末,并将粉末置于2ml的离心管中,待用;植物组织为新鲜的玉米叶片;
将装有粉末的离心管置于95℃的水浴中加热5min后,待用;
再向装有粉末的离心管中溶解有蛋白酶抑制剂的tfa水溶液,且所述tfa水溶液中tfa的体积分数为1%;所述粉末与所述tfa水溶液的比例为1g:5ml,所述tfa水溶液与蛋白酶抑制剂的比例为1ml:5μl;然后再将离心管置于4℃的环境中孵育60min,得到第一混合溶液,待用;其中所用蛋白酶抑制剂是产自美国密苏里州西格玛奥德里奇公司的蛋白酶抑制剂;
再将第一混合溶液在40w下超声裂解5min,得到第二混合溶液,待用,其中每超声6s停止超声8s;
将第二混合溶液在4℃且10000r/min下离心20min,得到上清液,待用;
将上清液过10kd的超滤管,得到的超滤液即为含有植物体内源肽的提取液;
将含有植物源内源肽的提取液脱盐处理后真空干燥,得到肽段。
脱盐处理过程中所用产品为产自美国密苏里州西格玛奥德里奇公司的c18针柱,内径为7mm,容量为3ml。按照该公司说明书进行操作。
上述提取方法重复三次,记录为第1组、第2组和第3组,且分别对这三组得到的肽段进行检测。
以下是对上述植物体内源肽的提取方法提取得到的植物体内源肽的检测方法。
具体检测方法为:
将2μg的肽段复溶于体积分数为0.1%2ml的tfa水溶液中,得到待测样品;
再将待测样品进行lc-ms/ms分析。
采用纳升流速hplc液相系统进行分离。液相a液为0.1%甲酸乙腈水溶液(乙腈为2%),b液为0.1%甲酸乙腈水溶液(乙腈为84%)。色谱柱(thermoeasycolumnsc200150μm*100mm(rp-c18))以100%的a液平衡。样品由自动进样器上样到thermoeasycolumnsc001traps150μm*20mm(rp-c18),再经色谱柱分离,流速为300nl/min。相关液相梯度如下:0min~115min,b液线性梯度从0%~45%;115min~117min,b液线性梯度从45%~100%;117min~120min,b液维持在100%。酶解产物经毛细管高效液相色谱分离后用q-exactive质谱仪进行质谱分析。分析时长:120min,检测方式:正离子,母离子扫描范围:300m/z~1800m/z,多肽和多肽的碎片的质量电荷比按照下列方法采集:ms1在m/z200时分辨率为70,000,agctarget:3e6,一级maximumit:10ms,numberofscanranges:1,dynamicexclusion:40.0s;每次全扫描后采集20个碎片图谱,二级在m/z200时分辨率为17,500,ms/msactivation模式:hcd,isolationwindow:2m/z,microscans:1,二级maximumit:60ms,normalizedcollisionenergy:30ev,underfillratio:0.1%。
采用lc-ms/ms方法对上述3组的肽段进行检测的结果如表1,从表1能够看出三次分别鉴定到4058、3650、3971条肽段。共计鉴定肽段4499条,对应蛋白828个。对这些肽段得分进行统计,提取到的肽段得分较高,说明该方法提取到的肽段质量较好(如图1所示)。对这些肽段长度进行统计,提取到的多肽长度在8-25范围内,且大致呈正态分布(如图2所示)。
表1质谱鉴定实施例1的三组肽段数量和蛋白数量统计
对比例1
一种植物体内源肽的提取方法,包括如下步骤:
利用液氮将放置在研钵中的植物组织冰冻后,研磨成粉末,并将粉末置于2ml的离心管中,待用;植物组织为新鲜的玉米叶片;
再向装有粉末的离心管中加入溶解有蛋白酶抑制剂的tfa水溶液,且所述tfa水溶液中tfa的体积分数为1%;其中粉末与tfa水溶液的比例为1g:5ml,tfa水溶液与蛋白酶抑制剂的比例为1ml:5μl;然后再将离心管置于4℃的环境中孵育1h,得到第一混合溶液,待用;
再将第一混合溶液在40w下超声裂解5min,得到第二混合溶液,待用,其中每超声6s停止超声8s;
将第二混合溶液在4℃且10000r/min下离心20min,得到上清液,待用;
将上清液过10kd的超滤管,得到的超滤液即为含有植物体内源肽的提取液;
将含有植物源内源肽的提取液脱盐处理后真空干燥,得到肽段(脱盐方法同实施例1)。
上述提取方法重复三次,记录为第1'组、第2'组和第3'组,且分别对这三组得到的肽段进行检测。
以下是对上述植物体内源肽的提取方法提取得到的植物体内源肽的检测方法。
具体的检测方法与实施例1的检测方法相同,检测结果为:
采用lc-ms/ms方法对上述3组的肽段进行检测的结果如表2,从表2能够看出三次分别鉴定到1125、969、1089条肽段。共计鉴定肽段1400条,对应蛋白382个。对这些肽段得分进行统计,提取到的肽段得分较低,说明该方法提取到的肽段质量较差,如图3所示。对这些肽段长度进行统计,提取到的多肽长度在8-25范围内,且大致呈正态分布如图4所示,与对比例1相比较的结果如图5所示。
表2质谱鉴定对比例1的三组肽段数量和蛋白数量统计
将实施例1与对比例1相比较,本发明方法操作简便,并且有效的保留植物体内天然长链肽,因此本发明的提取方法产率高,获得的肽段数目多,且肽段长度长。
实施例2
一种植物体内源肽的提取方法,包括如下步骤:
利用液氮将放置在研钵中的植物组织冰冻后,研磨成粉末,并将粉末置于2ml的离心管中,待用;植物组织为新鲜的玉米叶片;
将装有粉末的离心管置于94.5℃的水浴中加热4min后,待用;
再向装有粉末的离心管中加入溶解有蛋白酶抑制剂的tfa水溶液,且所述tfa水溶液中tfa的体积分数为1%;其中粉末与tfa水溶液的比例为1g:4ml,所述tfa水溶液与蛋白酶抑制剂的比例为1ml:4μl;然后再将离心管置于3℃的环境中孵育55min,得到第一混合溶液,待用;其中所用蛋白酶抑制剂是产自美国密苏里州西格玛奥德里奇公司的蛋白酶抑制剂;
再将第一混合溶液在40w下超声裂解4min,得到第二混合溶液,待用,其中每超声5.5s停止超声7.5s;
将第二混合溶液在3℃且9000r/min下离心18min,得到上清液,待用;
将上清液过10kd的超滤管,得到的超滤液即为含有植物体内源肽的提取液;
将含有植物源内源肽的提取液脱盐处理后真空干燥,得到肽段。
实施例3
一种植物体内源肽的提取方法,包括如下步骤:
利用液氮将放置在研钵中的植物组织冰冻后,研磨成粉末,并将粉末置于2ml的离心管中,待用;植物组织为新鲜的玉米叶片;
将装有粉末的离心管置于95.5℃的水浴中加热5min后,待用;
再向装有粉末的离心管中加入解有蛋白酶抑制剂的tfa水溶液,且所述tfa水溶液中tfa的体积分数为1%;其中粉末与tfa水溶液的比例为1g:6ml,tfa水溶液与蛋白酶抑制剂的比例为1ml:6μl;然后再将离心管置于5℃的环境中孵育65min,得到第一混合溶液,待用;其中所用蛋白酶抑制剂是产自美国密苏里州西格玛奥德里奇公司的蛋白酶抑制剂;
再将第一混合溶液在40w下超声裂解5min,得到第二混合溶液,待用,其中每超声6.5s停止超声8.5s;
将第二混合溶液在5℃且11000r/min下离心22min,得到上清液,待用;
将上清液过10kd的超滤管,得到的超滤液即为含有植物体内源肽的提取液;
将含有植物源内源肽的提取液脱盐处理后真空干燥,得到肽段。
以上公开的仅为本发明的较佳实施例,但是,本发明实施例并非局限于此,任何本领域的技术人员能思之的变化都应落入本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!