作为生物基尼龙原料生产中间体的己二酰二胺的制备方法与流程
相关申请的交叉引用
本申请要求于2018年8月28日提交的韩国专利申请no.10-2018-0101432的优先权,该申请通过引用其全部而并入本文。
本发明涉及一种通过使用生物质衍生的葡萄糖作为起始材料而生产己二酰二胺的新方法,所述己二酰二胺用作生产己二酸的中间体,所述己二酸用于各种应用,例如用于尼龙的原料。所述方法可包括:使用葡萄糖作为起始材料制备葡萄糖二酸钾盐;使用葡萄糖二酸钾盐制备葡萄糖酰胺;在高温高压氢气氛下,在特定催化剂的存在下,使用葡萄糖酰胺制备己二酰二胺。
背景技术:
在各种尼龙材料中,与尼龙6一起作为代表性尼龙材料的尼龙66,由于其优异的物理性能而具有很大的需求,但尚未建立使用生物质作为原料生产尼龙66的工艺技术。因此,可以预期用于生产生物基尼龙66的方法的开发不仅在经济方面而且在环境方面具有显著的涟漪效应。
尼龙66具有优异的耐热性、耐磨性和耐化学性,并且在汽车部件需要高温特性的部件中使用。此外,尼龙66是继尼龙6之后下一代在用于移动部件的尼龙中最常用的。尼龙66是通过己二胺和己二酸之间的缩聚反应而制备的。在尼龙66生产中用作单体的己二酸目前通过使用由在原油精炼过程中获得的苯而合成的环己酮作为中间体的化学合成方法进行制备。然而,这种基于石油的生产过程引起诸如油价不稳定,使用有毒物质的苯,产生包括一氧化氮(nox)的环境污染副产物等问题,因此需要用生物基技术取代。因此,使用生物基工艺生产尼龙可以同时表现出降低原料对石油依赖性的效果以及减少产生环境污染物的效果。
技术实现要素:
本发明是考虑到上述问题而提出的,并且涉及通过使用葡萄糖合成己二酰二胺的第一技术,所述己二酰二胺可用于生产己二酸。
本发明的目的为提供一种重要方法以改进使用衍生自陆生植物资源的葡萄糖合成己二酸。
一方面,本发明提供了一种用于生产己二酰二胺的方法。所述方法可包括以下步骤:a)通过一个或多个包括使葡萄糖、硝酸(hno3)、亚硝酸钠(nano2)和氢氧化钾(koh)反应的步骤来制备葡萄糖二酸钾盐;b)通过使步骤a)中制得的葡萄糖二酸钾盐与酸性溶液反应并从葡萄糖二酸钾盐中除去钾离子来制备葡萄糖酰胺;c)通过将步骤b)中制得的葡萄糖酰胺和催化剂加入至卤化氢(例如hbr)和乙酸中来制备反应混合物;d)在反应器中用氢气处理反应混合物,从而制备己二酰二胺。
在优选的方面,在步骤c)中,卤化氢和乙酸可以在反应溶液中结合或混合以制备反应混合物。
在优选的方面,在步骤d)中,可以通过将反应混合物引入反应器中并使其与氢气反应来处理反应混合物。
步骤a)中的方法可包括以下步骤:通过使亚硝酸钠(nano2)与包括葡萄糖和硝酸(hno3)的第一混合物反应来制备反应物;通过将氢氧化钾(koh)加入至反应物来制备ph值约为9至10的碱性反应物;通过将硝酸(hno3)加入至碱性反应物来制备ph值约为3至4的酸性反应物;使酸性反应物沉淀,然后过滤并洗涤形成的沉淀物以获得葡萄糖二酸钾盐。
在步骤a)中,亚硝酸钠(nano2)和第一混合物可以在约0℃至30℃的温度下反应。
当该步骤中的反应温度低于约0℃时,可能达不到反应温度,因此可能降低反应性。另一方面,当反应温度高于约30℃时,可能产生不必要的副产物,并且产率可能不会增加。
在步骤a)中,亚硝酸钠(nano2)和葡萄糖可以适当地以约1:500至1:1500的重量比混合。优选地,亚硝酸钠(nano2)和葡萄糖可以以约1:1000的重量比混合。
如本文所用的亚硝酸钠(nano2)可以引起葡萄糖二酸钾盐的晶体。因此,当亚硝酸钠与葡萄糖之间的混合比可能超出上述混合比时,可能无法适当地形成步骤a)中获得的葡萄糖二酸钾盐晶体。
因此,在制备反应物的步骤中制得的反应物可以通过加入氢氧化钾(koh)而碱化至碱性ph,然后通过加入硝酸(hno3)而酸化至酸性ph。接下来,可以使酸性反应物在乙醇中静置,从而产生作为酸碱反应产物的葡萄糖二酸钾盐。
步骤b)可包括以下步骤:通过使包括葡萄糖二酸钾盐和反应溶剂的第二混合物与酸性溶液反应,从步骤a)制得的葡萄糖二酸钾盐中除去钾离子;在除去钾离子的步骤中,向除去钾离子的物质中加入氨水溶液,然后混合预定时间,然后向其中加入乙醇以沉淀葡萄糖酰胺颗粒,并回收沉淀的葡萄糖酰胺颗粒。优选地,用于与葡萄糖二酸钾盐反应的酸性溶液可以在反应溶剂中。
在除去钾离子的步骤中使用的反应溶剂可以是选自c1至c10伯醇和仲醇中的任何一种或多种。在这些醇中,最优选使用甲醇。
酸性溶液可以适当地为硫酸(h2so4)或对甲苯磺酸。
除去钾离子的步骤中的反应可适当地进行约12至24小时。当反应进行少于约12小时时,可能不能适当地除去钾离子,因此可能降低葡萄糖酰胺的产率,并且当反应时间大于约24小时时,可以在不增加产量的情况下增加工艺成本,从而可能降低经济效率。
以氨水溶液的总重量计,氨水溶液可以适当地具有约25重量%至28重量%的氨浓度。
步骤c)和步骤d)可包括由步骤b)中制得的葡萄糖酰胺制备己二酰二胺的步骤。在步骤c)中,可以通过将步骤b)制得的葡萄糖酰胺和催化剂加入至溴化氢(hbr)和乙酸中来制备反应混合物。在步骤d)中,反应混合物和氢气可在反应器中反应,从而产生己二酰二胺。
步骤c)中的溴化氢的含量相对于乙酸可以为1体积%至2体积%。
以卤化氢和乙酸的总重量计,步骤c)中的葡萄糖酰胺可以以1重量%至2重量%的量加入。
步骤c)中的催化剂可适当地包括repd/ceo2催化剂或pt/sio2催化剂。以氧化铈(ceo2)的总重量计,repd/ceo2催化剂可包括量为约2重量%至10重量%的铼(re)和量为约1重量%至3重量%的钯(pd)。以二氧化硅(sio2)的总重量计,pt/sio2催化剂可包括量为约1重量%至5重量%的铂(pt)。
以反应混合物的总重量计,反应混合物可适当地以约0.3重量%至0.5重量%的量包括步骤c)中的催化剂。
在步骤d)中,可将步骤c)制得的反应混合物引入反应器中并使其反应达预定时间。可以将步骤d)中的氢气引入反应器中,使得反应器的内部压力为约30巴至50巴。
步骤d)中的反应可以在约120℃至150℃的温度下进行约2至10小时,从而产生己二酰二胺。
还提供了一种制备己二酸的方法。该方法可包括如本文所述的生产己二酰二胺的步骤。
还提供了一种尼龙产品,其包括通过本文所述方法而制得的己二酸。
以下公开了本发明的其他方面。
附图说明
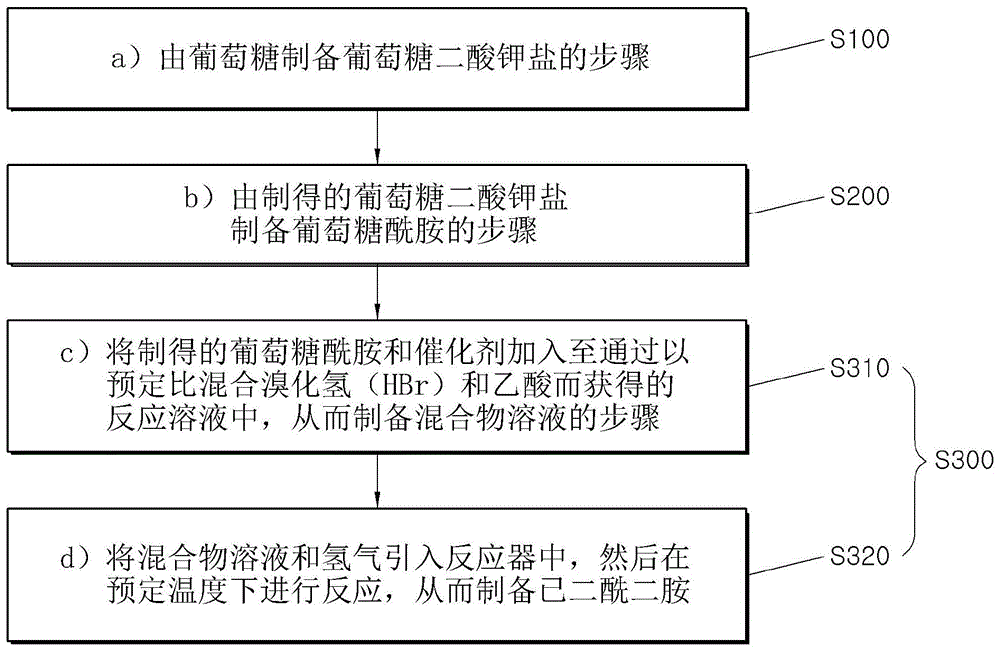
图1是显示根据本发明用于制备己二酰二胺的方法的流程图。
图2是显示在根据本发明用于制备己二酰二胺的方法中由葡萄糖制备葡萄糖二酸钾盐的步骤(s100)的详细流程图。
图3是显示在根据本发明用于制备己二酰二胺的方法中由葡萄糖二酸钾盐制备葡萄糖酰胺的步骤(s200)的详细流程图。
图4是显示在根据本发明用于制备己二酰二胺的方法中由葡萄糖酰胺制备己二酰二胺的步骤(s300)的详细流程图。
图5显示了根据本发明实施方案制备的己二酰二胺的核磁共振(nmr)波谱分析。
具体实施方式
下面将参考所附附图对本发明的优选实施方案进行具体描述。然而,提供的这些实施方案仅用于说明目的,并且本发明所属领域的技术人员可以进行各种改变和修改。因此,本发明的范围并不限于本文公开的实施方案。
本文所使用的术语是为了描述特定实施方案的目的,并不旨在限制。除非上下文中另有明确说明,如本文所使用的单数形式“一”、“一个”和“该”旨在也包括复数形式。应当进一步了解,当在本说明书中使用术语“包括”、“包括”、“具有”等指定所述特征、区域、整数、步骤、操作、元素和/或组件的存在,但不排除一种或多种其他特征、区域、整数、步骤、操作、元素、组件和/或其组合的存在或添加。
此外,除非特别指出或明显区别于上下文,本文中所用的术语“约”理解为在本领域内的普通公差的范围内,例如均值的2个标准偏差内。“约”可以理解为在所述值的10%、9%、8%、7%、6%、5%、4%、3%、2%、1%、0.5%、0.1%、0.05%或0.01%内。除非上下文明确说明,本文所提供的所有数值通过术语“约”进行修改。
此外,每个步骤的重复次数,工艺条件等没有特别限制,只要它们不损害本发明的目的即可。
另外,除非另外定义,否则本文使用的所有术语,包括技术术语或科学术语,具有与本发明所属领域的技术人员通常理解的含义相同的含义。
如图1所示,根据本发明示例性实施方案的用于制备己二酰二胺的方法可包括以下步骤:a)由葡萄糖制备葡萄糖二酸钾盐(s100);b)由制得的葡萄糖二酸钾盐制备葡萄糖酰胺(s200);c)和d)由制得的葡萄糖酰胺制备己二酰二胺(s300)。
在由葡萄糖制备葡萄糖二酸钾盐的步骤(s100)中,如下面的反应方案1所示,葡萄糖二酸钾盐可以由用作起始材料的葡萄糖制备。葡萄糖可以优选为衍生自作为生物质的陆生植物资源的葡萄糖,但并不限于此,并且本领域中通常使用的葡萄糖也可以用于该步骤。
[反应方案1]
在示例性实施方案中,如图2所示,步骤s100可包括以下步骤:(s110)通过使亚硝酸钠(nano2)与葡萄糖和硝酸(hno3)的第一混合物反应来制备反应物;(s120)通过将氢氧化钾(koh)加入至反应物来制备ph值约为9至10的碱性反应物;(s130)通过将硝酸(hno3)加入至碱性反应物来制备ph值约为3至4的酸性反应物;以及(s140)使酸性反应物沉淀,然后过滤并洗涤形成的沉淀物,从而获得葡萄糖二酸钾盐。
例如,步骤(s110)可包括将10至15g的葡萄糖加入至13ml70%的硝酸(hno3)中以制备混合物,并将10至20mg的亚硝酸钠(nano2)加入至混合物中,从而制备反应物。
制备反应物步骤中的反应可以优选在约0℃至30℃的温度下进行。当反应温度低于约0℃时,可能达不到反应温度,因此可能降低反应性。另一方面,当反应温度高于约30℃时,可能产生不必要的副产物,因此,可能无法获得诸如产率增加的效果。
在步骤(s110)中,亚硝酸钠和葡萄糖可以以约1:500至1:1500,或特别为约1:1000的重量比混合。
在步骤(s120)中,通过加入约45%的氢氧化钾,可以将步骤(s110)中制得的反应物碱化至约9至10的ph,从而制备碱性反应物。
当步骤(s120)中的碱性ph超出上述碱性ph范围时,例如,小于约9,或大于约10时,可能不能适当地形成葡萄糖二酸钾盐。
通过加入约70%的硝酸(hno3),可以将步骤(s120)中制得的碱性反应物酸化至约3至4的ph,从而制备酸性反应物(s130)。
然后,可以将制得的酸性反应物在室温(例如,15至30℃)下老化12小时以沉淀形成的固体颗粒,并且可以用甲醇洗涤沉淀物,从而获得高纯度的葡萄糖二酸钾盐(s140)。
在制备碱性反应物的步骤(s120)和制备酸性反应物的步骤(s130)中,反应物的ph可以通过ph试纸测量,但不一定限于此,并且ph也可以通过本领域通常使用的ph测量方法进行测量。
如图3所示,由步骤(s100)中制得的葡萄糖二酸钾盐制备葡萄糖酰胺的步骤(s200)可包括以下步骤:(s210)通过使包括葡萄糖二酸钾盐的第二混合物与酸性溶液(优选在反应溶剂中)反应而从葡萄糖二酸钾盐中除去钾离子,然后进行反应;(s220)向除去钾离子的葡萄糖二酸中加入氨水溶液和乙醇,从而获得葡萄糖酰胺粒子。
例如,在步骤(s210)中,可以加入量为1.24g(5mmol)的葡萄糖二酸钾盐并与用作反应溶剂的甲醇混合。在该步骤中使用的反应溶剂可以是任何一种或多种伯醇和仲醇。然而,除甲醇以外的醇存在的问题在于后续过程中得到的物质的产率会迅速降低。因此,可以适当地使用甲醇。
随后,可以将约0.3至1.0ml作为酸性溶液的硫酸(h2so4)缓慢加入至混合物中。作为酸性溶液,可以适当地使用对甲苯磺酸代替硫酸。
在步骤(s210)中加入的酸性溶液可以从葡萄糖二酸钾盐中分离钾(k)离子。因此,反应可以保持约12至24小时,以便可以适当地除去钾离子。然后,可以将反应在室温(15至30℃)下冷却以形成硫酸钾(k2so4)盐沉淀,然后通过过滤除去硫酸钾(k2so4)盐沉淀。
在回收葡萄糖酰胺颗粒的步骤(s220)中,可以通过从步骤(s210)中除去钾(k)离子的葡萄糖二酸中蒸发除去用作反应溶剂的甲醇。然后,将含有蒸发甲醇的葡萄糖二酸的反应器保持在温度为0℃的浴中,将约10ml的氨水溶液加入至葡萄糖二酸并搅拌约2至4小时。可以将150ml的乙醇加入至混合物,然后可以搅拌10小时并使得静置10分钟,从而获得葡萄糖酰胺颗粒。
氨水溶液可以适当地为通过将氨(nh3)以约25至28重量%的浓度溶解于水中而获得的溶液。
例如,在步骤(s200)中,如下面的反应方案2所示,葡萄糖酰胺可以通过以下步骤由葡萄糖二酸钾盐制备:通过将0.3ml硫酸(h2so4)缓慢加入至1.24g(5mmol)葡萄糖酸钾盐在150ml甲醇中的溶液,然后反应12小时,从葡萄糖二酸钾盐中除去钾(k)离子;通过从除去钾(k)离子的葡萄糖二酸中蒸发而完全除去甲醇;将10ml的氨水(nh3)溶液加入至蒸发掉甲醇的葡萄糖二酸中,然后搅拌2小时,同时将含有葡萄糖二酸的反应器保持在0℃的低温浴中;然后将150ml的乙醇加入至混合物中,然后搅拌10分钟并使得静置10分钟。
[反应方案2]
如下面的反应方案3所示,在步骤(s300)中,己二酰二胺可以由步骤(s200)中制得的葡萄糖酰胺制备。例如,如图4中所示,步骤(s300)可包括以下步骤:(s311)以预定比例混合乙酸和溴化氢(hbr)以制备反应溶液;(s312)将葡萄糖酰胺和催化剂加入至制得的反应溶液中以制备反应混合物;(s320)将反应混合物引入反应器中然后使混合物在高温下在高压(h2)气氛中反应,从而制备己二酰二胺。
[反应方案3]
步骤(s311)为制备由葡萄糖酰胺制备己二酰二胺所需的反应溶液的步骤。在该步骤中,乙酸可以用作溶剂,并且反应溶液可以包括相对于乙酸量为约1体积%至2体积%的溴化氢(hbr),并且可以通过混合制备。
本发明的特征在于使用酸性溶剂作为反应溶液的溶剂。通常,酸性溶剂包括盐酸,硫酸等。在根据本发明制备己二酰二胺的步骤中,葡萄糖酰胺可以仅在乙酸中反应,并且可以不发生用于制备己二酰二胺的反应。因此,本发明的特征在于使用乙酸。
在步骤(s312)中,可以将步骤s200中制得的葡萄糖酰胺和催化剂加入至步骤(s311)中制得的反应溶液中,从而制备反应混合物。在该步骤中,以反应溶液的总重量计,葡萄糖酰胺可以以约1至2重量%的量加入。
当葡萄糖酰胺的加入量超出上述范围时,例如,小于约1重量%或大于约2重量%,则用于制备己二酰二胺的反应性可能迅速降低。
此外,在反应混合物中使用的催化剂可以为repd/ceo2催化剂。例如,re和rd可以基于氧化铈的总重量在氧化铈(ceo2)上。优选地,在ceo2上可以负载约2至12重量%的铼(re)和约1至3重量%的钯(pd)。可替代地,催化剂可以为pt/sio2催化剂。例如,pt可以基于二氧化硅的总重量承载在二氧化硅(sio2)上。优选地,在sio2上可以负载约1至5重量%的铂(pt)。
以反应混合物的总重量计,repd/ceo2催化剂或pt/sio2催化剂的含量可以为约0.3至0.5重量%。
在如上所述本发明步骤(s310)中的催化剂可以按照如下所述进行制备。
用于制备repd/ceo2催化剂的方法的实施例如下。将铼(re)的前体高铼酸铵(ls-nikkocopperinc.,韩国)溶解于水中,然后将铼(re)前体高铼酸铵的水溶液加入至作为载体的球形ceo2颗粒(sigmaaldrich,美国)中,使得高铼酸铵以载体的总重量计以10重量%的量负载在载体上。将负载的材料在约100℃的温度下干燥。接下来,将钯(pd)前体pdcl2(sigmaaldrich,美国)的溶液加入至ceo2颗粒中,使得钯前体以载体的总重量计以3重量%的量负载在载体上,然后在约100℃的温度下干燥。接下来,通过负载预定量的铼(re)前体和钯(pd)前体而负载有铼(re)和钯(pd)的ceo2颗粒在约300℃的温度下煅烧,然后在氢气气氛中在300℃的温度下进行还原反应,从而制备repd/ceo2催化剂。
用于制备作为另一种催化剂的pt/sio2催化剂的方法如下。将铂(pt)前体四氨合铂硝酸盐(sigmaaldrich,美国)在水中的溶液加入至作为载体的球形sio2颗粒(sigmaaldrich,美国)中,使得四氨合铂硝酸盐以载体的总重量计以5重量%的量负载在载体上。将负载的材料在约100℃的温度下干燥,然后在约300℃的温度下煅烧,并在氢气气氛中在约300℃的温度下进行还原反应,从而制备pt/sio2催化剂。
在步骤(s320)中,可以通过将制得的反应混合物引入反应器中来制备己二酰二胺,并且可以使反应混合物进行氢化反应。例如,可将反应混合物引入反应器中,然后使得在约120至150℃的温度下反应约2至10小时,同时在约30至50巴的压力下将氢气引入反应器中。
当步骤(s320)中的氢气压力超出上述范围时,例如,小于约30巴或大于约50巴时,可能不适当地发生氢化反应,因此己二酰二胺的产率可能降低。
此外,当步骤(s320)中的反应时间小于约2小时时,由于反应时间短,己二酰二胺的产率可能降低,并且当反应时间大于约10小时时,由于反应时间过长,整个生产过程时间可能会增加,因此生产率可能降低。
另外,步骤(s320)中的反应温度可低于约120℃,氢化反应性可降低,并且当反应温度高于约150℃时,副产物的产生可能增加从而降低生产效率。由于这些原因,氢化反应可以优选在如上所述的120℃至150℃范围内的温度下进行。
在下文中,将参考实施例,对比实施例和测试实施例进一步详细描述本发明。然而,应该理解,这些实施例仅用于说明目的,本发明不限于这些实施例并且可以以各种方式进行修改和改变。
下表1和表2总结了在每个实施例和对比实施例中使用的溶剂的种类,反应条件以及在根据本发明的制备己二酰二胺的步骤(s300)中的己二酰二胺的制备。
在下表1和表2中,(a)示出作为反应溶液的酸性溶液的种类和是否加入溴化氢(hbr),(b)示出在反应溶液中的溴化氢(hbr)/酸性溶剂(乙酸)比率(v/v)。
表1
表2
上述表2中的对比实施例1至12是不满足在本发明的己二酰二胺制备方法中由葡萄糖酰胺制备己二酰二胺的步骤(s300)中使用的各反应条件的实施例。现在将详细描述这些对比实施例的结果。
在对比实施例1至3中,使用仅作为本发明中使用的催化剂载体ceo2或sio2,或使用作为常规催化剂的氧化铝(al2o3)。在这些对比实施例中,氢化反应性低,因此没有适当地实现己二酰二胺的合成。
在对比实施例4和5中,没有将溴化氢(hbr)加入至反应溶液中。在该对比实施例中,没有合成己二酰二胺,这表明加入溴化氢(hbr)对于进行本发明的氢化反应是必需的。
在对比实施例6中,反应器中的反应在50℃的温度下进行,该温度低于本发明提出的温度范围的下限。在该对比实施例中,由于反应温度低而不能提供反应所需的足够的热量使得反应性低,因此,没有合成己二酰二胺。
在对比实施例7至10中,反应溶液中溴化氢(hbr)与乙酸的混合比不在本发明提出的范围内。在这些对比实施例中,氢化反应性低,因此没有合成己二酰二胺。
在对比实施例11和12中,使用盐酸或硫酸代替乙酸作为反应溶液中的酸性溶剂。从上述表2的结果可以看出,当在反应溶液中使用除乙酸之外的酸性溶剂时,反应不进行,因此没有合成己二酰二胺。
在测试实施例1中,通过核磁共振(nmr)波谱法分析在本发明的一个实施例中制得的样品,以确认样品的组分。通过brukeraviii400仪器在cdcl3和二甲基亚砜(dmso)中使用三甲基硅烷(tms)作为内部标准(在400mhz处为1h,在100mhz处为13c)来分析样品的nmr波谱。
核磁共振波谱法是一种用于识别化合物的分析方法,其可以确定化合物中与氢原子键合的原子,并确定含有该原子的官能团,并确定该化合物的空间排列。
氢核磁共振波谱的结果如图5所示。在氢核磁共振波谱中出现了在7.21ppm、6.67ppm、2.03ppm和1.47ppm处的四个峰,表明合成了己二酰二胺。
通过分析在本发明的实施例中制得的样品获得的核磁共振波谱数据表明产生了所需的己二酰二胺。
同时,如下面的反应方案4所示,通过在酸性水溶液中在约100℃的温度下进行水解反应,可以将根据本发明制得的己二酰二胺转化为己二酸。
[反应方案4]
从石油化学化合物合成尼龙66原料的常规方法通常具有使用强毒性化合物或产率非常低的问题。然而,根据本发明的制备方法使得可以通过衍生自生物质(例如环境友好的植物资源)的葡萄糖的非常简单的方法以高产率低成本制备可以转化为己二酸的中间体己二酰二胺。因此,由中间体己二酰二胺产生的己二酸可用作用于车辆部件的尼龙的原料。
如上所述,根据本发明的用于制备己二酰二胺的方法具有以下优点:与基于石油化学的常规石油化学方法相比,通过非常简单的方法以高产率低成本制备可以转化为己二酸的中间体己二酰二胺。因此,由己二酰二胺制得的己二酸可以用作通过使用生物基己二酸生产尼龙66的原料,所述尼龙66用作汽车部件材料。因此,预期本发明的方法具有显著的经济和工业涟漪效应。
虽然已经参照不同的示例性实施方案描述了本发明,但是对于本领域技术人员来说显而易见的是,在不脱离所附权利要求限定的本发明的精神和范围的情况下,可以进行各种改变和修改。
- 还没有人留言评论。精彩留言会获得点赞!