一种血液多组分物质的分离方法及应用与流程
本发明属于生物技术领域,具体涉及一种血液多组分物质的分离方法及应用。
背景技术:
循环肿瘤细胞(circulatingtumorcell,ctc)是存在于外周血中的各类肿瘤细胞的统称。通过测序、染色、计数等方法分离检测外周血中痕量存在的ctc,可以动态监测肿瘤转移复发和疗效评价,对于个体化治疗方案的制定具有重要价值。
由于ctc的稀有性及没有良好的分子标志物,ctc的分离及后续分析检测长期以来进展缓慢。近年来得益于单细胞分析技术,出现了一批ctc分离检测方法,主要基于细胞物理特性(如细胞大小、密度、电荷状态等)分离和/或基于细胞分子标志物(如上皮标志物、血细胞标志物等)分离。基于细胞物理特性分离ctc的方法通常不需要标记细胞,能最大程度保持细胞原始状态,但存在特异性不够,分离不完全的问题。而基于细胞分子标志物分离ctc的方法特异性好,但通常需要先对细胞进行标记,对细胞损害较大,对下游检测造成不可逆的影响,且ctc没有统一的分子标志物,存在漏检、错检的情况。
现有的分离ctc的方法的缺点主要有如下几点:一是常规血液抗凝较为简单,利用edta与钙离子结合成螯合物的原理阻止血液凝固,血小板因聚集抑制不充分而聚集成团块,导致堵塞基于尺寸分离的器件装置和残留血细胞污染比例较高的问题;二是现有血液预处理在室温进行,基于尺寸大小的微流控分离方法多采用注射器,分离细胞活性低,完整性差;三是ctc回收过程对细胞完整性破坏大,rna易降解,进行单细胞转录组测序时,建库成功率低,mapping基因数少;四是ctc的回收效率低且纯度低,血细胞特别是血小板残留污染量大;五是全血中其它组分(如血浆游离dna、rna等)没有被充分利用,单次只能得到ctc信息。
技术实现要素:
本发明的目的是分离血液组分,尤其是分离ctc。
本发明首先保护一种血液组分的分离方法,可包括如下步骤:先采用保存液保存血液,然后分离血液组分;所述保存液中含有血小板激活抑制剂。
上述方法中,所述保存液可为含血小板激活抑制剂的缓冲液。所述含血小板激活抑制剂的缓冲液具体可为含血小板激活抑制剂的磷酸缓冲液。
上述方法中,所述保存液具体可为含8-12mg/ml(如8-10mg/ml、10-12mg/ml、8mg/ml、10mg/ml或12mg/ml)血小板激活抑制剂的磷酸缓冲液。
上述方法中,所述血小板激活抑制剂可为替罗非班、依替巴肽、阿西单抗、西洛他唑和双嘧达莫中的至少一种。
上述方法中,采用保存液保存血液通过向血液中加入保存液的方式实现。所述向血液中加入保存液得到血液混合液;血液混合液中血小板激活抑制剂的浓度可为1-80μg/ml(如1-2.5μg/ml、2.5-50μg/ml、50-80μg/ml、1μg/ml、2.5μg/ml、50μg/ml或80μg/ml)。在本发明的一个实施例中,所述血小板激活抑制剂具体可为替罗非班或依替巴肽。当采用含替罗非班的缓冲液保存时,具体操作可为:取新鲜抽取的人血液,加入含替罗非班的磷酸缓冲液,得到血液混合液;血液混合液中替罗非班的浓度可为2.5μg/ml。当采用含依替巴肽的缓冲液保存时,具体操作可为:取新鲜抽取的人血液,加入含依替巴肽的磷酸缓冲液,得到血液混合液;血液混合液中依替巴肽的浓度可为50μg/ml。
上述任一所述磷酸缓冲液可为含120-140mmnacl、2.5-3.0mmkcl、8-12mmna2hpo4和1.5-2.0mmkh2po4的水溶液,ph值可为7.2-7.4。
上述任一所述磷酸缓冲液具体可为含137mmnacl、2.7mmkcl、10mmna2hpo4和1.76mmkh2po4的水溶液,ph值可为7.2-7.4。
上述方法中,所述血液保存的参数可为:4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)保存24h以下(如1-8h、8-16h、16-24h、1h、8h、16h或24h)。
上述任一所述的方法中,所述分离血液组分可包括步骤a1)和a2);
a1)取保存液保存的血液,100-1800g(如100-800g、800-1800g、100g、800g或1800g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集液相和沉淀;
a2)取所述液相,12000-16000g(如12000-14000g、14000-16000g、12000g、14000g或16000g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集上层液相,上层液相即为血浆。进行该步骤可以从血液中分离到组分—血浆。
上述任一所述的方法中,所述分离血液组分还可包括步骤a3)-a7):
a3)将步骤a1)收集的沉淀进行重悬,然后加入去除人cd45的试剂,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)孵育0.5-2h(如0.5-1h、1-2h、0.5h、1h或2h),得到混合液;
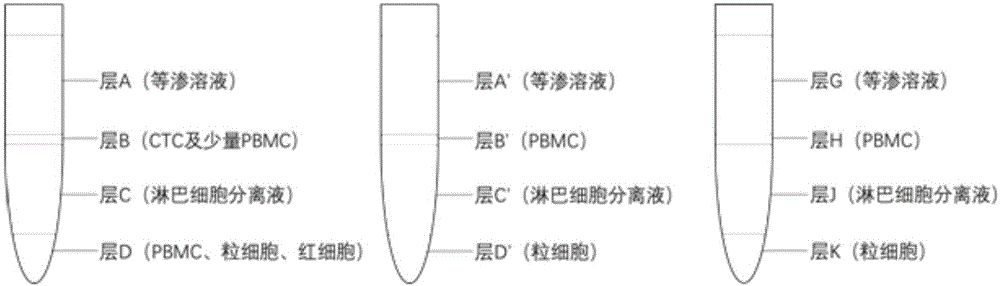
a4)将步骤a3)得到的混合液进行密度梯度离心,从上至下获得层a、层b、层c和层d(见图1中左图);
a5)取所述层d,裂解红细胞,然后4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、100-1800g(如100-500g、500-1800g、100g、500g或1800g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集沉淀;
a6)将步骤a5)收集的沉淀进行重悬,然后密度梯度离心,从上至下获得层a’、层b’、层c’和层d’;层b’为分离的pbmc;层d’为分离的粒细胞(见图1中中图);
a7)取所述层b,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、120-200g(如120-160g、160-200g、120g、160g或200g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集上清和沉淀;上清为分离的血小板。
进行至步骤a6)可以从血液中分离到组分—pbmc和/或粒细胞。
进行至步骤a7)可以从血液中分离到组分—血小板。
上述任一所述的方法中,所述分离血液组分可包括步骤b)或步骤c)。
所述步骤b)可包括步骤b1)-步骤b4):
b1)取保存液保存的血液,100-1800g(如100-800g、800-1800g、100g、800g或1800g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集沉淀;
b2)将步骤b1)收集的沉淀进行重悬,然后加入去除人cd45的试剂,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)孵育0.5-2h(如0.5-1h、1-2h、0.5h、1h或2h),得到混合液;
b3)将步骤b2)得到的混合液进行密度梯度离心,从上至下获得层a、层b、层c和层d;
b4)取所述层b,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、120-200g(如120-160g、160-200g、120g、160g或200g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集沉淀。
所述步骤a3)或步骤b2)中,所述去除人cd45的试剂可为humancd45depletioncocktail。所述“将步骤a1)收集的沉淀进行重悬”可向步骤a1)收集的沉淀中加入等渗溶液重悬。所述“将步骤b1)收集的沉淀进行重悬”可向步骤b1)收集的沉淀中加入等渗溶液重悬。所述等渗溶液的温度可为0~4℃。
所述步骤a4)或所述步骤b3)中,所述密度梯度离心的介质可为单个核细胞分离液。所述“将步骤a3)得到的混合液进行密度梯度离心”可为向步骤a3)得到的混合液中加入单个核细胞分离液(温度可为0-4℃),然后进行密度梯度离心。所述“将步骤b2)得到的混合液进行密度梯度离心”可为向步骤b2)得到的混合液中加入单个核细胞分离液(温度可为0-4℃),然后进行密度梯度离心。
所述步骤a5)中,所述裂解红细胞通过加入红细胞裂解液进行。所述“取层d,裂解红细胞”可为取层d,加入红细胞裂解液重悬细胞,静置2-6min(如2-4min、4-6min、2min、4min或6min)。
所述步骤a6)中,所述密度梯度离心的介质可为单个核细胞分离液。所述“将步骤a5)收集的沉淀进行重悬,然后密度梯度离心”可为向步骤a5)收集的沉淀中加入等渗溶液(温度可为0~4℃)重悬,然后加入单个核细胞分离液(温度可为0-4℃),进行密度梯度离心。
上述方法中,所述密度梯度离心的参数可为600-1400g(如600-1000g、1000-1400g、600g、1000g或1400g)离心10-20min(10-15min、15-20min、10min、15min或20min),升降速<15g/s。
所述步骤c)可包括步骤c1)-步骤c4):
c1)取保存液保存的血液,100-1800g(如100-800g、800-1800g、100g、800g或1800g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集沉淀;
c2)将步骤c1)收集的沉淀进行重悬,然后密度梯度离心,从上至下获得层g、层h、层j和层k(见图1中右图);
c3)取所述层h,加入抗cd45磁珠,孵育;然后置于磁力架静置5-10min(如5-8min、8-10min、5min、8min或10min),收集液相;
c4)取步骤c3)收集的液相,4-16℃、120-200g离心5-10min(如5-8min、8-10min、5min、8min或10min),收集沉淀。
上述任一所述的方法中,所述分离血液组分还可包括步骤a3’)-a6’):
a3’)将步骤a1)收集的沉淀进行重悬,然后密度梯度离心,从上至下获得层g、层h、层j和层k;
a4’)取所述层h,加入抗cd45磁珠,孵育;然后置于磁力架静置5-10min(如5-8min、8-10min、5min、8min或10min),收集液相和磁珠层;磁珠层为分离的pbmc;
a5’)取步骤a4’)收集的液相,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、120-200g(如120-160g、160-200g、120g、160g或200g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集上清和沉淀;上清为分离的血小板;
a6’)取所述层k,裂解红细胞,然后4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、100-800g(如100-500g、500-800g、100g、500g或800g)离心5-10min(如5-8min、8-10min、5min、8min或10min),收集上清;上清为分离的粒细胞。
进行至步骤a4’)可以从血液中分离到组分—pbmc。
进行至步骤a5’)可以从血液中分离到组分—血小板。
进行至步骤a6’)可以从血液中分离到组分—粒细胞。
所述步骤a3’)中,“将步骤a1)收集的沉淀进行重悬”可向步骤a1)收集的沉淀中加入等渗溶液重悬。所述步骤c2)中,所述“将步骤c1)收集的沉淀进行重悬”可向步骤c1)收集的沉淀中加入等渗溶液重悬。所述等渗溶液的温度可为0~4℃。
所述步骤a3’)或步骤c2)中,所述密度梯度离心的参数可为400-600g(如400-500g、500-600g、400g、500g或600g)离心10-20min(10-15min、15-20min、10min、15min或20min),升降速为8-15g/s(如8-10g/s、10-15g/s、8g/s、10g/s或15g/s)。
所述步骤a4’)或所述步骤c3)中,“取所述层h,加入抗cd45磁珠”可为取所述层h,加入等渗溶液,得到体系;该体系中的细胞密度为1×107-1×109/ml(如1×107-1×108个/ml、1×108-1×109个/ml、1×107个/ml、1×108个/ml或1×109个/ml)。然后加入抗cd45磁珠。
所述步骤a4’)或所述步骤c3)中,所述孵育可为4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、旋转孵育30-60min(如30-45min、45-60min、30min、45min或60min)。
所述步骤a6’)中,所述裂解红细胞通过加入红细胞裂解液进行。所述“取所述层k,裂解红细胞”可为取层k,加入红细胞裂解液重悬细胞,静置2-6min(如2-4min、4-6min、2min、4min或6min)。
上述任一所述的方法中,所述分离血液组分还可包括步骤a8):将步骤a7)收集的沉淀或步骤a5’)收集的沉淀或步骤b4)收集的沉淀或步骤c4)收集的沉淀进行重悬,然后在4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)条件下富集直径大于5~8μm的细胞,得到富集液;富集液为分离的ctc。进行该步骤可以从血液中分离到组分—ctc。
所述步骤a8)中,“将步骤a7)收集的沉淀或步骤a5’)收集的沉淀或步骤b4)收集的沉淀或步骤c4)收集的沉淀进行重悬”可为向步骤a7)收集的沉淀或步骤a5’)收集的沉淀或步骤b4)收集的沉淀或步骤c4)收集的沉淀中加入等渗溶液(温度可为0~4℃)重悬,得到ctc重悬液。所述富集采用孔径为5~8μm的微流控芯片。具体的,将ctc重悬液流经孔径为5~8μm的微流控芯片(流体流速可为20-100ml/h(如20-60ml/h、60-100ml/h、20ml/h、60ml/h或100ml/h),流体温度可为4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)),直径大于5~8μm的细胞会被微流控芯片富集,然后反向回冲进行回收。
上述任一所述的方法中,所述分离血液组分还可包括步骤a9):将步骤a8)得到的富集液进一步浓缩,得到浓缩液;浓缩液中含有ctc。进行该步骤可以从血液中分离到组分—ctc。浓缩液中的ctc比富集液中的ctc纯度更高,且血小板污染程度进一步降低。
所述步骤a9)中,“将步骤a8)得到的富集液进一步浓缩”具体可为步骤a8-1):取步骤a8)得到的富集液,4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、120-200g(如120-160g、160-200g、120g、160g或200g)离心5-10min(如5-8min、8-10min、5min、8min或10min),弃部分上清,得到浓缩液。
所述步骤a9)中,“将步骤a8)得到的富集液进一步浓缩”还可包括步骤a8-2):取步骤a8-1)得到的浓缩液,用等渗溶液洗涤,然后4-16℃(如4-10℃、10-16℃、4℃、10℃或16℃)、120-200g(如120-160g、160-200g、120g、160g或200g)离心5-10min(如5-8min、8-10min、5min、8min或10min),弃部分上清,得到浓缩液。
上述任一所述保存液也属于本发明的保护范围。
本发明还保护上述任一所述保存液或上述任一所述的方法在分离血液组分中的应用;所述血液组分可为ctc、血浆、粒细胞、pbmc和血小板中的至少一种。
需要说明的是,如果采用上述任一所述的方法分离的ctc是用于基因检测的,则保存液中不能含有肝素。
上述任一所述等渗溶液可为含130-140mmnacl、2.5-3.0mmkcl、8-12mmna2hpo4、1.6-1.8mmkh2po4和1-3%(v/v)fbs的水溶液。上述任一所述等渗溶液具体可为含137mmnacl、2.7mmkcl、10mmna2hpo4、1.76mmkh2po4和2%(v/v)fbs的水溶液。
实验证明,本发明提供的血液组分的分离方法操作简单、耗时短,且分离的ctc完整性好、纯度高,同时可分离得到血小板、血浆、粒细胞和pbmc等血液组分。本发明具有重要的应用价值。
附图说明
图1为血液多组分物质的分离过程中密度梯度离心的分层示意图。
图2为从血液中分离ctc的技术路线图。
图3为细胞膜完整性比较结果。
图4为血小板污染比较结果。
图5为文库的质量和产量的比较结果。
图6为是否造成芯片堵塞的比较结果。
具体实施方式
以下的实施例便于更好地理解本发明,但并不限定本发明。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
以下实施例中的定量试验,均设置三次重复实验,结果取平均值。
等渗溶液为含137mmnacl、2.7mmkcl、10mmna2hpo4、1.76mmkh2po4和2%(v/v)fbs的水溶液。
单个核细胞分离液(以下简称分离液)为天津市灏洋生物制品科技有限责任公司的产品。humancd45depletioncocktail(中文名称为人cd45去除试剂盒)为stemcell公司的产品,其可以去除人cd45。红细胞裂解液为stemcell公司的产品。微流控芯片为celsee公司的产品,微流控芯片的孔径为8μm。hoechst为invitrogen公司的产品。pi为sigma公司的产品。
实施例1、ctc的分离和鉴定
一、ctc的分离
本发明的发明人经过大量实验,建立了从血液中分离ctc的方法。采用该方法可分离ctc且分离的完整性好、纯度高,同时可分离得到血小板、血浆、粒细胞和外周血单个核细胞(peripheralbloodmononuclearcell,pbmc)。该方法的技术路线见图2。具体步骤如下:
1、血液保存
(1)取4ml新鲜抽取的人血液,加入替罗非班溶液(含10mg/ml替罗非班的磷酸缓冲液)或依替巴肽溶液(含5mg/ml依替巴肽的磷酸缓冲液),得到血液混合液。如果加入的是替罗非班,则血液混合液中替罗非班的浓度为2.5μg/ml。如果加入的是依替巴肽,则血液混合液中依替巴肽的浓度为50μg/ml。
磷酸缓冲液为含137mmnacl、2.7mmkcl、10mmna2hpo4和1.76mmkh2po4的水溶液,ph值为7.2-7.4。
(2)取步骤(1)得到的血液混合液,4℃保存4h,得到血液保存液。
2、血细胞的分离
(1)取步骤1得到的血液保存液,800g离心10min,收集液相和沉淀。沉淀即为血细胞。
(2)取步骤(1)收集的液相,16000g离心10min,收集上层液相。上层液相即为血浆。
将血浆进行常规保存或直接用于检测(如ctdna检测、microrna检测)。
3、pbmc和粒细胞的分离
(1)取步骤2中(1)收集的沉淀(收集于离心管中),先加入4ml0℃预冷的等渗溶液重悬,然后加入200μlhumancd45depletioncocktail,混合,4℃孵育1h,得到混合液。
加入humancd45depletioncocktail的目的为:pbmc不能穿过密度离心液被沉淀下来;加入humancd45depletioncocktail去除人cd45后,pbmc就可以穿过密度离心液被沉淀下来。
(2)取完成步骤(1)的离心管,加入3.5ml4℃预冷的分离液(作为密度梯度离心介质),1400g离心20min,升降速为10g/s。离心管中由上至下分为四层(分别命名为层a、层b、层c和层d,见图1中左图):第一层为等渗溶液层;第二层为等渗溶液与分离液界面层,该层包含ctc、血小板与少量的pbmc;第三层为分离液层(即淋巴细胞分离液);第四层为红细胞、pbmc和粒细胞层。
吸取第二层转移至另一新的离心管中,进行步骤4,即血小板的分离。
(3)完成步骤(2)后,除去第一层、第二层和第三层,加入3ml红细胞裂解液重悬细胞,静置6min,4℃、500g离心5min,收集沉淀。
(4)取步骤(3)收集的沉淀,加入8ml0℃预冷的等渗溶液重悬,得到重悬液。
(5)取步骤(4)得到的重悬液,加入3.5ml4℃预冷的分离液(作为密度梯度离心介质),600g离心20min,升降速<15g/s。离心管中由上至下分为四层(分别命名为层a’、层b’、层c’和层d’,见图1中中图,):第一层为等渗溶液层;第二层为等渗溶液与分离液界面层,该层包含pbmc;第三层为分离液层(即淋巴细胞分离液);第四层为粒细胞层。
吸取第二层,即为分离的pbmc。除去第一层、第二层和第三层,第四层即为分离的粒细胞。
4、血小板的分离
(1)取装有步骤3中(2)的第二层的离心管,4℃、120g离心10min,收集上清和沉淀。上清即为血小板。
将血小板常规保存或直接用于检测。
(2)取步骤(1)收集的沉淀,加入8ml等渗溶液重悬,得到ctc重悬液。
5、ctc的分离
(1)在4℃条件下,将ctc重悬液流经采用注射泵精确控制的微流控芯片(流速为80ml/h),直径较大的细胞会被微流控芯片富集,然后反向回冲,回收直径大于8μm的细胞,即获得体积约为2ml的ctc富集液。
与ctc重悬液相比,ctc富集液中ctc的纯度更高。
(2)取所述ctc富集液,4℃、200g离心10min,弃部分上清,得到体积为200μl的ctc浓缩液1。
(3)取所述ctc浓缩液1,用1.7ml等渗溶液洗涤,然后4℃、200g离心10min,弃部分上清,得到体积为200μl的ctc浓缩液2。
ctc浓缩液2即为本发明分离的ctc。
与ctc富集液相比,ctc浓缩液2中ctc的纯度更高,且血小板污染程度进一步降低。ctc浓缩液2中ctc回收效率可达85%,ctc纯度达10%,污染细胞的数量<200个/μl。
ctc回收效率=ctc浓缩液2中的ctc数/4ml人血液中的ctc数。
ctc纯度=ctc浓缩液2中的ctc数/ctc浓缩液2中有核细胞数。
按照上述方法,将步骤3和4替换为步骤a,其它步骤均不变,分离获得pbmc、粒细胞和血小板。步骤a具体如下:
(1)取步骤2中(1)收集的沉淀(收集于离心管中),先加入4ml0℃预冷的等渗溶液重悬,得到重悬液。
(2)取完成步骤(1)的离心管,400-600g离心20min,升降速为10g/s。离心管中由上至下分为四层(分别命名为层g、层h、层j和层k(见图1中右图)):第一层为等渗溶液层;第二层为单个核细胞层,该层包含血小板、pbmc与ctc;第三层为密度离心液(即淋巴细胞分离液);第四层为红细胞与粒细胞层。
(3)完成步骤(2)后,吸取第二层转移至另一新的离心管中,加入等渗溶液,得到体系;该体系中的细胞密度为1×107个/ml。
(4)取步骤(3)得到的体系,加入抗cd45磁珠(stemcell公司的产品),4℃、旋转孵育30-60min;然后置于磁力架上,静置5-10min,收集液相和磁珠层。磁珠层即为分离的pbmc。
(5)取步骤(4)收集的液相,4℃、120g离心10min,收集上清和沉淀。上清即为分离的血小板。
(6)取步骤(5)收集的沉淀,加入8ml等渗溶液重悬,得到ctc重悬液。
(7)完成步骤(2)后,除去第一层、第二层和第三层,加入3ml红细胞裂解液重悬细胞,静置6min,4℃、500g离心5min,收集上清。上清即为分离的粒细胞。
二、采用室温预处理方法分离ctc
按照步骤一的方法,将步骤一中的4℃替换为25℃,其它步骤均不变,得到ctc浓缩液。将该ctc浓缩液命名为室温对照ctc。
三、鉴定
1、细胞膜完整性比较
取待测ctc(步骤一分离的ctc或室温对照ctc),加入0.1μl浓度为10mg/ml的hoechst水溶液和0.1μl浓度为10mg/ml的pi水溶液,吹打混匀,室温静置5min。置于荧光显微镜下观察。
实验结果见图3(上图为室温对照ctc,下图为步骤一分离的ctc)。结果表明,步骤一分离的ctc和室温对照ctc均可回收到有核细胞;但室温对照ctc的pi染色显示红色,说明细胞膜结构被破坏;而步骤一分离的ctc的pi染色不显示红色,说明细胞膜结构完整。
2、血小板污染比较
在显微镜下分别观察步骤一中5(1)的ctc富集液和步骤一中5(3)的ctc浓缩液2。
实验结果见图4(左图为ctc富集液,右图为ctc浓缩液2,箭头所指为ctc)。结果表明,ctc富集液中残留的血小板为103-104/μl,ctc浓缩液2中残留的血小板<200个/μl。
3、文库的质量和产量的比较
(1)取待测ctc(步骤一分离的ctc或室温对照ctc),裂解细胞释放mrna,然后反转录合成cdna。
(2)在步骤(1)合成的cdna3’端加polya尾,采用含polyt的通用pcr引物合成双链dna。
反应程序为:37℃15min;70℃10min;95℃3min;50℃2min;72℃10min。
(3)取步骤(2)得到的双链dna,使用通用引物进行pcr扩增,得到pcr扩增产物。
反应程序为:95℃3min;95℃30s,67℃1min,72℃6min,20个循环。
(4)用磁珠纯化富集pcr扩增产物,得到ctc单细胞转录组扩增产物。
(5)取部分步骤(4)得到的ctc单细胞转录组扩增产物,使用tn5转座酶构建文库,文库经磁珠纯化后,质控合格做文库pooling上机测序
将文库进行毛细管电泳,检测产物总量及片段大小分布情况。文库产量在200-600ng、片段大小在700-3000bp之间的产物质量合格,适合进行建库测序实验。
实验结果见图5(左图为室温对照ctc,右图为步骤一分离的ctc)。结果表明,与室温对照ctc相比,步骤一分离的ctc构建的文库的质量和产量均显著提高。
4、文库中基因数的检测
取步骤3构建的文库,通过测序检测基因数目。
结果表明,采用步骤一分离的ctc构建的文库检测到的基因数目(9084个)远远多于室温对照ctc(1214个)。
5、芯片是否堵塞的比较
1、按照步骤一中1-4的方法,将步骤1替换为步骤a,其它步骤均不变,得到对照ctc重悬液。
步骤a:取4ml新鲜抽取的人血液,4℃保存4h,得到血液保存液。
2、在4℃条件下,将步骤一中4得到的ctc重悬液或对照ctc重悬液流经采用注射泵精确控制的微流控芯片(流速为20-100ml/h),观察微流控芯片的堵塞情况。
实验结果见图6(左图为对照ctc重悬液,右图为步骤一中4得到的ctc重悬液)。结果表明,对照ctc重悬液会激活血小板凝集,造成芯片堵塞;步骤一中4得到的ctc重悬液则有效避免了血小板凝集,不会造成芯片堵塞。
上述结果表明,步骤一分离的ctc具有如下优点:细胞膜结构完整,血小板污染少,制备的文库的质量好、产量高、检测的基因数目多,不会造成芯片堵塞。由此可见,采用本发明提供的方法分离ctc,具有重要的应用价值。
- 还没有人留言评论。精彩留言会获得点赞!