一种高效制备甘草次酸的重组酶及方法与流程
本发明属于酶工程领域,具体涉及一种高效制备甘草次酸的重组酶及方法。
背景技术:
甘草是我国最常用的中药材之一,具有补脾益气,清热解毒,祛痰止咳等功效。其天然提取物甘草次酸(glycyrrhetinicacid,ga)均具有抗炎、抗菌、抗肿瘤等药理作用,广泛用于保肝护肝、抗癌等领域,同时也被广泛的应用于食品、药品和化妆品等领域。
甘草次酸是由甘草酸(glycyrrhizin,gl)水解两个葡萄糖醛酸基得到的产物,属于五环三萜类化合物。甘草次酸作为一种重要的天然产物,目前合成的主要手段为化学合成法和酶催化法。针对化学合成法存在的环境污染、反应工艺复杂等问题,酶催化具有专一性强、副反应小、反应条件温和等优点,因此已被广泛应用于前体药物的结构修饰等方面。
目前常用于催化甘草酸得到甘草次酸的酶为:β-葡萄糖醛酸苷酶。然而经研究发现,自然界现有β-葡萄糖醛酸苷酶普遍存在含量少、稳定性差、底物特异性不高、催化能力低等问题,远不能满足生产需求。
自上世纪50年代起,国外就有学者对来源于动物体和大肠杆菌的β-葡萄糖醛酸苷酶做了研究,之后各国学者在葡萄球菌、乳酸菌、瘤胃球菌等细菌,青霉菌、曲霉菌、酵母菌等真菌,黄芪、拟南芥、烟草、水稻、玉米等高等植物中检测出该酶的活性。国内外学者有关β-葡萄糖醛酸苷酶的研究主要集中在肠杆菌科和哺乳动物中。可见,野生的β-葡萄糖醛酸苷酶广泛存在于动植物及微生物中,可通过常规技术手段获得各类生物体中的野生β-葡萄糖醛酸苷酶,并且不同类型的生物体中分离得到的野生β-葡萄糖醛酸苷酶的表达量、底物识别能力、催化活性、稳定性、产物得率都各自存在优势和缺陷。
例如,来源于米曲霉的β-葡萄糖醛酸苷酶pgus在底物识别方面不专一且底物浓度对酶活性影响较大,比酶活不高。而来源于土曲霉的β-葡萄糖醛酸苷酶atgus的热稳定性非常差,很难用于大规模发酵生产,同时其表达情况不好。来源于焦曲霉的两种β-葡萄糖醛酸苷酶:augusⅰ和augusⅱ虽然均可水解gl生成ga,但是其活性较差且难于异源表达。除此之外,还有来源嗜松蓝状菌的tpgus,还有来源于大肠杆菌的egus,和人的hgus等很多种酶。
本领域公知:选取任意两种各自优缺点互补的酶进行重组来获得兼顾二者优点的重组酶,概率是很低的,本领域已报道的成功的重组酶并不多,而通过重组获得比原始野生酶具有显著优势的重组酶的例子几乎没有。
尽管本领域人工制备重组酶的技术手段已非常成熟,但要从几乎无数种不同来源的β-葡萄糖醛酸苷酶中选择野生酶做为改造对象并成功获得可高效制备甘草次酸且适用于甘草次酸大规模工业生产的重组酶并非易事。
因此,本领域亟需开发一种底物识别能力强、催化活性好、稳定性好、产物得率高的新型重组酶,用于高效制备甘草次酸及甘草次酸大规模工业生产。
技术实现要素:
本发明基于本领域客观存在的上述疑难和需求,开发得到一种比原始野生酶表达量、稳定性、催化效率高出数倍、且底物转化率和目标产物得率均十分突出的重组酶,可用于工业上大规模生产甘草次酸。
本发明的技术方案如下:
一种高效制备甘草次酸的重组酶,其特征在于,包括来源于土曲霉的β-葡萄糖醛酸苷酶atgus的tim桶结构域、及来源于米曲霉的β-葡萄糖醛酸苷酶pgus的糖基结构域sbd和免疫球蛋白状β-三明治结构域imd。
所述pgus的糖基结构域sbd、免疫球蛋白状β-三明治结构域imd,与atgus的tim桶结构域按下述顺序连接组合:pgus的糖基结构域sbd—pgus的免疫球蛋白状β-三明治结构域imd—atgus的tim桶结构域。
所述重组酶为atgus-mix,其具备如seqidno.1所示的氨基酸序列;所述atgus-mix的基因具备如seqidno.2所示的核苷酸序列。
一种高效制备甘草次酸的重组载体,其特征在于,包括所述的重组酶的基因序列;
所述重组载体为表达载体上连接有如seqidno.2所示的核苷酸序列;
优选地,所述表达载体选自原核表达载体或真核表达载体;优选地,所述表达载体为真核表达载体;更优选地,所述表达载体选自:pet28a载体、pgapzα载体。
一种高效制备甘草次酸的转化体,其特征在于,其宿主细胞内包括:所述的重组酶的基因序列;和/或,所述的重组载体。
所述宿主细胞选自:大肠杆菌dh5α、或,top10、或,bl21(de3)、或,毕赤酵母gs115;
一株高效制备甘草次酸的工程菌ga108/pgapzαa-atgusmix,其保藏号为cgmccno.16731。
所述工程菌ga108/pgapzαa-atgusmix,包含重组酶atgus-mix基因序列的毕赤酵母工程菌,所述重组酶atgus-mix基因序列如seqidno.2所示。
所述工程菌ga108/pgapzαa-atgusmix为转化有连接了重组酶atgus-mix基因序列的重组载体的毕赤酵母工程菌;
更优选地,所述重组载体为连接了重组酶atgus-mix基因序列的重组后的pgapzα载体。
一种高效制备甘草次酸的重组酶的制备方法,其特征在于,包括:将atgus的tim桶结构域组装于pgus的结构底盘上;所述结构底盘包括pgus的糖基结构域sbd和免疫球蛋白状β-三明治结构域imd。
所述重组酶的制备方法还包括:将pgus的糖基结构域sbd和免疫球蛋白状β-三明治结构域imd、以及atgus的tim桶结构域按下述结构顺序进行依次有序组装:pgus的糖基结构域sbd—pgus的免疫球蛋白状β-三明治结构域imd—atgus的tim桶结构域。
所述重组酶的制备方法还包括:将如seqidno.2所示的基因序列与表达载体连接得到重组载体;
优选地,所述制备方法进一步包括:将所述重组载体转化至宿主细胞获得转化体;
更优选地,所述制备方法进一步包括:扩繁所述转化体,表达所述重组酶;
进一步优选地,所述制备方法还包括:对所述重组酶进行纯化。
一种高效制备甘草次酸的酶制剂,其特征在于,包括所述的重组酶。
所述酶制剂还包括辅料;所述辅料为酶制剂常用辅料
优选地,所述辅料选自:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂。
一种高效制备甘草次酸的方法,其特征在于,包括:采用所述的重组酶,和/或,所述的转化体,和/或,所述的工程菌ga108/pgapzαa-atgusmix,和/或,所述的酶制剂对底物进行催化反应。
所述催化反应条件为:底物的初始浓度为2-8g/l,发酵ph为4.0-5.0。
所述底物为甘草酸。
一种工业化生产甘草次酸的方法,其特征在于,包括:采用工程菌ga108/pgapzαa-atgusmix对底物进行催化反应;
所述工程菌ga108/pgapzαa-atgusmix为转化有连接了重组酶atgus-mix基因序列的重组载体的毕赤酵母工程菌;
所述重组酶atgus-mix基因序列如seqidno.2所示。
所述催化反应条件为底物的初始浓度为2-8g/l,发酵ph为4.0-5.0。
所述发酵的周期为24-156h,发酵过程中补料0-6次。
本发明意外发现将来源于土曲霉的β-葡萄糖醛酸苷酶atgus的tim桶结构域替换到来源于米曲霉的β-葡萄糖醛酸苷酶pgus上,可得到一株性状优良的重组酶atgus-mix。atgus-mix在60℃下的热稳定性比atgus高550%,且atgus-mix的比酶活比atgus和pgus分别高2和6.9倍。在此基础上,建立了批式补料转化gl生成ga的反应工艺,在8h内,补料5次,重组酶atgus-mix的底物转化率达到95.06%,ga的收率达到98.82%。gl补料量为19.45mm,是pgus的4倍、atgus的2倍;ga终浓度为19.22mm,是pgus的5.7倍、atgus的2.6倍。
为便于后期发酵生产甘草次酸,本发明将重组atgus-mix基因整合到毕赤酵母中,经筛选获得一株性能优良、可用于工业生产ga且ga得率高的工程菌ga108/pgapzαa-atgusmix,并摸索得到一套适用于该工程菌工业化发酵生产ga的方法。利用该工程菌进行分批补料发酵转化gl实验,确定其整个发酵周期为156h,补料4次,消耗甘草酸底物的浓度为11.53mm,ga的最终浓度为13.30mm,ga的得率为94.9%,ga的生产效率为0.085mm/h,此结果为甘草次酸大规模工业化生产奠定基础。
菌种保藏名称:ga108/pgapzαa-atgusmix
保藏号:cgmccno.16731
分类命名:巴斯德毕赤酵母
拉丁名:pichiapastoris
保藏单位:中国微生物菌种保藏管理委员会普通微生物中心
保藏单位地址:北京市朝阳区北辰西路1号院3号
保藏日期:2018年11月9日
附图说明
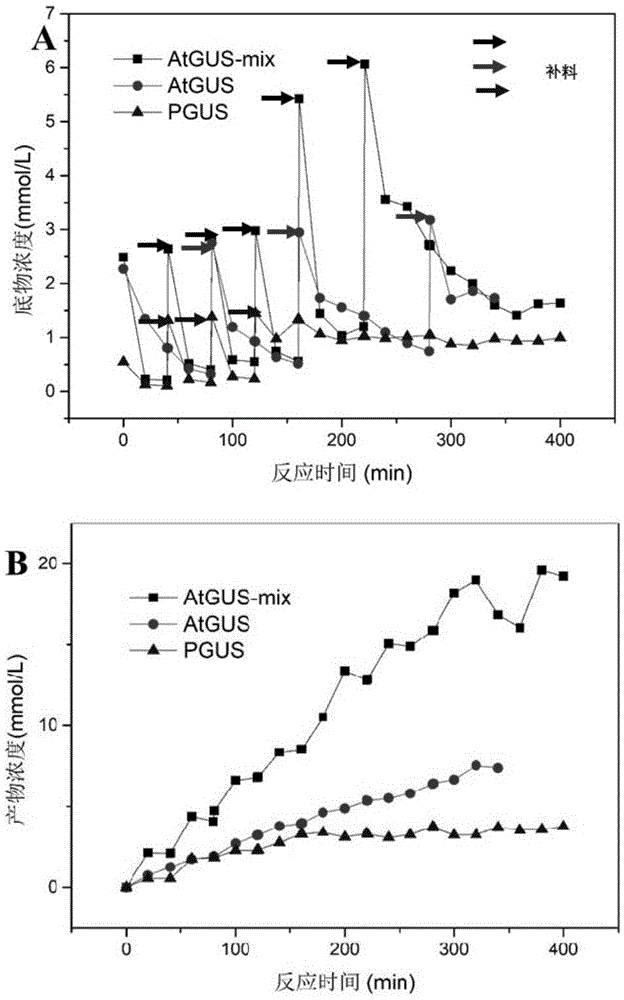
图1的a图示出了突变体atgus-mix在分批补料转化gl生成ga中的底物浓度随反应时间的变化情况,b图为产物浓度随反应时间的变化情况;其中,反应规模100ml,反应温度40℃,ph4.5,pgus补料时间为40min、80min、120min,atgus补料时间为80min、160min、280min,atgus-mix补料时间为40min、80min、120min、160min、220min。
图2示出了pgus、atgus和atgus-mix三种酶的gl转化率、ga得率。
图3的a图为ph对atgus-mix活性的影响,b图为甘草酸初始浓度对atgus-mix活性的影响。
图4示出了本发明工程菌毕赤酵母生长中od随时间变化图。
图5示出了150l发酵罐补料分批发酵的放大生产ga。
图6示出了pgus、atgus和atgus-mix在60℃的热稳定性。
具体实施方式
以下参考具体实施方式对本发明进行说明,需要说明的是,这些实施例仅作为解释和说明,而不能理解为对本发明的限制。
生物材料的来源
(1)大肠杆菌:dh5α,top10,bl21(de3)。
(2)毕赤酵母(pichiapastoris)gs115。
(3)土曲霉(aspergillusterreus),焦曲霉(aspergilusustus),嗜松篮状菌(talaromycespinophilum)。
(4)构建在pet28a载体上来源于土曲霉(aspergillusterreus)的atgus、来源于米曲霉(aspergillusoryzae)的pgus。
上述(1)、(2)、(3)均可商购获得,上述(4)保存于申请人实验室,自本发明申请日期20年内可向公众发放用于验证实验。
试剂与耗材
(1)培养基
lb培养基:0.5%酵母粉,1%蛋白胨,1%氯化钠。lb固体培养基:0.5%酵母粉,1%蛋白胨,1%氯化钠,2%琼脂粉。ypd培养基:1%酵母粉,2%蛋白胨,2%葡萄糖。ypd固体培养基:1%酵母粉,2%蛋白胨,2%葡萄糖,2%琼脂粉。ypd发酵培养基:1%酵母粉,2%蛋白胨,2%葡萄糖,0.5%甘草酸。pda一级培养基:马铃薯200g煮沸后保温20min定容至1l,2%葡萄糖。pda固体培养基:马铃薯200g煮沸后保温20min定容至1l,2%葡萄糖,2%琼脂粉。pda发酵培养基:马铃薯200g煮沸后保温20min定容至1l,0.5%甘草酸。(含葡萄糖的培养基灭菌条件为115℃,15min;不含葡萄糖的培养基灭菌条件为121℃,20min)
(2)常用溶液和缓冲液
毕赤酵母感受态的制备溶液:
1m山梨醇溶液:称取9.109g山梨醇粉末,用蒸馏水定容至50ml,灭菌待用。50%甘油溶液:量取50ml的甘油,用去离子水定容至100ml,121℃,灭菌20min,4℃保存待用。100mg/mliptg:溶解1g的iptg(异丙基硫代-β-d-半乳糖苷)于10ml水中,过滤除菌后分成小份贮存于-20℃。100mg/ml氨苄青霉素(ampicillin):溶解1g氨苄青霉素钠盐于足量的水中,最后定容至10ml。过滤除菌,分装成小份于-20℃贮存。100mg/ml卡那霉素(kanamycin):溶解1g卡那霉素于足量的水中,最后定容至10ml。过滤除菌,分装成小份于-20℃贮存。10%(w/v)sds:称量10g的sds,加入约80ml的去离子水,68℃加热溶解,浓盐酸调节ph值至7.2,定容至100ml后,室温保存。0.5medta(ph8.8):称取186.1gna2edta﹒h2o,加入约800ml的去离子水,充分搅拌,用naoh调节至ph值为8.8后定至1.0l,室温保存。1mtris-hcl(ph6.8):称量121.1gtris溶解于约800ml的去离子水中,用浓盐酸调节至ph为6.8,定容至1l。10%(w/v)过硫酸铵:称量1g过硫酸铵溶解于10ml蒸馏水中,分装成200μl小份后置于-20℃保存。sds-page染色液:称量0.25g考马斯亮蓝r-250,加入100ml甲醇充分溶解,加入25ml醋酸,蒸馏水定容至250ml。sds-page脱色液:量取100ml冰醋酸和50ml乙醇,蒸馏水定容至1l。5×sds-page电泳缓冲液:称量94gtris,15g甘氨酸,5gsds,溶于1l去离子水中,室温保存。蛋白缓冲液:a泵为50mmtris-hcl、150mmnacl:称取4.383g氯化钠,25ml1mtris-hcl(ph7.4)定容至500ml,抽滤,超声待用;b泵为1m咪唑:称取34g咪唑定容至500ml,抽滤,超声待用。20mmtris-hcl、20mmnacl:称取0.5844g氯化钠,10ml1mtris-hcl(ph7.4)定容至500ml,抽滤,超声待用。20mmtris-hcl:10ml1mtris-hcl(ph7.4)定容至500ml,抽滤,超声待用。200mmnacl:称取1.1688g氯化钠溶解在100ml水中。200mmcacl2:称取2.22g氯化钠溶解在100ml水中。7.14m盐酸胍:称取68.21g盐酸胍粉末溶解在100ml水中。
底物缓冲液:1m醋酸-醋酸钠缓冲液:称取无水乙酸钠4.1g溶于水中,用冰醋酸调节ph至4.5后定容至50ml。考马斯亮蓝g-250染液:称取考马斯亮蓝g-250100mg加入95%的乙醇100ml,溶解后加85%磷酸100ml,最后加水定容至1000ml,存于棕色瓶中待用。2g/l甘草酸:称取0.2g甘草酸单铵盐(纯度70%),加50mmph4.5的醋酸-醋酸钠缓冲液定容至100ml,保存待用。
第1组实施例、本发明的重组酶
本组实施例提供一种高效制备甘草次酸的重组酶,其特征在于,包括来源于土曲霉的β-葡萄糖醛酸苷酶atgus的tim桶结构域、及来源于米曲霉的β-葡萄糖醛酸苷酶pgus的糖基结构域sbd和免疫球蛋白状β-三明治结构域imd。
在一些实施例中,所述pgus的糖基结构域sbd、免疫球蛋白状β-三明治结构域imd,与atgus的tim桶结构域按下述顺序连接组合:pgus的糖基结构域sbd—pgus的免疫球蛋白状β-三明治结构域imd—atgus的tim桶结构域。
在具体的实施例中,所述重组酶为atgus-mix,其具备如seqidno.1所示的氨基酸序列;所述atgus-mix的基因具备如seqidno.2所示的核苷酸序列。
第2组实施例、本发明的重组载体
本组实施例提供一种高效制备甘草次酸的重组载体。本组所有的实施例都具备如下共同特征:所述重组载体包括第1组实施例任一所述的重组酶的基因序列。
在进一步的实施例中,所述重组载体为表达载体上连接有如seqidno.2所示的核苷酸序列;
在优选的实施例中,所述表达载体选自原核表达载体或真核表达载体;优选地,所述表达载体为真核表达载体;更优选地,所述表达载体选自:pet28a载体、pgapzα载体。
第3组实施例、本发明的转化体
本组实施例提供一种高效制备甘草次酸的转化体。本组所有的实施例都具备如下共同特征:其宿主细胞内包括:第1组实施例任一所述的重组酶的基因序列;和/或,第2组实施例任一所述的重组载体。
在具体的实施例中,所述宿主细胞选自:大肠杆菌dh5α、或,top10、或,bl21(de3)、或,毕赤酵母gs115。
第4组实施例、本发明的工程菌ga108/pgapzαa-atgusmix
本组实施例提供一株高效制备甘草次酸的工程菌ga108/pgapzαa-atgusmix。本组所有的实施例都具备如下共同特征:所述工程菌ga108/pgapzαa-atgusmix的保藏号为cgmccno.16731。
在一些实施例中,所述工程菌ga108/pgapzαa-atgusmix包含重组酶atgus-mix基因序列的毕赤酵母工程菌,所述重组酶atgus-mix基因序列如seqidno.2所示。
在进一步的实施例中,所述工程菌ga108/pgapzαa-atgusmix为转化有连接了重组酶atgus-mix基因序列的重组载体的毕赤酵母工程菌;
在优选的实施例中,所述重组载体为连接了重组酶atgus-mix基因序列的重组后的pgapzα载体。
第5组实施例、本发明重组酶的制备方法
本组实施例提供一种高效制备甘草次酸的重组酶的制备方法。本组所有的实施例都具备如下共同特征:所述制备方法包括:将atgus的tim桶结构域组装于pgus的结构底盘上。
在一些实施例中,所述制备方法还包括:将pgus的糖基结构域sbd和免疫球蛋白状β-三明治结构域imd、以及atgus的tim桶结构域进行依次有序组装。
在另一些实施例中,所述制备方法还包括:将如seqidno.2所示的基因序列与表达载体连接得到重组载体;
在优选的实施例中,所述制备方法进一步包括:将所述重组载体转化至宿主细胞获得转化体;
在更优选的实施例中,所述制备方法进一步包括:扩繁所述转化体,表达所述重组酶;
在进一步的实施例中,所述制备方法优选还包括:对所述重组酶进行纯化。
第6组实施例、本发明的酶制剂
本组实施例提供一种高效制备甘草次酸的酶制剂。本组所有的实施例都具备如下共同特征:所述酶制剂包括第1组实施例任一所述的重组酶。
在进一步的实施例中,所述酶制剂还包括辅料;所述辅料为酶制剂常用辅料
在优选的实施例中,所述辅料选自:溶剂、抛射剂、增溶剂、助溶剂、乳化剂、着色剂、黏合剂、崩解剂、填充剂、润滑剂、润湿剂、渗透压调节剂、稳定剂、助流剂、矫味剂、防腐剂、助悬剂、包衣材料、芳香剂、抗黏合剂、整合剂、渗透促进剂、ph值调节剂、缓冲剂、增塑剂、表面活性剂、发泡剂、消泡剂、增稠剂、包合剂、保湿剂、吸收剂、稀释剂、絮凝剂与反絮凝剂、助滤剂、释放阻滞剂。
第7组实施例、本发明制备甘草次酸的方法
本组实施例提供一种高效制备甘草次酸的方法。本组所有的实施例都具备如下共同特征:所述方法包括:采用第1组实施例任一所述的重组酶,和/或,第3组实施例任一所述的转化体,和/或,第4组实施例任一所述的工程菌ga108/pgapzαa-atgusmix,和/或,第6组实施例任一所述的酶制剂对底物进行催化反应。
在具体的实施例中,所述催化反应条件为:底物的初始浓度为6g/l,发酵ph为5.0。
在更具体的实施例中,所述底物为甘草酸。
第8组实施例、本发明工业化生产甘草次酸的方法
本组实施例提供一种工业化生产甘草次酸的方法。本组所有的实施例都具备如下共同特征:所述方法包括:采用工程菌ga108/pgapzαa-atgusmix对底物进行催化反应;所述工程菌ga108/pgapzαa-atgusmix的保藏号为cgmccno.16731。
所述工程菌ga108/pgapzαa-atgusmix为转化有连接了重组酶atgus-mix基因序列的重组载体的毕赤酵母工程菌;
所述重组酶atgus-mix基因序列如seqidno.2所示。
在一些实施例中,所述催化反应条件为底物的初始浓度为6g/l,发酵ph为5.0,发酵温度30℃,200rpm培养;
在另一些实施例中,所述发酵的周期为156h,发酵过程中补料4次。
实验例、本发明的具体实验操作
1.菌株的培养
大肠杆菌e.coli的活化与培养:取出-80℃保存的甘油冻存菌液,用接种环蘸取少许菌液划线接种于lb固体培养基,37℃恒温培养16h后,挑取大肠杆菌单菌落于lb液体培养基中,置于200rpm摇床中,37℃培养16h。
毕赤酵母p.pastorisgs115的活化与培养:取出-80℃保存的甘油冻存菌液,用接种环蘸取少许菌液划线接种于ypd固体培养基,30℃培养48h,挑取平板上的单菌落于液体ypd液体培养基中,置于200rpm摇床中,30℃培养72h。
2.质粒的提取、dna片段的回收与重构
(1)质粒的提取
质粒dna的提取采用天根生物技术有限公司的硅胶膜型质粒dna小量提取试剂盒,dna片段的回收采用thermoscientific的genejet凝胶提取试剂盒,利用限制性核酸内切酶同时切割dna片段和载体,再利用dna连接酶连接dna片段和载体。
①20μl体积pcr产物双酶切反应体系如下:
表1.双酶切反应体系
稍加离心,37℃水浴1-2h。
②t4dna连接酶对目的dna片段和载体的连接方案:
表2.连接体系
混匀,12-16℃金属浴16h。
(4)重叠延伸pcr(overlapextensionpcr,oe-pcr):
第一步对需要拼接的dna小片段进行扩增,回收pcr产物,得到纯化的dna片段。
第二步pcr反应体系如下:
表3.重叠延伸pcr反应体系
注:应保证各dna小片段摩尔数相同,加入的各片段总体积3μl。
回收第二步的pcr产物,得到纯化的重组dna片段。
3.β-葡萄糖醛酸苷酶的纯化与浓度检测
(1)β-葡萄糖醛酸苷酶的纯化
①使用lb固体培养基平板活化保存的甘油菌,置于37℃恒温培养箱中培养16h。
②挑取固体平板上的菌落接种在含卡那霉素的lb液体培养基中,放于37℃,200rpm恒温震荡摇床中过夜培养。
③将过夜培养的种子液以1%的比例转接到400ml不加卡那霉素的液体培养基中,待培养至od600=0.6时,加入终浓度0.1m的iptg,将三角瓶转移至16℃,200rpm恒温震荡摇床中培养24h。
④将发酵后的菌体12000rpm,5min离心去上清。
⑤水洗一次菌体。
⑥用50mmtris-hcl、150mmnacl重悬细胞。
⑦使用事先遇冷30min的超高压连续流细胞破碎仪破碎细胞,压力控制在1200bar。
⑧将破碎后的细胞12000rpm、10min离心,去除细胞碎片。
⑨将得到的上清使用0.45μm的水系滤膜过滤待用。
⑩使用histrapff柱,通过蛋白纯化系统按照不同a、b泵比例洗脱得到含有目标β-葡萄糖醛酸苷酶的溶液。
(2)考马斯亮蓝法检测β-葡萄糖醛酸苷酶的浓度
①取纯化得到的β-葡萄糖醛酸苷酶的溶液100μl,加5ml考马斯亮蓝g-250溶液,混匀,室温放置5min。
②使用事先预热20min的分光光度计检测不同样品的吸光值
③通过测得的标准曲线计算出对应的蛋白质浓度。
4.β-葡萄糖醛酸苷酶的酶活力测定
(1)制备得到纯酶。
(2)分别以gl、gamg为底物分别在最适反应条件下,反应10min,通过高效液相色谱检测反应后的样品。
(3)计算酶的比酶活。
酶活:在40℃,ph4.5的条件下,1min转化1μm底物所需要的酶量为一个活力单位(u)。
比酶活:单位质量(mg)的酶所具有酶的活力单位数,单位是u/mg。
5.蛋白质性质的检测
(1)β-葡萄糖醛酸苷酶的热稳定性
①在体系中加入相同量的溶于ph7.4的50mmtris-hcl、150mmnacl缓冲体系中的酶和相同体积的蛋白质缓冲液,共20μl。
②分别在60℃和65℃下保温不同的时间(20min,40min,60min,80min,100min,120min,140min,160min)。
③将保温后的酶加入等浓度的80μl的底物gl,反应相同时间后加入900μl甲醇,2.5μl的2m的naoh,处理样品并通过hplc检测。
6.粗酶液连续补料发酵
(1)使用lb固体培养基平板活化保存的甘油菌,置于37℃恒温培养箱中培养16h。
(2)挑取固体平板上的菌落接种在含卡那霉素的lb液体培养基中,放于37℃,200rpm恒温震荡摇床中过夜培养。
(3)将过夜培养的种子液以1%的比例转接到400ml不加卡那霉素的液体培养基中,待培养至od600=0.6时,加入终浓度0.1m的iptg,将三角瓶转移至16℃,200rpm恒温震荡摇床中培养24h。
(4)将发酵后的菌体12000rpm,5min离心去上清。
(5)水洗一次菌体。
(6)用40ml50mmtris-hcl、150mmnacl重悬atgus和atgus-mix,使用10ml50mmtris-hcl、150mmnacl重悬pgus。
(7)使用超声破碎间歇破碎20min,待用。
(8)配置浓度为2g/l的底物gl,取100ml底物置于控温磁力搅拌器上水浴加热至40℃,加入适量的粗酶液反应。每20min取样一次,hplc检测。连续补料,直至反应基本停止。
7.结构域替换的设计策略及突变体构建
7.1设计策略
考虑使用pcr扩增手段得到几段β-葡萄糖醛酸苷酶片段。设计特定的引物将需要重组的两端dna片段通过重叠延伸pcr或者gibsonassembly的方式连接得到重组酶的片段。在构建的过程中需要考虑重组酶片段两端需要引入新的不影响片段自身完整度的酶切位点,以便于后续将重组酶片段构建在表达质粒上。
表4.pcr基因扩增引物序列
(1)从米曲霉aspergillusoryzae中克隆了β-葡萄糖醛酸苷酶pgus的糖基结构域和三明治结构域基因序列。
采用的引物为上表中的pgus-f(seqidno.3)和pgus-271-r(seqidno.4)
pcr扩增pgus-si基因序列,扩增条件为:95℃,5min,30个循环(95℃30s,62℃30s,72℃1.5min),72℃延伸10min。片段通过琼脂糖凝胶电泳进行纯化和回收。
(2)从土曲霉aspergillusterreus中克隆了β-葡萄糖醛酸苷酶atgus的tim结构域。
采用的引物为上表中的pgus-atgus-271-f(seqidno.5)和atgus-r(seqidno.6)。
pcr扩增atgus—tim基因序列,扩增条件为:95℃,5min,30个循环(95℃30s,60℃30s,72℃1min),72℃延伸10min。片段通过琼脂糖凝胶电泳进行纯化和回收。
(3)将回收的pgus-si和atgus-tim基因序列,通过重叠延伸pcr构建新的杂合β-葡萄糖醛酸苷酶atgus-mix。为了方便克隆,在序列的5’、3’端分别设计了kpni和noti的酶切位点。通过重叠延伸pcr构建新的重组的杂合β-葡萄糖醛酸苷酶atgus-mix,采用的引物为上表中的pgus-f(seqidno.3)和atgus-r(seqidno.6)。
7.2突变体构建
通过上述手段得到重组酶dna片段,进行pcr扩增,对得到的重组片段和pet28a质粒同时进行双酶切37℃、2h,使用柱回收的方式得到酶切后片段,通过t4dna连接酶将酶切后的片段进行16℃低温连接过夜。将得到的重组质粒转化进大肠杆菌dh5α中富集培养,通过菌落pcr验证正确的菌株提取质粒测序,将测序正确的质粒通过化学转化法转化到大肠杆菌bl21(de3)中培养,待培养到合适时间后加入iptg低温诱导表达。将诱导后的菌体离心去上清、浓缩后采用超声破碎细胞的方式得到对应的上清和细胞碎片,将个样品的上清和细胞碎片均跑sds-page验证是否有目标蛋白,并确定目标蛋白是否可溶性表达。
7.3β-葡萄糖醛酸苷酶的比酶活
表5.比酶活
重组酶atgus-mix对于底物gamg的比酶活较两种野生酶pgus和atgus均略有提高,为两种野生酶的1.5倍。而重组酶对底物gl的比酶活有较大提升,为atgus的2.98倍,pgus的7.89倍。由上述结果可知重组酶的比酶活相较两种野生酶均有了很大程度的提高。
7.4粗酶液连续补料发酵
由图1得到以下结果,pgus反应gl初浓度为1.22mm,粗酶液量为400ml菌液浓缩得到,补料3次,每次补料量为0.1g,ga终浓度为3.75mm;atgus反应gl初浓度为2.43mm,粗酶液量为100ml菌液浓缩得到,补料3次,每次补料量为0.2g,ga终浓度为7.52mm;atgus-mix反应gl初浓度为2.43mm,粗酶液量为100ml菌液浓缩得到,补料5次,第4、5次补料量为0.4g,其余每次补料量为0.2g,ga终浓度为19.22mm。根据以上数据可知atgus-mix补料次数是pgus和atgus的1.5倍,催化底物量是pgus的4倍、是atgus的2倍;atgus-mix的产物ga浓度是pgus的5.7倍、是atgus的2.6倍。通过补料浓度、次数以及产物终浓度可知,重组酶atgus-mix对于底物gl的耐受性要高于两株野生酶,其催化活性要远高于pgus和atgus,同时产物ga对其影响也要小于两株出发酶。
本文中的“补料”具有本领域技术人员通常理解的含义,本发明的“补料”也可指:当反应进行到一段时间,底物快消耗完的时候,在反应体系中再加入底物进行转化,目的是为了提高酶的利用效率,提高一次反应的生产力,酶的活力越强,补料次数越多,代表能转化的甘草酸越多。
计算ga转化率和得率可知,如图2所示,pgus的gl转化率为79.56%、ga得率为87.83%,atgus的gl转化率为82.17%、ga得率为92.16%,atgus-mix的gl转化率为95.06%,较pgus提高19.5%,较atgus提高15.7%;ga得率为98.82%,较pgus和atgus均有提高。实验所用atgus-mix量也更少,相对成本也要低于两株野生酶。综合考虑时间成本、经济成本、gl转化率等atgus-mix的应用前景要优于pgus和atgus。
计算60℃半衰期得到数据,atgus的半衰期为20min,atgus-mix的半衰期为130min是atgus的6.5倍,而pgus在保温150min后还保留约80%的活性。从结果图6中可以看出atgus-mix的热稳定性趋势更趋向于pgus,这与最适温度更趋向于atgus结果不同,说明在以pgus作为底盘整合atgus的tim结构域过程中重组酶atgus-mix确实继承了两个酶的部分优点。以上结果表明重组酶atgus-mix的热稳定性要明显优于atgus,这使其在拥有更高活性的同时更加持久的发挥作用,为后续产业化应用提供优势。
测定比酶活后发现atgus-mix对于底物gamg的比酶活较两种野生酶pgus和atgus有显著提高,对底物gl的比酶活为atgus的2.98倍,为pgus的7.89倍;结合比酶活结果分析可知重组酶atgus-mix的活性较两种野生酶有很大程度的提高。粗酶液进行连续补料催化反应发现,重组酶atgus-mix对于底物gl浓度的耐受性要高于两株野生酶,且其催化活性要远高于pgus和atgus。重组酶atgus-mix补料6次,gl转化率达到95.06%,ga的收率达到98.82%。gl补料量为1.6g,是pgus的4倍、atgus的2倍;ga终浓度为19.22mm,是pgus的5.7倍、atgus的2.6倍。
7.5重组酶的应用
7.5.1重组酶毕赤酵母表达载体的构建
原核表达系统通常无法对表达时间及表达水平进行调控,有些基因的持续表达可能会对宿主细胞产生毒害作用,过量表达可能导致非生理反应,目的蛋白常以包涵体形式表达,导致产物纯化困难;而且原核表达系统翻译后加工修饰体系不完善,表达产物的生物活性较低。相对与原核表达系统,真核表达系统能诱导基因高效表达,严格调控基因表达同时可对翻译后蛋白进行加工可用于表达多复杂修饰的蛋白。将杂合基因atgus-mix经限制性核酸内切酶kpni和noti双酶切后16℃过夜连接到毕赤酵母表达载体pgapzα上,热击转化至e.coli感受态细胞,筛选阳性克隆并测序,将测序成功的pgapzα表达载体通过avrii酶进行线性化后电击转入毕赤酵母gs115表达宿主中,利用博来霉素进行抗性筛选。
具体操作为:用限制性内切酶kpni和noti对实施例2合成的基因atgus-mix进行双酶切后,将其与相同酶切的载体pgapzαa进行连接,连接产物转化大肠杆菌top10感受态细胞,在含有25μg/l的博来霉素抗性平板上筛选阳性克隆,提取质粒并测序,测序成功命名为pgapzαa-atgus-mix。将测序成功的pgapzαa-atgus-mix表达载体通过avrii酶进行线性化,后电击转入毕赤酵母gs115表达宿主中,在含有100μg/l的博来霉素抗性的ypd平板上筛选。
添加底物甘草酸培养筛选后发现,仅有ga108/pgapzαa-atgusmix的表达量和酶活均较好。后期需要进一步对其发酵条件进行优化。
7.5.2发酵条件优化
活化ga108/pgapzαa-atgusmix,将种子液按2%的接种量接种到含不同浓度甘草酸(2g/l、4g/l、6g/l、8g/l和10g/l)的液体ypd培养基中,结果显示,当gl浓度低于6g/l时,ga的产量随着甘草酸底物浓度的升高而升高;超过6g/l时,ga的产量随着浓度的增加而降低。分析原因发现,甘草酸本身溶解性较差,高浓度的甘草酸会形成胶体从而增加培养基的粘度影响溶解氧及营养成分的吸收;同时甘草酸本身具有一定的抑菌作用,抑制菌体的生长和酶的表达。所以综合分析确定最适底物浓度为6g/l。
ph在生物转化过程中发挥着重要的作用,ph改变会影响底物的状态,进而影响底物与酶的结合以及酶的带电性、反应活性位点的极性以及酶的活性和选择性等。在不同ph条件下,使用摇瓶发酵初步探究不同初始培养基ph对于酶活力的影响。实验通过测定产物甘草次酸的生成量发现在ph5.0以下,atgus-mix的活性随着反应的ph升高而增强。ph高于5.0时,ga的产量随着ph的升高逐渐下降,由于ga的产量与atgus-mix的酶活成正相关,最终确定发酵最适ph为5.0。
如图3所示,根据上述实验确定最终发酵控制初始底物浓度为6g/l,发酵ph为5.0;或者最适反应温度均为40℃,最适反应ph均为4.5。
批次发酵:
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在1l的摇瓶中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物2g/l,发酵时间24h,ga的最终浓度为1.07g/l,ga的得率为93.6%。
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在1l的摇瓶中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物4g/l,发酵时间24h,ga的最终浓度为2.15g/l,ga的得率为93.9%。
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在1l的摇瓶中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物6g/l,发酵时间24h,ga的最终浓度为3.13g/l,ga的得率为91.2%。
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在1l的摇瓶中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物8g/l,发酵时间24h,ga的最终浓度为4.11g/l,ga的得率为89.6%。
补料发酵:
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在5l的发酵罐中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物6g/l,发酵时间96h,每次补料甘草酸18g,补料4次,ga的最终浓度为16.3g/l,ga的得率为95%。
本发明将重组atgus-mix基因整合到毕赤酵母中,利用该工程菌进行分批补料发酵转化gl实验,在10l的发酵罐中,200rpm,反应温度30℃,反应ph值4.0-5.5,初始甘草酸底物6g/l,发酵时间120h,每次补料甘草酸54g,补料4次,ga的最终浓度为16.1g/l,ga的得率为93.3%。
本发明将重组酶整合到毕赤酵母基因组后对其进行分批补料发酵实验发现其整个发酵周期为156h,补料4次,消耗甘草酸底物的量为328.31mm,ga的最终浓度为13.30mm,ga的得率为94.9%,ga的生产效率为0.085mm/h。
本发明将重组酶整合到毕赤酵母基因组后对其进行分批补料发酵实验发现其整个发酵周期为156h,补料6次,消耗甘草酸底物的量为328.31mm,ga的最终浓度为13.30mm,ga的收率达到98.82%。
本发明工业生产ga的工艺条件和工艺效果还可参考下表6:
表6
关于工艺条件中的转速和发酵反应温度等参数,不一定采用200rpm和30℃,本领域技术人员可基于本发明的内容,出于提高ga得率的目的,在合理范围内对它们做出适应性调整和常规选择。
7.5.3甘草次酸的发酵放大
以前期摸索得到的最适发酵条件为基础,使用150l发酵罐进行中试放大实验。将平板保存的gs115-atgus-mix菌株接种在液体ypd培养基中,30℃,200rpm活化24h。按照10%接种量转接到装有1.5l二级培养基的5l摇瓶中,30℃,200rpm培养24h,将二级种子液转移到装有9l液体ypd培养基的15l发酵罐中,初始甘草酸底物浓度为6g/l,ph设定为5.0,发酵温度30℃,200rpm培养。发酵过程中实时检测菌体od情况如图4所示。
采用本发明的工程菌株ga108/pgapzαa-atgusmix进行工业发酵,生产工艺与产物得率随发酵规模的不同变化不大,本发明用3l、5l、10l发酵罐都测试过,工艺没有大的变化,产物得率都能保持在很高水平(90%以上)。因此任何人基于本发明的工程菌株对ga进行工业生产时,根据不同的生产规模,对发酵罐大小、对发酵规模做常规调整和选择均落入本发明的保护范围。
发酵过程中实时监测底物消耗量和产物的生成量,底物gl和产物ga的变化趋势如图5所示。整个发酵周期为156h,补料4次,消耗甘草酸浓度为11.53mm,ga的最终浓度为10.94mm,ga的得率为94.9%,ga的生产效率为0.085mm/h。
sequencelisting
<110>北京理工大学
<120>一种高效制备甘草次酸的重组酶及方法
<130>p180709/blg
<160>6
<170>patentinversion3.5
<210>1
<211>590
<212>prt
<213>artificialsequence
<220>
<223>atgus-mix氨基酸序列
<400>1
metleulysproglnglnthrthrthrargaspleuileserleuasp
151015
glyleutrplysphealaleualaseraspaspasnasnthrglnpro
202530
trpthrserglnleulysthrserleuglucysprovalproalaser
354045
tyrasnaspilephealaaspserlysilehisasphisvalglytrp
505560
valtyrtyrglnargaspvalilevalprolysglytrpsergluglu
65707580
argtyrleuvalargcysglualaalathrhishisglyargiletyr
859095
valasnglyasnleuvalalaasphisvalglyglytyrthrprophe
100105110
glualaaspilethraspleuvalalaalaglygluglnpheargleu
115120125
thrilealavalaspasngluleuthrtyrglnthrileproprogly
130135140
lysvalgluileleuglualathrglylyslysvalglnthrtyrgln
145150155160
hisaspphetyrasntyralaglyleualaargservaltrpleutyr
165170175
servalproglnglnhisileglnaspilethrvalargthraspval
180185190
glnglythrthrglyleuileasptyrasnvalvalalaserthrthr
195200205
glnglythrileglnvalalavalileaspgluaspglythrthrval
210215220
alathrserserglyserasnglythrilehisileproservalhis
225230235240
leutrpglnproglyalaalatyrleutyrglnleuhisalaserile
245250255
ileaspserserlyslysthrileaspthrtyrlysleualathrgly
260265270
ileargthrvallysvalserglyasnargpheleuileasnasplys
275280285
prophetyrphethrglypheglylyshisgluaspseralavalarg
290295300
glylysglytyraspproalatyrmetvalhisasppheglnleumet
305310315320
asptrpmetglyalaasnserpheargthrserhistyrprotyrala
325330335
glugluvalmetgluphealaasparghisglyilevalvalileasp
340345350
gluthrproalavalglyleualapheserileglyserglyvalser
355360365
sergluaspserproglnthrphethrprogluglyileasnasnasn
370375380
thrargglualahislysglnalailearggluleuilealaargasp
385390395400
lysasnhisalaservalvalmettrpserilealaasngluproala
405410415
serglngluvalglyalaargglutyrphealaproleuvalaspleu
420425430
alahisgluleuaspproserargprovalcysphealaasntyrgly
435440445
aspalathrtyrgluvalaspargileseraspmetpheaspvalleu
450455460
cysleuasnargtyrpheglytrptyrserglnthrglygluvalglu
465470475480
glualaglualaalaleuglulysgluleuleuglytrpgluglylys
485490495
tyrglylysproilevalilethrglutyrglyalaaspthrmetala
500505510
glyleuhisservalleualaleuprotrpsergluglupheglnval
515520525
glnleuleuaspmettyrhisargvalpheaspargileaspserval
530535540
valglygluhisvaltrpasnphealaasppheglnthralavalgly
545550555560
ileileargvalaspglyasnlyslysglyvalphethrarggluarg
565570575
lysprolysalaalaalahisthrleulysthrargtrpser
580585590
<210>2
<211>1770
<212>dna
<213>artificialsequence
<220>
<223>atgus-mix的基因序列
<400>2
atgctcaaaccgcagcaaactactacccgagacctcatctcgctcgacgggctatggaaa60
tttgccctagcatccgacgacaacaatacgcaaccatggacaagccaactaaaaacgtcc120
ctggaatgcccggtcccagcatcctacaatgacatattcgcagacagtaagatccacgat180
cacgtcggatgggtgtactaccagcgcgacgtgattgtgccaaagggctggtccgaagaa240
cggtatcttgtgcgctgtgaagccgcaacacaccatggccggatctacgtcaatggaaat300
ctggtcgcggaccatgtgggcggttacacgccgtttgaggcagatattaccgatctggtt360
gctgccggagaacaattccgcctgaccattgcggttgacaatgaactcacgtatcagacg420
atcccacctggaaaggtggagattctcgaggcgacgggcaagaaggtgcagacttatcag480
catgatttttacaattatgctgggctggctcggtcggtgtggctgtattctgtgccacag540
cagcacattcaggatatcactgttcggacggatgtgcagggcaccaccgggctgattgac600
tacaatgttgtggccagtacgacacaaggaaccattcaggttgccgtgatagatgaggat660
ggcacaaccgtagcgacaagctcaggatcgaacgggactatccatataccatccgttcac720
ctttggcaacctggcgccgcgtatctgtaccaactccatgccagcatcatagactcttcc780
aaaaagactattgatacatataagctagcaacgggcatccggacggtcaaagtaagtggg840
aacaggttcctcataaacgacaagccattttacttcactggctttgggaagcacgaggac900
agtgctgtgcgcggaaaaggctacgacccagcatacatggttcacgatttccagctgatg960
gattggatgggagccaactcgttccgcacctcccactacccctacgctgaagaggtcatg1020
gaatttgcggaccggcacggaatcgtcgtcattgacgagacgcccgccgtcggcctggca1080
ttctccattgggtctggagtttccagcgaagacagtccgcagactttcaccccggaaggg1140
atcaacaataacacccgcgaagctcacaagcaggcgatccgggagctcattgctcgggat1200
aagaatcacgccagcgtcgtcatgtggtcgattgcgaatgagcctgcgtcgcaggaggtg1260
ggagcccgtgagtatttcgcgccgctggttgacctggcccacgagctcgacccaagtcgc1320
cctgtttgttttgcaaattatggagacgccacgtatgaggtggatcggatctcggatatg1380
tttgatgtcctctgcctcaaccgctatttcgggtggtattcccaaaccggggaggttgag1440
gaggccgaggcggctctcgaaaaggaactattgggctgggaagggaaatacggcaaacct1500
atcgtcataacagaatacggagctgacaccatggccggcctccattctgtgcttgctctt1560
ccatggagtgaggaattccaggtccaactactcgatatgtatcatcgggtgtttgaccgc1620
attgactcagtggtaggagagcacgtctggaactttgctgatttccagacggctgtaggg1680
attattagggtggatggaaacaagaagggtgtctttaccagggaaaggaaaccaaaggct1740
gcagctcatacattgaaaacacggtggagt1770
<210>3
<211>43
<212>dna
<213>artificialsequence
<220>
<223>pgus-f
<400>3
ccggaattcggtaccatgctcaaaccgcagcaaactactaccc43
<210>4
<211>33
<212>dna
<213>artificialsequence
<220>
<223>pgus-271-r
<400>4
tactttgaccgtccggatgcccgttgctagctt33
<210>5
<211>55
<212>dna
<213>artificialsequence
<220>
<223>pgus-atgus-271-f
<400>5
gcatccggacggtcaaagtaagtgggaacaggttcctcataaacgacaagccatt55
<210>6
<211>41
<212>dna
<213>artificialsequence
<220>
<223>atgus-r
<400>6
cccaagcttactccaccgtgttttcaatgtatgagctgcag41
- 还没有人留言评论。精彩留言会获得点赞!