一种含羧烷基罗丹宁结构的1,3-二芳基吡唑类PTP1B抑制剂及其制备和应用的制作方法
本发明涉及一类具有ptp1b抑制活性的含羧烷基罗丹宁结构的1,3-二芳基吡唑类化合物或其药学上可接受的盐,还涉及该抑制剂的制备方法级作为胰岛素增敏剂,在预防、延缓或治疗由ptp1b介导的疾病,特别是ii型糖尿病和肥胖症的药物中的用途。
背景技术:
ii型糖尿病是一种常见的代谢紊乱疾病,其特征是外周对胰岛素产生抵抗作用,在分子水平表现为胰岛素与胰岛素受体结合后信号转导缺失。蛋白酪氨酸的磷酸化水平是细胞内信号转导的重要调节因素,它由蛋白酪氨酸激酶(proteintyrosinekinase,ptk)和蛋白酪氨酸磷酸酶(proteintyrosinephosphatase,ptp)共同调控。近年研究发现,蛋白酪氨酸磷酸酶1b可以专一地水解蛋白质中磷酸化酪氨酸上的磷酸基团,在胰岛素信号转导通路中起着重要的负调控作用。在胰岛素激活的信号传导通路中,胰岛素(insulin)与胰岛素受体(insulinreceptor,ir)。链的结合,使ir自身及胰岛素受体底物(insulinreceptorsubstrate,irs)磷酸化,进而激活磷脂酰激醇3激酶(phosphatidylinositol3kinase,pi3k)通路,促进葡萄糖转运蛋白的转录与翻译并引导葡萄糖转运蛋白从细胞质向细胞膜转移,最终促进细胞对葡萄糖的吸收。在这整个信号转导过程中,ptp1b可以把磷酸化的ir、irs去磷酸化,终止胰岛素激活的信号通路。ptp1b在体内过度表达,还会造成瘦素受体不能对瘦素应答而引起肥胖症。敲除ptp1b基因,或运用反义核苷酸(aso)抑制体内ptp1b蛋白及mrna的表达,不仅可以显著提高受试小鼠对胰岛素的敏感性,而且能明显降低肥胖症的患病几率。从上述研究结果可以看出,ptp1b在胰岛素信号和瘦素信号传导中起负性调节作用,它的过度表达会引起ptp1b催化活性的增高,从而导致胰岛素信号和瘦素信号传导受损,成为ii型糖尿病和肥胖症的致病因素。ptp1b特异性抑制剂极有希望成为有效地治疗由胰岛素抵抗导致的ii型糖尿病和肥胖症的药物。
到目前为止,已经发现了大量的高效、高选择性的小分子抑制剂,很多化合物对ptp1b的抑制活性已经达到了纳摩尔级。然而,令人遗憾的是,这些化合物本身具有较高的负电荷,在生物体内主要以负离子的形式存在,不利于透过细胞膜,导致生物利用度差;有些抑制剂对不同的ptpase的选择性不好,不利于有效作用于特定的ptpase靶点。这些因素限制了它们被开发成为有治疗价值的药物。寻求有效性、特异性和药学性质之间的平衡,是研究和开发小分子ptp1b抑制剂作为口服抗糖尿病药物所面临的巨大挑战。
技术实现要素:
本发明提供的代表性化合物对ptp1b具有较高的亲和力和抑制活性,具备进一步开发为新型ptp1b抑制剂的潜力,因此,本发明的目的在于提供制备该类化合物或其药学上可接受的盐的方法,又一目的在于提供该类化合物或其药学上可接受的盐作为胰岛素增敏剂,在预防、延缓或治疗由ptp1b介导的疾病,特别是ii型糖尿病和肥胖症的药物中的用途。
为了实现上述目的,本发明提供一类具有以下结构式(i)和(ii)所示结构的化合物或其药学上可接受的盐:
其中,r1、r2为c1~c6烷氧基、c1~6直链烷基、c1~6支链烷基、取代的苯基、h、卤素、no2、nh2、oh、sh、cn、coor3、conr3r4、so2r3,r3、r4为h、c1~6直链烷基、c1~6支链烷基、取代的苄氧基;n为1~10。
其中,r1、r2为c1~c6烷氧基、c1~6直链烷基、c1~6支链烷基、取代的苯基、h、卤素、no2、nh2、oh、sh、cn、coor3、conr3r4、so2r3,r3、r4为h、c1~6直链烷基、c1~6支链烷基、取代的苄氧基。
对于本发明的通式(i)和(ii)化合物结构中含有不对称碳,且本发明中的一些化合物可含有一个或多个不对称中心,其包括消旋体或光学活性体;另外,分子结构中存在顺反异构时,其包括顺式、反式或其混合物。虽然通式(i)和(ii)未以立体化学显示,但本发明包括此类光学异构体和非对映体,以及外消旋体和拆分的r或s立体异构体,r、s立体异构体的其他混合物和他们药学上可接受的盐。
本文所用“药学上可接受的盐”包括领域技术人员用已知方法易于制备的任何盐。这些衍生和生成的化合物可对动物和人给药,不具有毒性作用。该化合物可以为具有活性的药物,也可为前体药物。
目标化合物的合成路线如scheme1所示:
scheme1反应试剂和反应条件:(a)各种氨基酸、naoh和cs2的摩尔比为1∶2∶1,溶剂为水,反应温度为25℃,反应时间10~12小时;加入氨基酸等摩尔量的氯乙酸钠,反应3小时;加入16倍量的3mol/lhcl溶液,氮气保护,回流反应12小时;加入饱和nahco3溶液调剂ph值7,减压蒸干,经硅胶柱层析进行纯化得化合物2,收率范围约为30~65%。(b)苯肼溶解于适量无水乙醇,加入等摩尔量的取代苯乙酮,回流反应1~3小时,冷却,洗出固体,过滤,无水乙醇重结晶纯化得化合物4,收率范围约为60~75%。(c)0℃下,将pocl3加入到适量的dmf中,搅拌状态下加入化合物4,化合物4与pocl3的摩尔比为1∶4;升温至55~60℃,氮气保护,反应5小时,冷却至室温,反应液倒入冰水,用饱和碳酸钠溶液调节ph至7,析出固体,过滤,洗涤,干燥,乙酸重结晶的化合物5,收率范围约为60~80%。(d)化合物2和5的摩尔比为1∶1,无水乙醇为溶剂,加入催化量的冰醋酸和哌啶,氮气保护,40~50℃下反应8~12小时,反应结束后经过滤,减压蒸除溶剂,柱层析等进行纯化得化合物6,收率范围约为70~85%。
根据权利要求1、2和3所述的化合物或其药学上可接受的盐作为ptp1b抑制剂,在制备、预防、延缓或治疗由ptp1b介导的疾病,特别是ii型糖尿病和肥胖症的药物中的用途。
下面结合具体实施例对本发明作进一步阐述,但不限制本发明。
附图说明
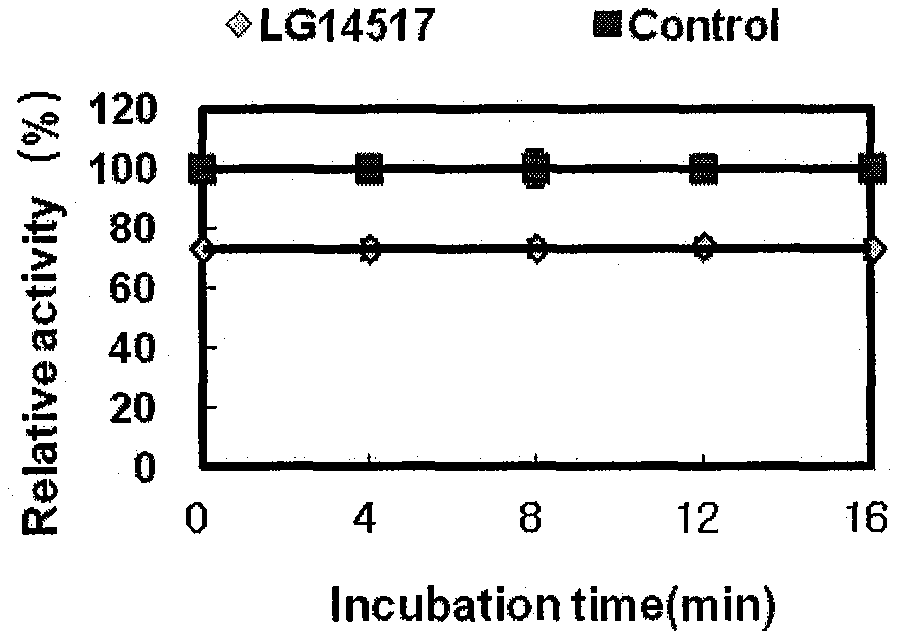
图1是化合物6j的ptp1b抑制效率与时间的关系图。
图2是不同浓度化合物6j对蛋白ptp1b的酶动力学性质影响图。
图3是不同浓度化合物6j酶促反应的初速度和底物浓度的关系图。
图4是化合物6j的抑制浓度与km的关系图。
具体实施方式
实施例化合物合成路线如scheme1所示。
实施例1:(z)-2-(5-((3-(萘-2-基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)乙酸(6a)将甘氨酸(10mmol,0.75g)溶于15ml水中,加入naoh(0.8g,20mmol),缓慢滴加0.6mlcs2(10mmol),室温搅拌10小时。向反应液中分批加入无水氯乙酸钠(0.82g,10mmol),室温继续搅拌3小时。加入6mhcl(30ml),n2保护,搅拌回流16小时,冷却。反应液经乙酸乙酯萃取(3*50ml),合并有机相,无水硫酸镁干燥,过滤,滤液旋干,得黄绿色油状物,粗品经硅胶柱层析(洗脱剂:二氯甲烷∶甲醇=20∶1)得白色固体(2a)1.24g,收率为65%。
将苯肼(0.57g,5.3mmol)溶于20ml无水乙醇,加入2′-萘乙酮(0.9g,5.3mmol),氮气保护,回流反应1小时。反应结束后,冷却,过滤,粗品经无水乙醇重结晶,得黄色固体(4a)1.77g,收率为68%。
取10mldmf,冷却至0℃,搅拌状态下,加入pocl3(21mmol)和化合物4a(1.3g,5mmol),反应液缓慢升温至55~60℃反应5小时,tcl跟踪至反应完全,冷却,倒入冰水中,析出固体,过滤,干燥得黄色固体,粗品经乙酸重结晶得浅黄色固体(5a)1.07g,收率为72%。
取化合物2a(0.19g,1mmol)和5a(0.30g,1mmol)溶于10ml无水乙醇中,加入催化量的冰醋酸和哌啶,氮气保护,加热至50℃反应8小时,tcl跟踪至反应完全,冷却,过滤,减压旋干,干燥得黄色固体,粗品经硅胶柱层析(洗脱剂:二氯甲烷∶甲醇=40∶1)得白色固体(6a)0.34g,收率为72%;m.p.324-326℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.88(s,1h),8.22(s,1h),8.16-7.98(m,5h),7.82(d,j=8.4hz,1h),7.70-7.57(m,5h),7.44(t,j=7.3hz,1h),4.51(s,2h).msm/z472(m+1).calcd.forc25h17n3o3s2:c,63.68;h,3.63;n,8.91;s,13.60.found:c,63.65;h,3.61;n,8.90;s,13.62.
实施例2:(z)-2-(5-((3-(3-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)乙酸(6b)将2′-萘乙酮置换为3-氯苯乙酮,其他同6a,得化合物6b,收率为91%;m.p.313-315℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.84(s,1h),8.06(d,j=8.1hz,2h),7.74(s,1h),7.61-7.53(m,6h),7.43(t,j=7.35hz,1h),4.49(s,2h).13cnmr(dmso-d6,75mhz,ppm):δ245.30,192.60,167.12,166.25,152.27,138.53,133.68,133.15,130.98,129.80,122.63,119.47,115.74,109.53,40.20,38.95.msm/z456(m+1).calcd.forc21h14cln3o3s2:c,55.32;h,3.09;n,9.22;s,14.07.found:c,55.31;h,3.07;n,9.20;s,14.08.
实施例3:(z)-2-(5-((3-(3-溴苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)乙酸(6c)将2′-萘乙酮置换为3-溴苯乙酮,其他同6a,得化合物6c,收率为88%;m.p.315-317℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.83(s,1h),8.07(d,j=7.6hz,2h),7.87(d,j=1.6hz,1h),7.74(m,1h),7.66(d,j=7.9hz,1h),7.54(m,4h),7.43(t,j=7.4hz,1h),4.35(s,2h).msm/z501(m+1).calcd.forc21h14brn3o3s2:c,50.41;h,2.82;n,8.40;s,12.82.found:c,50.39;h,2.80;n,8.38;s,12.81.
实施例4:(z)-2-(5-((3-(4-硝基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)乙酸(6d)将2′-萘乙酮置换为4-硝基苯乙酮,其他同6a,得化合物6d,收率为81%;m.p.321-323℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.88(d,j=1.1hz,1h),8.42-8.40(m,2h),8.12-7.89(m,4h),7.67-7.51(m,3h),7.44(t,j=7.3hz,1h),4.52(s,2h).msm/z467(m+1).calcd.forc21h14n4o5s2:c,54.07;h,3.02;n,12.01;s,13.75.found:c,54.05;h,3.01;n,11.99;s,13.76.
实施例5:(z)-2-(5-((3-(4-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)丙酸(6e)将甘氨酸置换为3-氨基丙酸,2′-萘乙酮置换为4-氯苯乙酮,其他同6a,得化合物6e,收率为87%;m.p.286-288℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.79(s,1h),8.04(d,j=8.0hz,2h),7.60(m,7h),7.42(t,j=7.4hz,1h),4.22-4.14(t,j=6.0hz,2h),2.98-2.87(t,j=6.0hz,2h).msm/z470(m+1).calcd.forc22h16cln3o3s2:c,56.22;h,3.43;n,8.94;s,13.65.found:c,56.20;h,3.41;n,8.92;s,13.66.
实施例6:(z)-2-(5-((3-(2,4-二氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)丙酸(6f)将甘氨酸置换为3-氨基丙酸,2′-萘乙酮置换为2,4-二氯苯乙酮,其他同6a,得化合物6f,收率为89%;m.p.279-281℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.85(d,j=3.9hz,1h),8.04(d,j=8.2hz,2h),7.89(s,1h),7.68-7.52(m,4h),7.43(t,j=7.3hz,1h),7.16(d,j=3.1hz,1h),4.19-4.08(t,j=7.5hz,2h),2.40-2.29(t,j=7.5hz,2h).13cnmr(dmso-d6,75mhz,ppm):δ248.32,192.50,172.89,166.43,150.96,138.53,133.95,129.61,122.09,119.44,116.95,101.71,43.53,39.54.msm/z503(m+1).calcd.forc22h15cl2n3o3s2:c,52.39;h,3.00;n,8.33;s,12.71.found:c,52.37;h,2.97;n,8.32;s,12.72.
实施例7:(z)-2-(5-((3-(4-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)丁酸(6g)将甘氨酸置换为4-氨基丁酸,2′-萘乙酮置换为4-氯苯乙酮,其他同6a,得化合物6g,收率为86%;m.p.258-260℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.82(s,1h),8.06(d,j=7.8hz,2h),7.75-7.63(m,4h),7.56(dd,j=16.1,8.2hz,3h),7.43(t,j=7.4hz,1h),4.06(t,j=6.8hz,2h),2.29(t,j=7.2hz,2h),1.96-1.81(m,2h).13cnmr(dmso-d6,75mhz,ppm):δ228.84,192.96,173.66,166.68,152.56,138.53,134.05,129.96,122.53,119.41,115.67,43.73,39.54.msm/z484(m+1).calcd.forc23h18cln3o3s2:c,57.08;h,3.75;n,8.68;s,13.25.found:c,57.06;h,3.74;n,8.67;s,13.26.
实施例8:(z)-2-(5-((3-(2,4-二氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)丁酸(6h)将甘氨酸置换为4-氨基丁酸,2′-萘乙酮置换为2,4-二氯苯乙酮,其他同6a,得化合物6h,收率为87%;m.p.269-271℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.87(s,1h),8.04(d,j=8.2hz,2h),7.90(d,j=0.7hz,1h),7.68-7.51(m,4h),7.43(t,j=7.3hz,1h),7.16(s,1h),4.02(t,j=7.0hz,2h),2.16(t,j=7.3hz,2h),1.90-1.75(m,2h).msm/z503(m+1).calcd.forc23h17cl2n3o3s2:c,53.28;h,3.31;n,8.11;s,12.37.found:c,53.26;h,3.30;n,8.10;s,12.35.
实施例9:(z)-2-(5-((3-(4-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)戊酸(6i)将甘氨酸置换为5-氨基戊酸,2′-萘乙酮置换为4-氯苯乙酮,其他同6a,得化合物6i,收率为88%;m.p.291-292℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.82(s,1h),8.05(d,j=8.1hz,2h),7.76-7.61(m,4h),7.61-7.48(m,3h),7.44(d,j=6.5hz,1h),4.01(t,j=6.0hz,2h),2.19(t,j=6.6hz,2h),1.51(m,4h).msm/z499(m+1).calcd.forc24h20cln3o3s2:c,57.88;h,4.05;n,8.44;s,12.88.found:c,57.86;h,4.04;n,8.42;s,12.89.
实施例10:(z)-2-(5-((3-(2,4-二氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)戊酸(6j)将甘氨酸置换为5-氨基戊酸,2′-萘乙酮置换为2,4-二氯苯乙酮,其他同6a,得化合物6j,收率为89%;m.p.283-285℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.87(d,j=1.3hz,1h),8.04(d,j=8.1hz,2h),7.90(s,1h),7.63-7.55(m,4h),7.45(d,j=6.3hz,1h),7.17(d,j=1.3hz,1h),3.99(t,j=6.0hz,2h),2.16(t,j=6.5hz,2h),1.61(m,2h),1.49(m,2h).13cnmr(dmso-d6,75mhz,ppm):δ192.72,174.57,166.62,150.99,138.51,133.77,129.60,127.74,122.32,119.43,116.93,56.01,40.37,39.26.msm/z533(m+1).calcd.forc24h19cl2n3o3s2:c,54.14;h,3.60;n,7.89;s,12.04.found:c,54.12;h,3.59;n,7.87;s,12.06.
实施例11:(z)-2-(5-((3-(4-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)己酸(6k)将甘氨酸置换为6-氨基己酸,2′-萘乙酮置换为4-氯苯乙酮,其他同6a,得化合物6k,收率为91%;m.p.278-280℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.80(d,j=3.1hz,1h),8.04(d,j=8.2hz,2h),7.67(m,4h),7.60-7.49(m,3h),7.42(t,j=7.4hz,1h),3.97(t,j=6.8hz,2h),2.16(t,j=7.2hz,2h),1.62(m,2h),1.51(m,2h),1.30(m,2h).msm/z513(m+1).calcd.forc25h22cln3o3s2:c,58.64;h,4.33;n,8.21;s,12.52.found:c,58.61;h,4.32;n,8.23;s,12.53.
实施例12:(z)-2-(5-((3-(2,4-二氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)己酸(6l)将甘氨酸置换为6-氨基己酸,2′-萘乙酮置换为2,4-二氯苯乙酮,其他同6a,得化合物6l,收率为90%;m.p.270-272℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ11.97(s,1h),8.88(s,1h),8.05(d,j=7.6hz,2h),7.91(d,j=0.8hz,1h),7.69-7.51(m,4h),7.44(t,j=7.4hz,1h),7.17(s,1h),3.97(t,j=7.2hz,2h),2.19(t,j=7.3hz,2h),1.60(m,2h),1.49(m,2h),1.29(m,2h).13cnmr(dmso-d6,75mhz,ppm):δ247.63,192.73,174.26,166.60,151.01,138.52,133.77,129.61,127.83,122.35,119.44,116.93,44.12,39.82,33.37.msm/z547(m+1).calcd.forc25h21cl2n3o3s2:c,54.94;h,3.87;n,7.69;s,11.73,found:c,54.93;h,3.85;n,7.66;s,11.75.
实施例13:(s,z)-2-(5-((3-(萘-2-基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6m)将甘氨酸置换为l-苯丙氨酸,其他同6a,得化合物6m,收率为82%;m.p.223-224℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.15(s,1h),8.12(s,1h),8.04-7.88(m,4h),7.81(d,j=7.3hz,3h),7.54(m,4h),7.41(d,j=7.4hz,1h),7.20(m,5h),6.01(s,1h),3.61(d,j=6.6hz,2h).msm/z501(m+1).calcd.forc32h23n3o3s2:c,68.43;h,4.13;n,7.48;s,11.42.found:c,68.42;h,4.12;n,7.46;s,11.43.
实施例14:(s,z)-2-(5-((3-(2-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6n)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为2-氯苯乙酮,其他同6a,得化合物6n,收率为78%;m.p.265-267℃.ir(kbr)cm-1:3419(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.10(s,1h),7.46-7.58(m,5h),7.49-7.37(m,5h),7.33(d,j=6.9hz,1h),7.16(d,j=6.5hz,4h),6.01(s,1h),3.61(d,j=6.5hz,2h).msm/z545(m+1).calcd.forc21h14cln3o3s2:c,61.59;h,3.69;n,7.70;s,11.74.found:c,61.58;h,3.68;n,7.71;s,11.73.
实施例15:(s,z)-2-(5-((3-(4-氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6o)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为4-氯苯乙酮,其他同6a,得化合物6o,收率为85%;m.p.202-204℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.11(s,1h),7.77(d,j=7.5hz,2h),7.65(s,1h),7.60(d,j=8.4hz,2h),7.56-7.48(m,5h),7.41(d,j=7.2hz,1h),7.20(d,j=6.8hz,4h),6.02(s,1h),3.62(d,j=6.5hz,2h).msm/z545(m+1).anal.calcd.forc28h20cln3o3s2:c,61.59;h,3.69;n,7.70;s,11.74.found:c,61.57;h,3.67;n,7.68;s,11/72.
实施例16:(s,z)-2-(5-((3-(2,4-二氯苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6p)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为2,4-二氯苯乙酮,其他同6a,得化合物6p,收率为88%;m.p.212-214℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.11(s,1h),7.76(d,j=7.7hz,2h),7.53(m,3h),7.45-7.36(m,3h),7.30(s,1h),7.19(t,j=8.2hz,6h),5.98(s,1h),3.59(d,j=6.6hz,2h).msm/z579(m+1).calcd.forc28h19cl2n3o3s2:c,57.93;h,3.30;n,7.24;s,11.05.found:c,57.91;h,3.28;n,7.22;s,11.03.
实施例17:(s,z)-2-(5-((3-(3-溴苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6q)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为3-溴苯乙酮,其他同6a,得化合物6q,收率为90%;m.p.199-201℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.12(s,1h),7.87(s,1h),7.77(d,j=8.1hz,2h),7.67-7.59(m,2h),7.53(t,j=7.9hz,3h),7.44-7.38(m,2h),7.23-7.16(m,5h),6.01(s,1h),3.62(d,j=6.5hz,2h).msm/z591(m+1).calcd.forc28h20brn3o3s2:c,56.95;h,3.41;n,7.12;s,10.86.found:c,56.93;h,3.39;n,7.10;s,10.84.
实施例18:(s,z)-2-(5-((3-(4-溴苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6r)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为4-溴苯乙酮,其他同6a,得化合物6r,收率为84%;m.p.207-209℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.11(s,1h),7.77(d,j=7.7hz,2h),7.66(d,j=8.1hz,3h),7.54(d,j=8.3hz,4h),7.41(d,j=7.5hz,1h),7.23-7.15(m,5h),6.01(s,1h),3.62(d,j=6.5hz,2h).13cnmr(dmso-d6,75mhz,ppm):δ190.54,166.03,153.50,138.48,135.26,131.73,130.49,129.94,129.70,128.74,127.55,126.62,119.18,115.94,76.10,29.32.msm/z591(m+1).calcd.forc28h20brn3o3s2:c,56.95;h,3.41;n,7.12;s,10.86.found:c,56.96;h,3.42;n,7.11;s,10.87.
实施例19:(s,z)-2-(5-((3-(4-硝基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6s)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为4-硝基苯乙酮,其他同6a,得化合物6s,收率为81%;m.p.205-207℃.ir(kbr)cm-1:3419(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.38(d,j=8.9hz,2h),8.15(s,1h),7.91-7.84(m,2h),7.78(m,2h),7.64(s,1h),7.54(t,j=7.7hz,2h),7.44(d,j=7.3hz,1h),7.24-7.16(m,5h),6.01(s,1h),3.62(d,j=6.9hz,2h).13cnmr(dmso-d6,75mhz,ppm):δ190.30,172.24,165.99,151.90,147.64,138.32,137.21,135.18,129.38,128.72,128.10,126.67,123.73,122.31,116.28,76.54,30.07.msm/z556(m+1).calcd.forc28h20n4o5s2:c,60.42;h,3.62;n,10.07;s,11.52.found:c,60.41;h,3.63;n,10.05;s,11.53.
实施例20:(s,z)-2-(5-((1,3-二苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6t)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为苯乙酮,其他同6a,得化合物6t,收率为79%;m.p.224-226℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.15(s,1h),7.75-7.50(m,8h),7.44-7.31(m,3h),7.26-6.95(m,5h),6.01(s,1h),3.60(d,j=6.8hz,2h).msm/z511(m+1).calcd.forc28h21n3o3s2:c,65.73;h,4.14;n,8.21;s,s,12.53.found:c,65.72;h,4.12;n,8.20;s,12.52.
实施例21:(s,z)-2-(5-((3-(4-甲基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6u)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为4-甲基苯乙酮,其他同6a,得化合物6u,收率为86%;m.p.218-220℃.ir(kbr)cm-1:3429(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.11(s,1h),7.77(d,j=7.8hz,2h),7.72(s,1h),7.52(m,4h),7.39(d,j=7.4hz,1h),7.32(d,j=7.9hz,2h),7.19(t,j=6.4hz,5h),6.01(s,1h),3.61(d,j=6.4hz,2h),2.44(s,3h).msm/z525(m+1).calcd.forc29h23n3o3s2:c,66.26;h,4.41;n,7.99;s,s,12.20.found:c,66.25;h,4.40;n,7.97;s,12.19.
实施例22:(s,z)-2-(5-((3-(2-甲氧基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6v)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为2-甲氧基苯乙酮,其他同6a,得化合物6v,收率为89%;m.p.209-211℃.ir(kbr)cm-1:3419(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.10(s,1h),7.77-7.59(m,5h),7.47(m,3h),7.34(d,j=6.4hz,1h),7.18(d,j=6.1hz,4h),7.08(d,j=7.8hz,2h),6.02(s,1h),3.81(s,3h),3.61(d,j=6.4hz,2h).msm/z541(m+1).calcd.forc29h23n3o4s2:c,64.31;h,4.28;n,7.76;s,11.84.found:c,64.29;h,4.26;n,7.77;s,11.83.
实施例23:(s,z)-2-(5-((3-(3-甲氧基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6w)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为3-甲氧基苯乙酮,其他同6a,得化合物6w,收率为82%;m.p.227-229℃.ir(kbr)cm-1:3419(oh),1707(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.10(s,1h),7.74(d,j=7.1hz,2h),7.61(m,3h),7.48(m,3h),7.28(m,5h),7.08(d,j=7.7hz,2h),6.02(s,1h),3.86(s,3h),3.61(d,j=6.3hz,2h).msm/z541(m+1).calcd.forc29h23n3o4s2:c,64.31;h,4.28;n,7.76;s,11.84.found:c,64.29;h,4.26;n,7.77;s,11.83.
实施例24:(s,z)-2-(5-((3-(4-甲氧基苯基)-1-苯基-1h-吡唑-4-基)亚甲基)-2-硫代-4-噻唑烷酮-3-基)-3-苯基丙酸(6x)将甘氨酸置换为l-苯丙氨酸,2′-萘乙酮置换为4-甲氧基苯乙酮,其他同6a,得化合物6x,收率为80%;m.p.226-228℃.ir(kbr)cm-1:3419(oh),1697(c=o).1hnmr(dmso-d6,300mhz,ppm):δ8.10(s,1h),7.77(d,j=7.9hz,2h),7.71(s,1h),7.59(d,j=8.4hz,2h),7.51(m,3h),7.39(d,j=6.9hz,1h),7.20(d,j=6.4hz,4h),7.04(d,j=8.3hz,2h),6.02(s,1h),3.88(s,3h),3.61(d,j=6.6hz,2h).msm/z541(m+1).calcd.forc29h23n3o4s2:c,64.31;h,4.28;n,7.76;s,11.84.found:c,64.33;h,4.29;n,7.75;s,11.83.
实施例25:利用分子生物学手段在大肠杆菌系统表达人源蛋白质酪氨酸磷酸酯酶1b(hpptp1b)催化结构域,经纯化后的hpptp1b重组蛋白能水解底物对硝基苯磷酸二钠(pnpp)的磷脂键,得到的产物对硝基苯酚(pnp)在405nm处有很强的光吸收,因此可以通过直接检测405nm处光吸收的变化以观察酶的活性变化以及化合物对酶活性的抑制情况。ptp1b筛选体系为:30nmgst-ptp1b,2mmpnpp,50mmmopsph6.5,2mmdtt,1mmedta,2%dms。
以pnpp为底物,na3vo4和齐墩果酸为(oleanolicacid,oa)为阳性对照药物,以相对活性对化合物浓度作图,经公式v/v0=100/(1+b*[i]/ic50)拟合,得出ic50值。化合物6a-x抑制ptp1b的抑制活性(ic50,μm)如表一所示。
表一:
athepnppassay.ic50valuesweredeterminedbyregressionanalysesandexpressedasmeans±sdofthreereplications.
bpositivecontrol.
实施例26:选择部分该类化合物对其他相关ptp酶选择性评价,抑制活性(ic50,μm)结果如表二所示。
表二:
athepnppassay.ic50valuesweredeterminedbyregressionanalysesandexpressedasmeans±sdofthreereplications.
bnotactiveat20μg/mlconcentration.
cpositivecontrol.
实施例27:选定化合物6j进行酶动力学实验,阐明其抑制剂类型。
实验方法:测定不同底物浓度时,酶促反应的初速度(底物浓度0-80mm)。对测得的反应速度与相应底物浓度进行回归分析,求得km值。计算公式为米氏方程(michaelis-mentenequation):v=vmax*[s]/(km+[s])(公式1),v代表反应初速度,vmax代表最大反应速度,[s]代表底物浓度。此运算可同时得到vmax。
根据公式vmax=kcat*[e](公式2)计算kcat;其中,vmax为最大反应速度,在计算km值时求得;[e]为酶浓度。
实验结论:(1)如图1所示,6j对ptp1b的抑制效率不随时间而改变,说明它属于快结合抑制剂;(2)如图2所示,分别测试不同浓度(0-3.2μm)抑制剂对蛋白ptp1b的酶动力学性质影响,结果表明随着化合物浓度升高,ptp1b的km值相应增大,而vmax不变。因此,初步判断6j为竞争型抑制类型;(3)利用双倒数作图确认抑制剂性质,即在不同抑制浓度条件下,底物浓度倒数(1/[s])对相应反应速度倒数(1/[v])做图。如图3所示,进一步确认6j为竞争型抑制剂;(4)确定了6j是ptp1b竞争型抑制剂,我们利用抑制浓度[i]对km做图,结果如图4所示呈线性相关,拟合直线与x轴交点绝对值为化合物的ki值,经计算ki=0.31μm。
- 还没有人留言评论。精彩留言会获得点赞!