一种从重组毕赤酵母中制备ELABELA多肽的方法与流程
本发明属于多肽制备
技术领域:
,具体涉及一种从重组毕赤酵母中制备elabela多肽的方法。
背景技术:
:利用重组细胞表达外源基因是分子生物学研究和生物医药开发中常用的技术。被用来作为表达宿主的细胞包括细菌、真菌(酵母和丝状真菌)、昆虫细胞和哺乳动物细胞。其中酵母是最简单的真核生物细胞,其作为表达宿主具有一系列优点,被用作重组乙肝疫苗或重组人血浆白蛋白等一系列蛋白质的生产。目前常用来进行基因工程构建的酵母,包括酿酒酵母和毕赤酵母。其中毕赤酵母被广泛用来表达外源蛋白。一系列表达载体被用于构建基因重组的毕赤酵母,包括ppic9k、pgapzαa等。elabela是一种新近发现的由32个氨基酸组成的人体多肽激素,与apelin13受体相结合,由孕期胚胎滋养细胞表达,研究表明elabela多肽与胚胎心血管发育密切相关,elabela的缺乏与孕妇先兆子痫病症之间存在密切关系。目前elabela的制备方法主要是化学合成法。化学合成法采用多种有毒有害试剂,如二甲基甲酰胺(dmf)和二氯甲烷,对操作者和环境均不友好,操作过程需要佩戴防护面具,保持通风,同时废弃物需要做无害化处理。因此需要开发一种不使用二甲基甲酰胺(dmf)和二氯甲烷等多种有毒有害试剂的生物法。技术实现要素:本发明提供了一种从重组毕赤酵母中制备elabela多肽的方法,是在生物体内制备的纯天然状态多肽,无需化学合成法中采用的二甲基甲酰胺(dmf)和二氯甲烷等多种有毒有害试剂。本发明的第一个目的是提供一种从重组毕赤酵母中制备elabela多肽的方法,合成一段编码elabela多肽的seqidno.1所示dna序列,并将这段dna序列克隆到毕赤酵母表达载体pgaphαa上,得到重组表达载体pgaphαa-elabela;然后将构建好的重组表达载体pgaphαa-elabela转化到毕赤酵母染色体中,构建出能够表达elabela多肽的重组毕赤酵母;利用重组毕赤酵母表达外源的elabela多肽,并将其分泌到酵母培养液上清中,将酵母培养液上清中的elabela多肽提取纯化,得到elabela多肽。优选的,重组表达载体pgaphαa-elabela按照以下步骤构建:合成pcr引物elaf和elar,elaf:5′-gaaaagagaggctgaagct-3′;elar:5′-gtctaaggctaaaactca-3′;以seqidno.1所示dna序列为模板,扩增获得elabela基因pcr扩增产物;合成pcr引物pvf和pvr,pvf:5′-tgagttttagccttagac-3′,pvr:5′-tctcatcgtttcgaata-3′;以毕赤酵母表达载体pgaphαa为模板,扩增获得pgaphαa载体pcr产物;elabela基因pcr扩增产物和pgaphαa载体pcr产物进行重组连接,得到重组表达载体pgaphαa-elabela。优选的,所述毕赤酵母表达载体pgaphαa是在商业化载体pgapzαa基础上改进得到的,采用潮霉素抗性基因替代了原始pgapzαa上的zeocin抗性基因。优选的,能够表达elabela多肽的重组毕赤酵母按照以下步骤构建:合成pcr引物linegap1和linegap2,linegap1:5′-gttgcgggtaaaacggag-3′;linegap2:5′-atgctgggaagagcat-3′,设置pcr程序,以重组表达载体pgaphαa-elabela为模板,扩增获得线性化的pgaphαa-elabela;将线性化pgaphαa-elabela电转化入毕赤酵母细胞悬液中,得到转化有pgaphαa-elabeladna的重组毕赤酵母细胞。优选的,所述毕赤酵母细胞为毕赤酵母x33。优选的,利用重组毕赤酵母表达外源的elabela多肽,并将其分泌到酵母培养液上清中的步骤如下:将转化了重组表达载体pgaphαa-elabela的毕赤酵母细胞接种于液体ypdh培养基中,在恒温震荡摇床上30℃、200rpm培养24~72小时;将培养物转移到离心管中,离心以获取上清,上清中即有重组毕赤酵母细胞分泌表达的elabela多肽。优选的,离心的条件为1500g离心力4℃离心5分钟。优选的,利用阳离子交换层析方式、阴离子交换层析方式,或者阴/阳组合的离子交换层析方式,在ph9.0~10.0之间对elabela多肽进行纯化。优选的,纯化时采用的层析介质为阳离子交换层析介质captos或者nuviatms,或者阴离子交换层析介质qsepharosehighperformance。根据权利要求8所述的从重组毕赤酵母中制备elabela多肽的方法的制造方法,其特征在于,阳离子交换层析方式如下:将含有elabela多肽的重组毕赤酵母培养液上清调节ph至ph9.0~10.0,得到碱性毕赤酵母培养液上清;阳离子交换层析柱平衡;将碱性毕赤酵母培养液上清上样于平衡好的阳离子交换层析柱中,使碱性毕赤酵母培养液上清在层析柱中保留时间大于等于3分钟;上样完毕后,使用10~50mm、ph9.0~10.0甘氨酸-氢氧化钠溶液冲洗阳离子交换层析柱,充分洗去阳离子交换层析柱上未结合的培养液上清成分;冲洗完毕后,使用洗脱液对层析柱上结合的蛋白质进行洗脱,得到elabela阳离子交换层析洗脱液,即纯化的elabela多肽溶液;所述洗脱液的要求如下:ph9.0~10.0的甘氨酸溶液中加入氯化钠,并使氯化钠的终浓度为0.3~1.0m;甘氨酸-氢氧化钠溶液、洗脱液采用相同的ph。与现有技术相比,本发明提供的一种从重组毕赤酵母中制备elabela多肽的方法至少具有以下有益效果:本发明通过重组毕赤酵母的方法制备elabela多肽的效率较高,每升酵母培养液上清可以获得160mg的elabela多肽。所述从酵母发酵液上清中纯化elabela多肽的层析技术简易高效,普通蛋白质进行离子交换层析时,ph通选择中性及其附近,本发明选用ph较偏碱性的范围,在此特殊ph范围内,可以实现目的多肽的纯化,所述纯化方法未见公开报道。现有技术通常化学合成法制备多肽的过程需要大量运用有毒有害的化学试剂,例如二甲基甲酰胺(dmf)和二氯甲烷,容易对环境和操作人员造成损害,后期无害化处理费用高昂。本发明通过基因重组方式制备多肽,整个过程环保不添加和产生有毒试剂,利于进一步工业化应用推广。另外目前化学合成法尚不能够在蛋白质的氨基酸侧链上进行复杂的糖基化修饰,所合成多肽与生物体内制备的纯天然状态多肽有所区别。本发明在生物体内天然合成,可以对氨基酸侧链上进行复杂的糖基化修饰,是纯天然多肽。附图说明图1是本发明设计的编码elabela多肽的dna序列测序图谱;图2是本发明实施例1所用毕赤酵母表达载体pgaphαa示意图;图3是重组表达载体pgaphαa-elabela构建过程dna电泳检测图谱;其中1号泳道是elabela基因扩增产物,2号泳道是pgaphαa载体pcr产物,3号泳道是dna分子量标准;图4是菌落pcr扩增产物电泳检测图谱;其中1号泳道是dna分子量标准,2~8是号泳道是菌落pcr扩增产物,且2、5泳道为阴性克隆,3、4、6、7、8泳道为阳性克隆;图5是实施例2中提纯elabela多肽过程的sds-page电泳检测图谱;其中1号泳道是蛋白质分子量标准,2号泳道是重组毕赤酵母培养液上清,3号泳道是阳离子交换层析柱纯化过程的流穿组分样品,4号泳道是洗脱液,5号泳道是再生液;图6是实施例3中提纯elabela多肽过程的sds-page电泳检测图谱;其中1号泳道是重组毕赤酵母培养液上清,2号泳道是阳离子交换层析柱纯化过程的流穿组分样品,3号泳道是洗脱液,4号泳道是蛋白质分子量标准;图7是实施例2和实施例4中提纯elabela多肽过程的sds-page电泳检测图谱;其中1号泳道是蛋白质分子量标准,2号泳道是实施例2阳离子交换层析柱纯化过程的流穿组分样品,3号泳道实施例4阴离子交换层析柱纯化过程的流穿组分样品,4号泳道是实施例4洗脱液;图8是实施例3和实施例5中提纯elabela多肽过程的sds-page电泳检测图谱;其中1号泳道是蛋白质分子量标准,2号泳道是实施例5洗脱液,3号泳道是实施例3阳离子交换层析柱纯化过程的流穿组分样品,4号泳道实施例5阴离子交换层析柱纯化过程的流穿组分样品。具体实施方式为了使本领域技术人员更好地理解本发明的技术方案能予以实施,下面结合具体实施例和附图对本发明作进一步说明。下面各实施例以及上述
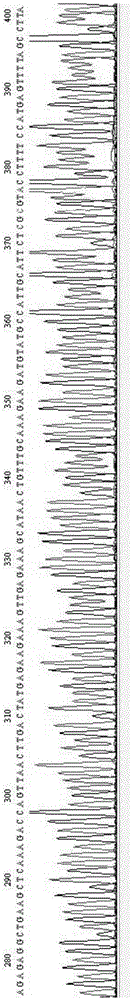
发明内容中未注明具体条件的试验方法,均按照本领域的常规方法和条件进行,所用的材料若无特殊说明均为市售。所述毕赤酵母表达载体pgaphαa是在invitrogen公司商业化载体pgapzαa基础上由发明人改进得到的,采用潮霉素(hygromycin)抗性基因替代了原始质粒上的zeocin抗性基因。潮霉素b抗性基因序列seqidno.9所示,插入位点为商业化载体pgapzαa的ncoⅰ1711与ecorⅴ2151之间。潮霉素(hygromycin)抗性基因的插入操作按照常规方法进行即可。本发明通过合成一段经过密码子优化的编码elabela多肽的seqidno.1所示dna序列,并将这段dna序列克隆到毕赤酵母表达载体pgaphαa上,得到重组表达载体pgaphαa-elabela;然后将构建好的重组表达载体pgaphαa-elabela转化到毕赤酵母染色体中,构建出能够表达elabela多肽的重组毕赤酵母。该重组毕赤酵母能以组成型表达的方式表达外源的elabela多肽,并将其分泌到酵母培养液上清中。在特定条件下通过阳离子交换层析和/或阴离子交换层析实现酵母培养液上清中的elabela多肽的提取纯化,得到elabela多肽备用。具体包括以下实施例。实施例1,dna序列的设计、构建重组毕赤酵母及elabela多肽的表达。步骤1,编码elabela多肽的dna序列的设计与合成通过化学合成的方式,合成seqidno.1所示dna序列。该dna序列考虑毕赤酵母密码子使用偏好性经过了密码子优化,密码子优化过程中结合了毕赤酵母密码子使用频率、目的多肽(elabela多肽)中各密码子出现频率及间隔。另外考虑到elabela多肽序列中第5个氨基酸位点是特有的n糖基化位点,而我们要表达的elabela多肽序列极短,在核糖体上合成停留的时间也较短,如果快速的从核糖体上释放进入酵母蛋白转运系统,存在多肽糖基化不完全的问题,未解决该问题,在核酸序列末端设计了毕赤酵母低频率使用的稀有密码子,以延长多肽在核糖体上的停留时间,使已翻译序列充分。综上,我们设计特有的dna序列如下:5′-agagaggctgaagctcaaagaccagttaacttgactatgagaagaaagttgagaaagcataactgtttgcaaagaagatgtatgccattgcattctcgggtaccttttccatgagttttagcctta-3′上述dna序列包含有编码elabela多肽32个氨基酸的基因序列。所编码的elabela多肽序列seqidno.2所示,为:glnargprovalasnleuthrmetargarglysleuarglyshisasncysleuglnargargcysmetproleuhisserargvalprophepro。seqidno.1所示dna序列测序图谱如图1所示。步骤2,将seqidno.1所示dna序列(elabela基因)克隆到毕赤酵母表达载体pgaphαa中,得到重组表达载体pgaphαa-elabela。毕赤酵母表达载体pgaphαa示意图如图2所示。合成聚合酶链式扩增(pcr)引物elaf和elar,elaf:5′-gaaaagagaggctgaagct-3′,seqidno.3所示;elar:5′-gtctaaggctaaaactca-3′,seqidno.4所示;以步骤1合成的seqidno.1所示dna序列为模板,设置pcr程序,扩增获得elabela基因pcr扩增产物。pcr扩增采用来自toyobo公司的kodfxpcr试剂,反应体系配制依据试剂说明书。elabela基因pcr扩增程序如下:94℃预变性2分钟;98℃变性10秒,44℃退火35秒,68℃延伸20秒,30个循环;68℃延伸5分钟;8℃保温备用。pcr反应结束后取3.0微升pcr扩增产物使用1.5%(w/v)浓度的琼脂糖凝胶进行电泳检测。电泳电压7v/cm,电泳时间30分钟。电泳结束后琼脂糖凝胶经过核酸染料染色,并于紫外凝胶成像仪下观察并记录结果,结果见图3,elabela基因扩增产物dna电泳条带位于126bp处,即介于分子量标准100bp和250bp之间。合成聚合酶链式扩增(pcr)引物pvf和pvr,pvf:5′-tgagttttagccttagac-3′,seqidno.5所示;pvr:5′-tctcatcgtttcgaata-3′,seqidno.6所示;以毕赤酵母表达载体pgaphαa为模板,设置pcr程序,扩增获得pgaphαa载体pcr产物。pcr扩增采用来自toyobo公司的kodfxpcr试剂,反应体系配制依据试剂说明书。毕赤酵母表达载体pgaphαa的pcr扩增程序如下:94℃预变性2分钟30秒;98℃变性15秒,42℃退火30秒,68℃延伸3分30秒,34个循环;68℃延伸10分钟;8℃保温备用。pcr反应结束后取2.5微升pcr扩增产物使用1.5%(w/v)浓度的琼脂糖凝胶进行电泳检测。电泳电压8v/cm,电泳时间30分钟。电泳结束后琼脂糖凝胶经过核酸染料染色,并于紫外凝胶成像仪下观察并记录结果,结果见图3。pgaphαa载体pcr产物dna电泳条带位于约3700bp处,即介于分子量标准3000bp和4000bp之间。用neb公司商品化的gibsonmastermix试剂对上述两次pcr扩增获得的elabela基因pcr扩增产物和pgaphαa载体pcr产物进行重组连接,连接反应体系如下:2×gibsonmastermix20μl,pgaphαa载体pcr产物5μl,elabela基因pcr扩增产物3μl,无菌去离子水12μl。上述反应体系混匀后在50℃条件下反应80分钟,即完成连接反应,得到重组表达载体pgaphαa-elabela。将重组表达载体pgaphαa-elabela转化大肠杆菌,筛选阳性克隆子备用:取反应产物重组表达载体pgaphαa-elabela10μl加入到大肠杆菌dh5α感受态细胞中,以《分子克隆实验指南》所记述方法进行转化,并将转化后细胞涂布在含有100μg/ml潮霉素b的固体肉汤培养基培养皿上,37℃培养获得转化子。转化子经过下述菌落pcr方法鉴定,筛选得到目的转化子菌落。菌落pcr采用thermoscientific公司pyrostartfastpcr试剂,使用引物linegap1和elar,linegap1:5′-gttgcgggtaaaacggag-3′,seqidno.7所示;elar:5′-gtctaaggctaaaactca-3′,seqidno.8所示;以转化子菌落为模板进行pcr扩增,得到菌落pcr产物,pcr反应体系配制和反应条件如下:2×pyrostartmastermix25μl,linegap11.5μl,elar1.5μl,转化子菌落模板0.5μl,无菌去离子水21.5μl。pcr扩增程序:95℃预变性2分钟30秒;94℃变性5秒,41℃退火5秒,68℃延伸20秒,29个循环;68℃延伸10秒;8℃保温备用。取3.0微升菌落pcr扩增产物使用1.0%(w/v)浓度的琼脂糖凝胶进行电泳检测。电泳电压8v/cm,电泳时间30分钟。电泳结束后琼脂糖凝胶经过核酸染料染色,并于紫外凝胶成像仪下观察并记录结果,结果见图4。获得正确基因重组的菌落,其菌落pcr检测结果中dna电泳条带应位于约700bp附近。电泳结果显示2号、3号和5号菌落为筛选到的正确克隆转化的克隆菌株,可用于进一步实验。步骤3,将重组表达载体pgaphαa-elabela转化到毕赤酵母中,构建出能够表达elabela多肽的重组毕赤酵母。(1)合成聚合酶链式扩增引物linegap1和linegap2,linegap1:5′-gttgcgggtaaaacggag-3′;linegap2:5′-atgctgggaagagcat-3′,设置pcr程序,以重组表达载体pgaphαa-elabela为模板,扩增获得线性化的pgaphαa-elabela。pcr扩增采用来自toyobo公司的kodfxpcr试剂,反应体系配制依据试剂说明书。pgaphαa-elabela载体线性化pcr扩增程序如下:94℃预变性2分钟30秒;98℃变性15秒,41℃退火35秒,68℃延伸3分钟30秒,30个循环;68℃延伸10秒;8℃保温备用。(2)收集毕赤酵母x33细胞悬液,备用将在ypd平板培养基上生长的毕赤酵母x33接入含有5ml液体ypd培养基的试管中,以30℃培养12h。然后将此5ml毕赤酵母培养物转接入含有50ml液体ypd培养基的250ml锥形瓶中,30℃培养8小时。然后将液体培养物在水平转子离心机中以1500g的离心力4℃离心5分钟收获毕赤酵母细胞。离心得到的毕赤酵母细胞使用30ml预冷无菌水重悬,并再次以1500g的离心力4℃离心5分钟收获毕赤酵母细胞。离心得到的毕赤酵母细胞使用1ml预冷的1m山梨醇溶液重悬后于离心机中以1500g、4℃离心5分钟收获细胞沉淀。离心得到细胞沉淀使用0.5ml预冷的1m山梨醇溶液重悬后,得到毕赤酵母x33细胞悬液,置于冰上备用。(3)将线性化pgaphαa-elabela电转化入毕赤酵母x33细胞悬液中,得到转化有pgaphαa-elabeladna的重组毕赤酵母x33细胞,具体如下:将本步骤获得的线性化pgaphαa-elabela产物加入到于冰上保存的0.5ml毕赤酵母x33细胞悬液中,得到的细胞-质粒混合物震荡混匀后继续于冰上保存5分钟。5分钟后取0.2ml细胞-质粒混合物加入到2mm缝隙的电击转化杯中,以2000v电压4.5毫秒放电时间进行电击转化。在电击后的混合物中立即加入1ml预冷的1m山梨醇溶液,然后置于30℃培养箱中静置培养2小时。培养后的细胞-质粒混合物涂布在ypdh固体培养基平皿上,放置于30℃培养箱中倒置培养60小时,挑选生长出来的酵母菌落,即为转化有pgaphαa-elabeladna的重组毕赤酵母x33细胞,冻存备用。至此,建好的重组表达载体pgaphαa-elabela通过基因重组的方式整合到毕赤酵母x33染色体中。本发明中,ypd培养基(液体)培养基成分如下:酵母提取物10g,蛋白胨20g,葡萄糖20g,蒸馏水定容至1l。ypdh培养基(液体)培养基成分如下:酵母提取物10g,蛋白胨20g,葡萄糖20g,潮霉素b200mg,蒸馏水定容至1l。ypd和ypdh固体培养基是在上述液体培养基中加入琼脂粉,并使琼脂粉的终浓度为15g/l。步骤4,重组毕赤酵母的液体发酵培养和elabela多肽的分泌表达将步骤3中转化成功的重组毕赤酵母x33细胞接种于含有30ml液体ypdh培养基中,在恒温震荡摇床上30℃、200rpm培养24小时,需要说明的是,24~72小时范围内数值均可,本实施例仅采用了一个优选的时间。将培养物转移到50ml离心管中,在水平转子离心机中以1500g离心力4℃离心5分钟以获取重组毕赤酵母培养液上清,重组毕赤酵母培养液上清中即有重组毕赤酵母细胞分泌表达的elabela多肽。实施例2使用阳离子交换层析介质captos纯化elabela多肽本实施例2所使用的阳离子交换层析介质captos,由ge公司生产,商品货号17-5441-10。具体步骤如下:s11,重组毕赤酵母培养液上清的制备取实施例1步骤3冻存的重组毕赤酵母x33细胞接种于含有5mlypd培养基的试管中,30℃振荡培养24小时。将培养液转接入含有200mlypd培养基的1l锥形瓶中,4层纱布覆口于30℃振荡培养36小时。然后将培养液倒入50ml离心管中,经2000g离心力离心分离10分钟,收集离心后的重组毕赤酵母培养液上清备用。s12,重组毕赤酵母培养液上清的调制至碱性在s11中获得的重组毕赤酵母培养液上清中按照3.75g/l的量加入甘氨酸,甘氨酸搅拌溶解后逐滴加入0.5m的氢氧化钠溶液,直至培养液上清的ph达到9.0,得到碱性毕赤酵母培养液上清。制备碱性毕赤酵母培养液上清时,也可用实施例1步骤4制备的含有elabela多肽的重组毕赤酵母培养液上清。s13,阳离子交换层析柱平衡在直径1.6cm的玻璃层析柱中装入44mlcaptos层析介质,形成一个柱高20cm的阳离子交换层析柱。阳离子交换层析柱使用50mm甘氨酸-氢氧化钠溶液平衡后再用于纯化elabela多肽。s14,阳离子交换层析柱纯化将碱性毕赤酵母培养液上清上样于平衡好的阳离子交换层析柱中,调节上样流速5ml/min,使碱性毕赤酵母培养液上清在层析柱中保留时间大于等于3分钟。收集流穿组分样品(上样过程中从阳离子交换层析柱上流出的液体)待测。碱性毕赤酵母培养液上清上样完毕后,用50mm甘氨酸-氢氧化钠溶液冲洗阳离子交换层析柱,充分洗去阳离子交换层析柱上未结合的培养液上清成分。实施例2中所述50mm甘氨酸-氢氧化钠溶液配制如下:计算并称量配制50mm的甘氨酸溶液所需的甘氨酸粉末,溶解在纯化水中,用0.5m的氢氧化钠溶液调节其ph达到9.0,纯化水定容到所需体积,使甘氨酸浓度为50mm。阳离子交换层析柱冲洗完毕后,使用洗脱液对层析柱上结合的蛋白质进行洗脱,纯化的elabela多肽即位于洗脱液中。本步骤得到的洗脱液加入去离子水稀释至电导率小于30ms/cm,得到elabela阳离子交换层析洗脱液,即纯化的elabela多肽溶液;用于下阶段的实验。实施例2中所述洗脱液的配制方法如下:向实施例2的50mm甘氨酸-氢氧化钠溶液中加入氯化钠,并使氯化钠的终浓度为0.3m。洗脱液收集完毕后使用缓冲液对阴离子层析柱进行再生,收集流出的再生液待测。实施例2中所述缓冲液的配制方法如下:向实施例2的50mm甘氨酸-氢氧化钠溶液中加入氯化钠,并使氯化钠的终浓度为1.0m。实施例2中,50mm甘氨酸-氢氧化钠溶液、洗脱液、缓冲液采用相同的ph,均为9.0。使用tricine-sds-page对实施例2中的各部分样品进行电泳检测,电泳电压160v,电泳时间50分钟。电泳后凝胶使用考马斯亮蓝g250进行染色,并使用含有30%乙醇和10%醋酸的混合溶液进行脱色。检测图谱见图5。图5中方框部分即为elabela多肽条带,再生液中含有少量elabela多肽是正常的,因为实施例2中只进行了一次洗脱,试剂操作中可至少用洗脱液洗脱两次,然后在进行再生。tricine-sds-page配制方法见下表1。表1tricine-sds-page配制方法溶液名称浓缩胶配制分离胶配制丙烯酰胺/甲叉双丙烯酰胺(40%)0.5ml(29:1)3.6ml(19:1)50%甘油\1.5ml3mtricine-glycineph8.451ml2ml水2.5ml1ml40%aps4μl8μltemed16μl12μl实施例3,使用阳离子交换层析介质nuviatms纯化elabela多肽实施例3所用阳离子交换层析介质nuviatms,由bio-rad公司生产,商品货号156-0311。重组毕赤酵母培养液上清中的elabela多肽纯化步骤如下:s21,重组毕赤酵母培养液上清的制备。取实施例1步骤3冻存的重组毕赤酵母x33细胞接种于含有5mlypd培养基的试管中,30℃振荡培养24小时。将培养液转接入含有200mlypd培养基的1l锥形瓶中,4层纱布覆口于30℃振荡培养36小时。然后将培养液倒入50ml离心管中,经2000g离心力离心分离10分钟,收集离心后的培养液上清备用。s22,重组毕赤酵母培养液上清的调制在s21获得的重组毕赤酵母培养液上清中按照1.5g/l的量加入甘氨酸,并搅拌溶解,然后在溶液中逐滴加入0.5m的氢氧化钠溶液,将培养液上清ph调节为10.0,得到碱性毕赤酵母培养液上清。s23,阳离子交换层析柱平衡在直径1.6cm的玻璃层析柱中装入42mlnuviatms层析介质,形成一个柱高19.8cm的阳离子交换层析柱。阳离子交换层析柱使用120ml的10mm甘氨酸-氢氧化钠溶液进行平衡,平衡流速5ml/min。s24,阳离子交换层析柱纯化将s22的碱性毕赤酵母培养液上清上样于s23平衡好的阳离子交换层析柱中,上样流速为5ml/min。培养液上清上样完毕后,收集流穿组分样品(上杨过程中从阳离子交换层析柱上流出的液体),使用120ml的10mm甘氨酸-氢氧化钠溶液冲洗层析柱,冲洗掉杂质。再使用洗脱液对层析柱上结合蛋白质进行洗脱,得到elabela阳离子交换层析洗脱液,即纯化的elabela多肽溶液,elabela多肽主要位于此部分洗脱液中。使用tricine-sds-page对实施例3中得到的样品进行电泳检测,电泳方法及tricine-sds-page配制方法同实施例2。检测图谱见图6,图6中方框部分即为elabela多肽条带。实施例3中所述10mm甘氨酸-氢氧化钠溶液配制方法如下:计算并称量配制10mm的甘氨酸溶液所需的甘氨酸粉末,溶解在纯化水中,用0.5m的氢氧化钠溶液调节其ph达到10.0,纯化水定容到所需体积,使甘氨酸浓度为10mm。实施例3中所述洗脱液的配制方法如下:计算并称量配制50mm的甘氨酸溶液所需的甘氨酸粉末,溶解在纯化水中,然后用0.5m的氢氧化钠溶液调节其ph达到10.0,纯化水定容到所需体积,使甘氨酸浓度为50mm;加入氯化钠,并使氯化钠的终浓度为1.0m。实施例4使用阴离子交换层析介质qsepharosehighperformance纯化elabela多肽实施例4所用阴离子交换层析介质qsepharosehighperformance,由ge公司生产,商品货号17-1014-01。对elabela多肽纯化步骤如下:s31,待纯化的elabela多肽溶液的调制向实施例2阳离子层析柱纯化的elabela多肽溶液中加入4倍体积的50mm甘氨酸-氢氧化钠溶液(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到9.0)进行稀释。然后测定溶液的ph值,并加入0.5m的氢氧化钠溶液使多肽溶液的ph值为9.0,得到多肽溶液上清。s32,qsepharosehighperformance层析柱的平衡在直径1.6cm的玻璃层析柱中装入35mlqsepharosehighperformance层析介质,形成一个柱高16cm的阴离子层析柱。阴离子层析柱使用120ml的50mm甘氨酸-氢氧化钠溶液(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到9.0)进行平衡,平衡流速2.5ml/min。s33,阴离子交换层析柱纯化将s31获得的多肽溶液上清上样于s32平衡好的阴离子层析柱中,上样流速为2.5ml/min,上样过程收集样品流穿组分样品(上样过程中从阴离子交换层析柱上流出的液体)。上样完毕后,使用120ml的50mm甘氨酸-氢氧化钠溶液(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到9.0)冲洗层析柱,洗去层析柱上未结合的培养液上清成分,并将此部分冲洗液合并到样品流穿组分样品中,得到阴离子层析柱纯化的elabela多肽溶液。收集完毕后使用实施例2所述缓冲液对阴离子层析柱进行再生。使用tricine-sds-page对实施例4中得到的样品进行电泳检测,电泳方法及tricine-sds-page配制方法同实施例2。检测图谱见图7,图7中方框部分即为elabela多肽条带。实施例5使用阴离子交换层析介质qsepharosehighperformance纯化elabela多肽实施例5所用阴离子交换层析介质qsepharosehighperformance,由ge公司生产,商品货号17-1014-01。对elabela多肽的纯化步骤如下:s41,待纯化的elabela多肽溶液的调制。向实施例3中阳离子层析柱纯化的elabela多肽溶液中加入4倍体积的50mm甘氨酸-氢氧化钠溶液(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到10.0)进行稀释。然后测定溶液的ph值,并加入0.5m的氢氧化钠溶液使多肽溶液的ph值为10.0,得到多肽溶液上清。s42,qsepharosehighperformance层析柱的平衡。在直径1.6cm的玻璃层析柱中装入35mlqsepharosehighperformance层析介质,形成一个柱高16cm的阴离子层析柱。阴离子层析柱使用120ml的50mm甘氨酸-氢氧化钠溶液(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到10.0)进行平衡,平衡流速2.5ml/min。s43,qsepharosehighperformanceaptos层析柱纯化发酵液上清。将s41的多肽溶液上清上样于s42平衡好的阴离子层析柱中,上样流速为2.5ml/min,上样过程收集样品流穿组分样品(上样过程中从阴离子交换层析柱上流出的液体)。培养液上清上样完毕后,使用120ml的(配制50mm的甘氨酸溶液,然后用0.5m的氢氧化钠溶液调节至ph达到10.0)冲洗层析柱,洗去层析柱上未结合的培养液上清成分,并将此部分冲洗液合并到样品流穿组分样品中,得到阴离子层析柱纯化的elabela多肽溶液。收集完毕后使用实施例3所述缓冲液对层析柱进行再生。使用tricine-sds-page对实施例5中得到的样品进行电泳检测,电泳方法及tricine-sds-page配制方法同实施例2。检测图谱见图8,图7中方框部分即为elabela多肽条带。需要说明的是,本发明实施例1~5中出现的用pcr扩增程序不应理解为对本发明的限制。实施例所用pcr扩增程序均可用其他pcr扩增程序替代,以能实现pcr扩增为目的,比如将退火温度上调或下调0.5℃。需要说明的是本发明权利要求书中涉及数值范围时,应理解为每个数值范围的两个端点以及两个端点之间任何一个数值均可选用,由于采用的步骤方法与实施例相同,为了防止赘述,本发明的描述了优选的实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。序列表<110>新乡医学院<120>一种从重组毕赤酵母中制备elabela多肽的方法<130>123<160>9<170>patentinversion3.3<210>1<211>126<212>dna<213>人工序列<400>1agagaggctgaagctcaaagaccagttaacttgactatgagaagaaagttgagaaagcat60aactgtttgcaaagaagatgtatgccattgcattctcgggtaccttttccatgagtttta120gcctta126<210>2<211>32<212>prt<213>人工序列<400>2glnargprovalasnleuthrmetargarglysleuarglyshisasn151015cysleuglnargargcysmetproleuhisserargvalprophepro202530<210>3<211>19<212>dna<213>人工序列<400>3gaaaagagaggctgaagct19<210>4<211>18<212>dna<213>人工序列<400>4gtctaaggctaaaactca18<210>5<211>18<212>dna<213>人工序列<400>5tgagttttagccttagac18<210>6<211>17<212>dna<213>人工序列<400>6tctcatcgtttcgaata17<210>7<211>18<212>dna<213>人工序列<400>7gttgcgggtaaaacggag18<210>8<211>18<212>dna<213>人工序列<400>8gtctaaggctaaaactca18<210>9<211>1026<212>dna<213>人工序列<400>9atgaaaaagcctgaactcaccgcgacgtctgtcgagaagtttctgatcgaaaagttcgac60agcgtctccgacctgatgcagctctcggagggcgaagaatctcgtgctttcagcttcgat120gtaggagggcgtggatatgtcctgcgggtaaatagctgcgccgatggtttctacaaagat180cgttatgtttatcggcactttgcatcggccgcgctcccgattccggaagtgcttgacatt240ggggagtttagcgagagcctgacctattgcatctcccgccgtgcacagggtgtcacgttg300caagacctgcctgaaaccgaactgcccgctgttctacaaccggtcgcggaggctatggat360gcgatcgctgcggccgatcttagccagacgagcgggttcggcccattcggaccgcaagga420atcggtcaatacactacatggcgtgatttcatatgcgcgattgctgatccccatgtgtat480cactggcaaactgtgatggacgacaccgtcagtgcgtccgtcgcgcaggctctcgatgag540ctgatgctttgggccgaggactgccccgaagtccggcacctcgtgcacgcggatttcggc600tccaacaatgtcctgacggacaatggccgcataacagcggtcattgactggagcgaggcg660atgttcggggattcccaatacgaggtcgccaacatcttcttctggaggccgtggttggct720tgtatggagcagcagacgcgctacttcgagcggaggcatccggagcttgcaggatcgcca780cgactccgggcgtatatgctccgcattggtcttgaccaactctatcagagcttggttgac840ggcaatttcgatgatgcagcttgggcgcagggtcgatgcgacgcaatcgtccgatccgga900gccgggactgtcgggcgtacacaaatcgcccgcagaagcgcggccgtctggaccgatggc960tgtgtagaagtactcgccgatagtggaaaccgacgccccagcactcgtccgagggcaaag1020aaatag1026当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1