一种基于foldon介导的寡聚化阿魏酸酯酶的制备方法与流程
本发明属于生物工程
技术领域:
,具体涉及一种基于foldon介导的寡聚化fae的制备方法。
背景技术:
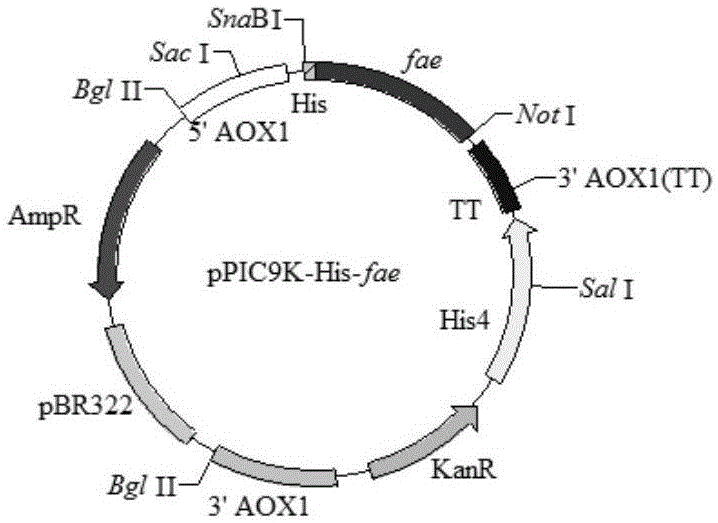
:植物细胞壁中,酚酸类物质(如阿魏酸、咖啡酸、对香豆酸等)通过酯键与多糖(如阿拉伯木聚糖、果糖)的阿拉伯糖基或半乳糖基相连,或者通过醚键与木质素相连,形成致密的网状结构。阿魏酸酯酶(feruloylesterasee.c3.1.1.73,fae)是羧酸酯酶的一个亚类,它能水解植物细胞壁中阿魏酸与多糖之间连接的酯键,释放阿魏酸。fae可以协同木质纤维降解酶,如木聚糖酶、纤维素酶及木质素酶,破坏木质纤维的致密网状结构,促进木质纤维降解。但目前报道的fae的催化性能有待提高,需对酶进行改造,例如陈云华等在华侨大学学报(自然版)(2016.37(2):p.224-229)公开的阿魏酸酯酶o42807在毕赤酵母gs115中的表达,再例如李兵等在微生物学通报(2017.44(5):p.1065-1073)公开的黑曲霉fae基因密码子优化及在毕赤酵母中的高效表达。申请号为201410724759.4的发明专利公开了一种重组fae的制备方法,利用阿魏酸酯酶o42807,密码子优化后人工合成其基因fae、构建pao815/fae表达载体、构建ppic9k/fae表达载体以及将ppic9k/fae表达载体转化至毕赤酵母gs115中表达,得到重组fae,sds-page分析显示其发酵上清液为单一条带,表观分子量为42kda,酶活为4.7u/ml,比酶活力为31.4u/mg。该发明获得的重组fae,与faeo42807相比表达量有所提高,但表达量仍很低。以定点突变和定向进化为代表的蛋白质工程技术已经成功地筛选了具有优化特性的酶,但这些方法在改造酶时仍存在困难,如突变体库的建立和大量筛选工作。而通过固定化或化学修饰,有时也能提高酶的性能,但存在酶在固定化过程中会引起酶失活,且首次固定化成本高,与大分子底物反应较困难等缺点。蛋白质的结构决定其功能,可通过蛋白质工程对蛋白质进行改造以获取蛋白质的新功能。寡聚化是许多蛋白质自我联合成寡聚体以获得功能优势的一种常用方式。寡聚化能够为目标酶提供多种功能优势,如提高热稳定性、ph耐受性、蛋白质分子结构稳定性及催化性能等。foldon是一种小的27个残基(gyipeaprdgqayvrkdgewvllstfl,如seqidno.2所示)的β-螺旋桨样三聚体,由单体β-发夹片段组成,最初在噬菌体t4纤维蛋白的c-末端被鉴定出来,通过基因融合,该结构域可与目标酶人工连接以改变其性质。由comp和foldon诱导形成的寡聚体通常可导致热稳定性的提高。can等(can,andn.b.holland,utilizingaviditytoimproveantifreezeproteinactivity:atypeiiiantifreezeproteintrimerexhibitsincreasedthermalhysteresisactivity.biochemistry,2013.52(48):p.8745-8752.)将foldon与抗冻蛋白进行连接后形成寡聚化同型抗冻蛋白且提高了冰晶表面结合的抗冻蛋白浓度,使其活力显著增加。wang等(wangx,geh,zhangd,etal.oligomerizationtriggeredbyfoldon:asimplemethodtoenhancethecatalyticefficiencyoflichenaseandxylanase[j].bmcbiotechnology,2017.17(1):57:p112-120)完成了foldon-elps-地衣多糖酶/木聚糖酶的在大肠杆菌中的胞内表达,酶的kcat/km分别提高4.2倍和3.0倍,申请人尝试将分子量较大且结构相对复杂的fae在大肠杆菌表达,但酶活力低且形成包涵体,无应用前景。技术实现要素:在下文中给出了关于本发明实施例的简要概述,以便提供关于本发明的某些方面的基本理解。应当理解,以下概述并不是关于本发明的穷举性概述。它并不是意图确定本发明的关键或重要部分,也不是意图限定本发明的范围。其目的仅仅是以简化的形式给出某些概念,以此作为稍后论述的更详细描述的前序。根据本发明的一个方面,提供一种基于foldon介导的寡聚化阿魏酸酯酶的制备方法,包括:设计linker序列,优化基因序列his-fae-linker-foldon,并在两端分别加入snabi和noti酶切位点,人工合成基因片段his-fae-linker-foldon;将ppic9k质粒及his-fae-linker-foldon用snabi和noti双酶切,用t4连接酶连接质粒ppic9k和基因片段his-fae-linker-foldon,并转化至e.colidh5α感受态细胞,筛选ppic9k/his-fae-linker-foldon质粒阳性克隆子并电转化至p.pastorisgs115(毕赤酵母)表达,得到ppic9k/his-fae-linker-foldon工程菌;将ppic9k/his-fae-linker-foldon工程菌在培养基中诱导表达,分离纯化获得寡聚化的阿魏酸酯酶。具体的,构建ppic9k/his-fae-linker-foldon工程菌具体包括如下过程:自行设计氨基酸序列如seqidno.1所示的linker,在uniprot数据库中筛选酶活较高的faeo42807,根据faeo42807的氨基酸序列对应的核苷酸序列、his、linker及foldon基因序列和毕赤酵母的密码子偏好使用频率,优化基因序列his-fae-linker-foldon,并在两端分别加入snabi和noti酶切位点,人工合成基因片段his-fae-linker-foldon。将ppic9k质粒及his-fae-linker-foldon用snabi和noti双酶切,胶回收双酶切片段后用t4连接酶将质粒ppic9k和基因片段his-fae-linker-foldon连接并转化至e.colidh5α感受态细胞,筛选出阳性克隆子sangon测序,测序正确的重组质粒命名为ppic9k/his-fae-linker-foldon质粒。ppic9k/his-fae-linker-foldon质粒转化至毕赤酵母具体包括:将ppic9k/his-fae-linker-foldonn用sacⅰ酶切,利用电转化法将线性化片段转化至p.pastorisgs115感受态后,涂布于md平板上筛选重组子,取md平板上生长良好的菌落用牙签点种至ypd摇瓶中,培养16~18h后提取其基因组dna,利用通用引物5’aox、3’aox进行pcr鉴定,得到表达fae的ppic9k/his-fae-foldonn工程菌。md培养基、ypd培养基按《毕赤酵母操作表达手册》(美国invitrogen公司)配制。ppic9k/his-fae-foldonn工程菌的诱导表达按以下进行:(1)将重组工程菌接种到种子培养基中。培养条件:28~30℃,150~250rpm,培养16~18h。种子培养基成份:bmgy培养基。(2)将完成(1)步骤培养液在2~4℃及3500~4500rpm离心4~6min,收集细胞,加入到诱导培养基中,培养条件:28~30℃,150~250rpm,培养96~100小时。诱导培养基成分:bmmy培养基,1~2%(质量百分比)去淀粉麦麸。去淀粉麦麸的制备方法:将新鲜麦麸于105℃下干燥4h,粉碎,按欧仕益等的方法采用淀粉酶脱除淀粉,样品烘干,粉碎,过80目备用(欧仕益,张宁.麦麸酶解产品清除自由基的体外实验研究[j].营养学报,2005,27(1):25-29.)。bmgy培养基、bmmy培养基,按《毕赤酵母操作表达手册》(美国invitrogen公司)配制。其中,本发明的培养基包括含有去淀粉麦麸诱导培养基。在诱导培养基中加入去淀粉麦麸的原理是:培养基质的选择对微生物是否能够产生fae至关重要。葡萄糖、木糖、乳糖、麦芽糖和木醇糖作为基质时,微生物不能产生fae,这是由于葡萄糖分解代谢物的阻遏作用。含有大量酯化阿魏酸的混合碳源,如麦麸、玉米皮、啤酒糟和甜菜渣等,最适合用作基质生产fae([1]benoiti,danchine,bleichrodtr,etal.biotechnologicalapplicationsandpotentialoffungalferuloylesterasesbasedonprevalence,classificationandbiochemicaldiversity[j].biotechnollett,2008,30(3):387-396)。f.oxysporum深层液体培养,去阿魏酸酯键的玉米芯与未处理的玉米芯作碳源相比,fae的产量降低了81.8%;若把游离的阿魏酸添加到脱酯玉米芯中,则fae的产量提仅高了1.5倍,该结果表明木质纤维中阿魏酸酯键是诱导f.oxysporum产fae的因子(topakase,christakopoulosp.productionandpartialcharacterizationofalkalineferuloylesterasesbyfusariumoxysporumduringsubmergedbatchcultivation[j].worldjmicrobiolbiotechnol,2004,20(3):245-250),现文献中报导的fae工程菌都是选择bmgy种子培养基、bmmy诱导培养基,构建的fae工程菌酶活低。本发明结合理论指导及实验基础上,筛选到去淀粉麦麸添加到bmmy诱导培养基,酶活提高明显。分离纯化毕赤酵母表达后的融合蛋白具体包括如下过程:2~4℃,8000~12000rpm离心8~12min,获得的上清液即为粗酶液,粗酶液用ni层析柱进行纯化得寡聚化fae。此外,本发明在研究过程中,发现酶活稳定性还跟保存方式关系密切,而现有技术中尚未有将阿魏酸酯酶存放于稳定剂的报导,因此,本发明在大量的实验和理论推导的基础上,将所得到的寡聚化的阿魏酸酯酶保存在特制的复合稳定剂中,可获得稳定性良好的寡聚化fae酶液。该复合稳定剂包括按质量百分比混合的如下成分:4~6%的木聚糖酶(≥20000u/ml)、2~4%的纤维素酶(≥10000u/ml)、0.02~0.04%的mgso4以及7~9%的peg400中,溶剂为去离子水。其酶活与仅在低温冰箱保藏相比的现有技术,其稳定性大大提高。上述复合稳定剂保持酶活的原理是:一般的酶液都是低温保存或添加普通的保护剂,如甘油,peg等,并没有针对具体的目标酶。而对于复杂网络结构的植物细胞壁,研究结果表明单一使用fae并不能有效地降解植物纤维质,只有fae和其他细胞壁降解酶的协同作用,才能大大提高植物纤维质的降解。faulds等报道了黑曲霉分泌的fae自身也能释放fa,但同时加入木聚糖酶,其fa的释放量增加近24倍。topakas等报道,嗜热侧孢霉产生的阿魏酸酯酶stfaec与木聚糖酶协同作用从植物纤维质中释放的fa是无木聚糖酶时的10倍。([1]fauldscb,williamsong.releaseofferulicacidfromwheatbranbyaferulicacidesterase(fae-iii)fromaspergillusniger[j].applmicrobiolbiot,1995,43(6):1082-1087.[2]topakase,vafiadic,stamatish,etal.sporotrichumthermophiletypecferuloylesterase(stfaec):purification,characterization,anditsuseforphenolicacid(sugar)estersynthesis[j].enzymemicrobtech,2005,36(5-6):729-736.)。本发明推测木聚糖酶等木质纤维降解酶是fae的“伴侣”,在此基础上本发明通过实验筛选到含有木聚糖酶、纤维素酶、mgso4及peg400复合稳定剂,可使寡聚化fae液酶活保持稳定。酶的储存稳定性与酶的存在形式有关,大部分酶在固体状态下相对比较稳定,而液体酶在储存的过程中易被微生物污染,丧失酶活性,不能长期保存。在实际工业生产过程中,将酶冷冻干燥的成本较高,而添加复合稳定剂,成本低、易操作。因此以复合稳定剂提高液体fae的储存稳定性,对其实际应用有着重要的意义。本发明将基于foldon基因及自行设计linker,构建ppic9k/his-fae-linker-foldon质粒并转化至毕赤酵母gs115中,将此工程菌在含有去淀粉麦麸培养基中诱导表达,分离纯化获得催化效率高的寡聚化的fae。将寡聚化fae保存在含有木聚糖酶、纤维素酶、mgso4及peg400复合稳定剂中,可获得稳定性良好的寡聚化fae酶液。与现有技术相比,具有如下优点:1、自行设计linker序列,实现基于foldon的寡聚化fae在毕赤酵母gs115中胞外表达,应用目标蛋白与foldon结构域融合可自发形成三聚体的特性对fae进行改造,以提高fae的催化性能。2、本发明创造性的在ppic9k/his-fae-foldon工程菌培养基中加入去淀粉麦麸,提高了fae的酶活,与不添加去淀粉麦麸的培养基相比,其酶活提高了1.13倍。3.本发明创造性将所得到的寡聚化fae保存在复合稳定剂中,其配方:5%的木聚糖酶(≥20000u/ml)、3%的纤维素酶(≥10000u/ml)、mgso4(0.03%)、peg400(8%)中。将纯化得到的寡聚化fae加入到复合稳定剂中保存在4℃下,20d后酶活残留率达96.2%,以仅低温保存无添加稳定剂的对照组相比,提高了1.12倍。基于foldon的寡聚化fae在毕赤酵母gs115中表达,且工程菌在诱导表达过程中培养基含有去淀粉麦麸,可得到酶活为8110u/ml,比酶活力为76.2u/mg,且寡聚化fae的底物亲和力(km)及催化效率(kcat/km)较对照组单体fae分别提高了5.42倍和24.6倍;且将纯化得到的寡聚化fae保存在复合稳定剂中放置在4℃下,20d后酶活残留率达96.2%。综上,本申请所建立的提高fae催化效率的方法简单、高效,无需事先详细了解酶的3d结构,有很好的应用前景。附图说明下面结合附图和实施例对本发明作进一步说明。图1为ppic9k/his-fae质粒(a)及ppic9k/his-fae-linker-foldon质粒(b)构建图。图2为重组质粒ppic9k/his-fae与ppic9k/his-fae-linker-foldon双酶切(noti,snabi)结果图,图中:m:marker;1:ppic9k/his-fae;2:ppic9k/his-fae-linker-foldon。图3(a)为ppic9k/his-fae质粒表达的产物结果图,图中:m为蛋白marker;1为ppic9k/his-fae发酵上清液,图示中的mon-fae为ppic9k/his-fae质粒表达的产物。图3(b)为ppic9k/his-fae-linker-foldon质粒表达的产物结果图,图中:m为蛋白marker;1为ppic9k/his-fae-linker-foldon发酵上清液,图示中的olig-fae为ppic9k/his-fae-linker-foldon质粒表达的产物。图4为诱导培养基中去淀粉麦麸对olig-fae酶活的影响。图5为重组fae的最适温度。图6为重组fae的温度稳定性,(a)mon-fae,(b)olig-fae。图7为重组fae的最适ph。图8为重组fae的ph稳定性。图9为olig-fae的tem图像。图10为多元醇对olig-fae热稳定性的影响。图11为其他酶对olig-fae酶液热稳定性的影响。图12为mgso4对olig-fae酶液热稳定性的影响。具体实施方式下面将参照附图来说明本发明的基于foldon介导寡聚化的fae的制备方法的详细过程。1.1主要材料1.1.1菌株和质粒e.colidh5α购自生工生物工程(上海)股份有限公司;p.pastorisgs115、载体ppic9k购自美国invitrogen公司。1.1.2主要试剂和培养基:限制性内切酶(snabⅰ、notⅰ、sacⅰ)、t4连接酶(美国thermofisher公司);质粒抽提试剂盒、胶回收试剂盒(生工生物工程(上海)股份有限公司);标准蛋白质marker(10-170kd)、sds-page凝胶配制试剂盒、考马斯亮蓝染色试剂盒(上海碧云天生物技术研究所);阿魏酸甲酯、peg400、木聚糖酶(≥20000u/ml)、纤维素酶(≥10000u/ml)(美国sigma公司);其他试剂均为国产或进口分析纯产品。md培养基、ypd种子培养基、bmgy种子培养基、bmmy诱导培养基按《毕赤酵母操作表达手册》(美国invitrogen公司)配制。透射电子显微镜(日本电子株式社)。1.2表达载体的构建uniprot数据库中筛选酶活较高的faeo42807,根据faeo42807的氨基酸序列对应的核苷酸序列、his、linker及foldon基因序列和毕赤酵母的密码子偏好使用频率,设计优化其基因序列his-fae-linker-foldon,并在两端分别设计snabi和noti酶切位点,人工合成基因片段his-fae-linker-foldon。将ppic9k质粒及his-fae-linker-foldon用snabi和noti双酶切,胶回收双酶切片段后用t4连接酶将质粒ppic9k和基因片段his-fae-linker-foldon连接并转化至e.colidh5α感受态细胞,筛选出阳性克隆子并测序(由上海sangon公司测序),测序正确的重组质粒命名为ppic9k/his-fae-linker-foldon质粒。其中,本实施例中,人工合成基因片段his-fae-linker-foldon中的linker为52个氨基酸序列(如seqidno.1所示):gaggaggaggaggaggsggsggsggsggsggsggsggaggaggaggaggagg。1.3重组fae在毕赤酵母中的表达和纯化将ppic9k/his-fae-linker-foldon用sacⅰ酶切,利用电转化法将线性化片段转化至p.pastorisgs115感受态后,涂布于md平板上筛选重组子,取md平板上生长良好的菌落用牙签点种至ypd摇瓶中,培养16~18h后提取其基因组dna,利用通用引物5’aox、3’aox进行pcr鉴定确定后,得到表达ppic9k/his-fae-linker-foldon工程菌。另,相同方法构建ppic9k/his-fae工程菌,做对照组。1.5重组fae培养基的研究(1)将重组工程菌接种到种子培养基中。培养条件:28℃,200rpm,培养16~18h。种子培养基成份:bmgy培养基。(2)将完成(1)步骤培养液在4℃及4000rpm离心5min,收集细胞,加入到诱导培养基中,培养条件:28℃,200rpm,培养96~100小时。诱导培养基成分:bmmy培养基加入不同浓度去淀粉麦麸。研究去淀粉麦麸对重组工程菌的表达时fae酶活力影响。bmgy种子培养基及bmmy诱导培养基按《毕赤酵母操作表达手册》(美国invitrogen公司)配制。1.4分离纯化毕赤酵母表达的融合蛋白获得诱导表达的培养液后,在4℃,10000rpm离心10min,获得的上清液即为粗酶液,粗酶液用ni层析柱进行纯化可得寡聚化fae,纯化后用bradford法测定蛋白质量浓度,sds-page分析纯化后的酶液。高效液相色谱法测定fae酶活力。空白对照为煮沸失活的酶液。酶活力单位定义为在25℃,ph值为6.0的条件下1min生成1μmol阿魏酸所需的酶量为1个酶活力单位。1.5重组fae酶学性质的研究1.5.1最适反应温度的测定取250μl酶液保温5min后,加入250μl阿魏酸甲酯溶液(由ph值为6.0的na2hpo4-柠檬酸缓冲溶液配置),在40~65℃中反应10min,测定重组fae的酶活力。以所测的最高酶活力为100%,计算相对酶活。1.5.2温度稳定性的测定将酶液置于30~50℃下,保温12h,每隔3h取样测定残留酶活力,以保温0h所测定的酶活力为100%,计算相对酶活。1.5.3最适反应ph值的测定取250μl酶液于25℃保温5min后,加入250μl的阿魏酸甲酯溶液(0.2mol/l的na2hpo4-柠檬酸缓冲溶液调节ph值在3.0~8.0之间),25℃下反应10min,测定重组fae的酶活力。以所测的最高酶活力为100%,计算相对酶活。1.5.4ph值稳定性的测定将酶液置于0.2mol/l、ph值为3.0~8.0的na2hpo4-柠檬酸缓冲液中,25℃保温2h,取250μl保温酶液,向其加入250μl阿魏酸甲酯溶液,25℃下反应10min,测定重组fae残留酶活力,以各ph值的0h酶活力为100%,计算相对酶活。1.5.5金属离子对重组fae酶活力的影响将酶液与含有10mmol/l的各种金属离子(na+,k+,mn2+,fe2+,cu2+,mg2+,ca2+,zn2+)的na2hpo4-柠檬酸缓冲溶液(ph=6.0)混合,于25℃保温2h,测定残留酶活,以不添加金属离子所测得的酶活力为100%,计算相对酶活。1.5.6重组fae动力学常数的测定取8支试管,每管都加好200g/l阿魏酸酯甲酯溶液,0.2mol/l、ph6.0的na2hpo4-柠檬酸缓冲液,在25℃下保温3min,用同一管酶液依次加样,依次在酶作用1-30min时测定酶活力,然后算出酶活力与反应时间的比值,在一定时间内比值保持稳定,则在此时间内酶作用为一级反应,此时间即可确定为测km值和vmax的反应时间。用不同浓度的底物,在0.2mol/l、ph6.0的na2hpo4-柠檬酸缓冲体系中,25℃下反应一定时间,测定酶活,计算相应的反应速度,利用米氏方程双倒数法求得km值及vmax。1.6重组fae透射电子显微镜分析将适量浓度蛋白质样品5μl滴加到碳支持膜涂覆的200目铜网格上并温育5min,过量的蛋白质样品用滤纸进行印记干燥。网格用两个20μl水洗涤并印记干燥,接着25μl2%乙酸铀酰滴30秒,印记干燥后使用透射电子显微镜在100kv下观察样品并使用ccd照相机记录电子显微照片。1.7稳定剂的筛选及浓度的优化1.7.1稳定剂对寡聚化fae热稳定性的影响向酶液中分别单独添加不同浓度的:(1)醇类:peg400、丙三醇、丙二醇、山梨醇;(2)木聚糖酶、纤维素酶、果胶酶。在25℃水浴中放置,0h和2h后取样,冰浴降温,测定酶活力后,计算酶活残留率。未添加稳定剂的酶液为对照组。1.7.2储存稳定性的测定将加入复合稳定剂的酶液及对照组的酶液在常温与4℃冰箱中保存,每隔一定时间测定酶活力,测定20d。以0d的酶活为100%,计算酶活残留率。未加稳定剂的酶液为对照组。2.结果与分析2.1重组fae转化子pcr鉴定与筛选分别以ppic9k/his-fae和ppic9k/his-fae-linker-foldon的基因组为模板,用5’aox1和3’aox1引物进行pcr验证,pcr产物用1%的凝胶电泳检测,结果如图2所示。显示目的基因his-fae及his-fae-linker-foldon已经成功整合到这些转化子基因组中。2.2重组fae的表达和纯化挑取上述阳性转化子,按照1.3进行培养和诱导表达,测定其表达量,挑选实验中产酶活性最高的1个转化子,取其发酵上清液用ni柱纯化后进行sds-page分析。如图3(a)所示,m为蛋白marker;1为ppic9k/his-fae发酵上清液,图示中的mon-fae为ppic9k/his-fae质粒表达的产物,由图3(a)图可知,在40kd得到一条清晰条带,而且几乎没有杂条带,初步说明mon-fae得到成功表达。图3(a)显示mon-fae的表观相对分子质量明显大于其理论值29.97kd,这主要是因为fae蛋白序列的n端的糖基化位点,而毕赤酵母表达外源蛋白时,会对其进行糖基化修饰,从而使相对分子质量增大。图3(b)所示,m为蛋白marker;1为ppic9k/his-fae-linker-foldon发酵上清液,图示中的olig-fae为ppic9k/his-fae-linker-foldon质粒表达的产物,由图3(b)图可知,上清发酵液在170kd处出现一条带。olig-fae表观相对分子质量明显大于其理论值99.12,其原因与mon-fae表观分子质量大于其理论值原因相同。比较了mon-fae和olig-fae的酶活力及比活性,见表1。表1表明olig-fae与mon-fae相比,酶活提高了42.4倍,比活力提高了3.73倍。表1重组fae的酶活及比活力蛋白质酶活(u/l)比活力(u/mg)mon-fae18716.1olig-fae811076.22.3重组fae培养基的研究研究去淀粉麦麸对重组工程菌的表达时fae酶活力及比活力的影响,实验结果如图4所示。实验结果表明,随着去淀粉麦麸添加量的增加,olig-fae的酶活先增加后减少,在1.5%(w/w)添加量时表达量最高,可为8110u/ml,而不添加去淀粉麦麸时其表达量为3800u/ml,与不添加去淀粉麦麸的培养基相比,其酶活提高了1.13倍,说明在bmmy诱导培养基添加去淀粉麦麸可提高酶活的表达量。2.4olig-fae酶学性质的研究2.4.1最适温度及温度稳定性的测定探究在40~65℃时酶反应的最适温度,结果如图5所示。由图5可知:mon-fae与olig-fae最适温度均为50℃,且50℃之前,两者的酶活均较高,相对酶活都在90%以上。超过50℃后,两者的酶活力下降均较快,可能是随着温度的升高,酶出现失活现象。将重组fae在30~55℃保温0,3,6,9,12h后,测定其残余酶活,结果如图6所示。mon-fae及olig-fae在30~55℃温度下,随着保温时间的延长,酶活力均逐渐下降,但olig-fae的下降趋势较mon-fae平缓。mon-fae在50℃保温3h后,基本丧失酶活,而olig-fae在50℃保温3h后,残留酶活力为78.0%。故olig-fae温度稳定性较mon-fae有很大提高。2.4.2最适ph及ph稳定性的测定重组酶的最适ph结果如图7所示。由图7可知,mon-fae的最适ph值为6.0;olig-fae的最适ph值为5.0。重组酶的ph值稳定性结果如图8所示。由图8可知,ph值为3.0~6.0时,随着ph增大,mon-fae的稳定性随之增大,ph值为6.0时,mon-fae的ph稳定性最高,ph值大于6.0时,mon-fae稳定性逐渐下降;ph值为3.0~5.0时,随着ph增大,olig-fae的稳定性随之增大,ph值为5.0时,olig-fae的ph稳定性最高,ph值大于5.0时,olig-fae的稳定性逐渐下降。2.4.3金属离子对olig-fae的影响金属离子对重组酶活力的影响见表2,mn2+、zn2+、ca2+、mg2+、fe3+、cu2+对其有促进作用,k+对olig-fae有一定的抑制作用。表2金属离子对olig-fae的影响2.4.4动力学常数的测定在25℃测定动力学常数,见表3。其中olig-fae的km(0.713±0.02)与mon-fae(4.55±0.07)相比较小,说明olig-fae的底物亲和力较mon-fae有所提高,且提高倍数为5.38倍;olig-fae的kcat/km(11.8±1.12)与mon-fae(0.461±0.63)相比较大,说明olig-fae的催化效率较mon-fae有明显提高,且提高倍数为24.6倍;同时,olig-fae的kcat、vmax较mon-fae均有所提高。表3重组fae动力学常数的测定2.5重组fae透射电子显微镜分析用透射电子显微镜图像进一步探究在25℃时olig-fae的蛋白结构性质,为了便于观察olig-fae的蛋白结构,对样品进行了稀释至0.15mg/ml,电镜结果如图9所示。图9中显示在负染色液包裹范围中有接近球形形态的颗粒聚集在一起,形成寡聚化结构。2.6复合稳定剂的影响2.6.1不同物质对olig-fae稳定性的影响选用7种物质作为酶液的稳定剂。在50℃水浴中放置,0h和2h后取样,冰浴降温,测定酶活力后,计算酶活残留率。未添加稳定剂的酶液为对照组。热稳定性实验结果如图10~12所示。低浓度的丙二醇、山梨醇、peg400及甘油对olig-fae的热稳定性随着浓度的增加,热稳定性先增加后降低,当peg400浓度为8%时,酶活稳定性增加,相对酶活为108%。而木聚糖酶及纤维素酶能明显保持olig-fae的热稳定性影响,当其木聚糖酶为5%及纤维素酶添加量为3%时,酶活相对保持稳定。通过单因子试验得出对olig-fae稳定作用的添加物及其最适添加量和酶活残留率,如表4。表4稳定剂对液体olig-fae热稳定性的影响表4结果显示,在相同的实验条件下,不添加任何稳定剂的对照组的酶活残留率是65.3%,单独添加表4所示的稳定剂,olig-fae的热稳定性有明显提高。2.6.2储存稳定性的测定将olig-fae置于复合稳定剂中(5%木聚糖酶、3%纤维素酶、0.03%mgso4、8%peg400),分别在常温和4℃冰箱中保存20d,每隔1~4d不等测定酶活力,研究在不同储存条件下酶的储存稳定性,实验结果表明,添加复合稳定剂在保存过程中能保持酶的稳定性。添加复合稳定剂的olig-fae酶液在4℃下,20d后的酶活是初始酶活的96.2%,而空白对照只能保存初始酶活的45.5%,提高了1.11倍。3.结论基于foldon的寡聚化fae在毕赤酵母gs115中表达,且工程菌在诱导表达过程中培养基含有去淀粉麦麸,可得到酶活为8110u/ml,比酶活力为76.2u/mg,且寡聚化fae的底物亲和力(km)及催化效率(kcat/km)较对照组单体fae分别提高5.38倍和24.6倍;且将纯化得到的寡聚化fae保存在复合稳定剂中保存在4℃下,20d后酶活残留率达96.2%。综上,本文所建立的提高阿魏酸酯酶fae的催化效率的方法简单、高效,无需事先详细了解酶的3d结构,有很好的应用前景。应该强调,术语“包括/包含”在本文使用时指特征、要素、步骤或组件的存在,但并不排除一个或更多个其它特征、要素、步骤或组件的存在或附加。此外,本发明的方法不限于按照说明书中描述的时间顺序来执行,也可以按照其他的时间顺序地、并行地或独立地执行。因此,本说明书中描述的方法的执行顺序不对本发明的技术范围构成限制。尽管上面已经通过对本发明的具体实施例的描述对本发明进行了披露,但是,应该理解,上述的所有实施例和示例均是示例性的,而非限制性的。本领域的技术人员可在所附权利要求的精神和范围内设计对本发明的各种修改、改进或者等同物。这些修改、改进或者等同物也应当被认为包括在本发明的保护范围内。序列表<110>华侨大学<120>一种基于foldon介导的寡聚化阿魏酸酯酶的制备方法<160>2<170>siposequencelisting1.0<210>1<211>52<212>prt<213>人工序列(artificialsequence)<400>1glyalaglyglyalaglyglyalaglyglyalaglyglyalaglygly151015serglyglyserglyglyserglyglyserglyglyserglyglyser202530glyglyserglyglyalaglyglyalaglyglyalaglyglyalagly354045glyalaglygly50<210>2<211>27<212>prt<213>人工序列(artificialsequence)<400>2glytyrileproglualaproargaspglyglnalatyrvalarglys151015aspglyglutrpvalleuleuserthrpheleu2025当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1