一种大麦条纹病致病性基因PgPBS及其应用的制作方法
本发明属于生物工程技术领域,具体涉及大麦条纹病致病性基因pgpbs及其维持致病菌细胞渗透平衡,保护致病菌细胞壁的完整性,以及沉默该基因降低大麦条纹病致病性的应用。
背景技术:
大麦条纹病是由真菌病原体―麦类核菌(drechsleragraminea[rabenh.ex.schlech.]shoemaker)引起的种子传播病害,常造成大麦产量严重减产。施用杀真菌剂和抗病育种可以减轻其产量损失,而抗病育种通常被认为是更经济和环保的解决方案。因此,了解该病害的毒性及致病性遗传基础具有重要意义。
双组分信号(tcs)系统在细菌,真菌和植物中起到调节细胞运动,控制细胞发育,调控抗生素抗性,致病性和环境应激反应等作用。在tcs途径中,酿酒酵母中的高渗透压甘油(hog)信号传导途径是最具特征的途径之一。hog途径包括两个分支sln1和sho1。丝裂素活化蛋白激酶激酶(mapkk)pbs2位于hog途径的两个分支的交叉处。
tcs信号途径的相关研究在麦类禾核腔菌中还未见报道。假设pbs2同源物pgpbs在hog信号传导途径中起重要作用。基于同源克隆技术扩增pgpbs基因,通过rna干扰(rnai)技术获得pgpbs沉默的转化体,研究pgpbs在渗透反应,营养分化,细胞壁完整性,抗药性和致病性中的作用。以期为麦类核菌的致病机理及大麦条纹病的控制提供基础。
现有技术存在的问题:现有技术中未见pgpbs基因及沉默该基因应用的报道。
技术实现要素:
鉴于现有技术的不足,本发明提供了一种大麦条纹病致病性基因pgpbs,以应对控制大麦条纹病基因的需求。本发明的另一目的在于提供一种大麦条纹病致病性基因pgpbs在渗透反应,营养分化,细胞壁完整性,抗药性和致病性中的应用。
为了达到上述目的,本发明采用了如下的技术方案:
一种大麦条纹病致病性基因pgpbs,该基因序列如序列表seqidno:1所示。
一种鉴定大麦条纹病致病基因的方法,包括如下步骤:
1、大麦条纹病菌株的培养
从甘肃秦王川采集大麦叶片中分离菌丝(菌株编号qwc),将菌丝置于pd液体培养基中,在25-30℃,180-200rpm的摇床培养2-3d,收集菌丝细胞,用于dna,rna及原生质体的制备。pda固体培养基的配方为200g/l的马铃薯,20g/l的葡萄糖,15g/l的琼脂。pd液体培养基的配方为:200g/l的马铃薯,20g/l的葡萄糖。
2、pgpbs基因的克隆及序列分析
分别利用dna试剂盒(omegabiotekinc,norcross,ga)和rna试剂盒(omegabiotekinc)提取菌丝细胞的dna和rna。采用反转录试剂盒(takarabiotech,dalian,china)将上述rna进行反转录合成cdna。采用附图5所述引物(pgpbs-f1和pgpbs-r1)为特异性引物,将cdna和dna模板进行聚合酶链式反应pcr扩增,将扩增后的产物链接在pmd19-t载体上进行测序分析。测序分析采用上海生工生物工程技术服务有限公司测序完成。
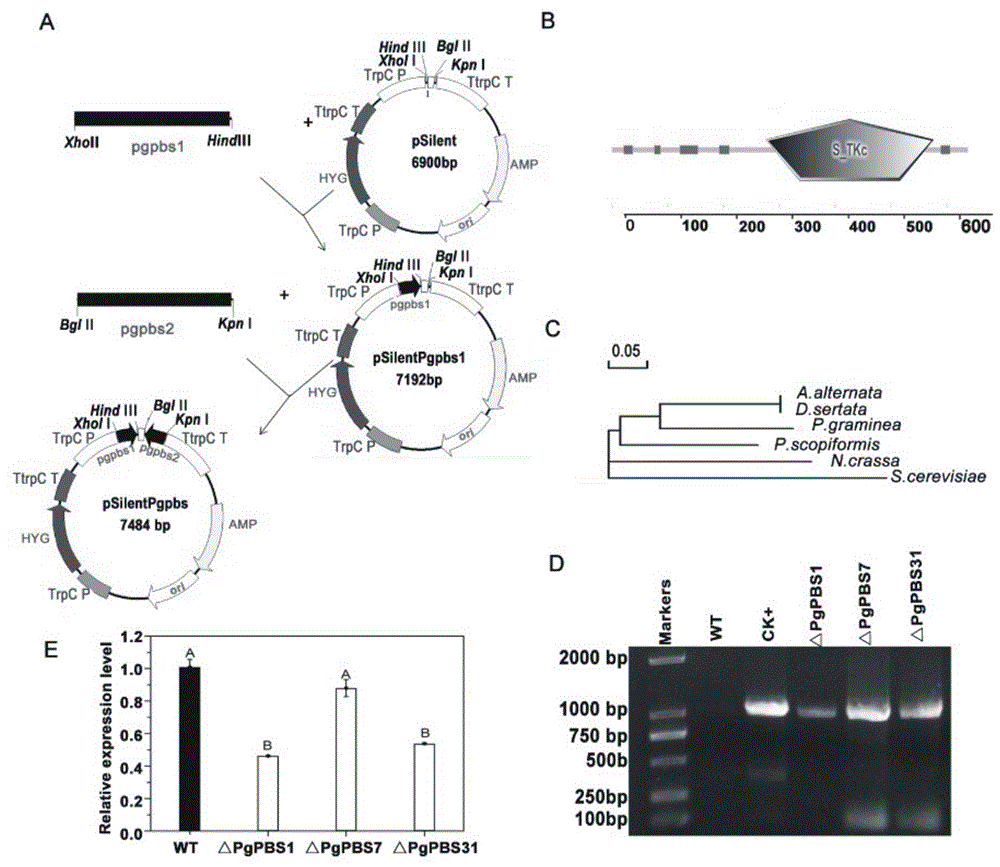
如附图1所示,其中,(a)编码pgpbs发夹的沉默构建体psilentpgpbs的示意图。构建体中的箭头指示pgpbs编码区的方向。(b)s_tkc功能域。(c)clustal1.83对pgpbs和pbs2同源物的系统发育分析。(d)qwc(wt)和沉默转化体△pgpbs1,△pgpbs7和△pgpbs31的pcr结果。(e)麦类核菌的pbs转化体△pgpbs1,△pgpbs7和△pgpbs31的相对表达量。根据duncan法,a和b表示未转化的wt和沉默的转化体(△pgpbs1,△pgpbs7和△pgpbs31)之间的显著差异(p<0.01);条形表示来自三次重复实验的标准误差。
pgpbs是一个长度为2075bp的基因,在该序列的核苷酸1597处有一个47bp的内含子。pgpbs编码676个氨基酸的蛋白质。蛋白质结构分析的结果表明存在s_tkc功能结构域(附图1b)。pgpbs的676个氨基酸序列与链格孢菌,赤霉病菌,红色面包霉,灰霉病菌和酿酒酵母中的相应序列具有相似性,分别为60.83%,60.83%,53%,56.58%和56%。系统发育分析发现,来自麦类核菌的a.altern和d.seriata的pbs序列组合在一起(附图1c)。
3、psilentpgpbs载体的构建
从上述cdna采用附图5中(pgpbs-bglii、pgpbs-kpni)和(pgpbs-hindiii、pgpbs-xhoi)引物分别扩增产物得到pgpbs1(292bp)和pgpbs2(292bp)片段,然后利用真菌沉默载体psilent-1构建psilentpgpbs,包含pgpbs1和pgpbs2片段的反向重复序列。接着采用xhoi和hindⅲ酶将pgpbs1片段和psilent-1载体消化,通过t4连接酶将pgpbs1片段连接到psilent-1载体的xhoi-hindⅲ位点。pgpbs2片段连接到psilentpgpbs1载体的kpni-bglⅱ位点,具体实验方法参照曲连海《哈茨木霉t88perg-22基因的功能研究》和李丽花《玉米大斑病菌钙调磷酸酶基因的功能研究》。
4、菌株原生质体制备
取直径为5-10mm的菌系小块,置于50ml的pda培养基上进行培养,接着将培养得到的真菌小块置于0.5-1ml的nl溶液中,30℃培养4-10h,其中nl溶液是由0.6mnacl和250-300mg/ml的细胞裂解酶组成。接着将培养液进行过滤,滤去残渣,将滤液再次置于nl溶液中,3500-4000rpm离心10-15min,收集原生质体,最后将原生质体置于stc溶液中保存备用。其中stc溶液是由0.7m的蔗糖,50mm的cacl2,10mmtris-hcl组成,ph=7.5。
5、psilentpgpbs载体转化
将100μl上述保存原生质体的stc溶液与1-10μg的psilentpgpbsdna混合,然后冰浴20-30min。接着将冰浴后的溶液置于100μl的ptc溶液中,轻轻震荡。其中ptc溶液是由60%的peg4000和stc溶液组成。将上述原生质体悬浮液置于冰上20min,再加入800-1000μl的ptc溶液,混合液常温静止15-20min。然后将静止后的溶液涂抹到再生培养基,在25-30°c条件下培养48-50h。将上述培养物置于含有100-150μg/ml潮霉素中,培养2-3d,直至形成单克隆斑点。挑取单克隆斑点,进行pcr扩增,转化株系的cdna溶解,测定其表达量。
为了研究pgpbs的作用,构建了pgpbs基因沉默的突变体。在基于潮霉素b抗性筛选转化体后,在50个真菌转化体中,随机选择三个pgpbs沉默突变体,并通过hpt特异性pcr分析用引物采用引物hyg-1/hyg-2鉴定(附图5)。这些突变体的预期长度为1026bp(附图1d),并通过实时pcr引物用pgpbs-f2和pgpbs-r2进行序列验证。与未转化的对照(qwc)相比,rnai转化体(△pgpbs1和△pgpbs31)中pgpbs转录水平显著降低(p=0.01)。与wt相比,△pgpbs1,△pgpbs31和△pgpbs7突变体的pgpbs相对表达减少了54%,46%和12%(附图1e)。这些结果证实已经分离出pgpbs沉默的麦类核菌菌株。
6、转化菌丝的生长鉴定
取直径为5-10mm的菌系小块,在25°c,黑暗条件下分别在全培养基,基本培养基,大麦琼脂培养基,v8琼脂培养基及pda培养基上进行培养,其中全培养基配方为:(cm:50ml/l20×硝酸盐,1ml/l微量元素,10g/ld-葡萄糖,2g/l蛋白胨,1g/l酵母提取物,1g/l酪蛋白氨基酸,1ml/l维生素溶液,和15g/l的琼脂),基本培养基的配方为:(mm:6g/lnano3,0.52g/lkcl,0.15g/lmgso4,1.52g/lkh2po4,0.01g/l硫胺素,1ml/l微量元素,10g/l葡萄糖和15g/l琼脂),大麦琼脂培养基的配方为:(bm:将50g大麦浸泡在1l蒸馏水中,70°c条件下温浴1h,过滤后加入15g琼脂),v8琼脂培养基的配方为:(100ml/lv8juice,0.2g/lcaco3,和15g/l琼脂)。
7、致病菌渗透性和细胞壁完整性观察及大麦条纹病致病性鉴定
菌丝小块置于含有5-10mm的h2o2,1-2m的nacl,0.5-1mm的cocl2,1-2m的山梨醇,0.5-1μg/ml的异菌脲及1.0-2μg/ml的戊唑醇的pda培养基上,在25-30°c黑暗条件下培养7-10d,并且观察菌丝的生长情况,菌丝生长速率(gr)的计算公式:gr=[(c–n)/(c–0.196)]×100,其中c为对照菌落的面积,n是处理菌落的面积。将菌盘置于添加了100µg/ml的刚果红,0.01%sds和200µg/ml的cfw的pda平板上,测定菌丝的生长速率及几丁质含量。同时,将菌丝涂抹至大麦叶片,25-30℃,16h光照/8h黑暗条件下进行培养2-3d,观察大麦叶片条纹病的诱发情况。
一种大麦条纹病致病性基因pgpbs的应用,具体包括:
(1)一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌渗透性的应用。
为了研究pgpbs在应激处理中的适应作用,wt和突变型(△pgpbs1,△pgpbs31,△pgpbs7)菌株进行以下处理:离子胁迫(na+),氧化应激(h2o2),重金属胁迫(cocl2),渗透胁迫(山梨糖醇)和杀真菌剂胁迫(二羧酰亚胺杀真菌剂和三唑戊唑醇杀真菌剂)。山梨醇胁迫下△pgpbs1,△pgpbs31和△pgpbs7的径向生长速率分别为8.6,9.4和11.4mm/d,nacl胁迫下的径向生长速率分别为2.7,3.1和5.0mm/d,而qwc的径向生长速率为11.0和5.57mm/d。与wt菌株相比,渗透(山梨糖醇)胁迫下△pgpbs1和△pgpbs31的生长速率受到显著抑制(△pgpbs1,71.1%;△pgpbs31,74.3%;wt,84.9%)和离子胁迫下(na+)(△pgpbs1,5.9%;△pgpbs31,7.9%;wt,21.1%)(p<0.05)。突变体△pgpbs7菌丝体的生长速率与wt相似。在过氧化氢(h2o2)和重金属(cocl2)应激物下形态变化没有显著差异(附图2b)。这些结果表明pgpbs与麦类核菌的渗透压和离子胁迫有关。
杀真菌剂敏感性测定结果表明,突变体△pgpbs1和△pgpbs31对异菌脲和戊唑醇的耐受性显著高于wt菌株(p<0.05)(附图2c;附图7)。△pgpbs1对异菌脲和戊唑醇的径向生长速率分别为6.1和4.2mm/d,△pgpbs31的相应径向生长速率分别为6.7和4.4mm/d,均高于wt的相应径向生长速率。△pgpbs1和△pgpbs31对异菌脲的百分比增长率(△pgpbs1,31.4%;△pgpbs31,28.3%;wt,20.4%,p<0.05)和戊唑醇(△pgpbs1,13.6%;△pgpbs31,13.4%;wt,8.25%,p<0.05)显著大于相应的wtqwc百分比生长速率。突变体△pgpbs7(19.8%和8.5%)菌丝体的生长速率与wt相似。因此,得出结论,pgpbs突变体对二羧酰亚胺和戊唑醇具有较强的耐受性。
(2)一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌细胞壁完整性的应用。
推测pgpbs突变菌丝对渗透和离子胁迫的敏感性升高可能与菌丝细胞壁结构和组成的完整性有关。为了验证这个假设,我们检测了突变体细胞壁的完整性。菌丝被接种到pda培养基,并且加入刚果红(100µg/ml),sds(0.01%)和cfw(200µg/ml)。突变体菌丝在sds和刚果红培养基上的生长速度与wt相似(附图4)。cfw培养基上△pgpbs1和△pgpbs31细胞增长率明显高于wt(△pgpbs1,32.6%和△pgpbs31,31.5%和wt,22.7%,p<0.05)(附图4c)。用荧光显微镜对几丁质真菌细胞壁成分进行荧光染色。在wt菌株qwc中,几丁质分子主要分布在隔膜中。相比之下,△pgpbs1和△pgpbs31细胞在cfw培养基上荧光沿菌丝轴(附图4b)。且△pgpbs1和△pgpbs31内几丁质含量明显高于wt(1.95%、1.77%和1.05%,p<0.05)(图4d)。这些结果表明,pgpbs能够调节细胞壁的完整性。
(3)一种大麦条纹病致病性基因pgpbs调控禾本科植物生长发育的应用。
禾本科植物中pgpbs的毒害主要表现在各种培养基中培养的真菌的生长。携带沉默子的pgpbs(△pgpbs1,△pgpbs31)的真菌菌落在pda,cm,bm,v8和mm培养基中的生长速率低于wt菌落(△pgpbs1:8.6,7.4,6.5,8.4和2.9mm/d;△pgpbs31:9.6,8.4,8.5,9.0和4.0mm/d;wt:分别为11.5,11.2,10.0,9.5和8.5mm/d)(附图2a;附图6)。在pda平板上生长的△pgpbs1和△pgpbs31的显微镜观察结果表明,与wt相比,菌丝体表现出畸形(附图3)。△pgpbs7菌丝体生长速度与wt无显著差异,pbs7菌丝体显微观察未发现变形(附图2a,附图6,附图3),这些结果证实pgpbs参与了调节禾本科植物的生长发育。
(4)一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌致病性的应用。
检测pgpbs的致病性,观察用菌丝体接种的大麦叶片。接种wt和△pgpbs7菌株的大麦叶片呈现严重的感染症状,如叶片变黄,叶片表面坏死和黄褐色病斑。相反,用△pgpbs1和△pgpbs31浸染的大麦叶片具有较轻的症状并且没有形成完整的病变(图4a)。然后将大麦种子用wt,△pgpbs1,△pgpbs31和△pgpbs7的菌丝体在4℃接种30天,以评估致病性。播种后14天观察大麦的生长趋势(附图4d)。感染wt和△pgpbs7的大麦生长缓慢并且在叶表面上显示出条纹(附图4b)。感染△pgpbs1和△pgpbs31的大麦生长旺盛,△pgpbs1(1%)和△pgpbs31(1.2%)的大麦叶条纹病发病率显著低于wt(18.3%)(p<0.05)(附图4e)。因此,突变体△pgpbs1和△pgpbs31的致病性低于wt。扫描电子显微镜的结果表明,wt的菌丝在叶片表面上形成明显的分枝,而突变体△pgpbs1和△pgpbs31菌丝生长较慢并且具有畸形分枝(附图4c)。
附图说明
图1为pgpbs沉默突变体的产生和鉴定。
其中,(a)编码pgpbs发夹的沉默构建体psilentpgpbs的示意图。构建体中的箭头指示pgpbs编码区的方向。(b)s_tkc功能域。(c)clustal1.83对pgpbs和pbs2同源物的系统发育分析。(d)qwc(wt)和沉默转化体△pgpbs1,△pgpbs7和△pgpbs31的pcr结果。(e)麦类核菌的pbs转化体△pgpbs1,△pgpbs7和△pgpbs31的相对表达量。根据duncan法,a和b表示未转化的wt和沉默的转化体(△pgpbs1,△pgpbs7和△pgpbs31)之间的显著差异(p<0.01);条形表示来自三次重复实验的标准误差。
图2为营养生长和高浓度溶质对wt和沉默转化体(△pgpbs1,△pgpbs7和△pgpbs31)生长的影响。
其中,(a)在25℃下培养7天后在不同培养基上的菌落形态。(b)在25℃下培养7天后,添加不同溶质的pda培养基上的菌落形态。(c)在25℃下培养7天后,添加二羧酰亚胺和戊唑醇的pda培养基上的菌落形态。右边的数据显示了每种胁迫条件下群体的生长速度。每个处理进行三次生物学重复。根据t检验,星号表示在p=0.05时wt和pgpbs突变体之间的显著差异。
图3在pda上培养7天的菌丝体(wt,△pgpbs1,△pgpbs7和△pgpbs31)的显微结构观察。
其中,白色箭头表示菌丝体变形的位置。
图4为大麦叶片的致病性实验观察结果。
其中,(a)用wt和△pgpbs1,△pgpbs31和△pgpbs7菌株的菌丝塞(5mm)接种2周龄大麦叶。在接种3天后进行观察。(b)典型的叶片是由大麦种子产生的,该菌种已经接种了来自wt,△pgpbs1,△pgpbs31和△pgpbs7的菌丝体,在4℃下培养30天。播种14天后接种。(c)在大麦叶片上生长的wt,△pgpbs1,△pgpbs31和△pgpbs7菌丝的扫描电子显微镜检查结果。(d)接种wt,△pgpbs1,△pgpbs31和△pgpbs7菌株的真菌菌丝在4℃下培养30天的大麦生长趋势。(e)菌株wt,△pgpbs1,△pgpbs31和△pgpbs7用“三明治”法侵染大麦叶片30天后的侵染率。星号表示各菌株之间的显著差异(p<0.05)。条形表示来自三次重复实验的标准误差。
图5为本发明所用引物序列。
图6为wt和突变体菌丝在不同培养基中的生长速率。
图7为各种应激物处理下wt和突变体的径向生长速率。
具体实施方式
为使发明的目的、技术方案和优点更加清楚,下面结合附图对本发明的具体实施方式进行详细说明。这些优选实施方式的示例在附图中进行了例示。附图中所示和根据附图描述的本发明的实施方式仅仅是示例性的,并且本发明并不限于这些实施方式。
在此,还需要说明的是,为了避免因不必要的细节而模糊了本发明的技术方案,在附图中仅仅示出了与根据本发明的方案密切相关的结构和/或处理步骤,而省略了关系不大的其他细节。
实施例1
本实施例提供一种大麦条纹病致病性基因pgpbs,该基因序列如序列表seqidno:1所示。
实施例2
本实施例提供一种鉴定大麦条纹病致病基因的方法,包括如下步骤:
1、大麦条纹病菌株的培养
从甘肃秦王川采集大麦叶片中分离菌丝(菌株编号qwc),将菌丝置于pd液体培养基中,在25-30℃,180-200rpm的摇床培养2-3d,收集菌丝细胞,用于dna,rna及原生质体的制备。pda固体培养基的配方为200g/l的马铃薯,20g/l的葡萄糖,15g/l的琼脂。pd液体培养基的配方为:200g/l的马铃薯,20g/l的葡萄糖。
2、pgpbs基因的克隆及序列分析
分别利用dna试剂盒(omegabiotekinc,norcross,ga)和rna试剂盒(omegabiotekinc)提取菌丝细胞的dna和rna。采用反转录试剂盒(takarabiotech,dalian,china)将上述rna进行反转录合成cdna。采用附图5所述引物(pgpbs-f1和pgpbs-r1)为特异性引物,将cdna和dna模板进行聚合酶链式反应pcr扩增,将扩增后的产物链接在pmd19-t载体上进行测序分析。测序分析采用上海生工生物工程技术服务有限公司测序完成。
如附图1所示,其中,(a)编码pgpbs发夹的沉默构建体psilentpgpbs的示意图。构建体中的箭头指示pgpbs编码区的方向。(b)s_tkc功能域。(c)clustal1.83对pgpbs和pbs2同源物的系统发育分析。(d)qwc(wt)和沉默转化体△pgpbs1,△pgpbs7和△pgpbs31的pcr结果。(e)麦类核菌的pbs转化体△pgpbs1,△pgpbs7和△pgpbs31的相对表达量。根据duncan法,a和b表示未转化的wt和沉默的转化体(△pgpbs1,△pgpbs7和△pgpbs31)之间的显著差异(p<0.01);条形表示来自三次重复实验的标准误差。
pgpbs是一个长度为2075bp的基因,在该序列的核苷酸1597处有一个47bp的内含子。pgpbs编码676个氨基酸的蛋白质。蛋白质结构分析的结果表明存在s_tkc功能结构域(附图1b)。pgpbs的676个氨基酸序列与链格孢菌,赤霉病菌,红色面包霉,灰霉病菌和酿酒酵母中的相应序列具有相似性,分别为60.83%,60.83%,53%,56.58%和56%。系统发育分析发现,来自麦类核菌的a.altern和d.seriata的pbs序列组合在一起(附图1c)。
3、psilentpgpbs载体的构建
从上述cdna采用附图5中(pgpbs-bglii、pgpbs-kpni)和(pgpbs-hindiii、pgpbs-xhoi)引物分别扩增产物得到pgpbs1(292bp)和pgpbs2(292bp)片段,然后利用真菌沉默载体psilent-1构建psilentpgpbs,包含pgpbs1和pgpbs2片段的反向重复序列。接着采用xhoi和hindⅲ酶将pgpbs1片段和psilent-1载体消化,通过t4连接酶将pgpbs1片段连接到psilent-1载体的xhoi-hindⅲ位点。pgpbs2片段连接到psilentpgpbs1载体的kpni-bglⅱ位点,具体实验方法参照曲连海《哈茨木霉t88perg-22基因的功能研究》和李丽花《玉米大斑病菌钙调磷酸酶基因的功能研究》。
4、菌株原生质体制备
取直径为5-10mm的菌系小块,置于50ml的pda培养基上进行培养,接着将培养得到的真菌小块置于0.5-1ml的nl溶液中,30℃培养4-10h,其中nl溶液是由0.6mnacl和250-300mg/ml的细胞裂解酶组成。接着将培养液进行过滤,滤去残渣,将滤液再次置于nl溶液中,3500-4000rpm离心10-15min,收集原生质体,最后将原生质体置于stc溶液中保存备用。其中stc溶液是由0.7m的蔗糖,50mm的cacl2,10mmtris-hcl组成,ph=7.5。
5、psilentpgpbs载体转化
将100μl上述保存原生质体的stc溶液与1-10μg的psilentpgpbsdna混合,然后冰浴20-30min。接着将冰浴后的溶液置于100μl的ptc溶液中,轻轻震荡。其中ptc溶液是由60%的peg4000和stc溶液组成。将上述原生质体悬浮液置于冰上20min,再加入800-1000μl的ptc溶液,混合液常温静止15-20min。然后将静止后的溶液涂抹到再生培养基,在25-30°c条件下培养48-50h。将上述培养物置于含有100-150μg/ml潮霉素中,培养2-3d,直至形成单克隆斑点。挑取单克隆斑点,进行pcr扩增,转化株系的cdna溶解,测定其表达量。
为了研究pgpbs的作用,构建了pgpbs基因沉默的突变体。在基于潮霉素b抗性筛选转化体后,在50个真菌转化体中,随机选择三个pgpbs沉默突变体,并通过hpt特异性pcr分析用引物采用引物hyg-1/hyg-2鉴定(附图5)。这些突变体的预期长度为1026bp(附图1d),并通过实时pcr引物用pgpbs-f2和pgpbs-r2进行序列验证。与未转化的对照(qwc)相比,rnai转化体(△pgpbs1和△pgpbs31)中pgpbs转录水平显著降低(p=0.01)。与wt相比,△pgpbs1,△pgpbs31和△pgpbs7突变体的pgpbs相对表达减少了54%,46%和12%(附图1e)。这些结果证实已经分离出pgpbs沉默的麦类核菌菌株。
6、转化菌丝的生长鉴定
取直径为5-10mm的菌系小块,在25°c,黑暗条件下分别在全培养基,基本培养基,大麦琼脂培养基,v8琼脂培养基及pda培养基上进行培养,其中全培养基配方为:(cm:50ml/l20×硝酸盐,1ml/l微量元素,10g/ld-葡萄糖,2g/l蛋白胨,1g/l酵母提取物,1g/l酪蛋白氨基酸,1ml/l维生素溶液和15g/l的琼脂),基本培养基的配方为:(mm:6g/lnano3,0.52g/lkcl,0.15g/lmgso4,1.52g/lkh2po4,0.01g/l硫胺素,1ml/l微量元素,10g/l葡萄糖和15g/l琼脂),大麦琼脂培养基的配方为:(bm:将50g大麦浸泡在1l蒸馏水中,70°c条件下温浴1h,过滤后加入15g琼脂),v8琼脂培养基的配方为:(100ml/lv8juice,0.2g/lcaco3,和15g/l琼脂)。
7、致病菌渗透性和细胞壁完整性观察及大麦条纹病致病性鉴定
菌丝小块置于含有5-10mm的h2o2,1-2m的nacl,0.5-1mm的cocl2,1-2m的山梨醇,0.5-1μg/ml的异菌脲及1.0-2μg/ml的戊唑醇的pda培养基上,在25-30°c黑暗条件下培养7-10d,并且观察菌丝的生长情况,菌丝生长速率(gr)的计算公式:gr=[(c–n)/(c–0.196)]×100,其中c为对照菌落的面积,n是处理菌落的面积。将菌盘置于添加了100µg/ml的刚果红,0.01%sds和200µg/ml的cfw的pda平板上,测定菌丝的生长速率及几丁质含量。同时,将菌丝涂抹至大麦叶片,25-30℃,16h光照/8h黑暗条件下进行培养2-3d,观察大麦叶片条纹病的诱发情况。
实施例3
本实施例提供一种大麦条纹病致病性基因pgpbs的应用,具体包括:
一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌渗透性的应用。
为了研究pgpbs在应激处理中的适应作用,wt和突变型(△pgpbs1,△pgpbs31,△pgpbs7)菌株进行以下处理:离子胁迫(na+),氧化应激(h2o2),重金属胁迫(cocl2),渗透胁迫(山梨糖醇)和杀真菌剂胁迫(二羧酰亚胺杀真菌剂和三唑戊唑醇杀真菌剂)。山梨醇胁迫下△pgpbs1,△pgpbs31和△pgpbs7的径向生长速率分别为8.6,9.4和11.4mm/d,nacl胁迫下的径向生长速率分别为2.7,3.1和5.0mm/d,而qwc的径向生长速率为11.0和5.57mm/d。与wt菌株相比,渗透(山梨糖醇)胁迫下△pgpbs1和△pgpbs31的生长速率受到显著抑制(△pgpbs1,71.1%;△pgpbs31,74.3%;wt,84.9%)和离子胁迫下(na+)(△pgpbs1,5.9%;△pgpbs31,7.9%;wt,21.1%)(p<0.05)。突变体△pgpbs7菌丝体的生长速率与wt相似。在过氧化氢(h2o2)和重金属(cocl2)应激物下形态变化没有显著差异(附图2b)。这些结果表明pgpbs与麦类核菌的渗透压和离子胁迫有关。
杀真菌剂敏感性测定结果表明,突变体△pgpbs1和△pgpbs31对异菌脲和戊唑醇的耐受性显著高于wt菌株(p<0.05)(附图2c;附图7)。△pgpbs1对异菌脲和戊唑醇的径向生长速率分别为6.1和4.2mm/d,△pgpbs31的相应径向生长速率分别为6.7和4.4mm/d,均高于wt的相应径向生长速率。△pgpbs1和△pgpbs31对异菌脲的百分比增长率(△pgpbs1,31.4%;△pgpbs31,28.3%;wt,20.4%,p<0.05)和戊唑醇(△pgpbs1,13.6%;△pgpbs31,13.4%;wt,8.25%,p<0.05)显著大于相应的wtqwc百分比生长速率。突变体△pgpbs7(19.8%和8.5%)菌丝体的生长速率与wt相似。因此,得出结论,pgpbs突变体对二羧酰亚胺和戊唑醇具有较强的耐受性。
一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌细胞壁完整性的应用。
我们推测pgpbs突变菌丝对渗透和离子胁迫的敏感性升高可能与菌丝细胞壁结构和组成的完整性有关。为了验证这个假设,我们检测了突变体细胞壁的完整性。菌丝被接种到pda培养基,并且加入刚果红(100µg/ml),sds(0.01%),和cfw(200µg/ml)。突变体菌丝在sds和刚果红培养基上的生长速度与wt相似(附图4)。cfw培养基上△pgpbs1和△pgpbs31细胞增长率明显高于wt(△pgpbs1,32.6%和△pgpbs31,31.5%和wt,22.7%,p<0.05)(附图4c)。用荧光显微镜对几丁质真菌细胞壁成分进行荧光染色。在wt菌株qwc中,几丁质分子主要分布在隔膜中。相比之下,△pgpbs1和△pgpbs31细胞在cfw培养基上荧光沿菌丝轴(附图4b)。且△pgpbs1和△pgpbs31内几丁质含量明显高于wt(1.95%、1.77%和1.05%,p<0.05)(图4d)。这些结果表明,pgpbs能够调节细胞壁的完整性。
一种大麦条纹病致病性基因pgpbs调控禾本科植物生长发育的应用。
禾本科植物中pgpbs的毒害主要表现在各种培养基中培养的真菌的生长。携带沉默子的pgpbs(△pgpbs1,△pgpbs31)的真菌菌落在pda,cm,bm,v8和mm培养基中的生长速率低于wt菌落(△pgpbs1:8.6,7.4,6.5,8.4和2.9mm/d;△pgpbs31:9.6,8.4,8.5,9.0和4.0mm/d;wt:分别为11.5,11.2,10.0,9.5和8.5mm/d)(附图2a;附图6)。在pda平板上生长的△pgpbs1和△pgpbs31的显微镜观察结果表明,与wt相比,菌丝体表现出畸形(附图3)。△pgpbs7菌丝体生长速度与wt无显著差异,pbs7菌丝体显微观察未发现变形(附图2a,附图6,附图3)这些结果证实pgpbs参与了调节禾本科植物的生长发育。
一种大麦条纹病致病性基因pgpbs降低大麦条纹病致病菌致病性的应用。
检测pgpbs的致病性,观察用菌丝体接种的大麦叶片。接种wt和△pgpbs7菌株的大麦叶片呈现严重的感染症状,如叶片变黄,叶片表面坏死和黄褐色病斑。相反,用△pgpbs1和△pgpbs31浸染的大麦叶片具有较轻的症状并且没有形成完整的病变(图4a)。然后将大麦种子用wt,△pgpbs1,△pgpbs31和△pgpbs7的菌丝体在4℃接种30天,以评估致病性。播种后14天观察大麦的生长趋势(附图4d)。感染wt和△pgpbs7的大麦生长缓慢并且在叶表面上显示出条纹(附图4b)。感染△pgpbs1和△pgpbs31的大麦生长旺盛,△pgpbs1(1%)和△pgpbs31(1.2%)的大麦叶条纹病发病率显著低于wt(18.3%)(p<0.05)(附图4e)。因此,突变体△pgpbs1和△pgpbs31的致病性低于wtqwc。扫描电子显微镜的结果表明,wt的菌丝在叶片表面上形成明显的分枝,而突变体△pgpbs1和△pgpbs31菌丝生长得较慢并且具有畸形分枝(附图4c)。
有益效果:本发明涉及一种鉴定大麦条纹病致病基因的方法,基于同源克隆技术扩增pgpbs基因,通过rna干扰(rnai)技术获得pgpbs沉默的转化体,进一步获得该基因在渗透反应、营养分化、细胞壁完整性、抗药性和致病性等方面的应用。
以上所述仅是本申请的具体实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本申请原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本申请的保护范围。
序列表
<110>甘肃农业大学
<120>一种大麦条纹病致病性基因pgpbs及其应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>2075
<212>dna
<213>麦类核菌(drechsleragraminea)
<400>1
atggccgactctgacccgtctaccccggacgtccacggcgattccgacaccgtcttcgat60
agcccttcaccctctcctgcaccgtcttctcctcctgcgccctctagccccaaggccgac120
accgatgccgccttcctgtccgccgaccgtcccccaccgcgaaccgcatccaccacaggc180
gcgacggccaacatgacgtcttcgtcaacaccactgggcaacatcaatgctgcgagaaat240
ccacgccctgcaaaccctcctaccatctccagcagaggcagcggtctcaacgtctcccaa300
gatatcctggccaggatacaagcagtccatcttggccggaaaggcgccccgccaaccggc360
ttgccaggaagagggcctgcgccccagagccctggtccgtcgcccaacagcaataatcca420
atgtcgccgccaggcggaaacatgggaggtgtacctggcaacttccgaatgcctgtcaga480
ccgccgacgaccaacttccagtcagctccagccgtccccggccgcgcaggcggccccaag540
ccttccatggccgaacggcgtggcatgaatctcggtggctttccgggcgcgtctcccccg600
ggcgctcctgctggcaggaagaagcccggcctgacgctctcgcaaatgaatggagacaaa660
cctgaagactcagcagagccgcgcaagcaagaaacccactttgacaagttttcccagttt720
gtcgacaccaagaccggcagcctcaagttcgcgggcaaggctatactgaactcggacggt780
gtacaattcgctagcggctcctccttcaacatctcgctagacgaagtcgatacgctagac840
gaacttggcaagggcaactatggcacagtatacaaggtcagacatagcagaccacggatg900
cgaaaaccgggacagggcctcgcaggaaacaaggctgctccaggctcgccgtcgcgaaag960
aactttgacgaagaaccgagcctcaacggcgtgcctgccgcaggcaccggcatcatcatg1020
gcaatgaaagaagtccggcttgaattggacgactcaaagtttgctgctatcatcatggag1080
ctggatgtcctccatcgctgtatatcacccttcatcgtcgatttctacggcgccttcttc1140
caagaaggtgctgtgtacatatgcatggagttcatggacggtggttcgatagacaagctt1200
tacgccgacggtgtgcccgaaggcgtgctgcggaaaataaccatggcgacgactatgggt1260
ttgaagtcattaaaggatgagcacaacatcattcaccgcgacgtaaagcccaccaacatc1320
ttgatgaacaccaaaggacagatcaagatctgtgatttcggtgtcagcggcaacttggtg1380
gccagtattgccaagaccaacatcggatgccaaagttacatggcgcccgagaggatatct1440
tctggtggcattgcacaagcaggcgccaaccccggaggcggcacatacagcgtccaaagt1500
gacatctggagtctcggactgacgataatcgagtgcgctctgggacgatatccctaccct1560
ccagaaacgtacaacaacatcttcagtcaactcagtgtaggtatctctgctggcatttca1620
atccttttactaatcacttgtaggcaattgtcgatggcgaaccgccggatctacctgcgg1680
agggatactctgatgcagcgcggaactttgtacgcggctgcttgaacaagattcctaacc1740
tccgaccaacatacgccatgttgcttcaacatgcgtggcttgcacctctcgccaagccag1800
acacaatcacagaagaggaagaggaagaagtggaagcagcaaatgaagcagctagtggcg1860
aagcagttggcgaccagggccccgccgaagcaattgacatggtagaagacaaggaagtag1920
cggattgggtaaaagccgccattgagaagaggaggagtggtaagatgaagggcgcggaaa1980
aaccggctctgcatgccgcacctttagatgcatcggtccaaagcccttcgccaaacggta2040
caaacggactggaaactgcggaagttgctgcgtaa2075
- 还没有人留言评论。精彩留言会获得点赞!