核酸编码的CAR-T细胞及其制备方法和应用与流程
本发明属于医学诊疗领域,涉及一种免疫治疗细胞及其制备方法,特别是涉及一种可精确靶向肿瘤细胞的免疫细胞及其制备方法。
背景技术:
癌症,是恶性肿瘤中最常见的一类,其致死率已跃居首位,据世界卫生组织统计,全世界每年约有400万人死于癌症。若治疗不及时,癌细胞会对身体持续啃蚀,直至夺走生命。传统上常使用的治疗手段是手术、化疗放疗等,但结果往往差强人意,接受治疗的患者5年存活率仅有50%左右。
免疫治疗旨在激活人体免疫系统,依靠自身免疫机能杀伤肿瘤细胞。免疫细胞是其中的关键一环,作为人体免疫的第三道防线,淋巴细胞在机体免疫应答中起到至关重要的作用。由于其免疫原性低、毒副作用小及生物相容性好等特性,淋巴细胞已被广泛地作为免疫治疗工具。近年来,嵌合抗原受体t细胞(car-t细胞)免疫疗法逐步走入人类的视野,因其是通过改造患者自身的t淋巴细胞实现对肿瘤细胞的靶向及杀伤,相较于其它的治疗方法,保证特异性、有效性的同时,安全性是绝对无可厚非的。
已存在的car-t细胞主要还存在以下几个问题:i.制备方面,体外t细胞的改造还存在操作复杂、耗时长等不足。ii.靶向方面,肿瘤细胞表达的大多数抗原是非特异性,靶向肿瘤细胞的同时也会识别正常细胞,脱靶效应严重。iii.效能方面,car-t细胞的大量回输,会给机体带来超负荷的细胞因子强度,毒副作用明显。因此,制备出简便、有效的car-t细胞用于肿瘤细胞的靶向及杀伤,将具有重要的研究意义和应用价值。
技术实现要素:
针对上述现有技术的不足,本发明提供一种核酸编码的car-t细胞的制备方法,选用生物相容性好的dna和t细胞作为原料,制备得到核酸编码的car-t细胞。该细胞具有良好的靶向识别能力,通过调控细胞表面修饰抗体的量有效控制细胞因子释放,安全、有效地促进对肿瘤细胞的杀伤。同时该方法能够有效解决car-t细胞制备的繁杂问题,针对癌细胞发展过程中表面特征分子的突变,可以通过及时调整修饰抗体的种类应对,有效改善靶标率,克服car-t细胞治疗脱靶严重、毒副作用强的不足。
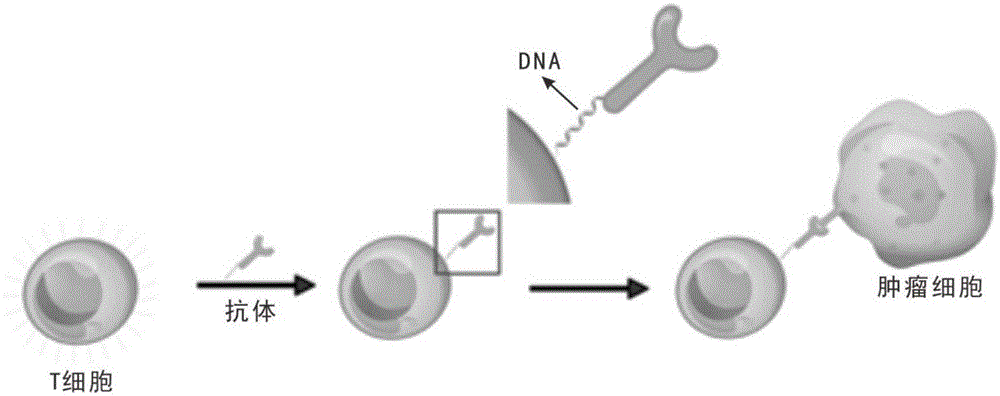
本发明制备可促进肿瘤细胞杀伤的核酸编码的car-t细胞的治疗机理如图1所示,具体为:t细胞与抗体分别用两条互补的dna链修饰,两者混合时,通过dna链杂交作用,将抗体修饰到t细胞表面,最终形成核酸编码的car-t细胞。
根据上述原理,本发明采用如下的技术方案:
本发明提供了一种核酸编码的car-t细胞的制备方法,包括以下步骤:
(1)将细胞与末端修饰有胆固醇的单链dna混合于培养基中,孵育,得到修饰有单链dna的细胞;
(2)然后,向步骤(1)的体系(含有修饰有单链dna的细胞)中,加入互补链dna修饰的抗体,混合均匀,孵育,得到所述核酸编码的car-t细胞。
本发明为保证连接效率,所选用的dna的碱基个数应大于等于10。
在一具体实施方式中,
步骤(1)中,所述修饰有单链dna的细胞中,所述单链dna的序列如seqidno.1所示:cacacacacacacacacacatttttttt。
步骤(2)中,所述互补链dna修饰的抗体中,所述互补链dna的序列如seqidno.2所示:tgtgtgtgtgtgtgtgtgtgtttttttt。
步骤(1)中所述单链dna与步骤(2)中所述互补链dna还可以用dna的纳米结构替代。
步骤(1)中,所述细胞为t细胞,包括jurkat、kit225等中的一种或多种;优选地,为kit225。
本发明步骤(1)中所述末端修饰有胆固醇的单链dna为商业用品,购买自生工生物工程(上海)股份有限公司。
优选地,所述末端修饰有胆固醇的单链dna为3’端胆固醇修饰的单链dna。
步骤(1)中,所述细胞与单链dna的加入比例为:100μl1×106/ml的细胞中,加入终浓度为8μmol/l~16μmol/l的单链dna;优选地,为10μmol/l。
步骤(1)中,通过将末端修饰有胆固醇的单链dna直接嵌入细胞膜表面,得到修饰有单链dna的细胞。
步骤(1)中,所述细胞培养基为1640培养基,所述培养基的组分及比例为90%1640培养基、10%胎牛血清、1%双抗以及150u/ml白介素-2,ph约为7.0。
本发明所述细胞培养基并不限制于上述1640培养基,任何能实现培养对应t细胞的目的的培养基都可以用于本发明。
步骤(1)中,所述细胞孵育的条件为37℃、5%co2孵育。
步骤(1)中,所述细胞孵育的时间为1~2小时;优选地,为1小时。
步骤(2)中,所述抗体可以用任何一种或者多种具有靶向识别的分子替代。
其中,具有靶向识别的分子包括但不限于叶酸分子、生物素分子、肿瘤坏死因子、胆酸等中的一种或多种。
步骤(2)中,所述互补链dna修饰的抗体利用异-双功能基试剂实现抗体与dna的连接。
其中,所述异-双功能基试剂包括spdp、smcc、emcs、gmbs等中的一种或多种;优选地,为spdp。
步骤(2)中,所述修饰有单链dna的细胞与互补链dna修饰的抗体的添加比例为:每100μl1×106的细胞中,抗体的加入量为10-30μg;优选地,为10、20、30μg;进一步优选地,为30μg。
步骤(2)中,所述孵育的条件为37℃、5%co2孵育。
步骤(2)中,所述孵育的时间为1~2小时;优选地,为1小时。
本发明步骤(2)之前还包括预处理步骤,除去步骤(1)中过量的修饰有胆固醇的单链dna的步骤。
本发明除去步骤(1)中过量的修饰有胆固醇的单链dna和清洗修饰有dna的细胞的具体步骤为:1000rpm,离心5分钟,此时细胞沉于底部,过量的dna游离于上清液;除去上清液,加入约1ml的pbs,上下吹打几次,1000rpm,离心5分钟;重复2~3次;
1000rpm,离心5分钟,除去上清液,加入与起始培养基的组成、含量、体积一致的培养基,重新分散,得到经提纯的含有修饰有单链dna的细胞体系。
具体地,所述步骤包括:
(1)将1×105个细胞分散于培养基中,加入修饰有胆固醇的dna,使其终浓度达到10μmol/l,混合均匀。置于37℃、5%co2培养箱孵育1小时,得到修饰有单链dna的细胞。
(2)将上述步骤(1)的细胞液用pbs清洗三次,加入修饰有dna的抗体,混合均匀,置于37℃、5%co2培养箱孵育1小时,得到所述核酸编码的car-t细胞。
其中,步骤(1)中,在加入修饰有胆固醇的dna后,用移液枪反复吹打,这样有助于细胞与dna在溶液中混合均匀。
本发明还提出了由上述制备方法制备得到的核酸编码的car-t细胞。
本发明制备得到的核酸编码的car-t细胞为表面修饰有特定抗体的t细胞,抗体的修饰量可以通过简单的调节dna的修饰量得以控制,该抗体的靶标物为肿瘤细胞表面特征分子,因此所制备的核酸编码的car-t细胞具备良好的肿瘤靶向性;同时,仅需替换抗体的种类即可实现对不同肿瘤细胞的靶向识别。
本发明提出的核酸编码的car-t细胞制备简单、生物相容性好,靶向性强,安全性高。相较于传统car-t长达数周甚至数月的制备过程,本发明仅需约7-9个小时(包括细胞表面dna修饰约1-2小时、抗体上dna修饰约5小时、细胞抗体组装约1-2小时等),即可完成全部car-t细胞的制备。本发明由于抗体修饰只作用于细胞膜表面,不会对细胞本身的蛋白表达造成影响,同时排除了传统car-t细胞疗法中基因插入的随机性。
本发明所述核酸编码的car-t细胞在多靶标精准定向及靶向多种肿瘤细胞中明显具有灵活多变的优势。
本发明还提出了所述核酸编码的car-t细胞在促进肿瘤细胞识别、杀伤过程中的应用。
其中,所述肿瘤细胞包括急性b淋巴细胞白血病细胞、前列腺癌细胞、胰腺癌细胞等。
其中,所述急性b淋巴细胞白血病细胞为k562细胞。
本发明还提出了所述核酸编码的car-t细胞在作为免疫治疗细胞中的应用。
本发明还提出了所述核酸编码的car-t细胞在癌症治疗中的应用。
本发明还提出了所述核酸编码的car-t细胞可以精确靶向肿瘤细胞。
其中,所述肿瘤细胞包括急性b淋巴细胞白血病细胞、前列腺癌细胞、胰腺癌细胞等。
其中,所述急性b淋巴细胞白血病细胞为k562细胞。
本发明中所述核酸编码的car-t细胞用于癌症治疗,具有如下特征:①靶向准确,同时可实现多种靶标分子的定向;②锚定分子可根据需求进行替换,应用范围更广;③细胞表面修饰分子量高度可控,显著减小细胞因子风暴。
本发明中所述核酸编码的car-t细胞,包括但不限于作为免疫治疗细胞。
本发明中所述核酸编码的car-t细胞,包括但不限于用于癌症治疗。
本发明所提供的核酸编码的car-t细胞的制备方法,反应条件简单,修饰步骤少,耗时短,生产成本低。本发明所提供的核酸编码的car-t细胞用于癌症治疗,具有生物相容性好、靶向性强、细胞毒性小、安全性高、灵活多变(本发明所用材料为核酸,生命体本身固有,因此生物相容性好、细胞毒性小、安全性高;图3是本发明制备好的car-t细胞与相应肿瘤细胞的粘附情况,由于修饰了靶向肿瘤特征分子的抗体,四周的car-t细胞紧紧环绕中心的癌细胞,印证其良好的靶向性)的优点,准确靶向肿瘤细胞,而对正常细胞无损伤。本发明所述的基于dna链杂交的car-t细胞不含任何刺激性成分,毒副作用小。另外,本发明可以通过改变所修饰抗体的种类即可实现对不同肿瘤细胞的靶向,因此可实现对相关肿瘤细胞的杀伤。本发明所提供的基于dna链杂交的car-t细胞用于前期癌症治疗,具有潜在的应用价值。
附图说明
图1是本发明制备核酸编码的car-t细胞的机理图。
图2是本发明实施例1中在不同dna浓度梯度下制备所得的核酸编码的car-t细胞。
图3是治疗组a在孵育1h后的细胞间粘附情况。
图4是治疗组b、对照组孵育18h后,细胞因子释放情况。
图5是t细胞修饰抗体前后对靶细胞的杀伤情况。
图6是分别注射t细胞修饰抗体前后的小鼠存活率情况。
具体实施方式
结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。
实施例1
(1)将1×105个t细胞与修饰有胆固醇的dna混合于培养基中,使dna终浓度达10μmol/l,37℃、5%co2孵育1个小时,得到修饰有单链dna的细胞;
(2)待步骤(1)中修饰有单链dna的细胞清洗后,加入互补链dna修饰的抗体,混合均匀,37℃、5%co2孵育1个小时,得到所述核酸编码的car-t细胞。
实施例2
(1)将1×105个t细胞与修饰有胆固醇的dna混合于培养基中,37℃、5%co2孵育1个小时,得到修饰有单链dna的细胞;
(2)待步骤(1)中修饰有单链dna的细胞清洗后,加入互补链dna修饰的抗体,混合均匀,37℃、5%co2孵育1个小时,得到所述核酸编码的car-t细胞。
调整步骤(1)中dna的加入量,可以有效的控制细胞表面分子的修饰量。将1×105个t细胞与修饰有胆固醇的dna混合于培养基中,使得dna的终浓度分别达到0、2、4、8、16μmol/l,37℃、5%co2孵育1个小时,得到修饰有单链dna的细胞。如图2所示,dna的加入量将直接影响细胞表面的修饰;同时,更换互补链dna修饰的抗体种类,即可制备靶向性不同的car-t细胞,说明了核酸编码的car-t细胞具有良好的可控性。
实施例3:
以本发明实验例1中制备的核酸编码的car-t细胞用于肿瘤细胞k562的杀伤,作为治疗组。
本实验采用体外细胞实验作为癌症治疗模型。通过在肿瘤细胞k562中加入核酸编码的car-t细胞,观察car-t细胞与肿瘤细胞k562的粘附情况,评价核酸编码的car-t细胞的靶向作用。
(1)建模
将表面表达有靶标分子的肿瘤细胞k562进行清洗,按照每孔2×104个细胞置于96孔板中孵育,作为待治疗的肿瘤。
(2)实验
将1×105个核酸编码的car-t细胞加入治疗组肿瘤细胞k562中,混合均匀,37℃、5%co2孵育。在加入核酸编码的car-t细胞前,先对肿瘤细胞k562进行hoechst染色,便于后期观察。孵育1个小时后,通过荧光显微镜观察肿瘤细胞k562的状态。
(3)结果
如图3所示,经过1h后,核酸编码的car-t细胞和肿瘤细胞k562粘附在一起。t细胞一开始的加入量是肿瘤细胞k562的5倍,由图3可以看出,一个肿瘤细胞k562(体积较大,位于中心)周围环绕多个t细胞(体积较小),并紧紧依附,与实验预设一致,这说明本发明实施例1制备的基于dna链杂交的car-t细胞具有较好的靶向性。
实施例4:
以本发明实验例1中制备的核酸编码的car-t细胞用于肿瘤细胞k562的杀伤,作为治疗组。
本实验采用体外细胞实验作为癌症治疗模型。通过在肿瘤细胞k562中加入核酸编码的car-t细胞,观察细胞因子释放情况,评价产品的杀伤作用。
(1)建模
将表面表达有靶标分子的肿瘤细胞k562进行清洗,按照每孔2×104个细胞置于96孔板中孵育,作为待治疗的肿瘤。
(2)实验分组
将建模成功的肿瘤细胞k562随机分为a、b两组,每组3孔。
a治疗组:加入核酸编码的car-t细胞作为治疗组。
b对照组:加入未修饰的t细胞作为对照组。
将1×105个核酸编码的car-t细胞加入治疗组肿瘤细胞k562中,混合均匀,37℃、5%co2孵育。对照组加入1×105个未修饰的t细胞(其中,“对照组”中的t细胞与“核酸编码的car-t细胞”中的t细胞相同),混合均匀,37℃、5%co2孵育。孵育18个小时后,收集a治疗组与b对照组的上清液,进行细胞因子酶联免疫分析。
(3)结果
如图4所示,孵育18小时后,通过治疗组、对照组细胞因子释放量的比较,明显观察到核酸编码的car-t细胞所释放的细胞因子量明显高于未修饰t的细胞,即治疗组的杀伤作用远胜于对照组,说明本发明实施例1制备的核酸编码的car-t细胞用于癌症治疗具有良好的效果。
实施例5:
以本发明实验例1中制备的核酸编码的car-t细胞用于肿瘤细胞k562的杀伤,作为治疗组。
本实验采用体外细胞实验作为癌症治疗模型。通过在肿瘤细胞k562中加入核酸编码的car-t细胞,观察肿瘤细胞凋亡情况,评价产品的杀伤作用。
(1)建模
将表面表达有靶标分子的肿瘤细胞k562进行清洗,作为待治疗的肿瘤,记作治疗组a。
同时,将表面没有靶标分子的另一种细胞(hela)进行清洗,作为待治疗的肿瘤,记作治疗组b。
(2)实验
将建模成功的a、b两组肿瘤细胞各自随机分为5组(a1~a5;b1~b5),每组3孔,按照每孔2×104个细胞置于96孔板中孵育。
a治疗组:按比例加入核酸编码的car-t细胞。
b治疗组:按比例加入核酸编码的car-t细胞。
按照比例将核酸编码的car-t细胞分别加入到治疗组a1~a5;b1~b5中,混合均匀,37℃、5%co2孵育。孵育3个小时后,对治疗组肿瘤细胞k562和hela分别进行annexinv/pi染色,通过流式细胞仪检测。
(3)结果
如图5所示,孵育3小时后,通过a、b两个治疗组肿瘤细胞凋亡情况的比较,明显观察到a组肿瘤细胞k562的凋亡量明显高于b组,即核酸编码的car-t细胞对治疗组a的杀伤作用远胜于治疗组b,说明本发明实施例1制备的核酸编码的car-t细胞可有效靶向相关肿瘤细胞并产生杀伤作用,即用于癌症治疗具有良好的效果。
实施例6:
以本发明实验例1中制备的核酸编码的car-t细胞用于肿瘤细胞的杀伤,作为治疗组。
本实验采用移植肿瘤的免疫缺陷小鼠作为癌症治疗模型。通过静脉注射核酸编码的car-t细胞,记录小鼠生长情况,以此来评价产品治疗癌症的效能。
(1)造模
取周龄4~6周的scid小鼠,于腹腔内接种5*104个k562肿瘤细胞/只,共6只。
(2)动物分组
建模成功的6只小鼠饲养一周后,随机分为a、b两组,每组3只,a为治疗组,b为对照组。
a治疗组:每天通过尾部静脉注射106个核酸编码的car-t细胞,连续5天。
b对照组:每天通过尾部静脉注射106个未修饰的t细胞(其中,“对照组”中的t细胞与“核酸编码的car-t细胞”中的t细胞相同),连续5天。
具体为,每天先给予小鼠100mg/kg的安道生,再分别通过尾部静脉注射106个核酸编码的car-t细胞(a治疗组)、106个未修饰的t细胞(b对照组),无菌鼠框内饲养。连续实施5天,观察记录小鼠生长情况。
(3)结果
如图6所示,饲养过程中,通过a、b两组小鼠生长情况的比较,观察到a组小鼠生长情况明显优于b组,且a组小鼠的平均存活时间长于b组,说明本发明实施例1制备的核酸编码的car-t细胞可对活体内k562肿瘤细胞产生杀伤,有效延长生命,即用于癌症治疗具有良好的效果。
如上所述仅为本发明的几个具体实施例,并不用于限制本发明。凡在本发明的精神和原则之内,采用与其相同或相似方法所得到的基于dna链杂交的car-t细胞用于癌症诊疗,均在本发明保护范围内。
sequencelisting
<110>华东师范大学
<120>核酸编码的car-t细胞及其制备方法和应用
<160>2
<170>patentinversion3.3
<210>1
<211>28
<212>dna
<213>人工合成
<400>1
cacacacacacacacacacatttttttt28
<210>2
<211>28
<212>dna
<213>人工合成
<400>2
tgtgtgtgtgtgtgtgtgtgtttttttt28
- 还没有人留言评论。精彩留言会获得点赞!