一种利用重组胞内RNA支架固定重组酶促进细胞催化阿洛醇生产的方法与流程
本发明涉及一种利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇(蒜糖醇)生产的方法。属于生物化工领域。
背景技术:
阿洛醇(蒜糖醇)是一种六碳的稀有糖醇,可在食品工业中用作无能量甜味剂或膨体剂,是治疗糖尿病、癌症和艾滋病的医药中间体,也是治疗便秘的药物。它还可以作为底物生产其他类型的d或l型稀有糖,如d/l-阿拉伯糖和d/l-阿洛糖。
阿洛醇在自然界中含量极低。因此,从自然资源中提取没有经济效益,并且会对环境造成严重破坏。化学合成阿洛醇工艺复杂,产率低,会产生有毒性的副产物。相比之下,生物转化是生产阿洛醇的理想方法。
在细胞中,对于天然的多酶反应途径,酶分子通常在物理和空间上组织成支架或簇或微腔。空间组织有助于底物在相互作用蛋白之间的流动,限制了不同中间代谢物之间的串扰,增加酶分子周围底物的浓度,加速了反应过程。但是,对于大多数表达多酶催化反应的重组菌株,表达的酶分子会在细胞内随机分布,造成不利影响。申请人研究发现在细胞内设置二维的三角形网状rna支架有助于使重组酶分子锚定到支架相邻位置,克服上述不利影响,有望在发酵生产中得到应用。检索显示,有关利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇(蒜糖醇)生产的方法还未见报道。
技术实现要素:
针对现有技术的不足,本发明要解决的问题是提供一种利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇(蒜糖醇)生产的方法。
本发明所述的利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇生产的方法,步骤是:
(1)构建用于细胞内重组蛋白固定的三角形网状rna支架;
合成一段如seqidno.6所示的dna序列,利用引物1和2将质粒pet22b线性化,根据同源重组构建重组质粒pet22b-scaffold;将同源重组液转化到dh5α感受态细胞中,通过菌落pcr验证获得阳性转化子,再提取重组质粒pet22b-scaffold,通过重组质粒转化到大肠杆菌中实现支架的构建;其中,所述引物1和2如下:
引物1:5’>ccctatagtgagtcgtattaacctaatgcaggtcccggaaga<3’,下划线序列为与pet22b质粒重叠序列;
引物2:5’>ccaatggcgcgccgagcttggcgtaatgctcgccacttcgggctcatgagcg<3’,下划线序列为与pet22b质粒重叠序列;
(2)构建三角形网状rna支架锚定核糖醇脱氢酶和甲酸脱氢酶的重组质粒;
从genebank基因库中查询获得的核糖醇脱氢酶基因片段和甲酸脱氢酶基因片段,利用大肠杆菌密码子偏好性进行密码子优化,确定seqidno.4所示的pp7的适配体序列和seqidno.5所示的biv-tat的适配体序列,将biv-tat标记fdh,将pp7标记rdh,利用引物5和6合成pp7-rdh和biv-tat-fdh基因,利用引物7,引物8通过pcr扩增得到核糖醇脱氢酶基因序列,利用引物9,引物10通过pcr扩增得到甲酸脱氢酶基因序列,同时利用引物3和4将pacycduet1质粒进行线性化,并将线性化的pacycduet1质粒与合成得到的pp7-rdh/biv-tat-fdh基因进行同源重组,通过菌落pcr验证获得将目标基因亚克隆到质粒pacycduet1中的重组菌株,对获得阳性转化子提取质粒,所获得的重组质粒命名为pacycduet1-pp7-rdh::biv-tat-fdh;将此构建的重组质粒转化到大肠杆菌blstar细胞中,并通过iptg诱导两种酶融合体的表达,确认重组质粒的正确性;其中,所述涉及的引物序列如下:
引物3:5’>ttaacctaggctgctgccac<3’,下划线序列为与pacycduet1质粒重叠序列;
引物4:5’>tcctgatcctttttcgaactgc<3’,下划线序列为与pacycduet1质粒重叠序列;
引物5:5’>cagcggtggcagcagcctaggttaattacacggcttttttgaattttg<3’下划线序列为与pacycduet1质粒重叠序列。
引物6:5’>agccacccgcagttcgaaaaaggatcaggaatgtccaaaaccatcgttctttcggt<3’下划线序列为与pacycduet1质粒重叠序列;
引物7:5’>ggatcaggaggaggaggatcaggaggaatggccattagcctggaaaataagg<3’下划线序列为与核糖醇脱氢酶基因重叠序列;
引物8:5’>tttcgattatgcggccgtgtacaatacgattacagatcaacactattcggcagaat<3’下划线序列为与核糖醇脱氢酶基因重叠序列;
引物9:5’>gtcatcaccatcatcaccacggatcaggaatggcaaaagtgctgtgcgtgctgt<3’下划线序列为与甲酸脱氢酶基因重叠序列;
引物10:5’>ttgctcagcggtggcagcagcctaggttaattacacggcttttttgaattttg<3’下划线序列为与甲酸脱氢酶基因重叠序列;
(3)构建利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌;
将重组质粒pacycduet1-pp7-rdh::biv-tat-fdh及pet22b-scaffold共同转化到大肠杆菌blstar中构建工程菌株,并进行鉴定验证即获得利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌,该工程菌包含大肠杆菌blstar的全基因组,重组质粒pet22b-scaffold和重组质粒pacycduet1-pp7-rdh::biv-tat-fdh;
(4)利用步骤(3)构建的大肠杆菌工程菌发酵生产阿洛醇;
活化步骤(3)构建的大肠杆菌工程菌菌种,按体积比1~2%的量将活化后的菌种接种到每100ml的发酵培养基中,先以37℃和200rpm培养,培养3h后,当培养菌液的od为0.6~0.8时,加入iptg至终浓度为1mm,并将发酵条件改变为28℃和140rpm,继续培养6~9h;然后将培养的菌液进行收菌,采用全细胞转化法,将d-阿洛酮糖转化为阿洛醇,通过标准曲线确定阿洛醇的产量并验证大肠杆菌工程菌内已将核糖醇脱氢酶和甲酸脱氢酶锚定在rna支架上;其中,所述发酵培养基的配方是:每100ml的发酵培养基中,含1g胰蛋白胨、0.5g酵母提取物、1gnacl、0.5g葡萄糖、终浓度为100μg/ml的氯霉素和氨苄青霉素、20mm的mgcl2。
上述利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇生产的方法中:所述用于细胞内重组蛋白固定的三角形网状rna支架是由二维的三角形网状rna支架与seqidno.4所示的pp7的适配体序列和seqidno.5所示的biv-tat的适配体序列组成,该用于细胞内重组蛋白固定的三角形网状rna支架的总核苷酸序列如seqidno.6所示;其中所述二维的三角形网状rna支架是由以3',5'-磷酸二酯键连接seqidno.1、seqidno.2和seqidno.3所示单链rna的核苷酸序列构成回文序列在细胞内形成三角形支架单元,该三角形支架单元中的每条seqidno.1、seqidno.2和seqidno.3所示单链rna的核苷酸序列又分别与相邻的三角形支架单元中与之完全相同的单链rna的核苷酸序列根据碱基配对形成rna双链,并以此方式不断配对形成rna双链,在细胞内构成了空间上呈二维的三角形网状rna支架。
本发明公开了一种利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌,其特征在于:所述工程菌是以大肠杆菌blstar为出发菌株,通过构建重组质粒pet22b-scaffold和重组质粒pacycduet1-pp7-rdh::biv-tat-fdh获得,该工程菌包含大肠杆菌blstar的全基因组,重组质粒pet22b-scaffold和重组质粒pacycduet1-pp7-rdh::biv-tat-fdh。
本发明公开了一种适于利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌的发酵培养基,其特征在于:所述发酵培养基的配方是:每100ml的发酵培养基中,含1g胰蛋白胨、0.5g酵母提取物、1gnacl、0.5g葡萄糖、终浓度为100μg/ml的氯霉素和氨苄青霉素、20mm的mgcl2。
本发明提供的利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌中,强化表达了核糖醇脱氢酶和甲酸脱氢酶,这两个融合蛋白在大肠杆菌细胞质内表达后可在rna支架的作用下指导相互作用的酶之间的亚层流动,限制其交叉作用并提高顺序代谢反应的产量。本发明提供的利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇生产的方法能够显著提高阿洛醇的产量,具有以下优点:
1)本发明构建的利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌中重组质粒的构建采用同源重组的方式进行连接,实现了多个片段的同时组装,与传统的限制性酶切、连接组装方法相比,不需要重复的酶切和连接反应,基因操作容易,基因组装过程高效省时,简化了实验步骤。
2)本发明方法构建的产阿洛醇的大肠杆菌工程菌能有效的增强途径的代谢流,并利用rna支架将靶酶分子共区域化,有助于相互作用蛋白之间流动,并且极大限制信号通路之间的串扰,最大化地增加连续代谢反应的产量。实验证实:与游离形式过表达两种靶酶相比,本发明构建的利用三角形网状rna支架固定核糖醇脱氢酶和甲酸脱氢酶催化阿洛醇的大肠杆菌工程菌将阿洛醇的产量从3.036g/l提高到4.433g/l。
附图说明
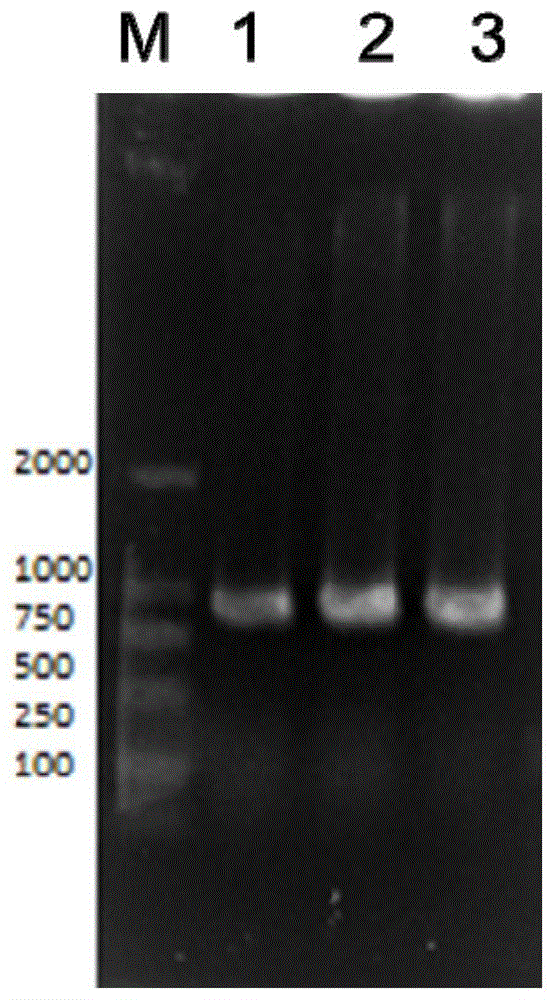
图1重组质粒pet22b-scaffold菌落pcr验证图
其中:m:250bp-ⅱmaker;1-3:菌落pcr验证成功条带。
图2重组质粒pacycduet1-pp7-rdh::biv-tat-fdh图谱。
图3重组蛋白表达图
其中:m:mf212(10kda-180kda);1:大肠杆菌工程菌株ⅰ诱导上清;2:大肠杆菌工程菌株ⅰiptg诱导超声破碎液。
图4运用rna支架生产阿洛醇的大肠菌株工程菌株ⅰ发酵生产阿洛醇的液相色谱图。
图5运用rna支架生产阿洛醇的大肠菌株工程菌株ⅰ和相关对照菌株ⅱ发酵生产阿洛醇的产量比较图。
具体实施方式
下面结合具体附图和实施例对本发明内容进行详细说明。如下所述例子仅是本发明的较佳实施方式而已,应该说明的是,下述说明仅仅是为了解释本发明,并非对本发明作任何形式上的限制,凡是依据本发明的技术实质对实施方式所做的任何简单修改,等同变化与修饰,均属于本发明技术方案的范围内。
下述实施例中,所使用的材料、试剂、质粒、专用试剂盒、大肠杆菌菌株等,如无特殊说明,均可从商业途径得到。
实施例1构建利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌
1.rna支架重组质粒的构建
1)委托公司合成一段dna序列如seqidno.6所示;
2)利用引物1,引物2将pet22b质粒进行线性化;
引物1:5’>ccctatagtgagtcgtattaacctaatgcaggtcccggaaga<3’,下划线序列为与pet22b质粒重叠序列。
引物2:5’>ccaatggcgcgccgagcttggcgtaatgctcgccacttcgggctcatgagcg<3’,下划线序列为与pet22b质粒重叠序列。
反应体系:
反应条件:
pcr扩增反应条件
3)为纯化线性化的pet22b质粒进行切胶回收:
a)在紫外灯下从电泳胶上切下所需回收的条带,注意刀片需消毒,胶块应尽量小,使之易融化完全;
b)事先将一个eppendorf管称重,然后将胶块放入后再次称重,获得胶块的重量;
c)以每100mg胶块加入300μl的量加入bindingbuffer,查看胶块是否浸在液体中;56℃水浴10min以融化胶块释放dna,期间每2-3min需取出震荡;
d)将highpurefiltertub安装到collectiontube上;
e)将所有eppendorf管中的液体转移到highpurefiltertube中去;
f)12000rpm离心1min倒掉收集管中的液体;
g)加入500μlwashbuffer后再次离心1min;
h)倒掉收集管中的液体后再次加500μl的washbuffer,12000rpm离心1min;
i)小心将filtertube取下后装入一个新的effendorf管上;
j)在滤芯的正中加上30ul的elutionbuffer,室温放置1min,12000rpm离心1min。最后,通过切胶回收,获得纯化的线性化pet22b质粒。
4)重组质粒pet22b-scaffold的获得
测定浓度,根据浓度比与合成的rna支架序列进行混合,利用组装形成环状质粒,进行大肠杆菌dh5α的转化。
重组体系:
反应条件:
37℃30min。
将10μl同源重组液加入到dh5α感受态细胞中,冰浴30min,热激(42℃,60s),再冰浴2min,加入500μl新鲜无抗lb液体培养基,37℃,180rpm,培养1h。取出200μl涂布于氨苄青霉素平板,37℃,过夜培养。
通过菌落pcr验证分别获得阳性转化子(图1),提取重组质粒pet22b-scaffold。
菌落pcr反应体系:
5)利用omga质粒试剂盒提取重组质粒pet22b-scaffold
提取步骤如下:
a)用1.5ml离心管收集1-5ml菌液。12,000rpm离心1min,弃上清。
b)加入250μlsolutionⅰ/rnasea混合液,漩涡剧烈振荡直至菌体完全重新悬浮。室温静置1-2min。
c)加入250μlsolutionⅱ,轻柔地反复颠倒混匀5-6次。室温放置1-2min,使菌体充分裂解,直至形成澄清的裂解溶液。
d)加入350μlsolutionⅲ,立即轻柔地反复颠倒混匀5-6次。此时会出现白色絮状沉淀。
e)12,000rpm室温离心10min,收集上清。
f)将上清置于dna纯化柱中,静置1-2min。
g)12,000rpm离心1min,弃滤液。
h)加入500μl溶液washbuffer,12,000rpm离心1min,弃滤液。
i)将dna纯化柱置于新的离心管中。向纯化柱中央处,悬空滴加50-100μl溶液ddh2o,室温放置2min。
按照上述的方法,可以得到浓度为200ng/ul的重组质粒pet22b-scaffold。
2.rna支架所锚定核糖醇脱氢酶和甲酸脱氢酶的重组质粒的构建
从genebank基因库中查询获得的核糖醇脱氢酶基因片段和甲酸脱氢酶基因片段,利用大肠杆菌密码子偏好性进行密码子优化,将biv-tat标记fdh,将pp7标记rdh,公司合成pp7-rdh和biv-tat-fdh基因,将目标基因亚克隆到pacycduet1中,命名为pacycduet1-pp7-rdh::biv-tat-fdh。将此构建体转化到大肠杆菌blstar细胞中,并通过iptg诱导两种酶融合体的表达。
1)利用引物3,引物4将pacycduet1质粒进行线性化
引物3:5’>ttaacctaggctgctgccac<3’,下划线序列为与pacycduet1质粒重叠序列。
引物4:5’>tcctgatcctttttcgaactgc<3’,下划线序列为与pacycduet1质粒重叠序列。
引物3和4用于pacycduet1质粒进行线性化。
反应体系:
反应条件:
pcr扩增反应条件
2)为纯化线性化的pacycduet1质粒进行切胶回收
a)在紫外灯下从电泳胶上切下所需回收的条带,注意刀片需消毒,胶块应尽量小,使之易融化完全;
b)事先将一个eppendorf管称重,然后将胶块放入后再次称重,获得胶块的重量;
c)以每100mg胶块加入300μl的量加入bindingbuffer,查看胶块是否浸在液体中;
d)56℃水浴10min以融化胶块释放dna,期间每2-3min需取出震荡;
e)将highpurefiltertub安装到collectiontube上;
f)将所有eppendorf管中的液体转移到highpurefiltertube中;
g)12000rpm离心1min倒掉收集管中的液体;
h)加入500ulwashbuffer后再次离心1min;
i)倒掉收集管中的液体后再次加500μl的washbuffer,12000rpm离心1min;
j)小心将filtertube取下后装入一个新的effendorf管上;
k)在滤芯的正中加上30μl的elutionbuffer,室温放置1min,12000rpm离心1min。最后,通过切胶回收,获得纯化的线性化pet22b质粒。
3)pp7-rdh/biv-tat-fdh基因的获得
引物5:5’>cagcggtggcagcagcctaggttaattacacggcttttttgaattttg<3’下划线序列为与pacycduet1质粒重叠序列。
引物6:5’>agccacccgcagttcgaaaaaggatcaggaatgtccaaaaccatcgttctttcggt<3’下划线序列为与pacycduet1质粒重叠序列,引物5和6为了获得pp7-rdh/biv-tat-fdh基因。
引物7:5’>ggatcaggaggaggaggatcaggaggaatggccattagcctggaaaataagg<3’下划线序列为与核糖醇脱氢酶基因重叠序列。
引物8:5’>tttcgattatgcggccgtgtacaatacgattacagatcaacactattcggcagaat<3’下划线序列为与核糖醇脱氢酶基因重叠序列。
引物9:5’>gtcatcaccatcatcaccacggatcaggaatggcaaaagtgctgtgcgtgctgt<3’
下划线序列为与甲酸脱氢酶基因重叠序列。
引物10:5’>ttgctcagcggtggcagcagcctaggttaattacacggcttttttgaattttg<3’下划线序列为与甲酸脱氢酶基因重叠序列。
利用引物5,引物6通过pcr对pacycduet1质粒进行线性化,利用引物7,引物8通过pcr扩增得到核糖醇脱氢酶基因序列,利用引物9,引物10通过pcr扩增得到甲酸脱氢酶基因序列。
步骤同上。
4)重组质粒pacycduet1-pp7-rdh::biv-tat-fdh的获得
将线性化的pacycduet1质粒,与扩增得到的核糖醇脱氢酶基因序列基因,甲酸脱氢酶基因序列以及公司合成pp7和biv-tat基因进行多片段同源重组,获得重组质粒。通过菌落pcr验证获得阳性转化子,提取重组质粒pacycduet1-pp7-rdh::biv-tat-fdh。
重组体系:
反应条件:
37℃,30min。
转化步骤:
将10μl同源重组液加入到dh5α感受态细胞中,冰浴30min,热激(42℃,60s),再冰浴2min,加入500μl新鲜无抗lb液体培养基,37℃,180rpm,培养1h。取出200μl涂布于氯霉素平板,37℃,过夜培养。
通过菌落pcr验证分别获得阳性转化子,提取重组质粒pacycduet1-pp7-rdh::biv-tat-fdh。
菌落pcr反应体系:
提取重组质粒,步骤同上,获得重组质粒pacycduet1-pp7-rdh::biv-tat-fdh(图2)。
将重组质粒pacycduet1-pp7-rdh::biv-tat-fdh及pet22b-scaffold共同转化到大肠杆菌blstar中,构建工程菌株,并进行鉴定验证。
将2μl质粒pet22b-scaffold和2μl重组质粒pacycduet1-pp7-rdh::biv-tat-fdh加入到100μldh5α感受态细胞中,冰浴30min,热激(42℃,60s),再冰浴2min,加入500μl新鲜无抗lb液体培养基,37℃,180rpm,培养1h。取出200μl涂布于氯霉素和氨苄青霉素平板,37℃,过夜培养。
将平板上长出来的菌落进行菌落pcr。
菌落pcr反应体系:
通过菌落pcr验证获得阳性转化子,提取重组质粒pacycduet1-pp7-rdh::biv-tat-fdh(图2)。
5)利用omga质粒试剂盒提取重组质粒pacycduet1-pp7-rdh::biv-tat-fdh提取重组质粒:
a)用1.5ml离心管收集1-5ml菌液。12,000rpm离心1min,弃上清。
b)加入250μlsolutionⅰ/rnasea混合液,漩涡剧烈振荡直至菌体完全重新悬浮。室温静置1-2min。
c)加入250μlsolutionⅱ,轻柔地反复颠倒混匀5-6次。室温放置1-2min,使菌体充分裂解,直至形成澄清的裂解溶液。
d)加入350μlsolutionⅲ,立即轻柔地反复颠倒混匀5-6次。此时会出现白色絮状沉淀。
e)12,000rpm室温离心10min,收集上清。
f)将上清置于dna纯化柱中,静置1-2min。
g)12,000rpm离心1min,弃滤液。
h)加入500μl溶液washbuffer,12,000rpm离心1min,弃滤液。
i)将dna纯化柱置于新的离心管中。向纯化柱中央处,悬空滴加50-100μl溶液ddh2o,室温放置2min。
按照上述的方法,质粒可以得到浓度为200ng/ul的重组质粒pacycduet1-pp7-rdh::biv-tat-fdh。
3.利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌ⅰ的构建
将重组质粒pacycduet1-pp7-rdh::biv-tat-fdh及pet22b-scaffold共同转化到大肠杆菌blstar中,构建工程菌株ⅰ,并进行鉴定验证。
将2μl质粒pet22b-scaffold和2μl重组质粒pacycduet1-pp7-rdh::biv-tat-fdh加入到100μldh5α感受态细胞中,冰浴30min,热激(42℃,60s),再冰浴2min,加入500μl新鲜无抗lb液体培养基,37℃,180rpm,培养1h。取出200μl涂布于氯霉素和氨苄青霉素平板,37℃,过夜培养。
将共转化后的大肠杆菌涂布在含有氨苄青霉素和氯霉素双抗性的平板上,转化成功的工程菌株可以在双抗性的平板上生长,继而获得阳性菌株。
实施例2验证重组核糖醇脱氢酶和甲酸脱氢酶在大肠杆菌工程菌中的表达
将筛选出大肠杆菌工程菌株的单菌落接种到培养基中作为种子液,培养基是含有1%胰蛋白胨,0.5%酵母提取物,1%nacl的添加氯霉素和氨苄青霉素至终浓度为100μg/ml的lb培养基。使用50ml含10ml培养基的烧瓶在37℃和200rpm下培养12h。
使用500ml的烧瓶进行培养,该烧瓶中装有加入氯霉素和氨苄青霉素至终浓度为100μg/ml的100ml培养基,接种量为1ml。培养基的配方是1%胰蛋白胨,0.5%酵母提取物,1%nacl,0.5%葡萄糖,20mm的mgcl2。最初以37℃和200rpm开始培养。培养3h后,当培养菌液的od为0.6~0.8时,加入iptg至终浓度为1mm,并将条件改变为28℃,140rpm,并继续培养6h。
8000rpm,4℃,10min离心后倒掉上清,菌液中加入1ml重悬溶液,振荡使菌体充分混匀,倒入置于冰盒上的干净烧杯中,每升菌体加入pmsf200μl。
超声波破碎两次,工作3s间歇6s破碎65次。14000rpm,4℃,50min,离心,立即倒入置于冰盒上的干净烧杯中。
对于蛋白样品直接取20ul的样品,依次加上20μl2xbuffer,混匀,煮沸10min。
加样:用移液枪取处理过的样品溶液10μl,小心地依次加入到各凝胶凹形样品槽内,marker加入到其中一个槽内,为区别两块板,marker可加在不同的孔槽中。
将电泳槽放置电泳仪上,接通电源,正负极对好。电压调至约150v保持恒压。待溴酚蓝标记移动到凝胶底部时,关电源,把电泳缓冲液倒回瓶中。
剥离胶把电泳槽取出,两块板拿下来,用刮片从长短玻片中间翘起,再把浓缩胶刮掉,取下。
染色放于加有r250染色液的染色皿中,染液漫过胶即可,置于摇床上,转速约为45rpm,时间约1h,完成后染液倒掉并用水洗掉染液。脱色取出染色过的胶放于加有脱色液的染缸里,脱色液漫过胶即可,置于摇床上,转速约为45rpm,时间约1h,本底色脱净,条带清晰可见即可,完成后倒掉脱色液。
从sds-page凝胶中可以得到核糖醇脱氢酶和甲酸脱氢酶已经分别与pp7和biv-tat的融合表达(图3)。
实施例3本发明的利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌ⅰ发酵生产阿洛醇的验证
用于种子培养或用于分子实验的细胞制备的培养基是含有1%胰蛋白胨,0.5%酵母提取物,1%nacl的添加氯霉素和氨苄青霉素至终浓度为100μg/ml的lb培养基。使用50ml含10ml培养基的烧瓶在37℃和200rpm下培养12h,得到活化的大肠杆菌工程菌株ⅰ菌种。
使用500ml的烧瓶进行培养,该烧瓶中装有加入氯霉素和氨苄青霉素至终浓度为100μg/ml的100ml培养基,接种量为1ml。培养基的配方是1%胰蛋白胨,0.5%酵母提取物,1%nacl,0.5%葡萄糖,20mm的mgcl2。最初以37℃和200rpm开始培养。培养3h后,当培养菌液的od为0.6~0.8时,加入iptg至终浓度为1mm,并将条件改变为28℃,140rpm,并继续培养6h。
将培养的大肠杆菌工程菌株ⅰ菌液进行收菌,采用全细胞转化法,将d-阿洛酮糖转化为阿洛醇。
通过以12000×g离心5min收集重组大肠杆菌细胞,并使用双蒸馏水洗涤两次。将洗涤后的细胞重悬于含有缓冲液,d-阿洛酮糖和甲酸钠的反应溶液中,重悬细菌溶液的od600为40。将重悬细菌溶液在水浴中保持在50℃。
通过使用配备有折射率检测器的hplc来测量d-阿洛酮糖和阿洛醇的量。将生物转化液样品以12000×g离心10min以去除细胞。然后,将上清液煮沸10min并离心以除去沉淀物。将所得的上清液通过0.22μm的膜滤器过滤,并注入hplc的carbomixpb-np柱(7.8×300mm,10μm,sepaxtechnologies)中进行分析。在78℃的柱温下,使用双蒸馏水以0.5ml/min的流速洗脱d-阿洛酮糖和阿洛醇。
基于d-阿洛酮糖和阿洛醇标准溶液的标准曲线对效价对转化液进行定量。使用双蒸馏水制备分别含100mg/mld-阿洛酮糖和10mg/ml阿洛醇的储备溶液。通过使用两次蒸馏水稀释储备溶液来制备标准溶液,以获得分别为20、40、60、80和100mg/ml的d-阿洛酮糖溶液以及分别为2、4、6、8和10mg/ml的阿洛醇溶液。然后使用通过hplc测量的标准溶液制作标准曲线。
根据标准曲线可以得到大肠杆菌工程菌株ⅰ发酵可以生产阿洛醇(图4)。
实施例4本发明的利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌ⅰ与菌株ⅱ发酵实验比较
将重组质粒pacycduet1-pp7-rdh::biv-tat-fdh转化到大肠杆菌blstar中,即完成菌株ⅱ的构建,与实施例3的大肠杆菌工程菌株ⅰ形成对照,比较菌株ⅰ和菌株ⅱ的阿洛醇产量以验证rna支架可以锚定核糖醇脱氢酶和甲酸脱氢酶并促进阿洛醇的生产。
将菌株ⅰ和菌株ⅱ于37℃摇瓶培养过夜后作为种子液,使用500ml的烧瓶进行培养,该烧瓶中装有加入氯霉素和氨苄青霉素至终浓度为100μg/ml的100ml发酵培养基,接种量为1ml。最初以37℃和200rpm开始培养。培养3h后,当培养菌液的od为0.6~0.8时,加入iptg至终浓度为1mm,并将条件改变为28℃,140rpm,并继续培养。其中上述发酵培养基的配方是:每100ml的发酵培养基中,含1g胰蛋白胨、0.5g酵母提取物、1gnacl、0.5g葡萄糖、终浓度为100μg/ml的氯霉素和氨苄青霉素、20mm的mgcl2。
通过以12000×g离心5min收集重组大肠杆菌细胞,并使用双蒸馏水洗涤两次。将洗涤后的细胞重悬于含有50mmtris-hcl缓冲液,d-阿洛酮糖和甲酸钠的反应溶液中,重悬细菌溶液的od600为40。将重悬细菌溶液在水浴中保持在50℃。
在转化时间为0,0.5,1,3,5,8,10h分别对阴性对照(只转化共表达酶的质粒的工程菌株)和大肠杆菌工程菌进行取样,将生物转化液样品以12000×g离心10min以去除细胞。然后,将上清液煮沸10min并离心以除去沉淀物。将所得的上清液通过0.22μm的膜滤器过滤,并注入hplc的carbomixpb-np柱(7.8×300mm,10μm,sepaxtechnologies)中进行分析。在78℃的柱温下,使用双蒸馏水以0.5ml/min的流速洗脱d-阿洛酮糖和阿洛醇。
根据标准曲线验证本发明的利用三角形网状rna支架固定重组酶催化阿洛醇的大肠杆菌工程菌ⅰ已将核糖醇脱氢酶和甲酸脱氢酶锚定在rna支架上,与游离形式过表达两种靶酶相比,阿洛醇的产量从3.036g/l提高到4.433g/l(图5)。
序列表
<110>山东大学,青岛龙鼎生物技术有限公司
<120>一种利用重组胞内rna支架固定重组酶促进细胞催化阿洛醇生产的方法
<141>2020-03-07
<160>6
<210>1
<211>12
<212>rna
<213>人工序列
<221>单链rna的核苷酸序列
<222>(1)…(12)
<400>1
uaaugcgcauua12
<210>2
<211>12
<212>rna
<213>人工序列
<221>单链rna的核苷酸序列
<222>(1)…(12)
<400>2
uagcucgagcua12
<210>3
<211>12
<212>rna
<213>人工序列
<221>单链rna的核苷酸序列
<222>(1)…(12)
<400>3
uccacuagugga12
<210>4
<211>28
<212>dna
<213>人工序列
<221>pp7的核苷酸序列
<222>(1)…(28)
<400>4
ggcucguguagcucauuagcuccgagcc28
<210>5
<211>25
<212>dna
<213>人工序列
<221>biv-tat的核苷酸序列
<222>(1)…(25)
<400>5
ggcacagaagauauggcuucgugcc25
<210>6
<211>221
<212>dna
<213>人工序列
<221>rna支架的总核苷酸序列
<222>(1)…(221)
<400>6
ttaatacgactcactatagggtaatgcgcattatagctcgagctatccactagtggaagg60
actcggctcgtgtagctcattagctccgagccgagtcctcgaatacgagctgggcacaga120
agatatggcttcgtgcccaggaagtgttcgcacttctctcgtattcgattgcgctagcat180
aaccccttggggcctctaaacgggtcttgaggggttttttg221
- 还没有人留言评论。精彩留言会获得点赞!