一株高产挥发性酯类化合物的生物降酸用植物乳杆菌及其在果酒中的应用的制作方法
本发明涉及一株高产挥发性酯类化合物的生物降酸用植物乳杆菌及其在果酒中的应用。
背景技术:
果酒是以水果为原料经完全或部分酒精发酵后获得的饮料,以葡萄酒为典型代表。果酒具有节约粮食、营养丰富、酒精含量低、适用人群广等优点,是国家提倡发展的一类酒产品。有机酸是果酒的重要组分,适量的有机酸可以赋予果酒清新、爽利的酸感,抑制病菌的活动,还可以溶解色素,使酒体颜色更加悦目;但是当有机酸含量过高时,会给人以尖涩、刺口、粗糙的感觉,严重影响果酒的口感。果酒中的有机酸主要有酒石酸、苹果酸、柠檬酸和琥珀酸等。由于酿造原料的酸度一般较高,所以在果酒的酿造过程中通常会面临降酸问题。
降酸方法主要有化学降酸、物理降酸和生物降酸法三种。化学降酸主要是使用碳酸钙等降酸剂与酒石酸形成沉淀,再通过过滤除去沉淀。物理降酸主要是通过阴离子交换或冷冻处理来调整有机酸的含量。以上两种降酸方法都容易导致处理后的果酒出现特征性风味消失、产生令人难以接受的涩味,因此还需进一步改进。生物降酸法主要是苹果酸乳酸发酵(malolacticfermentation,mlf),是指在乳酸菌的作用下,将l-苹果酸转化为l-乳酸并释放出co2的过程,具有降低果酒酸度和涩度、改善口感、提高微生物稳定性等作用。mlf可以自然发生,也可以通过人为接种乳酸菌来启动。自发的mlf在发酵时间上具有不确定性,而且不利于果酒的质量控制和安全控制,因此通过人为添加乳酸菌启动mlf是果酒降酸中非常重要的工序。此外,不同类型的降酸菌株会对果酒的酒体成分、挥发性组分及活性成分产生广泛而深远的影响,从而酿制不同风格和特征的果酒。
目前,在果酒的生产中,苹果酸乳酸菌种多以酒类酒球菌为主,但是近几年来,一类新型的降酸菌株—乳杆菌越来越引起酿造人员和研究者的关注。乳杆菌同样可以耐受果酒的“恶劣”环境,能够在高酸度、高so2浓度、高酒精度的果酒中生长,并实现将l-苹果酸代谢生成l-乳酸。而且,与目前果酒行业普遍使用的酒类酒球菌相比,乳杆菌具有两大优势,一是乳杆菌含有更多的芳香酶编码基因,例如酯酶、糖苷酶、蛋白酶等,可以增强果酒的风味复杂性。二是在发酵过程中可以产生一些抑菌物质,如乳酸菌素、过氧化氢等,能够显著性抑制致病菌、腐败菌等有害微生物的生长,增强果酒的生物稳定性。
目前我国果酒生产所需乳酸菌多依赖于进口,虽然保证了发酵批次的稳定性,但果酒的地域特征和品种优势却未有效凸显。我国独特复杂的地理、气候条件决定了我国的果酒产区存在着优良的乳酸菌株,因此筛选出适合我国果酒生产的优良乳酸菌株,实现资源的开发利用,对改变我国果酒生产乳酸菌主要依赖于进口的现状十分重要,也使得酿造高品质低酸果酒成为了可能。
技术实现要素:
本发明针对上述现有技术存在的不足,提供一株高产挥发性酯类化合物的生物降酸用植物乳杆菌及其在果酒中的应用,能迅速降解其中的l-苹果酸、缩短发酵周期,且显著提高果酒的挥发性酯类组分的合成量。
具体技术方案如下:
一株高产挥发性酯类化合物的生物降酸用植物乳杆菌,其保藏编号为cgmccno.19240。
该菌种是一株植物乳杆菌,命名为lactobacillusplantarumyj04,简称yj04,已保藏于北京的中国微生物菌种保藏管理委员会普通微生物中心,保藏号为cgmccno.19240。
yj04菌株对高酒精度、低ph值、高so2的酒体环境适应良好,能迅速降解果酒中的苹果酸,且具有高酯酶活性。
yj04菌株能够耐受如下一个或多个条件:酒精度(v/v)16%,ph2.8,so2含量100mg/l。在上述条件下,yj04菌株可正常生长。
本发明的试验所用的出发菌株,采集自山东烟台、青岛、日照等多县市的果园,来源包括葡萄、蓝莓、樱桃、桑葚。
本发明的第二个目的在于提供上述菌株yj04在果酒中的应用。
所述的应用包括在果酒降酸、挥发性酯类的合成量的提升以及缩短果酒的酿造周期。
本发明中的菌株yj04的筛选方法包括如下步骤:
(1)乳酸菌株的筛选:用生理盐水浸提水果表皮微生物得到微生物粗提液,而后对该粗提液进行梯度稀释,涂于atb和mrs分离培养基,厌氧培养,分离得乳酸菌。
具体方法如下:
向1ml生理盐水中加入5g水果表皮,振荡后得到微生物粗提液,而后对该粗提液进行梯度稀释,梯度分别是10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8,分别吸取0.1ml不同梯度的稀释液涂于atb和mrs分离培养基上,30℃厌氧箱中充n2培养3~7天,观测菌落形成情况。
atb和mrs培养基均在其原基础成分上添加50mg/l万古霉素、50mg/l放线菌酮和5g/l碳酸钙。
其中,atb固体培养基的组成为:酵母粉5g/l,蛋白胨10g/l,葡萄糖10g/l,硫酸镁0.2g/l,硫酸锰0.05g/l,西红柿汁25%(v/v),盐酸半胱氨酸0.5g/l,琼脂20g/l,ph4.8。
其中,mrs固体培养基的组成为:牛肉膏10g/l,蛋白胨10g/l,酵母粉5g/l,葡萄糖5g/l,乙酸钠5g/l,柠檬酸氢二铵2g/l,吐温-801g/l,硫酸镁0.2g/l,磷酸二氢钾2g/l,琼脂20g/l,ph6.4。
挑取产生透明圈的菌落,平板划线直至获得单菌落。观察菌落形态和显微形态特征,通过革兰氏染色、过氧化氢酶试验等检测技术,发现所有菌株均无芽孢、革兰氏染色阳性、过氧化氢酶试验阴性、无运动性;显微镜下观察细胞呈现杆状或球状,因此初步鉴定为乳酸菌。
(2)降酸且高产酯类化合物的乳酸菌株的筛选:
a.降酸活性筛选:将步骤(1)分离得的乳酸菌接种于含苹果酸的atb和mrs培养基,通过纸层析检测获得具备降酸能力的菌株。
具体的,将初选菌株按107cfu/ml的接种量加入含苹果酸(2g/l)的atb和mrs培养基中,每隔24h进行纸层析监测。观察苹果酸和乳酸斑点的变化,以层析纸上乳酸斑点扩大和苹果酸斑点消失所持续的时间来判断生物降酸进程。
b.抗性筛选方法:将步骤(2a)获得的菌株接种于含有乙醇、so2的酸性atb和mrs培养基,获得高抗性菌株。
具体的,将通过初筛,即具备苹果酸降解能力的菌株进行复筛。筛选标准为能够较好的耐受酒体“恶劣”环境,即能够在富含乙醇、so2的酸性培养基中生长并具备降酸能力的菌株。经试验证实,yj04分解苹果酸耗时最短,因而具有最高效的降酸活性。
抗性筛选实验包含单因子抗性实验(ph、so2、乙醇)和复合因子抗性实验。按107cfu/ml接种量将候选菌株纯培养物置于含有单因子或复合因子的atb和mrs培养基中,30℃静置培养3~7天,用比浊法对菌密度进行测定(od600nm)。实验结果表明,随着选择压力的不断增大,特别是ph降低、酒精度升高、so2浓度增加,乳酸菌的生长量均出现下降趋势。
结果显示,菌株yj04能够耐受16%酒精度(v/v)、ph2.8和100mg/lso2复合因子的抑制作用。
c.具有高酯酶活性乳酸菌的筛选:通过考察分解对硝基苯基丁酸酯、对硝基苯基己酸酯和对硝基苯基月桂酸酯的能力,筛选步骤(2a)获得的菌株,获得具有高酯酶活性的菌株。
具体的,具有高酯酶活性的乳酸菌能够增加果酒挥发性酯类化合物的合成量,提高果酒的香气特征,本发明利用乳酸菌分解对硝基苯基丁酸酯、对硝基苯基己酸酯和对硝基苯基月桂酸酯的能力进一步筛选具有高酯酶活性的菌株。配置0.1mol/l柠檬酸-磷酸缓冲液,取上述溶液860μl加入到2ml离心管中,再加入40μl100mmol/l对硝基苯基酯类底物溶液(溶于无水乙醇),然后加入500μg(湿重)候选乳酸菌(其制备方法为30℃静置培养3~7天,15000转/分离心10min,再称取),之后在40℃条件下反应1小时,再加入100μl0.5mol/lnaoh溶液终止反应,并立即在400nm处测定od值。根据检测结果判断乳酸菌的酯酶活性。od值越大,则菌株的酯酶活性越高。
本发明还提供了富含挥发性酯类的、果香浓郁的果酒的制备方法,制备过程中使用菌株yj04。
植物乳杆菌yj04可以采用顺序接种、同时接种两种方法接种至果酒中。
顺序接种的工艺流程如下:
酿造原料→去梗(核)、破碎→果实预处理(加入so2和果胶酶、调整总糖)→接种酿酒酵母→酒精发酵→接种植物乳杆菌yj04→苹果酸乳酸发酵→下胶澄清→冷冻→过滤→灌装
顺序接种即在酒精发酵结束后接种生物降酸用植物乳杆菌进行苹果酸乳酸发酵;接种量为以反应体系计106~108cfu/ml,20~25℃进行苹果酸乳酸发酵12~20天。
具体为:
酿造水果采摘后,去梗、破碎,输入发酵罐中,并加入50mg/lso2抑制果浆氧化,再加入30mg/l果胶酶反应6~24h。添加酿酒酵母之前,调整果浆中的总糖浓度(≥160g/l),然后接种酿酒酵母,并于24~28℃持续发酵6~8天。
酒精发酵过程中,监测果浆中总糖和酵母数的变化,定期搅拌循环;当醪液中总糖小于4g/l时,分离出酵母和果渣,终止酒精发酵。
而后接种植物乳杆菌yj04进行mlf(苹果酸乳酸发酵)。
yj04需要提前活化,其流程为从冻存管里挑取yj04转接至mrs液体培养基中,30℃静置培养1天,12000转/分钟离心后取菌体,用无菌水洗涤2~3次,再以106~108cfu/ml浓度接种至果酒中。
mlf过程中监测苹果酸含量的变化。mlf持续约12~20天,温度为20~25℃,直至l-苹果酸浓度≤0.5g/l。
mlf结束后,分离酒渣,并加入80~100mg/lso2。然后进行皂土下胶处理,7~10天后转罐。
冷冻前采用硅藻土过滤除去果酒的悬浮物,去除率要达到95%~98%,之后置于-2~5℃下冷处理7~10天,再用0.22或0.45微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
同时接种的工艺流程如下:
酿造原料→去梗(核)、破碎→果实预处理(加入so2和果胶酶、调整总糖)→接种酿酒酵母→酒精发酵1-2天→接种植物乳杆菌yj04→酒精发酵、mlf同时进行→下胶澄清→冷冻→过滤→灌装
同时接种即在酒精发酵进行1~2天时接种生物降酸用植物乳杆菌,使酒精发酵与苹果酸乳酸发酵同时进行;接种量为以反应体系计106~108cfu/ml,苹果酸乳酸发酵温度为20~25℃,总发酵时间为14~20天。
具体为:
酿造水果采摘后,去梗、破碎,输入发酵罐中,并加入50mg/lso2抑制果浆氧化,再加入30mg/l果胶酶反应6~24h。添加酿酒酵母之前,调整果浆中的总糖浓度(≥160g/l),然后接种酿酒酵母于,24~28℃持续发酵。
待酒精发酵进行1~2天后,接种yj04进行mlf(苹果酸乳酸发酵)。
yj04需要提前活化,其流程为从冻存管里挑取yj04转接至mrs液体培养基中,30℃静置培养1天,12000转/分钟离心后取菌体,用无菌水洗涤2~3次,再以106~108cfu/ml的浓度接种至果酒中。
同时发酵过程中监测糖和l-苹果酸含量的变化,同时发酵温度为20~25℃。总发酵过程持续14~20天,发酵结束后,分离发酵残渣,并加入80~100mg/lso2。
然后进行皂土下胶处理,7~10天后转罐。冷冻前采用硅藻土过滤除去果酒的悬浮物,去除率要达到95%~98%,之后置于-2~5℃下冷处理7~10天,再用0.22或0.45微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
【生物保藏说明】
中国微生物菌种保藏管理委员会普通微生物中心登记入册编号:cgmccno.19240;
参椐的生物材料(株):yj04;
上述请求保藏的生物材料(株)附有建议的分类命名:植物乳杆菌、lactobacillusplantarum。
保藏单位:中国微生物菌种保藏管理委员会普通微生物中心。
保藏单位地址:北京市朝阳区北辰西路1号院3号。
该生物材料(株)已于2019年12月25日由中国微生物菌种保藏管理委员会普通微生物中心收到,并登记入册。
该生物材料(株)的存活性经中国微生物菌种保藏管理委员会普通微生物中心于2019年12月25日检测,结果是存活。
本发明的有益效果如下:
本发明获得的植物乳杆菌yj04对高酒精度、低ph值、高so2的果酒“恶劣”环境适应良好,能迅速降解其中的l-苹果酸;能与酿造酵母同时接种,使酒精发酵和mlf同时进行,发酵周期缩短至20天以内,大幅提高果酒的生产效率;使用该植物乳杆菌能显著提高果酒的挥发性酯类组分的合成量,如丁酸乙酯、己酸乙酯、辛酸乙酯等,赋予果酒更加浓郁的果香,达到优质果酒的质量要求。本发明为我国水果产区生产高品质的果香型果酒产品提供了菌种技术支持。
附图说明
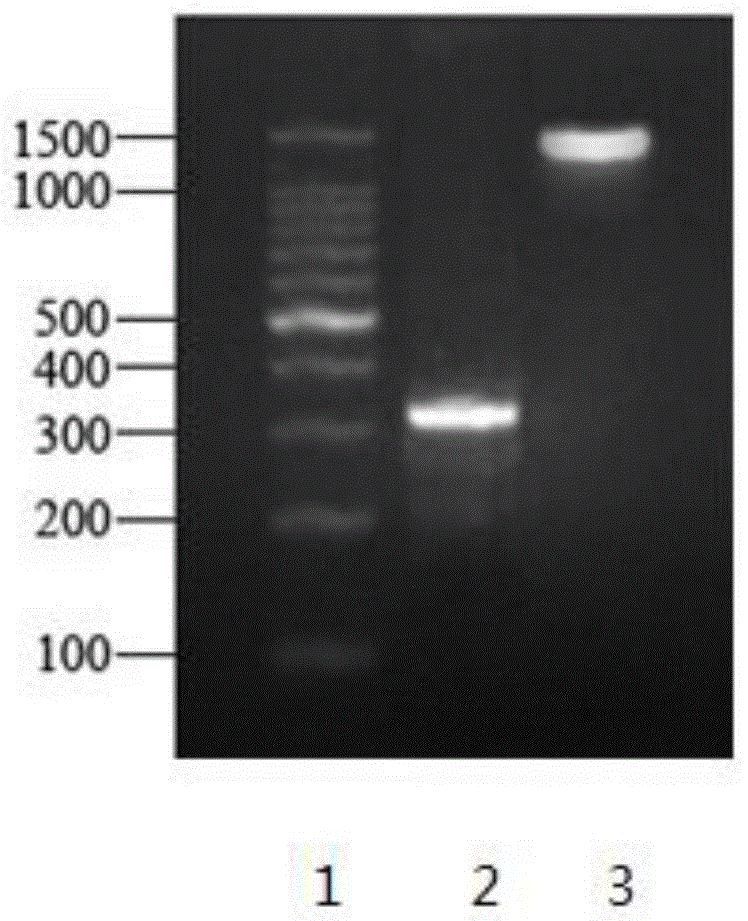
图1为植物乳杆菌yj04的琼脂糖电泳鉴定图谱;
图1中,泳道1为dna分子量标准,泳道2为reca基因,泳道3为16srdna基因。
具体实施方式
以下结合实例对本发明的原理和特征进行描述,所举实例只用于解释本发明,并非用于限定本发明的范围。
实施例中使用的果胶酶活力单位为120~180u/g,干酿酒酵母的活酵母数大于1010cfu/g。
实施例1菌株yj04的筛选分离与鉴定
一、菌株的筛选分离
(1)乳酸菌株的筛选:
向1ml生理盐水中加入5g水果表皮,振荡后得到微生物粗提液,而后对该粗提液进行梯度稀释,梯度分别是10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8,分别吸取0.1ml不同梯度的稀释液涂于atb和mrs分离培养基上,30℃厌氧箱中充n2培养3~7天,观测菌落形成情况。
atb和mrs培养基均在其原基础成分上添加50mg/l万古霉素、50mg/l放线菌酮和5g/l碳酸钙。
其中,atb固体培养基的组成为:酵母粉5g/l,蛋白胨10g/l,葡萄糖10g/l,硫酸镁0.2g/l,硫酸锰0.05g/l,西红柿汁25%(v/v),盐酸半胱氨酸0.5g/l,琼脂20g/l,ph4.8。
其中,mrs固体培养基的组成为:牛肉膏10g/l,蛋白胨10g/l,酵母粉5g/l,葡萄糖5g/l,乙酸钠5g/l,柠檬酸氢二铵2g/l,吐温-801g/l,硫酸镁0.2g/l,磷酸二氢钾2g/l,琼脂20g/l,ph6.4。
挑取产生透明圈的菌落,平板划线直至获得单菌落。观察菌落形态和显微形态特征,通过革兰氏染色、过氧化氢酶试验等检测技术,发现所有菌株均无芽孢、革兰氏染色阳性、过氧化氢酶试验阴性、无运动性;显微镜下观察细胞呈现杆状或球状,因此初步鉴定为乳酸菌。
(2)降酸且高产酯类化合物的乳酸菌株的筛选:
a.降酸活性筛选:将步骤(1)分离得的初选菌株按107cfu/ml的接种量加入含苹果酸(2g/l)的atb和mrs培养基中,每隔24h进行纸层析监测。观察苹果酸和乳酸斑点的变化,以层析纸上乳酸斑点扩大和苹果酸斑点消失所持续的时间来判断生物降酸进程。
b.抗性筛选方法:将步骤(2a)获得的菌株进行复筛。筛选标准为能够较好的耐受酒体“恶劣”环境,即能够在富含乙醇、so2的酸性培养基中生长并具备降酸能力的菌株。
抗性筛选实验包含单因子抗性实验(ph、so2、乙醇)和复合因子抗性实验。ph包括2.8、3.2、3.6三个因素;so2浓度包括50mg/l、80mg/l、100mg/l三个因素;酒精度包括12%、14%、16%三个因素。复合因子筛选同时含有以上3个单因素,共7个处理,如表1所示。
表1复合因子筛选组合
按107cfu/ml接种量将候选菌株纯培养物置于含有单因子或复合因子的atb和mrs培养基中,30℃静置培养7天,用比浊法对菌密度进行测定(od600nm)。实验结果表明,随着选择压力的不断增大,特别是ph降低、酒精度升高、so2浓度增加,乳酸菌的生长量均出现下降趋势。
表2显示所筛乳酸菌株对复合因子的抗性作用,部分菌体无法生长或生长量极低,而yj04等菌株仍表现出较高的抗性,能够耐受16%酒精度、ph2.8和100mg/lso2复合因子的抑制作用。
表2菌株对复合因子的抗性实验结果(od600nm)
c.具有高酯酶活性乳酸菌的筛选:通过考察分解对硝基苯基丁酸酯、对硝基苯基己酸酯和对硝基苯基月桂酸酯的能力,筛选步骤(2a)获得的菌株,获得具有高酯酶活性的菌株。配置0.1mol/l柠檬酸-磷酸缓冲液,取上述溶液860μl加入到2ml离心管中,再加入40μl100mmol/l对硝基苯基酯类底物溶液(溶于无水乙醇);然后加入候选乳酸菌,加入量为500μg(湿重),候选乳酸菌的制备方法为30℃静置培养3~7天,15000转/分离心10min,再称取;分解反应于40℃条件下进行1小时,再加入100μl0.5mol/lnaoh溶液终止反应,并立即在400nm处测定od值。根据检测结果判断乳酸菌的酯酶活性。od值越大,则菌株的酯酶活性越高。
二、菌株的鉴定
选定yj04作为降酸菌株,并对其进行分子生物学鉴定。
采用天根生化科技有限公司的细菌dna提取通用试剂盒提取菌株的基因组dna。
使用乳杆菌16srdna基因通用引物(scarpellini,m.,mora,d.,colombo,s.,franzetti,l.developmentofgenus/species-specificpcranalysisforidentificationofcarnobacteriumstrains.curr.microbiol.2002,45(1):24-29.)和reca基因(torriani,s.,felis,g.e.,dellaglio,f.differentiationoflactobacillusplantarum,l.pentosus,andl.paraplantarumbyrecagenesequenceanalysisandmultiplexpcrassaywithrecagene-derivedprimers.applienviron.microbiol.2001,67(8):3450-3454.)的特异性引物扩增,引物序列如表3所示。
表316srdna基因和reca基因的pcr扩增引物和条件
通过对菌株yj04的16srdna基因和reca基因进行pcr扩增,分别获得了大小为1483bp和321bp的基因片段,如图1所示。图1中,泳道1为dna分子量标准,泳道2为reca基因,泳道3为16srdna基因。所得扩增产物纯化后测序,输入genbank中进行同源性比对,结果显示菌株的reca基因片段与植物乳杆菌均达到95%以上,由此可判定yj04为植物乳杆菌。
实施例2植物乳杆菌yj04顺序接种在蛇龙珠葡萄酒中的应用
挑选新鲜的蛇龙珠葡萄,经过清洗、去梗、破碎制成葡萄浆,导入发酵罐中,添加果胶酶(30mg/l果浆)和so2(50mg/l果浆),添加蔗糖至总糖浓度达到210g/l。
果胶酶反应12h后,接种酿酒酵母lalvind254(300mg/l果浆),然后于24~26℃进行酒精发酵;发酵过程中每间隔8~12h进行搅拌,当总糖浓度≤4g/l时,酒精发酵已进行了7天,6000转/分离心20min除去酿酒酵母,终止酒精发酵,得到葡萄一次发酵酒。
预先将yj04在mrs培养基中活化,方法为从冻存管里挑取yj04转接至mrs液体培养基中,30℃静置培养1天,12000转/分钟离心后取菌体,用无菌水洗涤2次。
以106cfu/ml的浓度接种活化后的植物乳杆菌yj04至葡萄一次发酵酒中进行生物降酸。于22~24℃进行二次发酵。发酵过程利用纸层析和高效液相色谱法检测苹果酸浓度的变化,二次发酵16天后纸层析的苹果酸样品点消失,表示二次发酵过程结束。分离酒渣,并加入100mg/lso2。
二次发酵结束后测定蛇龙珠葡萄酒的理化指标,结果列于表4中。降酸过程在16天内完成,总酸含量降低至4.53g/l,苹果酸浓度降低至0.48g/l,苹果酸降解率为77.3%。酒精度未发生明显变化;挥发酸含量小幅上升。总之,该植物乳杆菌能较彻底的降解葡萄酒中的苹果酸,改善酸涩口感。
表4植物乳杆菌yj04顺序接种对蛇龙珠葡萄酒理化指标的影响
*总酸以酒石酸计;除不接种yj04外,未接种yj04的对照例的发酵条件、总发酵天数与实施例2相同。
此外,二次发酵结束后,采用hs-spme和gc-ms技术对未接种yj04和未接种yj04的蛇龙珠葡萄酒的挥发性组分进行萃取和检测,以明确yj04对葡萄酒芳香品质的影响。表5的检测结果表明,yj04促进了挥发性酯类和萜烯类化合物的释放,显著增加了丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、癸酸乙酯、香叶醇、β-大马酮等香气组分的产量。这些芳香化合物具有花香或果香类香气特征,会赋予葡萄酒更浓郁的花香和果香,提高其感官品质。
表5植物乳杆菌yj04顺序接种对蛇龙珠葡萄酒挥发性组分的影响(mg/l)
二次发酵结束后,使用皂土进行下胶处理,7天后转罐。冷冻前采用硅藻土过滤除去葡萄酒的悬浮物,去除率达到96%,之后置于-1℃下冷处理7天,再用0.22微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
实施例3植物乳杆菌yj04同时接种在赤霞珠葡萄酒中的应用
挑选新鲜的赤霞珠葡萄,经过清洗、去梗、破碎制成葡萄果浆,输入发酵罐中,添加果胶酶(30mg/l果浆)和so2(50mg/l果浆),添加蔗糖至总糖浓度达到210g/l。
果胶酶反应16h后,接种酿酒酵母lalvind21(300mg/l果浆),然后于25℃进行酒精发酵。
待酒精发酵进行2天后,接种yj04进行mlf(苹果酸乳酸发酵)。预先要将yj04进行活化,方法为从冻存管里挑取yj04转接至mrs液体培养基中,30℃静置培养1天,12000转/分钟离心后取菌体,用无菌水洗涤3次,再以107cfu/ml浓度接种至葡萄酒中,进行同时发酵。
同时发酵温度为23~25℃,发酵过程中每间隔8~12h进行搅拌,同时监测糖和l-苹果酸含量的变化,当总糖浓度≤4g/l、l-苹果酸含量≤0.5g/l时,总发酵时间为18天,除去酿酒酵母、植物乳杆菌和其它酒渣,终止发酵,并加入so2(100mg/l果浆)。
采用植物乳杆菌yj04同时接种方法酿制的赤霞珠葡萄酒的发酵周期及理化指标数据如表6所示,以yj04顺序接种获得的赤霞珠葡萄酒为对照(除了接种方式、发酵天数外,对照例的其他反应条件均与实施例3相同,发酵天数见表6)。整个发酵过程在18天内完成,总酸含量降低至4.30g/l,苹果酸浓度降低至0.32g/l,苹果酸降解率为85.4%。说明在同时接种模式下,yj04能较彻底的降解葡萄酒中的苹果酸,改善酸涩口感。
此外,从表6中还可看出,较之yj04顺序接种方法,同时接种方法在缩短发酵周期的同时,还进一步降低了挥发酸的浓度,对葡萄酒的品质具有积极影响。
表6植物乳杆菌yj04同时接种对赤霞珠葡萄酒理化指标的影响(以yj04顺序接种为对照)
发酵结束后,采用hs-spme和gc-ms技术对同时接种yj04的赤霞珠葡萄酒的挥发性组分进行萃取和检测,以yj04顺序接种获得的赤霞珠葡萄酒为对照(除了接种方式、发酵天数外,对照例的其他反应条件均与实施例3相同,发酵天数见表6),结果列于表7中。yj04同时接种促进了乙酸乙酯、己酸乙酯、癸酸乙酯、辛酸异戊酸酯、香叶醇、β-大马酮等组分的合成,而顺序接种方法则提高了丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯组分的产量。己酸乙酯、癸酸乙酯、辛酸异戊酸酯、香叶醇、β-大马酮等芳香化合物具有葡萄、苹果、香蕉等果香和薰衣草等花香,会赋予yj04同时接种的葡萄酒更丰富的香气特征,提高其感官品质。
表7植物乳杆菌yj04同时接种对赤霞珠葡萄酒挥发性组分的影响(mg/l)
二次发酵结束后,使用皂土进行下胶处理,7天后转罐。冷冻前采用硅藻土过滤除去葡萄酒的悬浮物,去除率达到96%,之后置于-1℃下冷处理7天,再用0.22微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
实施例4植物乳杆菌yj04顺序接种在大紫樱桃酒中的应用
挑选新鲜的大紫樱桃,经过清洗、去梗、去核、破碎制成樱桃果浆,而后添加果胶酶(30mg/l果浆)和so2(50mg/l果浆),添加蔗糖至总糖浓度达到210g/l。
果胶酶反应8h后,接种酿酒酵母lalvinrc212(300mg/l果浆),然后于24~26℃进行酒精发酵;发酵过程中每间隔8~12h进行搅拌,当总糖浓度≤4g/l时,酒精发酵已进行了7天,6000转/分离心20min除去酿酒酵母,终止酒精发酵,得到樱桃一次发酵酒。
预先将yj04在mrs培养基中活化,活化方法同实施例2。
以106cfu/ml的浓度接种活化后的植物乳杆菌yj04至葡萄一次发酵酒中进行生物降酸。于22~24℃进行二次发酵。发酵过程利用纸层析和高效液相色谱法检测苹果酸浓度的变化,二次发酵12天后纸层析的苹果酸样品点消失,表示二次发酵过程结束。分离酒渣,并加入100mg/lso2。
二次发酵结束后测定大紫樱桃酒的理化指标和挥发性香气组分的含量,结果列于表8中。降酸过程在12天内完成,总酸含量降低至5.18g/l,苹果酸浓度降低至0.36g/l,苹果酸降解率为80%。酒精度未发生明显变化,挥发酸含量小幅上升。总之,yj04能较彻底的降解樱桃酒中的苹果酸,改善酸涩口感。
表8植物乳杆菌yj04顺序接种对大紫樱桃酒理化指标的影响
*总酸以苹果酸计,除不接种yj04外,未接种yj04的对照例的发酵条件、总发酵天数与实施例4相同。
此外,二次发酵结束后,采用hs-spme和gc-ms技术对大紫樱桃酒的挥发性组分进行萃取和检测,以明确yj04对樱桃酒芳香品质的影响。表9的检测结果表明,yj04促进了挥发性酯类和萜烯类化合物的释放。yj04显著增加了苯乙醇、丁酸乙酯、乙酸异丁酯、己酸乙酯、辛酸乙酯、苯甲醛、里那醇、α-松油醇等香气组分的产量。这些芳香化合物具有花香或果香类香气特征,会赋予樱桃酒更浓郁的花香和果香,提高其感官品质。
表9植物乳杆菌yj04顺序接种对大紫樱桃酒挥发性组分的影响(mg/l)
发酵结束后使用皂土进行下胶处理,10天后转罐。冷冻前采用硅藻土过滤除去葡萄酒的悬浮物,去除率达到96%,之后置于-1℃下冷处理7天,再用0.22微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
实施例5植物乳杆菌yj04同时接种在红灯樱桃酒中的应用
以山东烟台产红灯樱桃为原料酿造樱桃酒。挑选新鲜的红灯樱桃,经过清洗、去梗、去核、破碎制成樱桃果浆,输入发酵罐中,添加果胶酶(30mg/l果浆)和so2(50mg/l果浆),添加蔗糖至总糖浓度达到210g/l。
果胶酶反应16h后,接种酿酒酵母lalvind21(300mg/l果浆),然后于26℃进行酒精发酵。
待酒精发酵进行1~2天后,接种yj04进行mlf。预先要将yj04进行活化,活化方法同实施例3,再以107cfu/ml浓度接种至葡萄酒中进行同时发酵。同时发酵温度为24℃,发酵过程中每间隔8~12h进行搅拌,同时监测糖和l-苹果酸含量的变化,当总糖浓度≤4g/l、l-苹果酸含量≤0.5g/l时,发酵总时间为16天,除去酿酒酵母、植物乳杆菌和其它酒渣,终止发酵,并加入so2(100mg/l果浆)。
采用植物乳杆菌yj04同时接种方法酿制的红灯樱桃酒的发酵周期及理化指标数据如表10所示,以yj04顺序接种获得的樱桃酒为对照(除了接种方式、发酵天数外,对照例的其他反应条件均与实施例5相同,发酵天数见表10)。整个发酵过程在16天内完成,总酸含量降低至5.30g/l,苹果酸浓度降低至0.45g/l,苹果酸降解率为75.7%。说明在同时接种模式下,yj04能较彻底的降解樱桃酒中的苹果酸,改善酸涩口感。
表10植物乳杆菌yj04同时接种对红灯樱桃酒理化指标的影响(以yj04顺序接种为对照)
*总酸以苹果酸计。
此外,还采用hs-spme和gc-ms技术对樱桃酒的挥发性组分进行萃取和检测,以yj04顺序接种获得的樱桃酒为对照(除了接种方式、发酵天数外,对照例的其他反应条件均与实施例5相同,发酵天数见表10),结果列于表11中。表中数据表明,较之顺序接种樱桃酒,yj04同时接种促进了苯乙醇、乙酸异丁酯、苯甲醛、α-松油醇和里那醇等组分的合成。这些化合物具有果香、坚果香和花香,会赋予樱桃酒更丰富的香气特征,能够进一步提高樱桃酒的感官质量。
表11植物乳杆菌yj04同时接种对红灯樱桃酒挥发性组分的影响(mg/l)
发酵结束后使用皂土进行下胶处理,7天后转罐。冷冻前采用硅藻土过滤除去葡萄酒的悬浮物,去除率达到96%,之后置于-1℃下冷处理7天,再用0.22微米板框过滤机精滤,工作压力为0.2~0.3mpa,最后罐装。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!