异双官能性单分散聚乙二醇以及使用该异双官能性单分散聚乙二醇的缀合物的制作方法
本发明涉及具有两个不同的化学反应性官能团的异双官能性单分散聚乙二醇。更具体地,本发明涉及异双官能性单分散聚乙二醇,其用于修饰例如生理活性蛋白、肽、抗体、核酸或低分子量药物的生物功能分子、药物递送系统中的药物载体、诊断用材料或医疗器械等,并且其对于修饰抗体药物是特别有用的,还涉及使用该异双官能性单分散聚乙二醇的缀合物。
背景技术:
抗体-药物缀合物(antibody-drugconjugate:adc)是一种抗体药物,其中药物结合于抗体并且其目标为通过利用抗体的抗原特异性将药物主动运输至疾病位点,并且是近年来在癌症治疗领域中最快速成长的技术之一。adc是由抗体、药物以及用于抗体和药物之间的结合的连接物的各个部分构成的。
许多用于adc的药物是疏水性的,当将多个这种疏水药物结合至抗体以制备adc时,存在由于药物的疏水性导致的聚集发生或抗体在血液中的稳定性下降的问题。因此,每个抗体能够搭载的药物数量受到限制,作为结果,在一些情况下adc的药效不能充分地获得。
对于该问题,研究的解决方案之一是使用亲水性连接物。作为亲水性连接物,使用了聚乙二醇、亲水性肽和糖链等。特别地,由于聚乙二醇具有低抗原性和高生物相容性,其在处于临床试验或前临床试验阶段的多个adc中使用。
在adc领域中,为了保证adc的均质性和简化纯化、分析和药物审批过程的目的,使用了包含90%以上具有特定乙二醇链长的组分的化合物。这样的化合物被称为单分散聚乙二醇。
在使用单分散聚乙二醇作为adc的连接物的情况下,由于需要分别地结合抗体和药物,采用了具有两个不同的化学反应性官能团的异双官能性单分散聚乙二醇。一般而言,使用在单分散聚乙二醇的两个末端具有互不相同的化学反应性官能团的化合物制备adc。
然而,近年来,报道了不使用单分散聚乙二醇作为连接抗体和药物的连接物主链,并且导入单分散聚乙二醇作为连接抗体和药物的分枝化连接物的侧链。
在非专利文献1中,关于使用单分散聚乙二醇作为连接抗体和药物的连接物主链的adc以及使用单分散聚乙二醇作为连接抗体和药物的分枝化连接物的侧链的adc,比较了其药物动力学和治疗效果,并且报道了后者的adc对于药物的疏水性具有高掩蔽效果且展现了优秀的药物动力学和治疗效果。
此外,在专利文献3和专利文献3中,公开了各种类型的具有作为分枝化连接物的侧链的单分散聚乙二醇,以及用于制备这些adc的中间体。
另外,在专利文献1中,记载了其中两个聚乙二醇链和两个官能团结合至季戊四醇骨架的聚乙二醇衍生物。
现有技术文献
专利文献
专利文献1:jp-a-2011-225860
专利文献2:wo2015/057699
专利文献3:wo2016/063006
非专利文献
非专利文献1:naturebiotechnology,2015,33,733-735
技术实现要素:
本发明解决的问题
在专利文献1中,仅公开了两个相同的官能团和两个相同的聚乙二醇链结合至季戊四醇骨架的化合物。这是因为在官能化反应中,季戊四醇的两个羟基被保护基团保护,在加成eo之后移除保护基团,然后进行官能化。
在非专利文献1、专利文献2或专利文献3记载的具有作为分枝化连接物的侧链的单分散聚乙二醇的adc中,使用在单分散聚乙二醇所结合的连接物的分枝部分中具有非对称碳的氨基酸。
在期望的化学结构的连接物是使用具有这样的手性中心的化合物通过各种化学转化过程构建而成的情况下,在化学转化过程中所包括的,在例如酸性或碱性反应条件、在有机催化剂或无机催化剂存在下的反应或者在缩合剂存在下的反应中发生不期望的手性中心的部分立体翻转或外消旋化,因此存在形成立体异构体的混合物的可能性。从立体异构体的混合物中分离具有期望的三维结构的化合物是极其困难的。在使用这样的立体异构体的混合物作为连接抗体和药物的连接物时,由于形成非均质adc,所以是不优选地。
此外,在专利文献2或专利文献3中,还公开了在分枝化连接物的侧链中具有两个以上单分散聚乙二醇的adc。然而,各个单分散聚乙二醇侧链的结合位置相互分离,并且由于作为具有多个聚乙二醇链的分枝化聚乙二醇的特征的伞状结构(biomaterials2001,22(5),405-417),对于疏水性药物的掩蔽效果小,使得由于多个单分散聚乙二醇侧链的存在带来的优势不能被有效地利用。
本发明的目标是提供具有两个相邻的单分散聚乙二醇侧链并且在分子结构中不具有手性中心的异双官能性单分散聚乙二醇,以及其中使用该异双官能性单分散聚乙二醇连接抗体和药物的抗体-药物缀合物。
解决问题的手段
为解决上述问题进行了大量研究,作为结果,发明人开发了一种异双官能性单分散聚乙二醇,其中两个单分散聚乙二醇侧链接近地相互结合并且在分子结构中不具有手性中心,以及一种其中使用该异双官能性单分散聚乙二醇连接抗体和药物的的抗体-药物缀合物。
此外,由于在本发明的异双官能性单分散聚乙二醇中两个单分散聚乙二醇链通过稳定的醚键结合于分枝部分的四级碳原子,其具有在异双官能性单分散聚乙二醇的结构的化学转化过程中难以分解为单链单分散聚乙二醇的特征。
即,本发明如下:
[1]一种异双官能性单分散聚乙二醇,如式(1)所示:
(在式(1)中,x1和y1各自为包含至少一个能够在与生物功能分子中存在的官能团的反应中形成共价键的官能团的原子团,原子团x1包含的官能团与原子团y1包含的官能团互不相同;r1是具有1至7个碳原子的烃基或氢原子;n是3至72的整数;a1表示-l1-(ch2)m1-、-l1-(ch2)m1-l2-(ch2)m2-或单键,l1表示醚键、酰胺键、氨基甲酸酯键、二级氨基或单键,l2表示醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数;并且b1表示-l3-(ch2)m3-、-l3-(ch2)m3-l4-(ch2)m4-或单键,l3表示酰胺键或单键,l4表示醚键、酰胺键或氨基甲酸酯键,并且m3和m4各自独立地表示1至5的整数。)
[2]根据[1]所述的异双官能性单分散聚乙二醇,其中,在式(1)中,a1表示-nhc(o)-(ch2)m1-或-nhc(o)-(ch2)m1-l2-(ch2)m2-,并且b1表示-(ch2)m3-或-(ch2)m3-l4-(ch2)m4-。
[3]根据[1]所述的异双官能性单分散聚乙二醇,其中,在式(1)中,a1表示-ch2-或-ch2-l2-(ch2)m2-,并且b1表示-ch2-或-ch2-l4-(ch2)m4-。
[4]根据[1]所述的异双官能性单分散聚乙二醇,其中,在式(1)中,a1表示-o-(ch2)m1-或-o-(ch2)m1-l2-(ch2)m2-,并且b1表示-ch2-或-ch2-l4-(ch2)m4-。
[5]根据[1]所述的异双官能性单分散聚乙二醇,其中,在式(1)中,a1表示-c(o)nh-(ch2)m1-或-c(o)nh-(ch2)m1-l2-(ch2)m2-,并且b1表示-ch2-或-ch2-l4-(ch2)m4-。
[6]根据[1]所述的异双官能性单分散聚乙二醇,其中,在式(1)中,a1表示-c(o)nh-(ch2)m1-或-c(o)nh-(ch2)m1-l2-(ch2)m2-,并且b1表示-c(o)nh-(ch2)m3-或-c(o)nh-(ch2)m3-l4-(ch2)m4-。
[7]根据[1]至[6]的任意一项所述的异双官能性单分散聚乙二醇,其中,在式(1)中,x1和y1各自独立地选自由式(a)、式(b1)、式(b2)、式(c)、式(d)、式(e)、式(f)、式(g)、式(h)、式(i)、式(j)、式(k)、式(l)、式(m)、式(n)和式(o)所组成的组:
(在式(d)中,r2是氢原子或具有1至5个碳原子的烃基;在式(e)中,r3是选自氯原子、溴原子和碘原子的卤素原子;并且在式(l)中,r4是氢原子或具有1至5个碳原子的烃基。)
[8]一种抗体-药物缀合物,包含异双官能性单分散聚乙二醇,如式(2)所示:
(在式(2)中,x2和y2中的一个是抗体,并且另一个是药物;r1是具有1至7个碳原子的烃基或氢原子;n是3至72的整数;a2表示-l1-(ch2)m1-l5、-l1-(ch2)m1-l2-(ch2)m2-l5或单键,l1表示醚键、酰胺键、氨基甲酸酯键、二级氨基或单键,l2表示醚键、酰胺键或氨基甲酸酯键,m1和m2各自独立地表示1至5的整数,并且l5是酰胺键、氨基甲酸酯键、硫醚键、二硫键、碳酸酯键、酯键、醚键、1h-1,2,3-三唑-1,4-二基结构、二级氨基、酰肼基、氧代酰胺基或包含上述任意的烃基;并且b2表示-l3-(ch2)m3-l6、-l3-(ch2)m3-l4-(ch2)m4-l6或单键,l3表示酰胺键或单键,l4表示醚键、酰胺键或氨基甲酸酯键,m3和m4各自独立地表示1至5的整数,并且l6是酰胺键、氨基甲酸酯键、硫醚键、二硫键、碳酸酯键、酯键、醚键、1h-1,2,3-三唑-1,4-二基结构、二级氨基、酰肼基、氧代酰胺基或包含上述任意的烃基。)
发明的效果
由于本发明的异双官能性单分散聚乙二醇不具有手性中心,在化学转化过程中从根本上不发生不期望的手性中心的部分立体翻转或外消旋化的问题,并且由于两个单分散聚乙二醇侧链通过稳定的醚键结合于分枝部分的四级碳原子,在化学转化过程中难以分解为单链单分散聚乙二醇。因此,通过使用异双官能性单分散聚乙二醇结合抗体与药物,能够获得具有高均质性的抗体-药物缀合物。
此外,由于在异双官能性单分散聚乙二醇中两个单分散聚乙二醇侧链接近地相互结合,所以当制备抗体-药物缀合物时,对疏水性药物的掩蔽效果大,从而能够抑制由于药物的疏水性导致的聚集发生或抗体在血液中的稳定性下降。
附图说明
图1是实施例8的使用疏水作用色谱(hic)柱的hplc测量的图谱。
图2是比较例7的使用疏水作用色谱(hic)柱的hplc测量的图谱。
图3是实施例11的对于实施例7获得的式(30)的药物-连接物化合物的使用疏水作用色谱(hic)柱的hplc测量的图谱。
图4是比较例16的对于比较例6获得的式(41)的药物-连接物化合物的使用疏水作用色谱(hic)柱的hplc测量的图谱。
图5是比较例17的对于比较例15获得的式(47)的药物-连接物化合物的使用疏水作用色谱(hic)柱的hplc测量的图谱。
具体实施方式
下文中将详细描述本发明。
在本说明书中,使用的术语“异双官能性”意指具有两个不同的化学反应性官能团,并且术语“单分散聚乙二醇”意指包含90%以上具有特定乙二醇链长的组分的化合物。此外,术语“不具有手性中心”意指重叠镜像是可能的。
本发明的异双官能性单分散聚乙二醇如式(1)所示。
本发明式(1)中的r1是烃基或氢原子。烃基的碳原子的数量优选为7以下。烃基的具体实例包括甲基、乙基、丙基、异丙基、叔丁基、苯基和苄基。r1的优选实施方式是甲基或氢原子,更优选为甲基。
本发明式(1)中的n表示单分散聚乙二醇的重复单元的数量,并且是3至72的整数,优选为4至48的整数,更优选为6至36的整数,并且特别优选为8至24的整数。
在本说明书中,式(1)中的原子团x1和y1互不相同并且没有特别限定,只要是包含至少一个能够与作为异双官能性单分散聚乙二醇的修饰对象的生物功能分子(例如生理活性蛋白、肽、抗体、核酸或低分子量药物)中存在的官能团的反应以形成共价键的官能团的原子团即可。官能团的实例包括例如在“hermanson,g.t.bioconjugatetechniques,2nded.;academicpress:sandiego,ca,2008”、“harris,j.m.poly(ethyleneglycol)chemistry;plenumpress:newyork,1992”和“pegylatedproteindrugs:basicscienceandclinicalapplications;veronese,f.m.,ed.;birkhauser:basel,switzerland,2009”等中记载的官能团。
其中,x1和y1所包括的官能团各自独立地优选为能够在温和反应条件下以高反应效率与由蛋白质所代表的生物功能分子中天然存在的官能团(例如氨基、巯基、醛基或羧基)、或者能够被人工导入上述生物功能分子的官能团(例如马来酰亚胺基、酮基、叠氮及或炔基)反应的官能团。更具体地,其优选为活性酯基、活性碳酸酯基、醛基、异腈酸酯基、异硫氰酸酯基、环氧基、马来酰亚胺基、乙烯基砜基、丙烯酰基、磺酰氧基、羧基、巯基、2-吡啶基二硫基、α-卤代乙酰基、羟基、炔基、烯丙基、乙烯基、氨基、氧代氨基、酰肼基、叠氮基或二苯并环辛炔(dbco)基。此外,考虑到反应效率,其优选为活性酯基、活性碳酸酯基、马来酰亚胺基、α-卤代乙酰基、炔基、叠氮基或二苯并环辛炔(dbco)基。
更具体地,x1和y1所包括的官能团各自独立地,在作为修饰对象的生物功能分子中存在的官能团为氨基的情况下,是活性酯基、活性碳酸酯基、醛基、异腈酸酯基、异硫氰酸酯基、环氧基、马来酰亚胺基、乙烯基砜基、丙烯酰基、磺酰氧基或羧基;在作为修饰对象的生物功能分子中存在的官能团为巯基的情况下,为活性酯基、活性碳酸酯基、醛基、异腈酸酯基、异硫氰酸酯基、环氧基、马来酰亚胺基、乙烯基砜基、丙烯酰基、磺酰氧基、羧基、巯基、2-吡啶基二硫基、α-卤代乙酰基、炔基、烯丙基或乙烯基;在作为修饰对象的生物功能分子中存在的官能团为醛基或羧基的情况下,为巯基、羟基、氨基、氧代氨基或酰肼基;在作为修饰对象的生物功能分子中存在的官能团为炔基的情况下,为巯基或叠氮基;在作为修饰对象的生物功能分子中存在的官能团为叠氮基的情况下,为炔基或二苯并环辛炔基;在作为修饰对象的生物功能分子中存在的官能团为卤代烷基、烷基磺酸酯或芳基磺酸酯的情况下,为巯基、羟基或氨基。
本文中所称的术语“活性酯基”指代由式:-c(=o)-l表示的活化羰基,其中l表示离去基团。由l表示的离去基团包括琥珀酰亚胺基氧基,邻苯二甲酰亚胺基氧基、4-硝基苯氧基、1-咪唑基、五氟苯氧基、苯并三唑-1-基氧基和7-氮杂苯并三唑1-基氧基等。本文中所称的术语“活性碳酸酯”指代由式:-o-c(=o)-l表示的活化碳酸酯基,并且l表示与上述相同的离去基团。
在本发明的优选实施方式中,x1和y1各自独立地是由基团(i)、基团(ii)、基团(iii)、基团(iv)、基团(v)或基团(vi)表示的基团。
基团(i):能够通过与生物官能性分子的氨基反应形成共价键的官能团
下列(a)、(b1)、(b2)、(c)、(d)、(e)和(f)
基团(ii):能够通过与生物官能性分子的巯基反应形成共价键的官能团
下列(a)、(b1)、(b2)、(c)、(d)、(e)、(f)、(g)、(h)和(l)
基团(iii):能够通过与生物官能性分子的醛基或羧基反应形成共价键的官能团
下列(g)、(i)、(j)、(k)和(o)
基团(iv):能够通过与生物官能性分子的炔基反应形成共价键的官能团
下列(g)、(i)、(j)、(k)和(n)
基团(v):能够通过与生物官能性分子的叠氮基反应形成共价键的官能团
下列(l)和(m)
基团(vi):能够通过与生物功能分子的卤代烷基、烷基磺酸酯或芳基磺酸酯反应形成共价键的官能团
下列(g)、(i)和(o)
上式中,r2和r4各自是氢原子或具有1至5个碳原子的烃基,并且烃基的具体实例包括甲基、乙基、丙基、异丙基、丁基、叔丁基和戊基。r3是选自氯原子、溴原子和碘原子的卤素原子。
作为式(1)中的原子团x1和y1所包含的官能团的组合的优选实例,当x1所包含的官能团是活性酯基或活性碳酸酯基时,y1所包含的官能团是选自马来酰亚胺基、乙烯基砜基、α-卤代乙酰基、炔基和叠氮基的基团;当x1所包含的官能团是醛基时,y1所包含的官能团是选自马来酰亚胺基、乙烯基砜基、炔基和叠氮基的基团;当x1所包含的官能团是马来酰亚胺基、乙烯基砜基或α-卤代乙酰基时,y1所包含的官能团是选自活性酯基、活性碳酸酯基、炔基和叠氮基的基团;当x1所包含的官能团是炔基或叠氮基时,y1所包含的官能团是选自马来酰亚胺基、乙烯基砜基、α-卤代乙酰基、活性酯基、活性碳酸酯基、氨基、氧代氨基和羟基的基团;当x1所包含的官能团是氨基或氧代氨基时,y1所包含的官能团是选自炔基、叠氮基、巯基、羟基和羧基的基团;并且当x1所包含的官能团是巯基、2-吡啶基二硫基或羟基时,y1是选自氨基、氧代氨基、叠氮基和羧基的基团。更优选地,当x1所包含的官能团是活性酯基或活性碳酸酯基时,y1所包含的官能团是选自马来酰亚胺基、α-卤代乙酰基、炔基和叠氮基的基团;当x1所包含的官能团是醛基时,y1所包含的官能团是选自马来酰亚胺基、α-卤代乙酰基、炔基和叠氮基的基团;当x1所包含的官能团是马来酰亚胺基或α-卤代乙酰基时,y1所包含的官能团是选自活性酯基、活性碳酸酯基、炔基和叠氮基的基团;当x1所包含的官能团是炔基或叠氮基时,y1所包含的官能团是选自马来酰亚胺基、α-卤代乙酰基、活性酯基、活性碳酸酯基、氨基、氧代氨基和羟基的基团;当x1所包含的官能团是氨基或氧代氨基时,y1所包含的官能团是选自炔基、叠氮基、羟基和巯基的基团;并且当x1所包含的官能团是巯基、2-吡啶基二硫基或羟基时,y1所包含的官能团是选自氨基、氧代氨基和叠氮基的基团。
本发明式(1)中的a1是分枝部分的四级碳原子与x1之间的二价间隔物,式(1)中的b1是分枝部分的四级碳原子与y1之间的二价间隔物,并且它们分别由共价键构成。具体地,a1表示-l1-(ch2)m1-、-l1-(ch2)m1-l2-(ch2)m2-或单键,l1表示醚键、酰胺键、氨基甲酸酯键、二级氨基或单键,l2表示醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数。b1表示-l3-(ch2)m3-、-l3-(ch2)m3-l4-(ch2)m4-或单键,l3表示酰胺键或单键,l4表示醚键、酰胺键或氨基甲酸酯键,并且m3和m4各自独立地表示1至5的整数。
在本发明的优选实施方式中,式(1)中的a1和b1的具体结构以及具有上述a1和b1的异双官能性单分散聚乙二醇的典型合成例将在下文中说明,但是本发明不应被解释为被限定于此。
(a)在本发明的优选实施方式中,式(1)中的a1表示-nhc(o)-(ch2)m1-或-nhc(o)-(ch2)m1-l2-(ch2)m2-,l2是醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数;b1表示-(ch2)m3-或-(ch2)m3-l4-(ch2)m4-,l4表示醚键、酰胺键或氨基甲酸酯键,并且m3和m4各自独立地表示1至5的整数。更优选地,a1表示-nhc(o)-(ch2)m1-,m1表示1至5的整数;并且b1表示-(ch2)m3-或-(ch2)m3-o-(ch2)m4-,并且m3和m4各自独立地表示1至5的整数。
上述异双官能性单分散聚乙二醇的合成的典型实例包括以下步骤。此处,例示了导入马来酰亚胺基和对硝基苯基碳酸酯基作为官能团的化合物。
(在式(3)中,p1是氨基的保护基团,并且p2是羟基的保护基团。)
将式(3)所示的化合物在无水溶剂中在强碱的存在下进行与一甲基单分散聚乙二醇的烷基或芳基磺酸酯或者一甲基单分散聚乙二醇的卤化物的亲核置换反应以获得下式(4)所示的化合物。
本文中所称的“保护基团”是阻止或阻碍分子中特定的官能团在某些反应条件下反应的部分。保护基团取决于要保护的官能团的类型、使用的条件和分子中其他官能团或保护基团的存在而变化。保护基团的特定实例能够在许多普通书籍中找到,并且例如在“wuts,p.g.m.;greene,t.w.protectivegroupsinorganicsynthesis,4thed.;wiley-interscience:newyork,2007”中有描述。此外,通过使用适合于各种保护基团的反应条件,即通过发生化学反应,能够使被保护基团保护的官能团去保护,而再生原始的官能团。保护基团的典型去保护条件记载在上述文献中。
作为要被保护的官能团和保护基团的优选组合,当要被保护的官能团是氨基时,例如,例示了酰基系保护基团和氨基甲酸酯系保护基团,并且其具体实例包括三氟乙酰基、9-芴甲氧羰基和2-(三甲基甲硅烷基)乙氧羰基。当要被保护的官能团是羟基时,例如,例示了甲硅烷基系保护基团和酰基系保护基团,并且其具体实例包括叔丁基二苯基甲硅烷基、叔丁基二甲基甲硅烷基、三异丙基甲硅烷基、乙酰基和三甲基乙酰基。
当要被保护的官能团是羧基时,例如,例示了烷基酯系保护基团和甲硅烷基酯系保护基团,并且其具体实例包括甲基、9-芴甲基和叔丁基二甲基甲硅烷基。当要被保护的官能团是磺酰基时,例如,例示了硫醚系保护基团、硫代碳酸酯系保护基团和二硫化物系保护基团,并且其具体实例包括s-2,4-二硝基苯基、s-9-芴甲氧羰基和s-叔丁基二硫基。此外,可以使用能够同时保护两个相同类型或不同类型的官能团的双官能性保护基团。作为要被保护的官能团和保护基团的优选组合,当要被保护的官能团是两个羟基时,例如,例示了环状缩醛系保护基团和环状甲硅烷系保护基团,并且其具体实例包括2,2-二甲基-1,3-二氧戊环基、2,2-二甲基-1,3-二氧六环基、2-苯基-1,3-二氧戊环基、2-苯基-1,3-二氧六环基和二叔丁基亚甲硅基。当要被保护的官能团是氨基和羟基时,例如,例示了恶唑啉系保护基团,并且其具体实例包括2-苯基恶唑啉基。
保护基团的典型去保护条件记载在上述文献中,并且能够选择适合于各个保护基团的反应条件。然而,在结构中所包含的官能团是在该官能团即使不被保护基团保护时也不抑制其他官能团的化学反应的官能团的情况下,不需要使用保护基团。
在脱保护上式(4)所示化合物的保护基团p1之后,所得的化合物在缩合剂的存在下与6-马来酰亚胺基己酸反应以获得下式(5)所示的化合物。此处,在选择羟基不与氨基的反应试剂反应的反应条件时,保护基团p2可以与保护基团p1同时脱保护。
在脱保护上式(5)所示化合物的保护基团p2之后,所得的化合物在碱的存在下与对硝基苯基氯代甲酸酯反应以获得下式(6)所示的化合物。
(b)在本发明的另一优选实施方式中,式(1)中的a1表示-ch2-或-ch2-l2-(ch2)m2-,l2是醚键、酰胺键或氨基甲酸酯键,并且m2表示1至5的整数;并且b1表示-ch2-或-ch2-l4-(ch2)m4-,l4表示醚键、酰胺键或氨基甲酸酯键,并且m4表示1至5的整数。更优选地,a1表示-ch2-nhc(o)-(ch2)m2-,m2表示1至5的整数;并且b1表示-ch2-或-ch2-o-(ch2)m4-,并且m4表示1至5的整数。
上述异双官能性单分散聚乙二醇的合成的典型实例包括以下步骤。此处,例示了导入碘代乙酰胺基和n-琥珀酰亚胺基酯基作为官能团的化合物。
(在式(7)中,p3是氨基的保护基团,并且p4是羟基的保护基团。)
将式(7)所示的化合物在无水溶剂中在强碱的存在下进行与一甲基单分散聚乙二醇的烷基或芳基磺酸酯或者一甲基单分散聚乙二醇的卤化物的亲核置换反应以获得下式(8)所示的化合物。
在脱保护上式(8)所示化合物的保护基团p4之后,所得的化合物在无水溶剂中在碱的存在下与4-羟基丁酸的羧基保护体反应以获得下式(9)所示的化合物。
(在式中,p5是羧基的保护基团。)
在脱保护上式(9)所示化合物的保护基团p3之后,所得的化合物与碘代乙酸酐反应以获得下式(10)所示的化合物。
在脱保护上式(10)所示化合物的保护基团p5之后,所得的化合物在缩合剂的存在下与n-羟基琥珀酰亚胺反应以获得下式(11)所示的化合物。
(c)在本发明的又一优选实施方式中,式(1)中的a1表示-o-(ch2)m1-或-o-(ch2)m1-l2-(ch2)m2-,l2是醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数;并且b1表示-ch2-或-ch2-l4-(ch2)m4-,l4表示醚键、酰胺键或氨基甲酸酯键,并且m4表示1至5的整数。更优选地,a1表示-o-(ch2)m1-nhc(o)-(ch2)m2-,m1和m2各自独立地表示1至5的整数;并且b1表示-ch2-或-ch2-o-(ch2)m4-,并且m4表示1至5的整数。
上述异双官能性单分散聚乙二醇的合成的典型实例包括以下步骤。此处,例示了导入2-吡啶基二硫基和n-琥珀酰亚胺基碳酸酯基作为官能团的化合物。
(在式(12)中,p6是氨基的保护基团,并且p7是羟基的保护基团。)
将式(12)所示的化合物在无水溶剂中在强碱的存在下进行与一甲基单分散聚乙二醇的烷基或芳基磺酸酯或者一甲基单分散聚乙二醇的卤化物的亲核置换反应以获得下式(13)所示的化合物。
在脱保护上式(13)所示化合物的保护基团p6之后,所得的化合物与3-(2-吡啶基二硫基)丙酸n-琥珀酰亚胺基酯反应以获得下式(14)所示的化合物。
在脱保护上式(14)所示化合物的保护基团p7之后,所得的化合物在碱的存在下与n,n-二琥珀酰亚胺基碳酸酯反应以获得下式(15)所示的化合物。
(d)在本发明的再一优选实施方式中,式(1)中的a1表示-c(o)nh-(ch2)m1-或-c(o)nh-(ch2)m1-l2-(ch2)m2-,l2是醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数;并且b1表示-ch2-或-ch2-l4-(ch2)m4-,l4表示醚键、酰胺键或氨基甲酸酯键,并且m4表示1至5的整数。更优选地,a1表示-c(o)nh-(ch2)m1-,m1表示1至5的整数;并且b1表示-ch2-或-ch2-o-(ch2)m4-,并且m4表示1至5的整数。
上述异双官能性单分散聚乙二醇的合成的典型实例包括以下步骤。此处,例示了导入叠氮基和对硝基苯基碳酸酯基作为官能团的化合物。
(在式(16)中,p8是羧基的保护基团,并且p9是羟基的保护基团。)
将式(16)所示的化合物在无水溶剂中在强碱的存在下进行与一甲基单分散聚乙二醇的烷基或芳基磺酸酯或者一甲基单分散聚乙二醇的卤化物的亲核置换反应以获得下式(17)所示的化合物。
在脱保护上式(17)所示化合物的保护基团p8之后,所得的化合物在缩合剂的存在下与3-叠氮基丙胺反应以获得下式(18)所示的化合物。
在脱保护上式(18)所示化合物的保护基团p9之后,所得的化合物在碱的存在下与对硝基苯基氯代甲酸酯反应以获得下式(19)所示的化合物。
(e)在本发明的又再一优选实施方式中,式(1)中的a1表示-c(o)nh-(ch2)m1-或-c(o)nh-(ch2)m1-l2-(ch2)m2-,l2是醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数;并且b1表示-c(o)nh-(ch2)m3-或-c(o)nh-(ch2)m3-l4-(ch2)m4-,l4表示醚键、酰胺键或氨基甲酸酯键,并且m3和m4各自独立地表示1至5的整数。更优选地,a1表示-c(o)nh-(ch2)m1-,m1表示1至5的整数;并且b1表示-c(o)nh-(ch2)m3-nhc(o)-(ch2)m4-,并且m3和m4各自独立地表示1至5的整数。
上述异双官能性单分散聚乙二醇的合成的典型实例包括以下步骤。此处,例示了导入二苯并环辛炔(dbco)基和马来酰亚胺基作为官能团的化合物。
(在式(20)中,p10是羧基的保护基团,并且p11是氨基的保护基团。)
将式(20)所示的化合物在无水溶剂中在强碱的存在下进行与一甲基单分散聚乙二醇的烷基或芳基磺酸酯或者一甲基单分散聚乙二醇的卤化物的亲核置换反应以获得下式(21)所示的化合物。
在脱保护上式(21)所示化合物的保护基团p10之后,所得的化合物在缩合剂的存在下与二苯并环辛炔(dbco)-氨基衍生物反应以获得下式(22)所示的化合物。
在脱保护上式(22)所示化合物的保护基团p11之后,所得的化合物与3-马来酰亚胺基丙酸n-琥珀酰亚胺基酯反应以获得下式(23)所示的化合物。
根据本发明的另一个方面,提供了一种式(2)所示的包含异双官能性单分散聚乙二醇的抗体-药物缀合物。
本发明式(2)中的r1是烃基或氢原子。烃基的碳原子的数量优选为7以下。烃基的具体实例包括甲基、乙基、丙基、异丙基、叔丁基、苯基和苄基。r1的优选实施方式是甲基或氢原子,更优选为甲基。
本发明式(2)中的n表示单分散聚乙二醇的重复单元的数量,并且是3至72的整数,优选为4至48的整数,更优选为6至36的整数,并且特别优选为8至24的整数。
在本说明书中,式(2)中的x2和y2中的一个是抗体,并且另一个是药物。
本说明书中的术语“抗体”用于表示其最广泛的含义,并且具体地包括单克隆抗体、多克隆抗体、二聚体、多聚体、多特异性抗体(例如双特异性抗体)和抗体片段,只要其展现期望的生物活性(miller,k.etal.j.immunol.2003,170,4854-4861)。
抗体可以是鼠抗体、人抗体、人源化抗体或嵌合抗体,或者能够源自其他物种。抗体是由免疫系统生成的蛋白质,其能够识别并结合特定的抗原(janeway,c.;travers,p.;walport,m.;shlomchik,m.immunobiology,5thed.;garlandpublishing:newyork,2001)
目标抗原一般具有被多个抗体的cdr识别的多个结合位点(也称为表位)。特异性结合于不同表位的抗体具有不同的结构。因此,一个抗原可以具有多于一个的对应抗体。抗体包括全长免疫球蛋白分子或全长免疫球蛋白分子的免疫活性部分(即,包含免疫特异性结合于目标抗原或其部分的抗原结合位点的分子)。这样的目标包括癌细胞和生成与自体免疫疾病相关联的自体免疫抗体的细胞,但不局限于此。本说明书中公开的免疫球蛋白可以是任意的型(type)(例如igg、ige、igm、igd或iga)、类(class)(例如igg1、igg2、igg3、igg4、iga1或iga2)或其亚类。免疫球蛋白可以源自任意物种。然而,在一个实施方式中,免疫球蛋白是人源的、鼠源的或兔源的。
多克隆抗体是例如源自免疫化动物的血清的抗体分子的非均质集团。可以通过使用本领域已知的多种方法产生目标抗原的多克隆抗体。例如,为了产生多克隆抗体,可以通过注射目标抗体或其衍生物使包括但不限于兔、小鼠、大鼠和豚鼠的各种宿主动物免疫化。取决于宿主的物种,可以通过使用包括但不限于弗氏(完全与不完全)佐剂、例如氢氧化铝的矿物凝胶、例如溶血卵磷脂的表面活性剂物质、多聚醇(pluronicpolyol)、聚阴离子、肽、油乳剂、匙孔戚血蓝蛋白、二硝基苯酚以及例如bcg(bacillecalmett-guerin)或小隐孢子虫(corynebacteriumparvum)的潜在有用人类佐剂的各种佐剂来增加免疫应答。这样的佐剂也是本领域已知的。
单克隆抗体是特定的抗原决定簇(例如细胞抗原(癌症或自体免疫细胞抗原)、病毒抗原、微生物抗原、蛋白质、肽、碳水化合物、化学物质、核酸或其抗原结合片段)的抗体的均质集团。可以通过使用本领域已知的任何技术产生目标抗原的单克隆抗体(mab)。其包括但不限于kohler,g;milstein,c.nature1975,256,495-497最初记载的杂交瘤技术、人类b细胞杂交瘤技术(kozbor,d.etal.immunol.today1983,4,72-79)和ebv-杂交瘤技术(cole,s.p.c.etal.monoclonalantibodiesandcancertherapy;alanr.liss:newyork,1985,pp.77-96)。这样的抗体可以是任意的免疫球蛋白的种类,包括igg、igm、ige、iga和igd及其任意亚类。产生本发明的单克隆抗体的杂交瘤可以在体外(invitro)或体内(invivo)培养。
单克隆抗体包括但不限于人单克隆抗体、人源化单克隆抗体、嵌合单克隆抗体和抗体片段。人单克隆抗体可以通过本领域已知的多种技术的任意一种制造(参见,例如teng,n.n.etal.proc.natl.acad.sci.usa.1983,80,7308-7312;kozbor,d.etal.immunologytoday1983,4,72-79;olssonl.etal.meth.enzymol.1982,92,3-16;以及美国专利号5,939,598和5,770,429)。例如嵌合单克隆抗体或人源化单克隆抗体的重组抗体能够通过本领域已知的标准重组dna技术制造(参见,例如美国专利4,816,567和4,816,397)。
抗体的免疫原性也能够通过抗体的表面重建(resurfacing)处理来降低(参见,例如美国专利5,225,539以及欧洲专利0239400、0519596和0592106)。
在本发明的一个实施方式中,抗体可以是双特异性抗体。制造双特异性抗体的方法是本领域已知的。全长双特异性抗体的传统制造方法利用了两个链具有不同特异性的两个免疫球蛋白重链-轻链对的同时表达(参见,milstein,c.etal.nature1983,305,537-539)。根据不同的方法,双特异性抗体也能够通过具有所需的结合特异性的抗体可变域(抗体-抗原结合位点)与免疫球蛋白恒定域序列的融合来产生。
其他有用的抗体包括抗体的片段,但不限于f(ab')2片段、fab'片段、fab片段、fvs、单链抗体(sca)(例如,如美国专利4,946,778、bird,r.e.etal.science1988,242,423-442、huston,j.s.etal.proc.natl.acad.sotusa1988,85,5879-5883和ward,e.s.etal.nature1989,334,544-554中所记载)、scfv、sc-fv-fc、fvdsfv、微抗体(minibody)、双链抗体(diabody)、三链抗体(triabody)、四链抗体(tetrabody)以及包含cdr并且具有与抗体相同的特异性的任意其他分子,例如域抗体(domainantibody)。
在本发明的优选实施方式中,可以使用用于治疗或预防癌症的已知抗体。包括其表达与癌症、细胞增殖障碍或肿瘤的细胞中的表达相关联的任意靶蛋白的全部靶蛋白能够被抗体靶向。
在本发明的优选实施方式中,抗体对于癌症的治疗是有用的。于癌症的治疗有用的抗体的实例包括但不限于:美罗华(rituxan)(注册商标)(genentechinc.),其是用于治疗患有非霍奇金淋巴瘤(non-hodgkin'slymphoma)的患者的嵌合抗-cd20单克隆抗体;ovarex(altarexcorp.),其是用于治疗卵巢癌的鼠抗体;panorex(glaxowellcomeinc.),其是用于治疗结肠直肠癌的鼠igg2a抗体;cetuximaberbitux(imclonesystemsinc.),其是用于治疗例如头癌或颈癌的表皮生长因子阳性癌的抗-egfrigg嵌合抗体;vitaxin(medimmuneinc.),其是用于治疗肉瘤的人源化抗体;campathi/h(leukositeinc.),其是用于治疗慢性淋巴细胞白血病(cll)的人源化igg1抗体;smartm195(proteindesignlabsinc.),其是用于治疗急性髓性白血病(aml)的人源化抗-cd33igg抗体;lymphocide(immunomedicsinc.),其是用于治疗非霍奇金淋巴瘤的人源化抗-cd22igg抗体;smartid10(proteindesignlabsinc.),其是用于治疗非霍奇金淋巴瘤的人源化抗-hla-dr抗体;oncolym(technicloneinc.),其是用于治疗非霍奇金淋巴瘤的放射性标记的鼠抗-hla-dr10抗体;allomune(biotransplantinc.),其是用于治疗霍奇金病(hodgkin'sdisease)或非霍奇金淋巴瘤的人源化抗-cd2mab;avastin(genentechinc.),其是用于治疗肺癌或结肠直肠癌的抗-vegf人源化抗体;epratuzamab(immunomedicsinc.和amgeninc.),其是用于治疗非霍奇金淋巴瘤的抗-cd22抗体;以及ceacide(immunomedicsinc.),其是用于治疗结肠直肠癌的人源化抗-cea抗体。
在本发明的优选实施方式中,抗体是下列抗原的抗体:ca125、ca15-3、ca19-9、l6、lewisy、lewisx、甲胎蛋白、ca242、胎盘碱性磷酸酶、前列腺特异膜抗原、ephb2、tmeff2、前列腺酸性磷酸酶、表皮生长因子、mage-1、mage-2、mage-3、mage-4、转铁蛋白受体、p97、muc1-klh、cea、gp100、mart1、前列腺特异性抗原、il-2受体、cd20、cd52、cd33、cd22、人绒毛膜促性腺激素、cd38、cd40、粘蛋白、p21、mpg以及neu致癌基因产物。
一些特定有用的抗体包括但不限于:cd40抗原的mab,例如br96mab(trail,p.a.etal.science1993,261,212-215)、br64(trail,p.a.etal.cancerresearch1997,57,100-105)或s2c6mab(francisco,j.a.etal.cancerres.2000,60,3225-3231);其他抗-cd40抗体,例如美国专利申请公开号2003/0211100和2002/0142358中公开的那些;cd70抗原的mab,例如1f6mab和2f2mab;以及cd30抗原的mab,例如ac10(bowen,m.a.etal.j.immunol.1993,151,5896-5906、wahl,a.f.etal.cancerres.2002,62(13),3736-3742)或mdx-0060(美国专利申请公开号2004/0006215)。
能够在本发明中使用的药物包括化疗药剂。化疗药剂是在癌症治疗中有用的化合物。化疗药剂的实例包括下列:烷基化剂,例如噻替派(thiotepa)或环磷酰胺(cyclophosphamide)(cytoxan(商标));烷基磺酸盐类,例如白消安(busulfan)、英丙舒凡(improsulfan)或哌泊舒凡(piposulfan);氮丙啶类,例如苯佐替派(benzodopa)、卡波醌(carboquone)、美妥替派(meturedopa)或乌瑞替派(uredopa);亚乙基亚胺类和甲基蜜胺类,包括六甲蜜胺(altretamine)、三亚乙基蜜胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺(triethylenethiophosphoramide)、三甲基奥罗蜜胺(trimethylolomelamine);番荔枝内酯类(acetogenin)(特别地,布拉他辛(bullatacin)和布拉他辛酮(bullatacinone);喜树碱(camptothecin)(包括合成类似物托泊替康(topotecan));苔藓抑素(bryostatin);callystatin;cc-1065(包括其阿多来新(adozelesin)、卡折来新(carzelesin)和比折来新(bizelesin)合成类似物);隐藻素类(cryptophycins)(特别地,隐藻素1和隐藻素8);多拉司他汀(dolastatin);duocarmycin(包括合成类似物kw-2189和cbi-tmi);艾榴塞洛素(eleutherobin);水鬼蕉碱(pancratistatin);sarcodictyin;海绵抑素(spongistatin);氮芥类(nitrogenmustard),例如苯丁酸氮芥(chlorambucil)、萘氮芥(chlornaphazine)、cholophosphamide、雌莫司汀(estramustine)、异环磷酰胺(ifosfamide)、二氯甲基二乙胺(mechlorethamine)、盐酸氧氮芥(盐酸甲氧氮芥)、美法仑(melphalan)、新恩比兴(novembichin)、苯芥胆甾醇(phenesterine)、泼尼莫司汀(prednimustine)、曲磷胺(trofosfamide)或尿嘧啶氮芥(uracilmustard);亚硝脲类(nitrosoureas),例如卡莫司汀(carmustine)、吡葡亚硝脲(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)或雷莫司汀(ranimnustine);抗生素类,诸如烯二炔类(enediyne)抗生素(例如加利车霉素(calicheamicin),特别地,加利车霉素gemma1和加利车霉素theta1,参见例如angewchemintl.ed.engl.33:183-186(1994);dynemicin(包括dynemicina);埃斯培拉霉素(esperamicin);或者新制癌菌素(neocarzinostatin)发色团和相关色蛋白烯二炔抗生素发色团);阿克拉霉素(aclacinomysin)、放线菌素(actinomycin)、氨茴霉素(authramycin)、重氮丝氨酸(azaserine)、博来霉素(bleomycin)、放线菌素c(cactinomycin)、carabicin、洋红霉素(carminomycin)、嗜癌霉素(carzinophilin)、色霉素(chromomycinis)、放线菌素d(dactinomycin)、柔红霉素(daunorubicin)、地托比星(detorubicin)、6-二氮-5-氧-l-正亮氨酸、多柔比星(doxorubicin)(包括吗啉代多柔比星、氰基吗啉代多柔比星、2-吡咯代多柔比星和脱氧多柔比星)、表柔比星(epirubicin)、依索比星(esorubicin)、伊达比星(idarubicin)、麻西罗霉素(marcellomycin)、丝裂霉素类(mitomycins)、霉酚酸(mycophenolicacid)、诺加霉素(nogalamycin)、橄榄霉素(olivomycin)、培洛霉素(peplomycin)、potfiromycin、嘌呤霉素(puromycin)、三铁阿霉素(quelamycin)、罗多比星(rodorubicin)、链黑菌素(streptonigrin)、链脲霉素(streptozocin)、块菌素(tubercidin)、乌苯美司(ubenimex)、净司他丁(zinostatin)、佐柔比星(zorubicin);代谢拮抗剂,例如甲氨蝶呤(methotrexate)和5-氟尿嘧啶(5-fu);叶酸类似物,例如二甲叶酸(denopterin)、甲氨蝶呤、蝶罗呤(pteropterin)或三甲曲沙(trimetrexate);嘌呤类似物,例如氟达拉滨(fludarabine)、6-巯基嘌呤、硫咪嘌呤(thiamiprine)或硫鸟嘌呤(thioguanine);嘧啶类似物,例如安西他滨(ancitabine)、阿扎胞苷(azacitidine)、6-氮尿苷(6-azauridine)、卡莫氟(carmofur)、阿糖胞苷(cytarabine)、双脱氧尿苷(dideoxyuridine)、多西氟尿苷(doxifluridine)、依诺他滨(enocitabine)、氟尿苷(floxuridine)或5-fu;雄激素类(androgen),例如如卡鲁睾酮(calusterone)、屈他雄酮丙酸酯(dromostanolonepropionate)、环硫雄醇(epitiostanol)、美雄烷(mepitiostane)或睾内酯(testolactone);抗肾上腺类(anti-adrenal),例如氨鲁米特(aminoglutethimide)、米托坦(mitotane)或曲洛司坦(trilostane);叶酸补充剂,例如亚叶酸(frolinicacid);醋葡醛内酯(aceglatone);醛磷酰胺糖苷(aldophosphamideglycoside);氨基乙酰丙酸(aminolevulinicacid);安吖啶(amsacrine);阿莫司汀(bestrabucil);比生群(bisantrene);依达曲沙(edatraxate);defofamine;地美可辛(demecolcine);亚丝醌(diaziquone);依氟鸟氨酸(elfomithine);依利醋铵(elliptiniumacetate);埃博霉素(epothilone);依托格鲁(etoglucid);硝酸镓;羟基脲;香菇多糖(lentinan);氯尼达明(lonidamine);美登醇类(maytansinoid),诸如美登素(maytansine)或安丝菌素类(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫哌达醇(mopidamol);二胺硝吖啶(nitracrine);喷司他丁(pentostatin);蛋氨氮芥(phenamet);吡柔比星(pirarubicin);鬼臼酸(podophyllinicacid);2-乙基酰肼;丙卡巴肼(procarbazine);psk(注册商标);雷佐生(razoxane);根瘤菌素(rhizoxin);西佐喃(sizofiran);锗螺胺(spirogermanium);细交链孢菌酮酸(tenuazonicacid);三亚胺醌(triaziquone);2,2',2"-三氯代三乙胺;单端孢霉烯类(trichothecene)(特别地,t-2毒素、疣孢菌素a(verracurina)、杆孢菌素a(roridina)和蛇行菌素(anguidine));脲烷(urethane);长春地辛(vindesine);达卡巴嗪(dacarbazine);甘露莫司汀(mannomustine);二溴甘露醇(mitobronitol);二溴卫矛醇(mitolactol);哌泊溴烷(pipobroman);gacytosine;阿糖胞苷(arabinoside,“ara-c”);环磷酰胺;噻替派;紫杉烷类(taxoid),例如紫杉醇(paclitaxel)(taxol(注册商标),bristol-myerssquibboncology)或多西他赛(doxetaxel)(taxotere(注册商标),rhone-poulencrorer);苯丁酸氮芥(chlorambucil);吉西他滨(gemcitabine);6-硫鸟嘌呤(6-thioguanine);巯基嘌呤;甲氨蝶呤;铂类似物,例如顺铂(cisplatin)或卡铂(carboplatin);长春花碱(vinblastine);铂;依托泊苷(etoposide)(vp-16);异环磷酰胺;丝裂霉素c(mitomycinc);米托蒽醌;长春新碱(vincristine);长春瑞滨(vinorelbine);诺维本(navelbine);诺肖林(novantrone);替尼泊苷(teniposide);道诺霉素(daunomycin);氨基蝶呤(aminopterin);希罗达(xeloda);伊班膦酸盐(ibandronate);cpt-11;拓扑异构酶抑制剂rfs2000;二氟甲基鸟氨酸(dmfo);视黄酸;卡培他滨(capecitabine);以及任意上述物质的药学上可接受的盐、酸或衍生物。能够作用以调节或抑制对于肿瘤的激素作用的抗激素剂,例如抗雌激素药物,包括但不限于,他莫昔芬(tamoxifen)、雷洛昔芬(raloxifene)、4(5)-咪唑抑制芳香酶、4-羟基他莫昔芬、曲沃昔芬(trioxifene)、盐酸雷洛昔芬(keoxifene)、ly117018、奥那司酮(onapristone)和托瑞米芬(toremifene)(fareston);以及抗雄激素药物,例如氟他米特(flutamide)、尼鲁米特(nilutamide)、比卡鲁胺(bicalutamide)、亮丙瑞林(leuprolide)或戈舍瑞林(goserelin);sirna,以及任意上述物质的药学上可接受的盐、酸或衍生物也包括在定义中。能够在本发明中使用的其他化疗药剂在美国专利申请号2008/0171040和2008/0305044中公开,其全部内容通过引用以其整体并入本文。
在本发明的优选实施方式中,化疗药剂是低分子量药物。低分子量药物的分子量优选为100至1500,更优选为120至1200,还更优选为200至1000。典型地,作为低分子量药物,广泛使用的是分子量小于约1000的有机、无机或有机金属化合物。本发明的低分子量药物还包括分子量小于约1000的寡肽和其他生物分子。低分子量药物是本领域明确已知的,例如,尤其参见wo05/058367、ep-a-85901495、ep-a-8590319和美国专利4,956,303,其全部内容通过引用以其整体并入本文。
本发明的低分子量药物是能够连接至抗体的低分子量药物。本发明包括已知药物,以及具有被了解的可能性的药物。特别优选的低分子量药物包括细胞毒性药剂。
优选的细胞毒性药剂包括美登醇类、cc-1065类似物、吗啉类、多柔比星类、紫杉烷类(taxane)、隐藻素类、埃博霉素类、加利车霉素类、瑞奥西汀类(auristatin)和吡咯并苯二氮平(pyrrolobenzodiazepine)二聚体类。
本发明的式(2)所示的包含异双官能性单分散聚乙二醇的抗体-药物缀合物能够通过使用式(1)所示的异双官能性单分散聚乙二醇结合抗体和药物来制备。式(2)所示的抗体-药物缀合物的制备方法可以是其中式(1)所示的异双官能性单分散聚乙二醇先结合至药物然后再结合至抗体的方法,或者是其中式(1)所示的异双官能性单分散聚乙二醇先结合至抗体然后再结合至药物的方法。此外,纯化可以在抗体和药物的任意一个结合之后进行、或者在抗体和药物两者都结合之后进行。
其中式(1)所示的异双官能性单分散聚乙二醇结合至药物的化合物能够通过例如柱色谱、萃取、重结晶、吸附处理、再沉淀或超临界萃取的纯化方法纯化。此外,其中式(1)所示的异双官能性单分散聚乙二醇结合至抗体的化合物以及其中式(1)所示的异双官能性单分散聚乙二醇结合至抗体与药物两者的抗体-药物缀合物能够通过例如柱色谱、萃取或吸附处理的纯化方法纯化。
通过本发明的式(1)所示的异双官能性单分散聚乙二醇结合于抗体的药物的数量由每抗体的药物平均数来定义。药物数量优选为1至20,更优选为2至16,还更优选为3至12,特别优选为4至8。
adc中每抗体的药物数量能够通过本领域技术人员已知的方法确定,例如紫外/可见分光光谱法、质谱法、elisa法、电泳法、hplc或者这些方法的组合。
本发明式(2)中的a2是分枝部分的四级碳原子与x2之间的二价间隔物,并且式(2)中的b2是分枝部分的四级碳原子与y2之间的二价间隔物,并且它们分别由共价键构成。
具体地,a2表示-l1-(ch2)m1-l5-、-l1-(ch2)m1-l2-(ch2)m2-l5-或单键,l1表示醚键、酰胺键、氨基甲酸酯键、二级氨基或单键,l2表示醚键、酰胺键或氨基甲酸酯键,并且m1和m2各自独立地表示1至5的整数。此处,l5表示通过式(1)所示的异双官能性单分散聚乙二醇中的x1所包含的官能团与抗体或药物中存在的官能团的反应形成的原子团,并且优选为酰胺键、氨基甲酸酯键、硫醚键、二硫键、碳酸酯键、酯键、醚键、1h-1,2,3-三唑-1,4-二基结构、二级氨基、酰肼基、氧代酰胺基或包含上述任意的烃基。
此外,b2表示-l3-(ch2)m3-l6-、-l3-(ch2)m3-l4-(ch2)m4-l6-或单键,l3表示酰胺键或单键,l4表示醚键、酰胺键或氨基甲酸酯键,并且m3和m4各自独立地表示1至5的整数。此处,l6表示通过式(1)所示的异双官能性单分散聚乙二醇中的y1所包含的官能团与抗体或药物中存在的官能团的反应形成的原子团,并且优选为酰胺键、氨基甲酸酯键、硫醚键、二硫键、碳酸酯键、酯键、醚键、1h-1,2,3-三唑-1,4-二基结构、二级氨基、酰肼基、氧代酰胺基或包含上述任意的烃基。
实施例
将通过参考实施例,进一步具体地描述本发明,但是本发明不被解释为局限于这些实施例。
在1h-nmr分析中,使用了由jeoldatumltd.制造的jnm-ecp400或jnm-eca600。在测量中,使用了
实施例1
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的500ml四颈烧瓶中注入三羟甲基氨基甲烷(30.3g,250mmol)、碳酸钠(5.30g,50mmol)、无水甲醇(237g)和苯甲腈(5.15g,50mmol),在65℃进行反应24小时。过滤反应混合物,在减压下蒸馏去除溶剂,然后通过加入异丙醇和二氯甲烷溶解残留物,并且用10wt%氯化钠水溶液清洗溶液。有机层用无水硫酸钠干燥,过滤,在减压下蒸馏去除溶剂。在thf中溶解残留物,并且通过加入己烷进行结晶,随后过滤获得式(24)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.06(2h,brs,-oh),
3.65-3.81(4h,dd,>c(ch2oh)2),
4.38(2h,s,-cno-ch2-),
7.32-7.83(5h,m,芳香h)
实施例2
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的100ml三颈烧瓶中注入十二乙二醇单甲醚(10.4g,18.5mmol)、甲苯(52.0g)、三乙胺(2.44g,24.1mmol)和甲磺酰氯(2.34g,20.4mmol),在40℃进行反应3小时。通过加入二氯甲烷稀释反应溶液,然后用水清洗,并且将有机层用无水硫酸镁干燥。过滤后,减压蒸馏去除溶剂,以获得式(25)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.08(3h,s,-o-so2-ch3),
3.38(3h,s,-o-ch3),
3.45-3.85(46h,m,ch3-o-(ch2ch2o)11-ch2ch2-o-so2-ch3),
4.38(2h,m,-ch2-o-so2-ch3)
实施例3
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(24)的化合物(0.21g,1.01mmol)、无水thf(7.70g)、式(25)的化合物(2.46g,3.84mmol)、1m叔丁醇钾thf溶液(3.72g,4.04mmol),在50℃进行反应4小时。在加入二氯甲烷和25wt%氯化钠水溶液后,用水进行清洗,并且将有机层用无水硫酸钠干燥。过滤后,减压蒸馏去除溶剂,以获得式(26)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.38(6h,s,-o-ch3),
3.40-3.75(100h,m,>c(ch2o)2-,-o-(ch2ch2o)12-,-cno-ch2-),
4.36(2h,s,-cno-ch2-),
7.37-7.94(5h,m,芳香h)
实施例4
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的100ml三颈烧瓶中注入式(26)的化合物(1.13g,0.877mmol)和蒸馏水(31.1g)使其溶解。在加入85%磷酸(0.43ml)将ph调整至1.5之后,在50℃进行反应3小时。在加入400g/l氢氧化钠水溶液(5.58ml)并且冷却之后,在50℃进行反应6小时。随后,加入6n盐酸将ph调整至2.0,并且向其中加入甲苯和氯仿进行清洗。加入氯化钠以提供25%氯化钠水溶液,然后使用400g/l氢氧化钠水溶液将ph调整至12.5。通过使用甲苯进行萃取,并且将萃取物用无水硫酸钠干燥。过滤后,减压蒸馏去除溶剂,以获得式(27)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.08(1h,brs,-oh),
3.38(6h,s,-o-ch3),
3.40-3.80(102h,m,>c(ch2o)2-,-o-(ch2ch2o)12-,>cnh2-ch2-oh)
实施例5
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(27)的化合物(0.800g,0.663mmol)、6-马来酰亚胺基己酸(0.161g,0.762mmol)、dmt-mm(0.263g,0.762mmol)、乙腈(8.00g)和三乙胺(0.081g,0.796mmol),在25℃进行反应7小时。向其中加入ph3.0的柠檬酸盐缓冲液(9.60g),然后通过使用甲苯进行清洗。通过使用氯仿进行萃取,并且用10%氯化钠水溶液清洗有机层。有机层用无水硫酸镁干燥,过滤,并且在减压下蒸馏去除溶剂,以获得式(28)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.31(2h,m,-ch2ch2ch2-conh-),
1.62(4h,m,-ch2ch2ch2ch2-conh-),
2.18(2h,t,-ch2-conh-),
3.38(6h,s,-o-ch3),
3.40-3.85(104h,m,>c(ch2o)2-,-o-(ch2ch2o)12-,>cnh-ch2-oh,-ch2-马来酰亚胺),
4.62(1h,t,-oh),
6.23(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺)
实施例6
向装有搅拌器的4-ml螺纹盖试管中加入式(28)的化合物(0.050g,0.036mmol)、n-甲基吗啉(0.036g,0.357mmol)、双(4-硝基苯基)碳酸酯(0.087g,0.286mmol)和无水乙腈(0.281g),在氮气气氛下在25℃进行反应10小时。向其中加入蒸馏水(0.018g,1.00mmol)和n-甲基吗啉(0.022g,0.214mmol),混合物在25℃搅拌6小时然后使用二氯甲烷稀释。通过使用ph3.0的柠檬酸盐缓冲液、ph10.0的硼酸盐缓冲液以及25%氯化钠水溶液清洗混合物。有机层用无水硫酸钠干燥,过滤,并且在减压下蒸馏去除溶剂,以获得式(29)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.31(2h,m,-ch2ch2ch2-conh-),
1.59(4h,m,-ch2ch2ch2ch2-conh-),
2.16(2h,t,-ch2-conh-),
3.38(6h,s,-o-ch3),
3.40-3.85(102h,m,>c(ch2o)2-,-o-(ch2ch2o)12-,-ch2-马来酰亚胺),
4.70(1h,s,>cnh-ch2-ocoo-),
6.02(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺),
7.35-8.35(4h,m,芳香h)
实施例7
向装有搅拌器的4-ml螺纹盖试管中加入多柔比星盐酸盐(4.08mg,7.03μmol)、n,n-二异丙基胺(1.98mg、14.7μmol)、n,n-二甲基甲酰胺以及式(29)的化合物(10.0mg,6.38μmol),进行反应4小时。用二氯甲烷稀释之后,使用5wt%磷酸二氢钠十二水合物水溶液并且随后用离子交换水清洗混合物。有机层用无水硫酸钠干燥,过滤,并且在减压下蒸馏去除溶剂,以获得式(30)的药物-连接物化合物。
1h-nmr(cd3cl,tms内标);δ(ppm):
1.23-1.31(5h,m),1.55-1.65(4h,m),1.75-1.88(2h,m),
2.08(2h,t),2.14-2.39(2h,m),2.88(1h,dd),
3.02(1h,s),3.18(2h,dd),3.38(3h,s),
3.41-3.90(110h,m),4.03-4.06(1h,m),4.09(3h,s),
4.12-4.14(1h,m),4.22-4.47(1h,m),4.65(1h,s),
4.77(2h,d),5.33(1h,s),5.42-5.44(1h,m),
5.53(1h,s),6.16(1h,s),6.69(2h,s),
7.41(1h,d),7.80(1h,t),8.06(1h,d)
实施例8
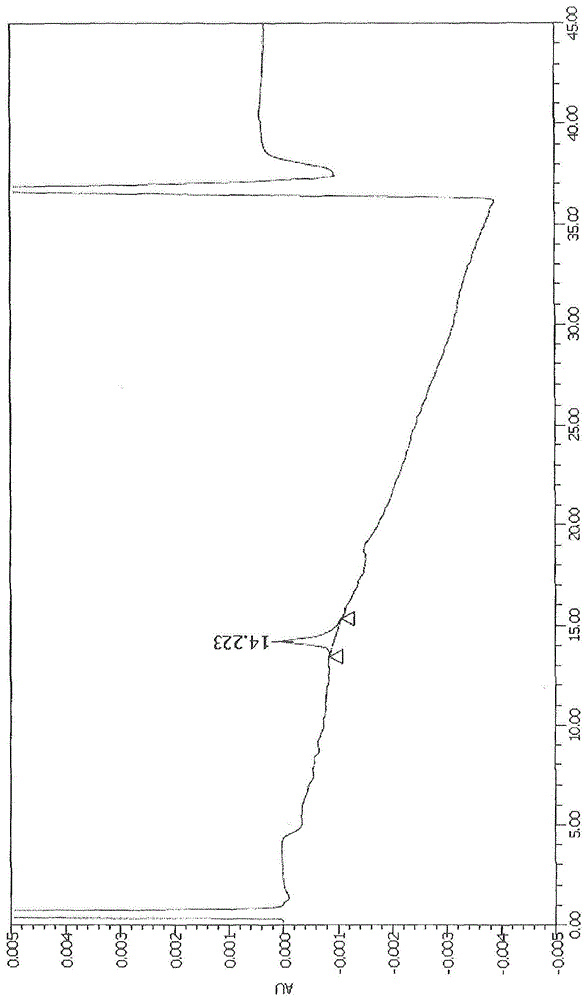
对于实施例7中获得的式(30)的药物-连接物化合物,使用疏水作用色谱(hic)柱在下列测量条件下进行hplc测量。测量结果的图谱在图1中示出。
hplc仪器:alliance(waters)
色谱柱:tskgelbutyl-npr(4.6×35mm,2.5μm;tosohcorp.)
流速:0.8ml/分钟
分析时间:45分钟
柱温:25℃
进样量:100μl
检测器:光电二极管阵列(测量波长:200-600nm)
流动相a:包含1.5m硫酸铵的50mm磷酸钠缓冲液(ph7.0)
流动相b:包含80%的50mm磷酸钠缓冲液(ph7.0)和20%的异丙醇的混合溶液
梯度程序:0%-0%(0分钟-2.5分钟)、0%-100%(2.5分钟-35分钟)、100%-0%(35.1分钟-45分钟)
实施例9
将鼠产生的单克隆抗白细胞介素-1β抗体(0.500mg,sigma-aldrich)溶解于磷酸盐缓冲生理盐水(pbs,0.500ml)。将溶液(0.048ml)装入0.5ml聚丙烯试管中,向其中加入50.0mm乙二胺四乙酸(edta,0.006ml)和0.800mm三(2-羧甲基)膦盐酸盐(tcep)水溶液(0.006ml;抗体的15倍当量),将混合物在37℃震荡1小时。向溶液中加入包含n,n-二甲基甲酰胺和2.50mm式(30)的化合物的溶液(0.007ml;抗体的53倍当量),进一步将混合物在20℃震荡1小时。向其中加入2.50mmn-乙酰基半胱氨酸溶液(0.007ml;抗体的53倍当量),进一步将所得混合物在20℃震荡1小时。将所得溶液装入使用pbs(10ml)平衡的nap-5色谱柱(gehealthcarelifescience),用pbs洗脱以分离抗体组分。
实施例10
能够通过测量抗体-药物缀合物的水溶液在280nm和495nm的两个波长处的uv吸光度,然后进行下列计算来算出抗体-药物缀合物中每抗体的平均结合数。
由于在特定波长的总吸光度等于系统中存在的所有吸光化学物种的吸光度的总和(吸光度的加成性),假设在抗体与药物的缀合反应前后,抗体和药物的摩尔消光系数没有变化,在抗体-药物缀合物中的抗体浓度和药物浓度由下式表示。
a280=ad,280+aa,280=εd,280cd+εa,280ca式(i)
a495=ad,495+aa,495=εd,495cd+εa,495ca式(ii)
此处,a280表示抗体-药物缀合物的水溶液在280nm的吸光度,a495表示抗体-药物缀合物的水溶液在495nm的吸光度,aa,280表示抗体在280nm的吸光度,aa,495表示抗体在495nm的吸光度,ad,280表示药物-连接物化合物在280nm的吸光度,ad,495表示药物-连接物化合物在495nm的吸光度,εa,280表示抗体在280nm的摩尔消光系数,εa,495表示抗体在495nm的摩尔消光系数,εd,280表示药物-连接物化合物在280nm的摩尔消光系数,εd,495表示药物-连接物化合物在495nm的摩尔消光系数,ca表示抗体-药物缀合物中的抗体浓度,并且cd表示抗体-药物缀合物中的药物浓度。
此处,对于εa,280、εa,495、εd,280和εd,495,使用预先准备的值(估计值或从化合物的uv测量中获得的测量值)。εa,495通常为0。εd,280和εd,495能够通过测量其中溶解了特定摩尔浓度的使用的药物-连接物的溶液的吸光度并且根据朗伯-比尔定律计算而获得(吸光度=摩尔浓度×摩尔消光系数×样品池光路长度)。能够通过测量抗体-药物缀合物的水溶液的a280和a495,并且将这些值带入式(i)和式(ii),通过解出联立方程而获得ca和cd。此外,每抗体的药物平均结合数能够通过用cd除以ca获得。
作为使用摩尔消光系数εa,280=206,999(估计值)、εa,495=0、εd,280=8067(测量值)以及εd,495=8121(测量值)解出上述联立方程的结果,每抗体的药物平均结合数为8.4。
实施例11
对于实施例7中获得的式(30)的药物-连接物化合物,使用疏水作用色谱(hic)柱在下列测量条件下进行hplc测量。测量波长为495nm的测量结果的图谱在图3中示出。
hplc仪器:alliance(waters)
色谱柱:tskgelbutyl-npr(4.6×35mm,2.5μm;tosohcorp.)
流速:0.8ml/分钟
分析时间:45分钟
柱温:25℃
进样量:100μl
检测器:紫外可见分光光度计(测量波长:495nm和280nm)
流动相a:包含1.5m硫酸铵的50mm磷酸钠缓冲液(ph7.0)
流动相b:包含80%的50mm磷酸钠缓冲液(ph7.0)和20%的异丙醇的混合溶液
梯度程序:0%-0%(0分钟-2.5分钟)、0%-100%(2.5分钟-35分钟)、100%-0%(35.1分钟-45分钟)
实施例12
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的300ml四颈烧瓶中注入四乙二醇单甲醚(23.0g,110mmol)、甲苯(115g)、三乙胺(14.5g,143mmol)和甲磺酰氯(13.9g,121mmol),在40℃进行反应2小时。通过加入二氯甲烷稀释反应溶液,然后用水清洗,并且将有机层用无水硫酸镁干燥。过滤后,减压蒸馏去除溶剂,以获得式(31)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.08(3h,s,-o-so2-ch3),
3.38(3h,s,-o-ch3),
3.45-3.85(14h,m,ch3-o-(ch2ch2o)4-ch2ch2-o-so2-ch3),
4.38(2h,m,-ch2-o-so2-ch3)
实施例13
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的500ml四颈烧瓶中注入式(24)的化合物(5.00g,24.1mmol)、无水thf(138g)、式(31)的化合物(16.6g,57.9mmol)、1m叔丁醇钾thf溶液(52.6g,33.7mmol),在50℃进行反应4小时。在加入二氯甲烷和25wt%氯化钠水溶液后,用水进行清洗,并且将有机层用无水硫酸钠干燥。过滤后,减压蒸馏去除溶剂,以获得式(32)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.38(6h,s,-o-ch3),
3.40-3.75(36h,m,>c(ch2o)2-,-o-(ch2ch2o)4-,-cno-ch2-),
4.36(2h,s,-cno-ch2-),
7.37-7.94(5h,m,芳香h)
实施例14
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的500ml四颈烧瓶中注入式(32)的化合物(12.0g,20.4mmol)和蒸馏水(168g)使其溶解。在加入85%磷酸(6.3ml)将ph调整至1.5之后,在50℃进行反应2小时。在加入400g/l氢氧化钠水溶液(72.9ml)并且冷却之后,在50℃进行反应5小时。随后,加入6n盐酸将ph调整至2.0,并且向其中加入甲苯和氯仿进行清洗。加入氯化钠以提供25%氯化钠水溶液,并且随后使用400g/l氢氧化钠水溶液将ph调整至12.5。通过使用甲苯进行萃取,萃取物用无水硫酸钠干燥,过滤,在减压下蒸馏去除溶剂,以获得式(33)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.08(1h,brs,-oh),
3.38(6h,s,-o-ch3),
3.40-3.80(38h,m,>c(ch2o)2-,-o-(ch2ch2o)4-,>cnh2-ch2-oh)
实施例15
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的100ml三颈烧瓶中注入式(33)的化合物(3.00g,5.98mmol)、6-马来酰亚胺基己酸(1.45g,6.88mmol)、dmt-mm(1.90g,6.88mmol)、乙腈(30.0g)和三乙胺(0.726g,7.18mmol),在25℃进行反应5小时。向其中加入ph3.0的柠檬酸盐缓冲液(36.0g),然后通过使用甲苯进行清洗。通过使用氯仿进行萃取,并且用10%氯化钠水溶液清洗有机层。有机层用无水硫酸镁干燥,过滤,在减压下蒸馏去除溶剂,以获得式(34)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.31(2h,m,-ch2ch2ch2-conh-),
1.62(4h,m,-ch2ch2ch2ch2-conh-),
2.18(2h,t,-ch2-conh-),
3.38(6h,s,-o-ch3),
3.40-3.85(40h,m,>c(ch2o)2-,-o-(ch2ch2o)4-,>cnh-ch2-oh,-ch2-马来酰亚胺),
4.62(1h,t,-oh),
6.23(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺)
实施例16
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(34)的化合物(2.50g,3.60mmol)、n-苯基吗啉(1.47g,9.00mmol)、对硝基苯基氯代甲酸酯(1.45g,7.20mmol)和二氯甲烷(47.7g),在25℃进行反应2小时。向其中加入蒸馏水(0.39g,21.6mmol)和n-苯基吗啉(1.47g,9.00mmol),混合物在25℃搅拌6小时然后使用己烷稀释。通过使用0.2m盐酸、ph10的硼酸盐缓冲液以及10%氯化钠水溶液清洗混合物。有机层用无水硫酸钠干燥,过滤,在减压下蒸馏去除溶剂。残留物用乙腈溶解。通过加入己烷和叔丁醇清洗溶液,在减压下蒸馏去除溶剂,以获得式(35)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.31(2h,m,-ch2ch2ch2-conh-),
1.59(4h,m,-ch2ch2ch2ch2-conh-),
2.16(2h,t,-ch2-conh-),
3.38(6h,s,-o-ch3),
3.40-3.85(38h,m,>c(ch2o)2-,-o-(ch2ch2o)4-,-ch2-马来酰亚胺),
4.70(1h,s,>cnh-ch2-ocoo-),
6.08(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺),
7.35-8.35(4h,m,芳香h)
比较例1
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的100ml三颈烧瓶中注入2-氨基-2-甲基-1,3-丙二醇(13.1g,125mmol)、碳酸钠(2.65g,25mmol)、无水甲醇(19.8g)和苯甲腈(2.58g,25mmol),并且以与实施例1相同的方式进行反应和纯化,以获得式(36)的化合物。
1h-nmr(cd3od,tms内标);δ(ppm):
1.33(3h,s,>cch3-ch2-oh),
3.49-3.60(2h,dd,>cch3-ch2-oh),
4.10-4.53(2h,dd,-cno-ch2-),
7.43-7.93(5h,m,芳香h)
比较例2
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(36)的化合物(0.130g,0.680mmol)、无水thf(1.87g)、式(25)的化合物(0.651g,1.02mmol)、1m叔丁醇钾thf溶液(0.928g,1.02mmol),并且以与实施例3相同的方式进行反应和纯化,以获得式(37)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.37(3h,s,>cch3-ch2-o-ch2-),
3.38(3h,s,-o-ch3),
3.40-3.80(50h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)12-,-cno-ch2-),
4.01-4.47(2h,dd,-cno-ch2-),
7.38-7.95(5h,m,芳香h)
比较例3
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(37)的化合物(0.160g,0.218mmol)和蒸馏水(4.40g)使其溶解。在加入85%磷酸(0.11ml)将ph调整至1.5之后,在50℃进行反应6小时。在加入400g/l氢氧化钠水溶液(1.40ml)并且冷却之后,在50℃进行反应5小时。随后,加入6n盐酸将ph调整至2.0,并且向其中加入甲苯和氯仿进行清洗。然后,以与实施例4相同的方式进行纯化,以获得式(38)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.03(3h,s,>cch3-ch2-o-),
2.91(1h,brs,-oh),
3.38(3h,s,-o-ch3),
3.00-3.85(52h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)12-,>cch3-ch2-oh)
比较例4
向装有搅拌器的4-ml螺纹盖试管中注入式(38)的化合物(0.0920g,0.142mmol)、6-马来酰亚胺基己酸(0.0345g,0.163mmol)、dmt-mm(0.0564g,0.163mmol)、乙腈(0.980g)和三乙胺(0.0172g,0.170mmol),在25℃进行反应5小时。向其中加入ph3.0的柠檬酸盐缓冲液(1.10g),然后通过使用甲苯进行清洗。然后,以与实施例5相同的方式进行纯化,以获得式(39)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.27(3h,s,>cch3-ch2-o-),1.32(2h,m,-ch2ch2ch2-conh-),
1.63(4h,m,-ch2ch2ch2ch2-conh-),2.18(2h,t,-ch2-conh-),
3.38(3h,s,-o-ch3),
3.40-3.80(54h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)12-,>cch3-ch2-oh,-ch2-马来酰亚胺),
4.62(1h,brs,-oh),6.20(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺)
比较例5
向装有搅拌器的4-ml螺纹盖试管中加入式(39)的化合物(0.050g,0.0595mmol)、n-甲基吗啉(0.0601g,0.595mmol)、双(4-硝基苯基)碳酸酯(0.145g,0.476mmol)和无水乙腈(0.467g),在氮气气氛下在25℃进行反应4小时。向其中加入蒸馏水(0.030g,1.67mmol)和n-甲基吗啉(0.0361g,0.357mmol),混合物在25℃搅拌6小时然后使用二氯甲烷稀释。然后,以与实施例5相同的方式进行纯化,以获得式(40)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.32(2h,m,-ch2ch2ch2-conh-),1.45(3h,s,>cch3-ch2-o-),
1.60(4h,m,-ch2ch2ch2ch2-conh-),2.15(2h,t,-ch2-conh-),
3.38(6h,s,-o-ch3),
3.41-3.80(52h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)12-,-ch2-马来酰亚胺),
4.51-4.59(2h,dd,>cch3-ch2-ocoo-),
5.92(1h,s,-ch2-conh-),6.68(2h,s,-马来酰亚胺),
7.39-8.29(4h,m,芳香h)
比较例6
向装有搅拌器的4-ml螺纹盖试管中注入多柔比星盐酸盐(6.34mg,10.9μmol)、n,n-二异丙基胺(2.95mg、22.9μmol)、n,n-二甲基甲酰胺以及式(40)的化合物(10.0mg,9.94μmol),进行反应4小时。用二氯甲烷稀释之后,使用5wt%磷酸二氢钠十二水合物水溶液并随后用离子交换水清洗混合物。有机层用无水硫酸钠干燥,过滤,在减压下蒸馏去除溶剂,以获得式(41)的药物-连接物化合物。
1h-nmr(cd3cl,tms内标);δ(ppm):
1.25-1.34(8h,m),1.55-1.65(4h,m),1.75-1.88(2h,m),
2.06-2.10(2h,m),2.16-2.38(2h,m),2.88(1h,dd),
3.00(1h,s),3.18(2h,dd),3.38(3h,s),
3.41-3.90(60h,m),4.03-4.06(1h,m),4.09(3h,s),
4.12-4.14(1h,m),4.61(1h,s),4.77(2h,d),
5.32(1h,s),5.43-5.48(1h,m),5.53(1h,s),
6.06(1h,d),6.68(2h,s),7.41(1h,d),
7.80(1h,t),8.06(1h,d)
比较例7
对于比较例6中获得的式(41)的药物-连接物化合物,使用疏水作用色谱(hic)柱在与实施例8相同的测量条件下进行hplc测量。测量结果的图谱在图2中示出。
比较例8
将鼠产生的单克隆抗白细胞介素-1β抗体(0.500mg,sigma-aldrich)溶解于磷酸盐缓冲生理盐水(pbs,0.500ml)。将溶液(0.048ml)装入0.5ml聚丙烯试管中,向其中加入50.0mm乙二胺四乙酸(edta,0.006ml)和0.800mm三(2-羧甲基)膦盐酸盐(tcep)水溶液(0.006ml;抗体的15倍当量),将混合物在37℃震荡1小时。向溶液中加入包含n,n-二甲基甲酰胺和2.50mm式(41)的化合物的溶液(0.007ml;抗体的53倍当量),进一步将混合物在20℃震荡1小时。向其中加入2.50mmn-乙酰基半胱氨酸水溶液(0.007ml;抗体的53倍当量),进一步将所得混合物在20℃震荡1小时。将所得溶液装入使用pbs(10ml)平衡的nap-5色谱柱(gehealthcarelifescience),用pbs洗脱以分离抗体组分。
比较例9
通过与实施例10相同的方法计算平均药物结合数,并且每抗体的药物平均结合数为8.5。
比较例10
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入二十四乙二醇单甲醚(2.05g,1.88mmol)、甲苯(10.3g)、三乙胺(0.552g,5.45mmol)和甲磺酰氯(0.478g,4.17mmol),在25℃进行反应8小时。通过加入二氯甲烷稀释反应溶液,然后用水清洗,并且将有机层用无水硫酸镁干燥。过滤后,减压蒸馏去除溶剂,以获得式(42)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
3.09(3h,s,-o-so2-ch3),
3.38(3h,s,-o-ch3),
3.45-3.85(94h,m,ch3-o-(ch2ch2o)23-ch2ch2-o-so2-ch3),
4.38(2h,m,-ch2-o-so2-ch3)
比较例11
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(36)的化合物(0.174g,0.910mmol)、无水thf(2.86g)、式(42)的化合物(1.38g,1.18mmol)、1m叔丁醇钾thf溶液(1.82g,2.00mmol),并且以与实施例3相同的方式进行反应和纯化,以获得式(43)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.37(3h,s,>cch3-ch2-o-ch2-),
3.38(3h,s,-o-ch3),
3.40-3.80(98h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)24-),
4.01-4.47(2h,dd,-cno-ch2-),
7.38-7.95(5h,m,芳香h)
比较例12
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(43)的化合物(0.909g,0.720mmol)和蒸馏水(25.0g)使其溶解。在加入85%磷酸(0.250ml)将ph调整至1.5之后,在50℃进行反应6小时。在加入400g/l氢氧化钠水溶液(7.63ml)并且冷却之后,在50℃进行反应10小时。随后,加入6n盐酸将ph调整至2.0,并且向其中加入甲苯和氯仿进行清洗。然后,以与实施例4相同的方式进行纯化,以获得式(44)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.03(3h,s,>cch3-ch2-o-),
3.00(1h,brs,-oh),
3.38(3h,s,-o-ch3),
3.00-3.85(100h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)24-,>cch3-ch2-oh)
比较例13
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(44)的化合物(0.729g,0.620mmol)、6-马来酰亚胺基己酸(0.164g,0.775mmol)、dmt-mm(0.214g,0.775mmol)、乙腈(7.29g)和三乙胺(0.082g,0.806mmol),在25℃进行反应3小时。向其中加入ph3.0的柠檬酸盐缓冲液(8.75g),然后通过使用甲苯进行清洗。然后,以与实施例5相同的方式进行纯化,以获得式(45)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.23(3h,s,>cch3-ch2-o-),
1.32(2h,m,-ch2ch2ch2-conh-),
1.63(4h,m,-ch2ch2ch2ch2-conh-),
2.18(2h,t,-ch2-conh-),
3.38(3h,s,-o-ch3),
3.40-3.80(102h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)24-,>cch3-ch2-oh,-ch2-马来酰亚胺),
4.71(1h,brs,-oh),
6.26(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺)
比较例14
向配备有温度计、氮气进气管、搅拌器、迪安-斯塔克管和冷凝管的50ml三颈烧瓶中注入式(45)的化合物(0.600g,0.438mmol)、n-苯基吗啉(0.179g,1.10mmol)、对硝基苯基氯代甲酸酯(0.177g,0.876mmol)和二氯甲烷(5.81g),在25℃进行反应3小时。向其中加入蒸馏水(0.047g,2.63mmol)和n-苯基吗啉(0.179g,1.10mmol),混合物在25℃搅拌6小时然后使用己烷稀释。然后,以与实施例16相同的方式进行纯化,以获得式(46)的化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.28(2h,m,-ch2ch2ch2-conh-),
1.41(3h,s,>cch3-ch2-o-),
1.63(4h,m,-ch2ch2ch2ch2-conh-),
2.15(2h,t,-ch2-conh-),
3.38(3h,s,-o-ch3),
3.41-3.80(100h,m,>cch3-ch2-o-ch2-,-o-(ch2ch2o)24-,-ch2-马来酰亚胺),
4.51-4.60(2h,dd,>cch3-ch2-ocoo-),
6.01(1h,s,-ch2-conh-),
6.69(2h,s,-马来酰亚胺),
7.38-8.36(4h,m,芳香h)
比较例15
向装有搅拌器的4-ml螺纹盖试管中注入多柔比星盐酸盐(5.40mg,9.31μmol)、n,n-二异丙基胺(2.51mg、19.4μmol)、n,n-二甲基甲酰胺以及式(35)的化合物(13.0mg,8.47μmol),进行反应4小时。然后,以与实施例7相同的方式进行纯化,以获得式(47)的药物-连接物化合物。
1h-nmr(cdcl3,tms内标);δ(ppm):
1.25-1.34(8h,m),1.55-1.65(4h,m),1.75-1.88(2h,m),
2.06-2.10(2h,m),2.16-2.38(2h,m),2.88(1h,dd),
3.00(1h,s),3.18(2h,dd),3.38(3h,s),
3.41-3.90(103h,m),4.03-4.06(1h,m),
4.09(3h,s),4.12-4.14(1h,m),4.61(1h,s),
4.77(2h,d),5.32(1h,s),5.43-5.48(1h,m),
5.53(1h,s),6.06(1h,d),6.68(2h,s),
7.41(1h,d),7.80(1h,t),8.06(1h,d)
比较例16
对于比较例6中获得的式(41)的药物-连接物化合物,使用疏水作用色谱(hic)柱在与实施例11相同的测量条件下进行hplc测量。测量波长为495nm的结果的图谱在图4中示出。
比较例17
对于比较例15中获得的式(47)的药物-连接物化合物,使用疏水作用色谱(hic)柱在与实施例11相同的测量条件下进行hplc测量。测量波长为495nm的结果的图谱在图5中示出。
式(30)的药物-连接物化合物在图1的图谱的保留时间14.2分钟处被检出。另一方面,式(41)的药物-连接物化合物在图2的图谱的保留时间15.3分钟处被检出。因此,表明了由于具有短的保留时间的前一个药物-连接物化合物疏水性低,所以本发明的异双官能性单分散聚乙二醇能够有效地掩蔽药物的疏水性。
在比较例中,式(41)的药物-连接物化合物在图4的图谱的保留时间14.3分钟处被检出,并且式(47)的药物-连接物化合物在图5的图谱的保留时间14.3分钟处被检出,保留时间处于相同的水平而与单分散聚乙二醇的链长无关。另一方面,根据本发明的式(30)的药物-连接物化合物在图3的图谱的保留时间13.2分钟处被检出。因此,表明由于具有短的保留时间的式(30)的药物-连接物化合物疏水性低,所以本发明的异双官能性单分散聚乙二醇能够有效地掩蔽药物的疏水性。
尽管已详细地并参考具体实施方式对本发明进行了描述,但对于本领域技术人员来说,显然可以在不背离其精神和范围时,在其中做出各种改变和修改。
本发明基于2017年3月30日提交的日本专利申请(日本专利申请号2017-066987),其全部内容通过参考并入本文。而且,本文中引用的所有参考文献以其整体并入本文。
- 还没有人留言评论。精彩留言会获得点赞!