血癌治疗剂的制作方法
【
技术领域:
】本发明涉及用于预防、改善或治疗血癌的组合物,其包含具有治疗效果的具有至少一种1-β-d-呋喃型阿拉伯糖基胞嘧啶作为修饰的核酸的新型寡核苷酸-修饰的核酸或其药学上可接受的盐作为有效成分。
背景技术:
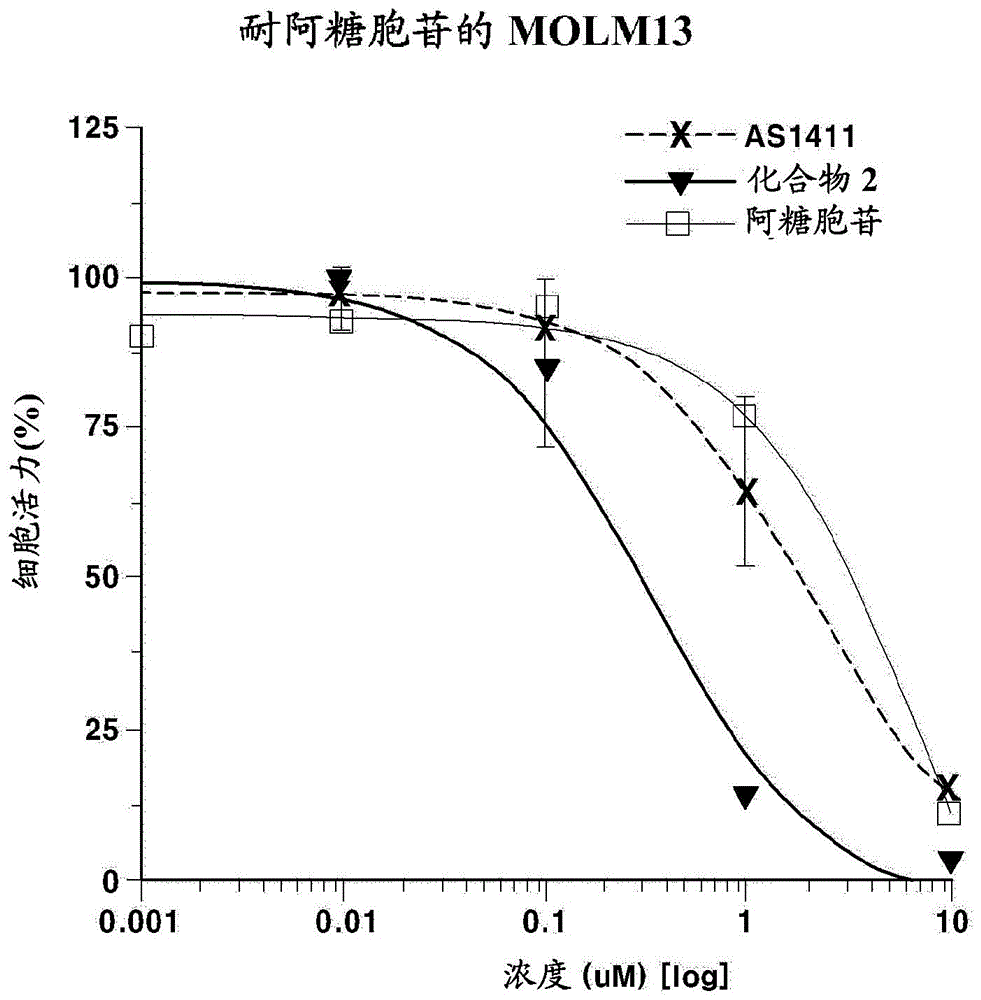
:血液(血液学)癌症是指其中各种血细胞转化为癌细胞的癌症,以及攻击血液,骨髓和/或淋巴系统的癌症类型。这类癌症包括白血病,淋巴瘤和多发性骨髓瘤。白血病是血癌,其中从产生血液的造血干细胞转化的癌细胞引起白血病细胞的过度产生,但是阻止正常血细胞的正常产生,导致感染,贫血,出血等。淋巴瘤是发生在淋巴系统中的癌症,包括非霍奇金淋巴瘤和霍奇金淋巴瘤。多发性骨髓瘤是由浆细胞的异常分化和增殖引起的血癌,浆细胞是血液中的一种白细胞。更具体地,血癌选自:非霍奇金淋巴瘤,霍奇金淋巴瘤,多发性骨髓瘤,白血病,淋巴瘤,骨髓增生异常综合征,急性淋巴细胞白血病,急性髓性白血病,慢性淋巴细胞性白血病,慢性髓性白血病,单发性骨髓瘤和再生障碍性疾病贫血。每年,新确诊的所有癌症病例中,白血病,霍奇金淋巴瘤和非霍奇金淋巴瘤和骨髓瘤的新病例几乎占10%。在老龄化社会中,患有血癌的老年人数量正在增加,但是其存活率很低。尤其是65岁或65岁以上的患者的存活率仅为9.4%,而80岁或80岁以上的患者的存活率则低至0%(blood,2012,120;1165-1174)。血液(血液)癌症是由血液和淋巴系统中产生的突变细胞转变为癌细胞而引起的疾病,而突变细胞则遍及人体,大约有70种类型的血癌。因此,被诊断患有血癌的患者首先接受缓解诱导化疗,以从体内清除所有免疫细胞,以杀死突变的异常细胞。此后,进行巩固化学疗法,包括仅向异常细胞中注入有毒化学物质。缓解诱导化学疗法是通过高剂量的高细胞毒性抗癌药物的联合施用来进行的,这种药物具有很高的毒性和不良作用,因此不适用于老年患者。这就是为什么老年血癌患者的生存能力很低的原因(blood,2010,116:5818-5823)。另外,对血癌没有治疗效果,因为即使对大剂量缓解诱导化疗也无反应,或者由于五年之内的高耐药率和高复发率,与血癌相关的医疗需求仍未得到满足。当前,已经开发出使用抗体和激酶抑制剂的靶疗法,但是对血癌的治疗仍然在很大程度上取决于化学疗法和放射疗法(thenewenglandjournalofmedicine,2014,371:1005-1015)。用作血癌化学治疗剂的抗癌药是具有相当毒性的细胞毒性抗癌药,由于生物利用度低和难以将靶标传递至癌细胞而以非常高的剂量施用。这对患者造成严重的副作用,从而使治疗困难。因此,需要具有更少毒性和有效治疗功效的新型治疗剂。已知富含鸟苷的寡核苷酸对多种癌细胞具有抑制细胞生长的作用,并通过与细胞中的特定蛋白(例如对细胞生长和死亡特异性寡核苷酸重要的蛋白,诸如eef1a,jnk,ki-ras,核仁蛋白,stat3,端粒酶和拓扑异构酶蛋白)(当使用这些蛋白处理癌细胞时)结合来调节细胞周期,这些蛋白在癌细胞中的表达要高于正常细胞(christopherr.iresonetal.molecularcancertherapy,2006,2957-2962;naijiejingetal.cancerresearch,2004,6603-6609;christophemarchandetal.thejournalofbiologicalchemistry,2002,8906-8911)。这些富含鸟苷的寡核苷酸除了与胞嘧啶的三氢键合外,还具有特殊的结构特征。富含鸟苷的寡核苷酸可通过分子内键合或分子间键合而具有四链结构。不是通过腺苷和硫胺素之间以及鸟苷和胞苷之间的氢键形成双螺旋结构,而是将四个鸟苷在一个平面上定位以形成hoogsteen型氢键,从而构成一个g四联体。2个或多个这样的g-四链体连续定位以形成四螺旋结构。通常,由于寡核苷酸在血液中的低稳定性和低细胞渗透性,将寡核苷酸开发成药物存在困难。然而,由于其结构特征,已知构成这种g-四链体的寡核苷酸具有相对较高的血液稳定性和细胞渗透性。如美国专利号7,314,926和美国专利公开号2007-105805中所述,已知构成这种g-四链体的寡核苷酸与在癌细胞表面上高表达的特定蛋白质结合,然后通过内吞作用渗透到癌细胞中,并与参与细胞死亡的蛋白质结合以抑制细胞生长。据报道,此类寡核苷酸由于细胞抑制作用而不是细胞毒性作用而诱导凋亡(paulaj.batesetal.thejournalofbiologicalchemistry,1999,26369-26377;brunaetal.febsjournal,2006,1350-1361)。另外,除了抑制癌细胞生长的作用外,已知构成g-四链体的寡核苷酸具有各种体内功能和调节功能,例如,美国专利号5,567,604公开了构成g-四链体的寡核苷酸具有抗病毒性,美国专利号6,994,959公开了构成g-四链体的寡核苷酸具有免疫调节活性,及美国专利公开号2007-105805公开了构成g-四链体的寡核苷酸对亨廷顿氏病具有治疗作用(cheryla.stoddartetal.antimicrobialagentsandchemotherapy,1998,2113-2115;michaelskogenetal.bmcneuroscience,2006,7:65)。构成g-四链体的此类寡核苷酸由于细胞抑制作用而诱导凋亡,因此凋亡率相对较高。因此,难以将寡核苷酸与高毒性化学治疗剂组合施用(paulaj.batesetal.experimentalandmolecularpathology,2009,151-164;christopherr.iresonetal.molecularcancertherapy,2006,2957-2962)。韩国专利第10-0998365号公开了通过将用于处理而提供凋亡作用的修饰的核酸引入形成g-四链体的寡核苷酸中来改善凋亡作用的例。但是,该专利既没有公开根据本发明的寡核苷酸-修饰的核酸,也没有公开其对血癌的治疗作用以及对耐药性血癌细胞的凋亡作用。【现有技术】【专利文件】韩国专利第10-0998365号美国专利第7,314,926号美国专利公开第2007-105805号美国专利第us5,567,604号美国专利第6,994,959号美国专利公开第2007-105805号【非专利文件】非专利文献1:christopherr.iresonetal.molecularcancertherapy,2006,2957-2962;naijiejingetal.cancerresearch,2004,6603-6609;christophemarchandetal.thejournalofbiologicalchemistry,2002,8906-8911。非专利文献2:paulaj.batesetal.thejournalofbiologicalchemistry,1999,26369-26377;brunaetal.febsjournal20061350-1361。非专利文献3:cheryla.stoddartetal.antimicrobialagentsandchemotherapy,1998,2113-2115;michaelskogenetal.bmcneuroscience,2006,7:65。非专利文献4:paulaj.batesetal.experimentalandmolecularpathology,2009,151-164;christopherr.iresonetal.molecularcancertherapy,2006,2957-2962。技术实现要素:【技术问题】鉴于上述问题,本发明人将一种或多种1-β-d-呋喃型阿拉伯糖基胞嘧啶(其为具有通过细胞毒性作用诱导细胞凋亡的治疗作用的修饰的核酸)引入了富含具有细胞生长抑制作用的鸟苷的寡核苷酸,从而形成g-四链体,以便提高血液和细胞通透性的稳定性,并更有效地抑制血癌细胞的生长,从而诱导细胞死亡,并合成了具有这种结构的新型寡核苷酸,并且根据细胞毒性的比较发现,该寡核苷酸具有杀死血癌细胞的显著改善的作用,特别是对耐药性血癌细胞(使治疗变得困难,因为它们对血癌的常规治疗药物无反应)具有优异的抗癌作用(nm水平),并且对血癌具有出色的治疗效果。最后,基于该发现完成了本发明。因此,本发明的一个目的是提供一种新颖的含有至少一种1-β-d-呋喃型阿拉伯糖基胞嘧啶的寡核苷酸-修饰的核酸作为具有治疗效果并且富含鸟苷的修饰的核酸。本发明的另一个目的是提供一种用于预防、改善或治疗血癌的组合物,其包含寡核苷酸-修饰的核酸或其药学上可接受的盐作为活性成分。【要解决的技术问题】一方面,本发明提供了一种寡核苷酸-修饰的核酸,其包含由下式2表示的化合物以形成g-四链体结构:[式2]寡核苷酸-修饰的核酸可以由以下序列表示:序列1:ggtggtggttntggtggtgg;序列2:ggtggtggtnntggtggtgg;序列3:nggtggtggttgtggtggtgg;或序列4:nnggtggtggttgtggtggtgg;其中g是鸟苷或鸟苷衍生物,t是胸腺嘧啶或胸腺嘧啶衍生物,n是1-β-d-呋喃型阿拉伯糖基胞嘧啶。另一方面,本发明提供了一种用于预防、改善或治疗血癌的组合物,其包含寡核苷酸-修饰的核酸或其药学上可接受的盐作为活性成分。【发明的有益效果】根据本发明的新的寡核苷酸-修饰的核酸是具有新结构的化合物,该化合物能够通过掺入至少一种1-β-d-呋喃型阿拉伯糖基胞嘧啶和鸟苷而形成g-四链体,由于具有优异的凋亡活性和对癌细胞以及耐药性癌细胞的抗癌治疗作用,因此可用作血癌的预防和治疗剂。【附图说明】从以下结合附图的详细描述中,将更清楚地理解本发明的上述和其他目的,特征和其他优点,其中:图1是表示寡核苷酸-修饰的核酸对具有对阿糖胞苷(血癌的主要治疗剂)的耐药性的aml细胞(耐阿糖胞苷的molm13)的细胞毒性作用的图。图2是寡核苷酸-修饰的核酸对具有阿糖胞苷抗药性的血癌细胞(耐阿糖胞苷的mv-4-11)的抗增殖作用的图。图3是表示在血癌异种移植模型(luc-molm13)中寡核苷酸-修饰的核酸的体内细胞毒性的图。图4是表示在血癌动物模型(luc-molm13)中寡核苷酸-修饰的核酸的体内细胞毒性功效的图。图5是显示在血癌动物模型(luc-molm13)中的抗增殖功效和寡核苷酸-修饰的核酸的存活率的图。图6显示了在血癌同基因模型(c1498)中的抗癌功效和寡核苷酸-修饰的核酸的存活率。图7显示了在血癌同基因模型(wehi-3)中的抗癌功效和寡核苷酸-修饰的核酸的存活率。图8显示了寡核苷酸-修饰的核酸对源自复发/难治患者的骨髓单核细胞的抗增殖效力。【实施发明的最佳方式】现在将详细参考本发明的优选实施例,其示例在附图中示出。应当理解,在说明书中,当关于参数提及范围时,该参数涵盖包括该范围内公开的包括端点的所有附图。例如,范围“5~10”包括5、6、7、8、9和10的图形,以及任意子范围,例如6~10、7~10、6~9及7~9的范围,以及介于该范围内的适当整数之间的任何数,例如5.5、6.5、7.5、5.5~8.5和6.5~9。另外,例如,“10%~30%”的范围涵盖包括例如10%,11%,12%和13%以及30%的数的所有整数,以及10%~15%,12%~18%或20%~30%的任何子范围,以及例如10.5%,15.5%和25.5%的落入该范围内的适当整数之间的任何数。在下文中,将详细描述本发明。一方面,本发明涉及包含由下式1表示的化合物以形成g-四链体的寡核苷酸-修饰的核酸:[式1]其中r1为氢或另一核酸的磷酸部分的磷原子,且r2为氢或另一核酸的磷酸部分的磷原子。一方面,本发明涉及寡核苷酸-修饰的核酸,其中该化合物由以下式2表示:[式2]在本发明的一方面,寡核苷酸-修饰的核酸可以由以下序列表示:gatbnc其中g是鸟苷或鸟苷衍生物,t是胸腺嘧啶或胸腺嘧啶衍生物,n是1-β-d-呋喃型阿拉伯糖基胞嘧啶或其衍生物的修饰的核酸,g,t和n通过排列随机排列,a是1~30中选择的整数,b是0~30中选择的整数,c是1~30中选择的整数,前提是a,b和c的总和不超过60。在本发明的一方面,寡核苷酸-修饰的核酸可以由以下序列表示:序列1:ggtggtggttntggtggtgg;序列2:ggtggtggtnntggtggtgg;序列3:nggtggtggttgtggtggtgg;或序列4:nnggtggtggttgtggtggtgg;在以上序列中,g为鸟苷或鸟苷衍生物,t为胸腺嘧啶或胸腺嘧啶衍生物,并且n为1-β-d-阿拉伯糖呋喃型阿拉伯糖基胞嘧啶的修饰的核酸。在本发明的一方面,鸟苷或鸟苷衍生物可包括选自下列中的一种或多种:2-脱氧-鸟苷,鸟苷,2'-o-甲基-鸟苷,2'-氟-鸟苷,lna(锁核酸)-鸟苷,d-脱氧鸟苷和d-鸟苷。另一方面,本发明涉及用于预防、改善或治疗血癌的组合物,其包含至少一种选自上述那些的寡核苷酸-修饰的核酸或其药学上可接受的盐作为活性成分。在另一方面,血癌包括下列中的至少一种:非霍奇金淋巴瘤,霍奇金淋巴瘤,多发性骨髓瘤,白血病,淋巴瘤,骨髓增生异常综合征(mds),急性淋巴细胞白血病,急性髓性白血病,慢性淋巴细胞性白血病,慢性髓性白血病和单发性骨髓瘤。在下文中,将更详细地描述本发明的实施例。一方面,本发明提供了一种新型的寡核苷酸-修饰的核酸,其作为具有治疗效果的修饰的核酸而含有至少一种1-β-d-呋喃型阿拉伯糖基胞嘧啶,且富含鸟苷。在另一方面,本发明提供了一种用于预防、改善或治疗血癌的组合物,其包含寡核苷酸-修饰的核酸或其药学上可接受的盐作为活性成分。如本文所用,术语“g-四链体”是指含有大量的选自下列的一种或多种:2-脱氧-鸟苷,鸟苷,2'-o-甲基-鸟苷,2'-氟-鸟苷的寡核苷酸,lna(锁核酸)-鸟苷,d-脱氧鸟苷和d-鸟苷代表代表性的是鸟苷(g)[见图1],因此在一定顺序的情况下,基于由位于一个平面中的四个鸟苷形成的hoogsteen型氢键,具有四螺旋结构。然后将其合成,从而将具有治疗效果的修饰的核酸引入这种结构。已知基于丰富的鸟苷形成g-四链体结构的寡核苷酸可以更选择性地与癌细胞结合,并通过细胞内的各种机制抑制癌细胞的生长。将形成一种或多种修饰的核酸的g-四链体寡核苷酸转移到癌细胞中。此后,g-四链体表现出抑制细胞生长的作用,并且当被核酸酶降解时表现出治疗作用的修饰的核酸直接抑制细胞生长,从而协同地导致癌细胞死亡。因为形成g-四链体的寡核苷酸仅具有抑制细胞生长的活性,所以当单独使用它们时,细胞的死亡率不是很高,并且需要在一定时间内进行连续处理。然而,通过本发明确定,掺入对血癌具有治疗作用的修饰的核酸直接改善了细胞死亡作用,从而迅速增加了细胞死亡率。一方面,具有治疗功效的修饰的核酸可以是1-β-d-呋喃型阿拉伯糖基胞嘧啶。在一个具体的实施方式中,本文所用的胞苷来源的治疗性修饰的核酸(n)是由下式2表示的胞苷衍生物,其中该核苷酸可以通过常规方法以亚磷酰胺的形式制备[oligonucleotidesandanalogues:apracticalapproach1991fritzecksteinetal.irlpress:oxford],或者可以根据常规报道的方法使用dna合成仪通过固相合成将其制成在富含鸟苷的寡核苷酸中掺入购自glenresearchcorporation,berry&associatesinc.,okeanostechnologies,llc.,chemgenescorp.,proligocorp.等的核苷酸亚磷酰胺。[式2]寡核苷酸-修饰的核酸可以使用固相合成仪,以亚磷酰胺形式生成的修饰的核酸,通过常规方法来生成。即,修饰的核酸亚磷酰胺是通过溶解在无水乙腈中并将其装载在dna合成仪上而合成的。寡核苷酸-修饰的核酸使用常规合成和纯化方法,参考glenresearchcorporation提供的指南(手册)以及美国专利号5,457,187和5,614,505来合成。此外,可以使用如上所述的修饰的核酸合成的寡核苷酸-修饰的核酸的代表性序列如下:序列1:ggtggtggttntggtggtgg序列2:ggtggtggtnntggtggtgg序列3:nggtggtggttgtggtggtgg序列4:nnggtggtggttgtggtggtgg其中在适当位置掺入了修饰的核酸的序列的化合物对血癌细胞和耐药性血癌细胞显示出优异的凋亡作用,而对正常细胞则没有显示出明显的作用。通过动物实验还确定了该序列的化合物具有优异的抗血癌治疗作用。因此,可以通过将根据本发明的胞苷修饰的核酸引入具有生物学活性同时通过取代形成g-四链体的寡核苷酸序列中来完成新的核苷酸修饰的核酸。具有治疗效果的修饰的核酸(n)作为下式1表示的化合物存在于寡核苷酸-修饰的核酸中。[式1]其中r1是氢或另一个核酸的磷酸部分的磷原子,r2是氢或另一个核酸的磷酸部分的磷原子。在序列中,g代表鸟苷,并且优选地包括选自下列的一种或多种:2-脱氧-鸟苷,鸟苷,2'-o-甲基-鸟苷,2'-氟-鸟苷,lna(锁核酸)-鸟苷,d-脱氧鸟苷和d-鸟苷,并且n是作为胞苷衍生的修饰的核酸的1-β-d-呋喃型阿拉伯糖基胞嘧啶。具有治疗效果的常规含核苷治疗剂可能涉及诸如全身毒性和药物抗性的副作用,并且许多癌细胞可能对这种治疗性核苷抗癌药物具有抗性,这可能需要选择其他药物。当将具有这种治疗效果的核苷掺入对癌细胞相对更具选择性的g-四链体寡核苷酸中时,可以使对体内正常细胞的影响最小化,甚至可以提高耐药性肿瘤细胞的死亡(凋亡)率。当存在钾离子(k+)时,该g-四链体结构更稳定,因此在诸如血液等一般生理条件下长时间具有稳定的结构。因此,在本发明中,在使用前,用一定浓度(30~70mm)的kcl溶液等使含有具有治疗效果的修饰的核酸的g-四链体寡核苷酸稳定化。与含有具有治疗作用的核苷的常规治疗剂相比,根据本发明的新型寡核苷酸-修饰的核酸在血癌细胞和耐药性血癌细胞中显示出显著改善的凋亡作用,并且在使用动物模型的抗癌功效评估中显示出优异的抗癌治疗功效。因此,本发明提供了一种预防、改善或治疗癌症的组合物,其包含寡核苷酸-修饰的核酸或其药学上可接受的盐作为活性成分。药理学上可接受的盐包括例如金属盐,与有机碱的盐,与无机酸的盐,与有机酸的盐,与碱性或酸性氨基酸的盐等。合适的金属盐包括:碱金属盐,例如钠盐和钾盐;和碱土金属盐,例如钙盐,镁盐和钡盐;和铝盐等。与有机碱形成的盐的合适实例包括三甲胺,三乙胺,吡啶,甲基吡啶,2,6-二甲基吡啶,乙醇胺,二乙醇胺,三乙醇胺,环己胺,二环己胺,n,n-二苄基乙二胺等的盐。与无机酸形成的盐的合适实例包括盐酸,氢溴酸,硝酸,硫酸,磷酸等的盐。与有机酸形成的盐的合适实例包括甲酸,乙酸,三氟乙酸,邻苯二甲酸,富马酸,草酸,酒石酸,马来酸,柠檬酸,琥珀酸,甲磺酸,苯磺酸,对甲苯磺酸的盐等。与碱性氨基酸的盐的合适实例包括精氨酸,赖氨酸,鸟氨酸等的盐。与酸性氨基酸形成的盐的合适实例包括天冬氨酸,谷氨酸等的盐。当化合物中具有酸性官能团时,特别优选的盐包括无机盐,例如碱金属盐(例如,钠盐和钾盐)和碱土金属盐(例如,钙盐,镁盐和钡盐)以及铵盐之类的有机盐。当化合物在其中具有碱性官能团时,特别优选的盐包括与无机酸如盐酸,氢溴酸,硝酸,硫酸和磷酸的盐,以及与有机酸如乙酸、邻苯二甲酸、富马酸、草酸、酒石酸、马来酸、柠檬酸、琥珀酸、甲磺酸和对甲苯磺酸的盐。包含根据本发明的寡核苷酸-修饰的核酸的用于预防、改善或治疗癌症的组合物除活性成分外还可包含药学上可接受的载体。在注射溶液的情况下,药学上可接受的载体可以是防腐剂,等渗剂,麻醉剂,增溶剂,缓冲剂,稳定剂等的混合物。对于口服施用,可药用载体可以是增溶剂,粘合剂,赋形剂,分散剂,稳定剂,悬浮剂,崩解剂,润滑剂,调味剂等。对于局部施用,药学上可接受的载体可以是基剂,赋形剂,润滑剂,防腐剂等。根据本发明的组合物制剂可以与药学上可接受的载体的混合物不同地制备。另外,该组合物可以以单位剂量安瓿或多种剂型的形式制备,并且可以以片剂,酏剂,胶囊剂,混悬剂,锭剂,糯米纸囊剂,糖浆剂等形式制成用于口服施用,并且可以配制成片剂,丸剂,胶囊剂,缓释制剂等。同时,用于配制的合适的载体,赋形剂和稀释剂的实例包括微晶纤维素,木糖醇,赤藓醇,甲基纤维素,聚乙烯吡咯烷酮,淀粉,阿拉伯胶,藻酸盐,明胶,乳糖,右旋糖,蔗糖,羟基苯甲酸丙酯,纤维素,水,羟基苯甲酸甲酯,硬脂酸镁,滑石粉,山梨糖醇,甘露糖醇,麦芽糖醇,磷酸钙,硅酸钙,矿物油等。本文使用的术语“施用”是指通过任何合适的方法将某种物质引入患者。活性成分的施用途径可以是使药物被递送至靶组织的任何一般途径。施用途径的实例包括但不限于静脉内,皮下,口服,肌内,腹膜内,肺内,直肠,局部,鼻内和皮内施用。但是,由于寡核苷酸在通过口服施用时被消化,因此必须制备用于口服施用的组合物,以使其可以在胃肠道中分解和吸收。优选地,它可以通过注射或通过鼻内途径施用。活性成分在本发明的制剂中的含量可以根据活性成分在体内的吸收率,失活率,排泄率,年龄,性别和使用者的状况等适当选择。本发明的活性成分的剂量可以是1~1,000mg/kg,优选3~100mg/kg,并且可以每天连续1~3次或通过输注预定的时间段连续施用。【实施方式】在下文中,将参考以下实施例详细描述本发明,但本发明不限于此。【实施例1:合成新的寡核苷酸-修饰的核酸】使用常规固相dna合成仪以1μmol规模进行dna合成。关于用于合成的亚磷酰胺,脱氧鸟苷,胸苷和1-β-d-呋喃型阿拉伯糖基胞嘧啶亚磷酰胺购自glenresearchcorporation,将其以0.067m的浓度溶解在干燥的乙腈中,并装载在polygeneinc.的固相dna合成仪上。反应沿3′→5′的方向进行,并且第一个核苷酸的3′羟基连接到树脂上。在添加一个碱基的过程中,重复了四步化学反应,包括5′-末端去三苯甲基化,新碱基的偶联,未偶联dna链的封端以及磷酸基团的氧化。反应完成后,除去保护基,将合成的cpg树脂浸入氨水中,并在55℃下静置5小时。然后,将氨水干燥,得到白色粉末。通过使用waters阴离子交换hplc柱在hplc系统中将1mnacl溶液增加到5%~70%来进行纯化。收集主峰,向其中加入100%乙醇,沉淀寡核苷酸,然后干燥。结果,通过hplc获得了纯度为85%以上的寡核苷酸,并且使用esi-lc-ms(q-trap2000esi-ms)测量了分子量以确定合成是否成功。除了见于下表1的序列之外,对于已经报道的用于治疗目的的寡核苷酸序列或形成g-四链体的同时表现出生理活性的各种序列,还可以以与上述相同的方式产生寡核苷酸-修饰的核酸。[表1]化合物号ngt序列lc/ms化合物11-β-d-呋喃型阿拉伯糖基胞嘧啶2′-脱氧-鸟苷胸苷ggtggtggttntggtggtgg6323.1化合物21-β-d-呋喃型阿拉伯糖基胞嘧啶2′-脱氧-鸟苷胸苷ggtggtggtnntggtggtgg6324.1化合物31-β-d-呋喃型阿拉伯糖基胞嘧啶2′-脱氧-鸟苷胸苷nggtggtggttgtggtggtgg6652.3化合物41-β-d-呋喃型阿拉伯糖基胞嘧啶2′-脱氧-鸟苷胸苷nnggtggtggttgtggtggtgg6957.5【实施例2:新型寡核苷酸-修饰的核酸溶液的生产】将每种寡核苷酸-修饰的核酸在10mmtris-hcl(ph7.4)溶液中稀释至终浓度100μm。将稀释的溶液在94℃下静置5分钟,然后将试管在冰上静置。向所得溶液中加入2mkcl溶液,使得kcl溶液的终浓度变为50mm,使其在60℃下静置3小时,然后缓慢冷却至室温。将每种寡核苷酸在10mmtris-hcl(ph7.4)溶液中稀释至10μm的浓度,并使其在94℃下静置5分钟,并将试管置于冰上。向所得溶液中加入2mkcl溶液,使得kcl溶液的最终浓度变为50mm,并使其在60℃下静置3小时,然后缓慢冷却至室温,然后将其用于本实施例。【实验例1:在体外对血癌细胞和耐药性血癌细胞的细胞毒性功效】在实验前一天,将190μl的包含血癌细胞,例如hl60,mv-4-11,ccrf-cem,molt-4和molm-13细胞系和耐药性血癌细胞,例如耐阿扎胞苷(aza-1)的molm13,耐地西他滨(dec-5)的molm13和耐阿糖胞苷(arac-1)的molm13细胞系,以及正常细胞,例如作为wi38,将ccd-18co和fa2n4细胞的培养基(浓度为104至105个细胞/ml)接种在96孔板上。第二天,添加10μl实施例2中制备的寡核苷酸-修饰的核酸溶液,然后培养5天。药物治疗五天后,进行mtt分析以测量细胞系的细胞毒性[见jbc1999,26369]。从表2可以看出,通过根据本发明的新型寡核苷酸-修饰的核酸的细胞毒性的测量结果表明,该新型寡核苷酸-修饰的核酸的ic50,即本发明的化合物的1、2、3和4对多种血癌细胞系表现出优异的细胞毒性作用[表2]。另外,可以看出,根据本发明的新的寡核苷酸-修饰的核酸对多种耐药性血癌细胞也表现出优异的细胞毒性作用[表3]。另外,可以看出,根据本发明的新的寡核苷酸-修饰的核酸对各种血癌细胞以及各种耐药性血癌细胞显示出优异的细胞毒性作用,而它们对正常细胞几乎没有作用[表4]。细胞毒性作用的测量结果示于下表2至4中。另外,鉴定本发明的寡核苷酸-修饰的核酸对耐药血癌细胞的细胞毒性作用,并显示于图1和2。[表2]表2涉及对血癌细胞的细胞毒性作用。[表3]表3涉及对耐药性血癌细胞的细胞毒性作用。[表4]表4涉及对正常细胞的细胞毒性作用。【实验例2:在体内人源性血癌细胞(luc-molm13)异种移植小鼠模型中的抗癌功效】为了鉴定对动物中人源性血癌细胞的功效,用nod-scid小鼠诱导了血癌,以评估其体内的抗癌功效。首先,具体如下进行血癌的诱导。实验组由媒介物组(8只小鼠)和药物施用组(9只小鼠)组成。将luc-moml-13细胞(人mds/aml细胞系)以107(细胞/小鼠)的密度静脉内注射到8周龄的nod-scid小鼠中。作为施用的药物,将化合物2以2mm的浓度溶解在钾缓冲液中,然后将该溶液在94℃下静置5分钟,然后缓慢冷却至室温3小时,然后用于本例。从细胞接种后第二天开始,每天静脉内施用(150mg/kg),持续两周,每周五次,监测存活率。结果示于图5。另外,从开始施用开始10天后,通过生物医学成像将血癌细胞的细胞毒性作用与媒介物组的细胞毒性作用进行比较,结果示于图3和4。如图3和4所示,与媒介物组相比,药物施用组的血癌细胞显著减少。从图5可以看出,与媒介物组相比,药物施用组的存活率显著提高。【实验例3:在体内aml(c1498)同基因小鼠模型中的抗癌功效】为了鉴定具有免疫系统的血癌细胞的体内功效,在将小鼠衍生的血癌细胞(c1498)移植到c57bl/6小鼠后,监测了小鼠的存活率。血癌的诱导具体如下进行。实验组由媒介物组(8只小鼠),药物施用组(9只小鼠)和对照组(8只小鼠)组成。将化合物2以300mg/kg的剂量作为药物施用组注射,将阿糖胞苷以30mg/kg的剂量作为阳性对照组注射(阿糖胞苷的量与化合物2的300mg/kg相同)。将c1498细胞(小鼠aml细胞系)以5×105(细胞/小鼠)的密度静脉内注射到8周龄的c57bl/6小鼠中。作为施用药物,将化合物2以2mm的浓度溶解在钾缓冲液中,并在4℃下静置6小时。从细胞接种后的第二天开始,连续两周每天两次皮下注射药物,并监测存活率。结果示于图6。从图6可以看出,与媒介物组相比,药物施用组的存活率显著提高,并且药物施用组的存活率远优于阳性对照组。【实验例4:在体内aml(wehi-3)同基因小鼠模型中的抗癌功效】为了鉴定具有免疫系统的aml细胞的体内功效,通过将小鼠衍生的血癌细胞(wehi-3)移植到balb/c小鼠中来评估小鼠的生存能力。血癌的诱导具体如下进行。实验组由媒介物组(7只小鼠),药物施用组(7只小鼠)和对照组(7只小鼠)组成。将化合物2以300mg/kg的剂量作为药物施用组注射,将阿糖胞苷以30mg/kg的剂量作为阳性对照组注射(阿糖胞苷的量与化合物2的300mg/kg相同)。将wehi-3细胞(小鼠aml细胞系)以5×105(细胞/小鼠)的密度静脉内注射到8周大的balb/c小鼠中。作为施用药物,将化合物2以2mm的浓度溶解在钾缓冲液中,并在4℃下静置6小时。从细胞接种后的第二天开始,每天两次皮下注射药物,持续两周,并测量生存力。结果示于图7。从图7可以看出,与媒介物组相比,药物施用组的存活率显著提高,并且药物施用组的存活率远优于阳性对照组。【实验例5:来自复发/难治性患者的骨髓单核细胞中的抗癌功效】为了鉴定在实际患者血癌细胞中的抗癌功效,分别使用源自复发/难治性(r/r)急性髓性白血病患者的骨髓单核细胞分别针对化合物2和阿糖胞苷(as1411)进行集落形成。这些细胞是irb批准在首尔的asan医学中心提供的。将骨髓单核细胞接种到集落形成培养基上,然后分别用0.25μm,0.5μm和1μm的每种药物处理,培养16天,并计数集落数。从图8可以看出,相同浓度的阳性对照药物对复发/难治性血癌细胞的治疗效果不足,而化合物2的抗癌效果非常优异。【实验例6:毒性测试】对本发明活性成分的毒性试验如下进行。将化合物2溶解在钾缓冲液中,并将该溶液以1g/kg的剂量注入小鼠(每组10只小鼠)中,然后观察7天。结果,没有小鼠死亡,这意味着致死剂量(ld50)至少为1g/kg。另外,当在与实验例4相同的条件下向没有血癌的正常小鼠施用药物时,对照组中正常白细胞迅速减少,而施用化合物2的药物施用组保持相对较高的白细胞计数(媒介物组平均值:6.29,媒介物组范围:4.70~8.97,药物施用组平均值:4.07,药物施用组范围:3.36~4.77,对照组平均值:2.34,对照组范围:0.95~4.31),从而显示出极好的安全性。总之,实验例3~5的结果表明,化合物2特异性地杀死血癌细胞并最小化正常血细胞的死亡,因此显示出作为靶向血癌的治疗剂的优异特性。【制备例1:注射液的制备】通过以下方法制备含有10mg化合物2的注射溶液。将1g化合物2、0.6g氯化钠和0.1g抗坏血酸溶解在蒸馏水中以制备100ml溶液。将溶液装满瓶子,并通过在20℃加热30分钟进行灭菌。注射液的成分如下:1g活性成分0.6g氯化钠0.1g抗坏血酸适量蒸馏水尽管已经出于说明性目的公开了本发明的优选实施例,但是本领域技术人员将理解,在不脱离所附权利要求书中公开的本发明的范围和精神的情况下,可以进行各种修改,增加和替换。序列1:ggtggtggttntggtggtgg序列2:ggtggtggtnntggtggtgg序列3:nggtggtggttgtggtggtgg序列4:nnggtggtggttgtggtggtgg序列表<110>aptabiotherapeuticsltd.<120>血癌治疗剂<130>pct-2018-0544<160>4<170>kopatentin3.0<210>1<211>20<212>dna<213>人工序列<220><223>修饰的寡核苷酸<400>1ggtggtggttntggtggtgg20<210>2<211>20<212>dna<213>人工序列<220><223>修饰的寡核苷酸<400>2ggtggtggtnntggtggtgg20<210>3<211>21<212>dna<213>人工序列<220><223>修饰的寡核苷酸<400>3nggtggtggttgtggtggtgg21<210>4<211>22<212>dna<213>人工序列<220><223>修饰的寡核苷酸<400>4nnggtggtggttgtggtggtgg22当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1