用于CRISPR/CAS激活系统的合成的指导RNA的制作方法
领域
本公开内容涉及包含rna适体序列的合成的两部分指导rna和其用途。
背景
crispr/cas9协同激活介质(sam)系统(konermann等人,nature,2015,517(7536):583-588)通过组合vp64-dcas9人工转录因子与募集另外的转录辅激活因子的适体-sgrna提供高水平转录激活的平台。因为另外的适体序列,单一sam-grna的化学合成仍有挑战。因此,使用sgrna可限制crispr/cas9sam系统的易用性和效率。因此,需要可容易和高效产生的与crispr/cas激活系统一起使用的两部分含适体grna系统。
简述
在本公开内容的各个方面中,提供了合成的两部分指导rna(grna),其中每个两部分grna包含(a)成簇的规律间隔的短回文重复序列(crispr)rna(crrna)和(b)反式作用crrna(tracrrna)。每个crrna包含与染色体dna中的靶序列互补的5’序列和能够与tracrrna的一部分碱基配对的3’序列,和每个tracrrna包含5’四环和至少一个茎-环,和所述5’四环和/或至少一个茎-环经修饰以含有至少一个形成发夹的rna适体序列。
一般而言,至少一个形成发夹的rna适体序列可以是ms2序列、pp7序列、com序列、盒b(boxb)序列、组蛋白mrna3’序列、富含au的元件(are)序列或其变体,和至少一个形成发夹的rna适体序列可位于tracrrna的5’四环、至少一个茎-环和/或3’末端中。
在一些实施方案中,tracrrna的至少一个茎-环包含茎-环1、茎-环2和茎-环3,和至少一个形成发夹的rna适体序列可位于5’四环和/或茎-环2中。在一些情况下,5’四环和/或茎-环2可进一步包含延伸序列,其范围可为约2个核苷酸至约30个核苷酸。在某些实施方案中,crrna进一步包含能够与tracrrna的5’四环中的延伸序列或5’四环中的延伸序列的一部分碱基配对的序列。
在某些实施方案中,crrna是化学合成的和tracrrna是体外酶促合成的。
本文还提供了编码上述tracrrna的核酸。
本公开内容的另一方面包括包含上文定义的tracrrna的试剂盒。在一些实施方案中,试剂盒进一步包含至少一种上述crrna。在一些重复中,所述至少一种crrna包含crrna分子的库。
在进一步的实施方案中,试剂盒进一步包含与至少一种功能结构域缔合的至少一种rna适体结合蛋白或编码与至少一种功能结构域缔合的至少一种rna适体结合蛋白的核酸。在一些实施方案中,至少一种rna适体结合蛋白可以是mcp、pcp、com、n22、slbp或fxr1,和与至少一种rna适体结合蛋白缔合的至少一种功能结构域可以是转录激活结构域、转录阻抑结构域、表观遗传修饰结构域、标记结构域或其组合。在各种实施方案中,转录激活结构域可以是vp16激活结构域、vp64激活结构域、vp160激活结构域、来自nfκb的p65激活结构域、热激因子1(hsf1)激活结构域、myod1激活结构域、gcn4肽、病毒r反式激活因子(rta)、53激活结构域、camp反应元件结合蛋白(creb)激活结构域、e2a激活结构域或活化t细胞核因子(nfat)激活结构域。在备选的实施方案中,转录阻抑结构域可以是kruppel-关联盒(krab)阻抑结构域、诱导型camp早期阻抑(icer)结构域、yy1富甘氨酸阻抑结构域、sp1-样阻抑结构域、e(spl)阻抑结构域、iκb阻抑结构域或甲基-cpg结合蛋白2(mecp2)阻抑结构域。在仍其它实施方案中,表观遗传修饰结构域可具有乙酰基转移酶活性、去乙酰基酶活性、甲基转移酶活性、去甲基酶活性、激酶活性、磷酸酶活性、氨基化活性、去氨基化活性、遍在蛋白连接酶活性、去遍在蛋白化活性、腺苷酸化活性、去腺苷酸化活性、sumo化活性、去sumo化活性、核糖基化活性、去核糖基化活性、豆蔻酰化活性、去豆蔻酰化活性、瓜氨酸化活性、烷基化活性、去烷基化活性、解旋酶活性、氧化活性或核小体相互作用活性。在特定的实施方案中,表观遗传修饰结构域可以是p300组蛋白乙酰基转移酶、激活诱导的胞苷脱氨酶(aid)、apobec胞苷脱氨酶或tet甲基胞嘧啶双加氧酶。在还其它实施方案中,标记结构域可以是荧光蛋白、纯化标签或表位标签。在某些重复中,rna适体结合蛋白可进一步包含至少一种核定位信号、至少一种细胞穿透肽、至少一种标记结构域或其组合。
在还进一步的实施方案中,试剂盒可进一步包含至少一种crispr/cas蛋白或编码crispr/cas蛋白的核酸。在一些情况下,至少一种crispr/cas蛋白可具有核酸酶活性和可以是crispr/cas核酸酶或与非crispr/cas核酸酶结构域连接的催化无活性的crispr/cas蛋白。在特定的实施方案中,crispr/cas蛋白可以是ii型crispr/cas9核酸酶。在其它情况下,至少一种crispr/cas蛋白可具有非核酸酶活性,其是与非核酸酶结构域连接的催化无活性的crispr/cas蛋白,其中非核酸酶结构域可以是转录激活结构域、转录阻抑结构域或表观遗传修饰结构域,其实例在上文描述。在特定的实施方案中,crispr/cas蛋白可以是与非核酸酶结构域连接的催化无活性的(死)crispr/cas9蛋白。在某些重复中,crispr/cas蛋白可进一步包含至少一种核定位信号、至少一种细胞穿透肽、至少一种标记结构域或其组合。
本公开内容的进一步的方面包括组合物,其包含本文定义的合成的两部分grna、至少一种本文定义的rna适体结合蛋白和至少一种本文定义的crispr/cas蛋白。
本公开内容的另一方面包括用于在真核细胞中靶向转录激活、靶向转录阻抑、靶向表观基因组修饰、靶向基因组修饰或靶向基因组基因座可视化的方法。该方法包括向真核细胞中引入(a)上文定义的合成的两部分grna、(b)至少一种本文定义的rna适体结合蛋白或编码核酸和(c)至少一种本文定义的crispr/cas蛋白或编码核酸,其中(a)、(b)、(c)和染色体dna中的靶序列之间的相互作用导致在真核细胞中的靶向转录激活、靶向转录阻抑、靶向表观基因组修饰、靶向基因组修饰或靶向基因组基因座可视化。该方法可进一步包括引入一种或多种另外的crrna,其中每种另外的crrna包含不同的5’序列但包含通用的3’序列。
在各种实施方案中,真核细胞可在体外或在体内。在其它情况下,真核细胞可以是哺乳动物细胞,例如人细胞。
本公开内容的其它特征和方面在下文详细描述。
附图简述
图1提供两部分crrna(seqidno:38)和适体-tracrrna(seqidno:39)的序列和二级结构(设计#1)。tracrrna中的四环延伸用下划线表示,和tracrrna中的ms2茎-环结构用粗体表示。
图2a显示在hek293细胞中用crispr两部分合成crrna和适体-tracrrna系统进行的pou5f1基因的靶向激活。
图2b提供在hek293细胞中用crispr两部分合成crrna和适体-tracrrna系统进行的il1b基因的靶向激活。
详细描述
本公开内容提供了与crispr/cas激活系统一起使用的包含适体序列的合成的两部分指导rna。该两部分系统包含靶标特异性的crrna和通用的适体-tracrrna。短的靶标特异性的crrna可容易化学合成,和较长的通用适体-tracrrna可经体外酶促合成并贮存以供后面使用。或者,crrna和tracrrna二者均可经化学合成。本文还提供了包含合成的两部分指导rna的组合物、包含合成的两部分指导rna的试剂盒和使用合成的两部分指导rna的方法。
(i)合成的两部分指导rna
本公开内容的一个方面提供了合成的两部分指导rna(grna),其包含crisprrna(crrna)和反式作用crrna(tracrrna)或由它们组成,其中tracrrna包含至少一个形成发夹的rna适体序列。
(a)crrna
本文公开的合成的两部分grna包含crrna。每种crrna包含与染色体dna中的靶序列互补的5’序列(即,间隔序列)和能够与tracrrna的一部分碱基配对的3’序列。5’间隔序列在每种crrna中不同,而3’序列通常可以在每种crrna中相同。
crrna的5’末端的间隔序列与染色体dna中的靶序列(即,前间隔序列(protospacersequence))互补,使得crrna可与靶序列杂交。靶序列没有序列限制,除了该序列邻近前间隔区邻近基序(pam)之外。例如,用于各种crispr/cas蛋白的pam序列包括5'-ngg(spcas9)、5'-nggng(st3cas9)、5'-nnagaaw(st1cas9)、5'-nngrrt(sacas9)、5’nnnngatt(nmcas9)和5'-tttn(ascpf1),其中n被定义为任何核苷酸,和w被定义为a或t。
与靶序列互补的5’间隔序列的长度范围可以是约10个核苷酸至超过约25个核苷酸。在一些实施方案中,crrna的间隔序列和靶序列之间碱基配对的区域可以是14、15、16、17、18、19、20、21、22或23个核苷酸长度。在特定的实施方案中,crrna的间隔序列和靶序列之间碱基配对的区域可以是19、20或21个核苷酸长度。例如,spcas9crrna的间隔序列可包含n20或gn17-20gg。一般而言,crrna的间隔序列和靶序列之间的序列同一性可以是至少约80%、至少约85%、至少约90%、至少约95%或至少约99%。本领域技术人员理解的是,与靶序列的序列同一性增加可导致较少的脱靶效应。
crrna还包含能够与tracrrna的5’末端附近的序列碱基配对的3’序列。crrna的3’序列的长度范围可以是约5个核苷酸至约25个核苷酸。在一些实施方案中,crrna的3’序列的长度范围可以是约9个核苷酸至约15个核苷酸。在特定的实施方案中,crrna的3’序列的长度可以是约12个核苷酸。crrna的3’序列和互补的tracrrna序列之间的序列同一性通常是至少约50%。因此,crrna和tracrrna之间的碱基配对可包含至少两对连续碱基对的段(例如,被非杂交序列分隔的三对或更多对连续碱基对的两个或更多个段)。
在一些实施方案中,crrna可进一步包含另外的3’序列,其能够与tracrrna的5’四环中的延伸序列或5’四环中的延伸序列的一部分碱基配对(见下文)。crrna中另外的序列的范围可以是约2个核苷酸至约30个核苷酸。crrna中另外的序列和5’四环中的延伸序列之间的序列同一性通常是至少约50%。
一般而言,crrna使用固相合成技术化学合成。因此,crrna可包含标准的核糖核苷酸或修饰的核糖核苷酸。修饰的核糖核苷酸包括碱基修饰(例如,假尿苷、2-硫尿苷、n6-甲基腺苷等)和/或糖修饰(例如,2’-o-甲基、2’-氟、2’-氨基、锁核酸(lna)等)。crrna的主链也可经修饰以包含硫代磷酸酯或硼烷磷酸酯键或肽核酸。crrna的5’和3’末端可缀合至功能部分,例如荧光染料(例如,fam、tmr、cy3、cy5、texasred、oregongreen、alexafluors、halo标签等)、检测标签(例如,生物素、地高辛、量子点、金颗粒等)、聚合物、蛋白等。本领域技术人员将理解,crrna也可体外酶促合成。
(b)适体-tracrrna
本文公开的合成的两部分grna还包含tracrrna,其包含至少一个形成发夹的rna适体序列。本文公开的tracrrna从5’至3’包含5’四环、能够与crrna碱基配对的序列、至少一个内部茎-环和单链3’序列。至少一个内部茎-环可包含1个茎-环、2个茎-环、3个茎-环、4个茎-环、5个茎-环或多于5个茎-环。在特定的实施方案中,至少1个内部茎-环可包含茎-环1、茎-环2和茎-环3(参见图1)。tracrrna的内部茎-环可形成与crispr/cas蛋白相互作用以形成稳定的三元dna-grna-蛋白复合物的二级结构。tracrrna的序列和/或二级结构可以和将要根据例如其经设计以与之复合的crispr/cas蛋白的身份(例如,spcas9、sacas9、cjcas9等)而改变。
本文公开的tracrrna进一步包含至少一个形成发夹的rna适体序列。至少一个形成发夹的rna适体序列可位于tracrrna的5’四环、至少一个内部茎-环和/或3’末端中。在一些实施方案中,至少一个形成发夹的rna适体序列可位于5’四环中。在其它实施方案中,至少一个形成发夹的rna适体序列可位于tracrrna的至少一个内部茎-环中。例如,至少一个形成发夹的rna适体序列可位于茎-环2中。在进一步的实施方案中,至少一个形成发夹的rna适体序列可位于tracrrna的3’末端中。在仍其它实施方案中,形成发夹的rna适体序列可位于5’四环和茎-环2中。在备选的实施方案中,形成发夹的rna适体序列可位于tracrrna的5’四环和3’末端中。在进一步的实施方案中,形成发夹的rna适体序列可位于tracrrna的5’四环、茎-环2和3’末端中。
可将多个形成发夹的rna适体序列包括在本文公开的tracrrna中。形成发夹的rna适体序列可包含多个下文列出的适体序列或其任何组合。在一些实施方案中,至少一个形成发夹的rna适体序列可以是ms2适体序列或其变体,其结合ms2噬菌体外壳蛋白(mcp)(lowary等人,nucacidres,1987,15(24):10483-10493)。ms2变体包括f5和f6适体(parrott等人,nuclacidsres,2000,28(2):489-497)。在其它实施方案中,至少一个形成发夹的rna适体序列可以是pp7序列,其结合pp7噬菌体外壳蛋白(pcp)(lim等人,jbiolchem,2001,276(25):22507-22513)。在备选的实施方案中,至少一个形成发夹的rna适体序列可以是com序列,其结合mu噬菌体com蛋白(hattman,pharmacol&ther,1999,84(3):367-388)。在进一步的实施方案中,至少一个形成发夹的rna适体序列可以是盒b序列,其结合λ噬菌体n22蛋白(daigle等人,natmethods,2007,4:633-636)。在进一步的实施方案中,至少一个形成发夹的rna适体序列可以是富含au的元件(are)序列,其结合脆性x精神发育迟缓综合征-相关蛋白1(fxr1)(vasudevan等人,science,2007,318(5858):1931-1934)。在仍其它实施方案中,至少一个形成发夹的rna适体序列可以是组蛋白mrna3’序列,其结合茎-环结合蛋白(slbp)。在还其它实施方案中,至少一个形成发夹的rna适体序列可以是结合来自噬菌体的蛋白的序列,所述噬菌体选自ap205、bz13、f1、f2、fd、fr、id2、jp34/ga、jp501、jp34、jp500、ku1、m11、m12、mx1、nl95、pp7、ϕcb5、ϕcb8r、ϕcb12r、ϕcb23r、qβ、r17、sp-β、tw18、tw19或vk。
引入tracrrna的至少一个环中的形成发夹的rna适体序列的长度可以和将要根据形成发夹的rna适体序列的身份而改变。例如,ms2适体序列的长度可以是约34个核苷酸。在各种实施方案中,形成发夹的rna适体序列的长度范围可以是约10个核苷酸至约50个核苷酸。
在其中至少一个形成发夹的rna适体序列位于5’四环和/或一个或多个内部茎-环中的实施方案中,5’四环和/或内部茎-环可进一步包含延伸序列。在一些实施方案中,至少一个形成发夹的rna适体序列位于5’四环中,和5’四环进一步包含延伸序列。在这样的实施方案中,crrna可进一步包含与5’四环中的延伸序列或5’四环中的延伸序列的一部分互补的序列(非限制性实例在图1中示出)。
延伸序列的长度范围可以是约2个核苷酸至约30个核苷酸。在一些实施方案中,延伸序列的长度范围可以是约3个核苷酸至约25个核苷酸,或约5个核苷酸至约25个核苷酸。在各种实施方案中,延伸序列可包含约2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30个核苷酸。在特定的实施方案中,延伸序列可包含4个核苷酸、6个核苷酸、8个核苷酸、10个核苷酸、12个核苷酸、14个核苷酸、16个核苷酸、18个核苷酸或20个核苷酸。
适体-tracrrna的总长度可以和将要根据rna适体序列的身份、tracrrna中存在的rna适体序列的数量以及任选的延伸序列的长度而改变。一般而言,适体-tracrrna的长度范围可以是约80个核苷酸至约300个核苷酸。在各种实施方案中,适体-tracrrna的总长度范围可以是至多约120个核苷酸、至多约125个核苷酸、至多约150个核苷酸、至多约175个核苷酸、至多约200个核苷酸、至多约225个核苷酸、至多约250个核苷酸、至多约275个核苷酸或至多约300个核苷酸。
在一些实施方案中,tracrrna可以是体外酶促合成的。例如,编码tracrrna的dna可以可操作连接至被噬菌体rna聚合酶识别的启动子序列,如下文章节(iv)中详述的。因此,tracrrna包含标准核糖核苷酸(或可通过体外使用的酶掺入的那些)。在其它实施方案中,tracrrna可以是化学合成的,和可包含标准核糖核苷酸、修饰的核糖核苷酸、标准磷酸二酯键或修饰的键(例如,硫代磷酸酯、硼烷磷酸酯或肽核酸键)。
(ii)组合物
本公开内容的另一方面包括包含或由以下组成的组合物:1)上文章节(i)中描述的合成的两部分指导rna和至少一种rna适体结合蛋白,或2)合成的两部分指导rna、至少一种rna适体结合蛋白和至少一种crispr/cas蛋白。在一些实施方案中,组合物可包含编码至少一种rna适体结合蛋白和/或crispr/cas蛋白的核酸(见下文章节(iv))。
(a)rna适体结合蛋白
组合物包含至少一种rna适体结合蛋白。rna适体结合蛋白结合位于合成的两部分指导rna的tracrrna中的一个或多个适体序列。rna适体蛋白通常与至少一种功能结构域缔合。至少一种功能结构域可以是转录激活结构域、转录阻抑结构域、表观遗传修饰结构域、标记结构域或其组合。
(i)rna适体结合蛋白
合适的rna适体结合蛋白的非限制性实例包括ms2外壳蛋白(mcp)、pp7噬菌体外壳蛋白(pcp)、mu噬菌体com蛋白、λ噬菌体n22蛋白、茎-环结合蛋白(slbp)和脆性x精神发育迟缓综合征-相关蛋白1(fxr1)。在其它实施方案中,rna适体结合蛋白可以是来自噬菌体的蛋白,所述噬菌体选自ap205、bz13、f1、f2、fd、fr、id2、jp34/ga、jp501、jp34、jp500、ku1、m11、m12、mx1、nl95、pp7、ϕcb5、ϕcb8r、ϕcb12r、ϕcb23r、qβ、r17、sp-β、tw18、tw19或vk。
(ii)功能结构域
rna适体结合蛋白与至少一种功能结构域缔合,其中所述功能结构域是转录激活结构域、转录阻抑结构域、表观遗传修饰结构域、标记结构域或其组合。
在一些实施方案中,至少一种功能结构域可以是转录激活结构域。合适的转录激活结构域包括但不限于单纯疱疹病毒vp16结构域、vp64(其是vp16的四聚体衍生物)、vp160(即,10xvp16)、来自nfκb的p65激活结构域、热激因子1(hsf1)激活结构域、myod1激活结构域、gcn4肽、10xgcn4、病毒r反式激活因子(rta)、vpr(vp64-p65-rta的融合物)、p53激活结构域1和2、creb(camp反应元件结合蛋白)激活结构域、e2a激活结构域或活化t细胞核因子(nfat)激活结构域。
在其它实施方案中,至少一种功能结构域可以是转录阻抑结构域。合适的转录阻抑结构域的非限制性实例包括kruppel-关联盒(krab)阻抑结构域、诱导型camp早期阻抑(icer)结构域、yy1富甘氨酸阻抑结构域、sp1-样阻抑物、e(spl)阻抑物、iκb阻抑物或甲基-cpg结合蛋白2(mecp2)阻抑结构域。
在进一步的实施方案中,至少一种功能结构域可以是表观遗传修饰结构域。表观遗传修饰结构域可改变dna或染色质结构(并且可能或可能不改变dna序列)。合适的表观遗传修饰结构域的非限制性实例包括具有dna甲基转移酶活性(例如,胞嘧啶甲基转移酶)、dna去甲基酶活性、dna去氨基化(例如,胞嘧啶脱氨酶、腺苷脱氨酶、鸟嘌呤脱氨酶)、dna氨基化、dna氧化活性、dna解旋酶活性、组蛋白乙酰基转移酶(hat)活性(例如,衍生自e1a结合蛋白p300的hat结构域)、组蛋白去乙酰基酶活性、组蛋白甲基转移酶活性、组蛋白去甲基酶活性、组蛋白激酶活性、组蛋白磷酸酶活性、组蛋白遍在蛋白连接酶活性、组蛋白去遍在蛋白化活性、组蛋白腺苷酸化活性、组蛋白去腺苷酸化活性、组蛋白sumo化活性、组蛋白去sumo化活性、组蛋白核糖基化活性、组蛋白去核糖基化活性、组蛋白豆蔻酰化活性、组蛋白去豆蔻酰化活性、组蛋白瓜氨酸化活性、组蛋白烷基化活性、组蛋白去烷基化活性、组蛋白氧化活性或核小体相互作用/重塑活性的那些。在特定的实施方案中,表观遗传修饰结构域可包含胞苷脱氨酶活性、组蛋白乙酰基转移酶活性或dna甲基转移酶活性。在具体的实施方案中,表观遗传修饰结构域可以是p300组蛋白乙酰基转移酶、激活诱导的胞苷脱氨酶(aid)、apobec胞苷脱氨酶或tet甲基胞嘧啶双加氧酶。
在仍其它实施方案中,至少一种功能结构域可以是标记结构域。标记结构域包括荧光蛋白和纯化或表位标签。合适的荧光蛋白包括但不限于绿色荧光蛋白(例如,gfp、egfp、gfp-2、taggfp、turbogfp、emerald、azamigreen、单体azamigreen、copgfp、acegfp、zsgreen1)、黄色荧光蛋白(例如,yfp、eyfp、citrine、venus、ypet、phiyfp、zsyellow1)、蓝色荧光蛋白(例如,bfp、ebfp、ebfp2、azurite、mkalama1、gfpuv、sapphire、t-sapphire)、青色荧光蛋白(例如,ecfp、cerulean、cypet、amcyan1、midoriishi-cyan)、红色荧光蛋白(例如,mkate、mkate2、mplum、dsred单体、mcherry、mrfp1、dsred-express、dsred2、dsred-monomer、hcred-tandem、hcred1、asred2、eqfp611、mrasberry、mstrawberry、jred)和橙色荧光蛋白(例如,morange、mko、kusabira-orange、单体kusabira-orange、mtangerine、tdtomato)。合适的纯化或表位标签的非限制性实例包括6xhis、flag®、ha、gst、myc等。
(iii)rna结合蛋白和功能结构域之间的缔合
rna适体结合蛋白与至少一种功能结构域缔合。在一些实施方案中,rna适体结合蛋白可与一种功能结构域缔合。在其它实施方案中,rna适体结合蛋白可与两种功能结构域缔合。在进一步的实施方案中,rna适体结合蛋白可与三种功能结构域缔合。在另外的实施方案中,rna适体结合蛋白可与四种功能结构域或超过四种功能结构域缔合。与rna适体结合蛋白缔合的功能结构域可具有相同的功能,或者它们可具有不同的功能。例如,rna适体结合蛋白可与两种转录激活结构域、两种表观遗传修饰结构域、转录激活结构域和表观遗传修饰结构域、至少一种转录激活结构域和标记结构域等缔合。
rna适体结合蛋白可通过化学键直接或通过接头间接与至少一种功能结构域缔合。化学键可以是共价的(例如,肽键、酯键等)。或者,化学键可以是非共价的(例如,离子、静电、氢、疏水、范德华相互作用或π-效应)。在一些实施方案中,rna适体结合蛋白可与至少一种功能结构域通过非共价蛋白-蛋白、蛋白-rna或蛋白-dna相互作用缔合。在某些实施方案中,rna适体结合蛋白和缔合的结构域可通过肽键直接连接,从而形成融合蛋白。
在其它实施方案中,rna适体结合蛋白可与至少一种功能结构域通过接头缔合。接头是通过至少一个共价键连接一个或多个其它化学基团的化学基团。合适的接头包括氨基酸、肽、核苷酸、核酸、有机接头分子(例如,马来酰亚胺衍生物、n-乙氧基苄基咪唑、联苯基-3,4′,5-三甲酸、对氨基苄基氧基羰基等)、二硫化物接头和聚合物接头(例如,peg)。接头可包括一种或多种间隔基团,包括但不限于亚烷基、亚烯基、亚炔基、烷基、烯基、炔基、烷氧基、芳基、杂芳基、芳烷基、芳烯基、芳炔基等。接头可以是中性的,或携带正电荷或负电荷。另外,接头可以是可裂解的,使得连接接头与另一化学基团的接头共价键可在某些条件下断裂或裂解,所述条件包括ph、温度、盐浓度、光、催化剂或酶。
在进一步的实施方案中,rna适体结合蛋白可通过肽接头连接至至少一种功能结构域。肽接头可以是柔性氨基酸接头(例如,包含小的、非极性或极性氨基酸)。柔性接头的非限制性实例包括legggs(seqidno:1)、tgsg(seqidno:2)、ggsgggsg(seqidno:3)和(ggggs)1-4(seqidno:4)。或者,肽接头可以是刚性氨基酸接头。这样的接头包括(eaaak)1-4(seqidno:5)、a(eaaak)2-5a(seqidno:6)和papap(seqidno:7)。合适的接头的实例是本领域众所周知的,和设计接头的程序是容易获得的(crasto等人,proteineng.,2000,13(5):309-312)。在某些实施方案中,rna适体结合蛋白和相关的结构域可通过肽接头直接连接,从而形成融合蛋白。
至少一种功能结构域可与rna适体结合蛋白的n-末端、c-末端和/或内部位置缔合。
(iv)任选的核定位信号和/或细胞穿透肽
rna适体结合蛋白可进一步包含至少一种核定位信号(nls)和/或细胞穿透肽(cpp)。核定位信号的非限制性实例包括pkkkrkv(seqidno:8)、pkkkrrv(seqidno:9)、krpaatkkagqakkkk(seqidno:10)、ygrkkrrqrrr(seqidno:11)、rkkrrqrrr(seqidno:12)、paakrvkld(seqidno:13)、rqrrnelkrsp(seqidno:14)、vsrkrprp(seqidno:15)、ppkkared(seqidno:16)、pqpkkkpl(seqidno:17)、salikkkkkmap(seqidno:18)、pkqkkrk(seqidno:19)、rklkkkikkl(seqidno:20)、rekkkflkrr(seqidno:21)、krkgdevdgvdevakkkskk(seqidno:22)、rkclqagmnlearktkk(seqidno:23)、nqssnfgpmkggnfggrssgpyggggqyfakprnqggy(seqidno:24)和rmrizfknkgkdtaelrrrrvevsvelrkakkdeqilkrrnv(seqidno:25)。合适的细胞穿透肽的实例包括但不限于grkkrrqrrrppqpkkkrkv(seqidno:26)、plssifsrigdppkkkrkv(seqidno:27)、galflgwlgaagstmgapkkkrkv(seqidno:28)、galflgflgaagstmgawsqpkkkrkv(seqidno:29)、ketwwetwwtewsqpkkkrkv(seqidno:30)、yaraaarqara(seqidno:31)、thrlprrrrrr(seqidno:32)、ggrrarrrrrr(seqidno:33)、rrqrrtsklmkr(seqidno:34)、gwtlnsagyllgkinlkalaalakkil(seqidno:35)、kalaweaklakalakalakhlakalakalkcea(seqidno:36)和rqikiwfqnrrmkwkk(seqidno:37)。
至少一种核定位信号和/或细胞穿透肽可与rna适体结合蛋白的n-末端、c-末端和/或内部位置和/或至少一种功能结构域缔合。
(b)crispr/cas蛋白
组合物可进一步包含crispr/cas蛋白。在一些实施方案中,crispr/cas蛋白具有核酸酶活性和能够裂解双链dna序列的两条链(即,产生双链断裂)。在其它实施方案中,crispr/cas蛋白具有非核酸酶活性(即,是与非核酸酶结构域连接的催化无活性的crispr/cas蛋白)。合适的非核酸酶结构域包括转录激活结构域、转录阻抑结构域和表观遗传修饰结构域。
一般而言,crispr/cas蛋白和rna适体结合蛋白经选择以协同起作用。例如,具有核酸酶活性的crispr/cas蛋白可与rna适体结合蛋白一起使用,所述rna适体结合蛋白与具有核小体相互作用活性的结构域缔合。类似地,与转录激活结构域连接的催化无活性的crispr/cas蛋白可与rna适体结合蛋白一起使用,所述rna适体结合蛋白与转录激活结构域缔合。本领域技术人员可理解许多可能性。
(i)具有核酸酶活性的crispr/cas蛋白
crispr/cas核酸酶。具有核酸酶活性的crispr/cas蛋白可衍生自i型(即,ia、ib、ic、id、ie或if)、ii型(即,iia、iib或iic)、iii型(即,iiia或iiib)或v型crispr系统,其存在于各种细菌和古细菌中。例如,crispr/cas系统可来自链球菌属物种(streptococcussp.)(例如,酿脓链球菌(s.pyogenes)、嗜热链球菌(s.thermophiles)、巴氏链球菌(s.pasteurianus))、弯曲杆菌属物种(campylobactersp.)(例如,空肠弯曲杆菌(campylobacterjejuni))、弗朗西斯氏菌属物种(francisellasp.)(例如,新凶手弗朗西斯菌(francisellanovicida))、acaryochlorissp.、醋盐杆菌属物种(acetohalobiumsp.)、氨基酸球菌属物种(acidaminococcussp.)、嗜酸硫杆菌属物种(acidithiobacillussp.)、脂环酸芽孢杆菌属物种(alicyclobacillussp.)、allochromatiumsp.、ammonifexsp.、鱼腥藻属物种(anabaenasp.)、节旋藻属物种(arthrospirasp.)、芽胞杆菌属物种(bacillussp.)、伯克氏菌目物种(burkholderialessp.)、caldicelulosiruptorsp.、candidatussp.、梭菌属物种(clostridiumsp.)、crocosphaerasp.、蓝丝菌属物种(cyanothecesp.)、微小杆菌属物种(exiguobacteriumsp.)、芬戈尔德菌属物种(finegoldiasp.)、纤线杆菌属物种(ktedonobactersp.)、毛螺旋菌科物种(lachnospiraceaesp.)、乳杆菌属物种(lactobacillussp.)、lyngbyasp.、海杆菌属物种(marinobactersp.)、甲烷盐菌属物种(methanohalobiumsp.)、微颤菌属物种(microscillasp.)、微鞘藻属物种(microcoleussp.)、微囊藻属物种(microcystissp.)、natranaerobiussp.、奈瑟菌属物种(neisseriasp.)、亚硝化球菌属物种(nitrosococcussp.)、诺卡土壤菌属物种(nocardiopsissp.)、节球藻属物种(nodulariasp.)、念珠藻属物种(nostocsp.)、颤藻属物种(oscillatoriasp.)、极单胞菌属物种(polaromonassp.)、pelotomaculumsp.、假交替单胞菌属物种(pseudoalteromonassp.)、石袍菌属物种(petrotogasp.)、普雷沃菌属物种(prevotellasp.)、葡萄球菌属物种(staphylococcussp.)、链霉菌属物种(streptomycessp.)、链孢子囊菌属物种(streptosporangiumsp.)、聚球藻属物种(synechococcussp.)、栖热腔菌属物种(thermosiphosp.)或疣微菌门物种(verrucomicrobiasp.)。在其它实施方案中,crispr/cas核酸酶可衍生自古细菌crispr系统、crispr/casx系统或crispr/casy系统(burstein等人,nature,2017,542(7640):237-241)。
在一些实施方案中,crispr/cas核酸酶可衍生自i型crispr/cas系统。在其它实施方案中,crispr/cas核酸酶可衍生自ii型crispr/cas系统。在仍其它实施方案中,crispr/cas核酸酶可衍生自iii型crispr/cas系统。在进一步的具体实施方案中,crispr/cas核酸酶可衍生自v型crispr/cas系统。
crispr/cas核酸酶可以是野生型或天然存在的蛋白。或者,crispr/cas蛋白可经工程改造以具有改进的特异性、改变的pam特异性、降低的脱靶效应、增加的稳定性等。
合适的crispr/cas核酸酶的非限制性实例包括cas蛋白(例如,cas9、cas1、cas2、cas3等)、cpf蛋白、c2c蛋白(例如,c2c1、c2c2、cdc3)、cmr蛋白、csa蛋白、csb蛋白、csc蛋白、cse蛋白、csf蛋白、csm蛋白、csn蛋白、csx蛋白、csy蛋白、csz蛋白和其衍生物或变体。在特定的实施方案中,crispr/cas核酸酶可以是ii型cas9蛋白、v型cpf1蛋白或其衍生物。
在一些实施方案中,crispr/cas核酸酶可以是酿脓链球菌cas9(spcas9)、嗜热链球菌cas9(st1cas9或st3cas9)或巴氏链球菌(spacas9)。在其它实施方案中,crispr/cas核酸酶可以是空肠弯曲杆菌cas9(cjcas9)。在备选的实施方案中,crispr/cas核酸酶可以是新凶手弗朗西斯菌cas9(fncas9)。在还其它实施方案中,crispr/cas核酸酶可以是脑膜炎奈瑟菌(neisseriameningitides)cas9(nmcas9)。在仍其它实施方案中,crispr/cas核酸酶可以是灰色奈瑟菌(neisseriacinerea)cas9(nccas9)。在进一步的实施方案中,crispr/cas核酸酶可以是新凶手弗朗西斯菌cpf1(fncpf1)、氨基酸球菌属物种cpf1(ascpf1)或毛螺旋菌科细菌nd2006cpf1(lbcpf1)。
一般而言,crispr/cas核酸酶包含rna识别和/或rna结合结构域,其与tracrrna相互作用。crispr/cas核酸酶还包含至少一种具有内切核酸酶活性的核酸酶结构域。例如,cas9蛋白包含ruvc-样核酸酶结构域和hnh-样核酸酶结构域,和cpf1蛋白包含ruvc-样结构域和nuc结构域。crispr/cas核酸酶还可包含dna结合结构域、解旋酶结构域、rna酶结构域、蛋白-蛋白相互作用结构域、二聚结构域以及其它结构域。
在一些实施方案中,crispr/cas核酸酶可以是crispr/cas切口酶,其中crispr/cas核酸酶已被修饰以仅裂解dna的一条链。与一对偏置指导rna组合使用的crispr/cas切口酶(即,crispr/cas双重切口酶)可在双链序列中产生双链断裂。crispr/cas核酸酶可通过一个或多个突变和/或缺失转化为切口酶。例如,cas9切口酶可在核酸酶结构域之一(例如,ruvc-样结构域或hnh-样结构域)中包含一个或多个突变。例如,一个或多个突变在ruvc-样结构域中可以是d10a、d8a、e762a和/或d986a,或一个或多个突变在hnh-样结构域中可以是h840a、h559a、n854a、n856a和/或n863a,使得切口酶仅裂解双链dna序列的一条链。
与非crispr/cas核酸酶结构域连接的催化无活性的crispr/cas蛋白。在另外的实施方案中,具有核酸酶活性的crispr/cas蛋白包含与非crispr/cas核酸酶结构域连接的催化无活性的crispr/cas蛋白。催化无活性的crispr/cas蛋白已通过突变和/或缺失被修饰以缺少所有核酸酶活性。例如,催化无活性的crispr/cas蛋白可以是催化无活性的(死)cas9(dcas9),其中ruvc-样结构域包含d10a、d8a、e762a和/或d986a突变,和hnh-样结构域包含h840a、h559a、n854a、n865a和/或n863a突变。或者,催化无活性的crispr/cas蛋白可以是催化无活性的(死)cpf1蛋白,其包含在核酸酶结构域中相当的突变。
催化无活性的crispr/cas蛋白可与衍生自限制性内切核酸酶或归巢内切核酸酶的核酸酶结构域连接。在特定的实施方案中,核酸酶结构域可衍生自ii-s型限制性内切核酸酶。ii-s型内切核酸酶裂解在通常远离识别/结合位点数个碱基对的位点处的dna,并因此具有可分离的结合和裂解结构域。这些酶通常是单体,其短暂缔合以形成二聚体,在错开位置裂解dna的每条链。合适的ii-s型内切核酸酶的非限制性实例包括bfii、bpmi、bsai、bsgi、bsmbi、bsmi、bspmi、foki、mboii和sapi。在特定的实施方案中,核酸酶结构域可以是foki核酸酶结构域或其衍生物。ii-s型核酸酶结构域可经修饰以促进两个不同的核酸酶结构域的二聚。例如,foki的裂解结构域可通过突变某些氨基酸残基来修饰。在特定的实施方案中,foki核酸酶结构域可包含第一foki半-结构域,其包含q486e、i499l和/或n496d突变;和第二foki半-结构域,其包含e490k、i538k和/或h537r突变。
催化无活性的crispr/cas蛋白可通过化学键直接或通过接头间接连接至非crispr/cas核酸酶结构域。化学键可以是共价的(例如,肽键、酯键等)。或者,化学键可以是非共价的(例如,离子、静电、氢、疏水、范德华相互作用或π-效应)。合适的接头在上文章节(ii)(a)(iii)中描述。核酸酶结构域可连接至催化无活性的crispr/cas蛋白的n-末端、c-末端和/或内部位置。
任选的蛋白结构域。具有核酸酶活性的crispr/cas蛋白可进一步包含至少一种核定位信号(nls)、细胞穿透肽(cpp)和/或标记结构域。至少一种nls、cpp和/或标记结构域可直接或间接连接至具有核酸酶活性的crispr/cas蛋白的n-末端、c-末端和/或内部位置。
核定位信号的非限制性实例包括pkkkrkv(seqidno:8)、pkkkrrv(seqidno:9)、krpaatkkagqakkkk(seqidno:10)、ygrkkrrqrrr(seqidno:11)、rkkrrqrrr(seqidno:12)、paakrvkld(seqidno:13)、rqrrnelkrsp(seqidno:14)、vsrkrprp(seqidno:15)、ppkkared(seqidno:16)、pqpkkkpl(seqidno:17)、salikkkkkmap(seqidno:18)、pkqkkrk(seqidno:19)、rklkkkikkl(seqidno:20)、rekkkflkrr(seqidno:21)、krkgdevdgvdevakkkskk(seqidno:22)、rkclqagmnlearktkk(seqidno:23)、nqssnfgpmkggnfggrssgpyggggqyfakprnqggy(seqidno:24)和rmrizfknkgkdtaelrrrrvevsvelrkakkdeqilkrrnv(seqidno:25)。合适的细胞穿透肽的实例包括但不限于grkkrrqrrrppqpkkkrkv(seqidno:26)、plssifsrigdppkkkrkv(seqidno:27)、galflgwlgaagstmgapkkkrkv(seqidno:28)、galflgflgaagstmgawsqpkkkrkv(seqidno:29)、ketwwetwwtewsqpkkkrkv(seqidno:30)、yaraaarqara(seqidno:31)、thrlprrrrrr(seqidno:32)、ggrrarrrrrr(seqidno:33)、rrqrrtsklmkr(seqidno:34)、gwtlnsagyllgkinlkalaalakkil(seqidno:35)、kalaweaklakalakalakhlakalakalkcea(seqidno:36)和rqikiwfqnrrmkwkk(seqidno:37)。标记结构域可以是荧光蛋白和/或纯化或表位标签。合适的荧光蛋白包括但不限于,绿色荧光蛋白(例如,gfp、egfp、gfp-2、taggfp、turbogfp、emerald、azamigreen、单体azamigreen、copgfp、acegfp、zsgreen1)、黄色荧光蛋白(例如,yfp、eyfp、citrine、venus、ypet、phiyfp、zsyellow1)、蓝色荧光蛋白(例如,bfp、ebfp、ebfp2、azurite、mkalama1、gfpuv、sapphire、t-sapphire)、青色荧光蛋白(例如,ecfp、cerulean、cypet、amcyan1、midoriishi-cyan)、红色荧光蛋白(例如,mkate、mkate2、mplum、dsred单体、mcherry、mrfp1、dsred-express、dsred2、dsred-monomer、hcred-tandem、hcred1、asred2、eqfp611、mrasberry、mstrawberry、jred)和橙色荧光蛋白(例如,morange、mko、kusabira-orange、单体kusabira-orange、mtangerine、tdtomato)。合适的纯化或表位标签的非限制性实例包括6xhis、flag®、ha、gst、myc等。
(ii)具有非核酸酶活性的crispr/cas蛋白
在备选的实施方案中,crispr/cas蛋白可具有非核酸酶活性。例如,crispr/cas蛋白可以是与至少一种非核酸酶结构域连接的催化无活性的crispr/cas蛋白。如上文所提及的,催化无活性的crispr/cas蛋白已通过突变和/或缺失修饰以缺少所有核酸酶活性。例如,催化无活性的crispr/cas蛋白可以是催化无活性的(死)cas9(dcas9),其中ruvc-样结构域包含d10a、d8a、e762a和/或d986a突变和hnh-样结构域包含h840a、h559a、n854a、n865a和/或n863a突变。或者,催化无活性的crispr/cas蛋白可以是催化无活性的(死)cpf1蛋白,其包含在核酸酶结构域中相当的突变。
与催化无活性的crispr/cas蛋白连接的至少一种非核酸酶结构域可以是转录激活结构域、转录阻抑结构域或表观遗传修饰结构域。
在一些实施方案中,催化无活性的crispr/cas蛋白可连接至至少一种转录激活结构域。合适的转录激活结构域包括但不限于,单纯疱疹病毒vp16结构域、vp64(其是vp16的四聚体衍生物)、vp160(即,10xvp16)、来自nfκb的p65激活结构域、热激因子1(hsf1)激活结构域、myod1激活结构域、gcn4肽、10xgcn4、病毒r反式激活因子(rta)、vpr(vp64-p65-rta的融合物)、p53激活结构域1和2、creb(camp反应元件结合蛋白)激活结构域、e2a激活结构域或活化t细胞核因子(nfat)激活结构域。在一些情况下,催化无活性的crispr/cas蛋白可连接至一种转录激活结构域、两种转录激活结构域、三种转录激活结构域或超过三种转录激活结构域。
在其它实施方案中,催化无活性的crispr/cas蛋白可连接至至少一种转录阻抑结构域。合适的转录阻抑结构域的非限制性实例包括kruppel-关联盒(krab)阻抑结构域、诱导型camp早期阻抑(icer)结构域、yy1富甘氨酸阻抑结构域、sp1-样阻抑物、e(spl)阻抑物、iκb阻抑物或甲基-cpg结合蛋白2(mecp2)阻抑结构域。在一些情况下,催化无活性的crispr/cas蛋白可连接至一种转录阻抑结构域、两种转录阻抑结构域、三种转录阻抑结构域或超过三种转录阻抑结构域。
在进一步的实施方案中,催化无活性的crispr/cas蛋白可连接至至少一种表观遗传修饰结构域。表观遗传修饰结构域可改变dna或染色质结构(并且可能或可能不改变dna序列)。合适的表观遗传修饰结构域的非限制性实例包括具有dna甲基转移酶活性(例如,胞嘧啶甲基转移酶)、dna去甲基酶活性、dna去氨基化(例如,胞嘧啶脱氨酶、腺苷脱氨酶、鸟嘌呤脱氨酶)、dna氨基化、dna氧化活性、dna解旋酶活性、组蛋白乙酰基转移酶(hat)活性(例如,衍生自e1a结合蛋白p300的hat结构域)、组蛋白去乙酰基酶活性、组蛋白甲基转移酶活性、组蛋白去甲基酶活性、组蛋白激酶活性、组蛋白磷酸酶活性、组蛋白遍在蛋白连接酶活性、组蛋白去遍在蛋白化活性、组蛋白腺苷酸化活性、组蛋白去腺苷酸化活性、组蛋白sumo化活性、组蛋白去sumo化活性、组蛋白核糖基化活性、组蛋白去核糖基化活性、组蛋白豆蔻酰化活性、组蛋白去豆蔻酰化活性、组蛋白瓜氨酸化活性、组蛋白烷基化活性、组蛋白去烷基化活性、组蛋白氧化活性或组蛋白相互作用/重塑活性的那些。在特定的实施方案中,表观遗传修饰结构域可包含胞苷脱氨酶活性、组蛋白乙酰基转移酶活性或dna甲基转移酶活性。在具体的实施方案中,表观遗传修饰结构域可以是p300组蛋白乙酰基转移酶、激活诱导的胞苷脱氨酶(aid)、apobec胞苷脱氨酶或tet甲基胞嘧啶双加氧酶。在一些情况下,催化无活性的crispr/cas蛋白可连接至一种表观遗传修饰结构域、两种表观遗传修饰结构域、三种表观遗传修饰结构域或超过三种表观遗传修饰结构域。
催化无活性的crispr/cas蛋白可通过化学键直接或通过接头间接连接至至少一种非核酸酶结构域。化学键可以是共价的(例如,肽键、酯键等)。或者,化学键可以是非共价的(例如,离子、静电、氢、疏水、范德华相互作用或π-效应)。合适的接头在上文章节(ii)(a)(iii)中描述。至少一种非核酸酶结构域可连接至催化无活性的crispr/cas蛋白的n-末端、c-末端和/或内部位置。
任选的蛋白结构域。与至少非核酸酶结构域连接的催化无活性的crispr/cas蛋白可进一步包含至少一种核定位信号(nls)、细胞穿透肽(cpp)和/或标记结构域。合适的nls、cpp和标记结构域的实例如上文章节(ii)(b)(i)中描述。至少一种nls、cpp和/或标记结构域可直接或间接连接至具有非核酸酶活性的crispr/cas蛋白的n-末端、c-末端和/或内部位置。
在一些实施方案中,具有非核酸酶活性的crispr/cas蛋白可进一步包含至少一种可检测标记。可检测标记可以是荧光团(例如,fam、tmr、cy3、cy5、texasred、oregongreen、alexafluors、halo标签或合适的荧光染料)、半抗原(例如,生物素、地高辛等)、量子点或金颗粒。
(iii)试剂盒
本公开内容的又一方面提供了包含本文公开的适体-tracrrna、合成的两部分指导rna、rna适体结合蛋白和/或crispr/cas蛋白的试剂盒。
在一些实施方案中,试剂盒可包含至少一种如上文章节(i)(b)中描述的适体-tracrrna,或如下文章节(iv)中描述的编码至少一种适体-tracrrna的核酸。在其它实施方案中,试剂盒可包含至少一种适体-tracrrna(或编码核酸)和至少一种如上文章节(ii)(a)中描述的rna适体结合蛋白或如下文章节(iv)中描述的编码至少一种rna适体结合蛋白的核酸。在还其它实施方案中,试剂盒可包含至少一种适体-tracrrna(或编码核酸)、至少一种rna适体结合蛋白(或编码核酸)和至少一种如上文章节(ii)(b)中描述的crispr/cas蛋白或编码至少一种crispr/cas蛋白的核酸。任何这些试剂盒可进一步包含至少一种crrna(例如,crrna的库)或编码所述crrna的核酸。或者,终端使用者可提供至少一种crrna以与试剂盒中的适体-tracrrna结合使用。
在其它实施方案中,试剂盒可包含至少一种如上文章节(i)中描述的合成的两部分指导rna。在其它实施方案中,试剂盒可包含至少一种合成的两部分指导rna和至少一种如上文章节(ii)(a)中描述的rna适体结合蛋白或如下文章节(iv)中描述的编码至少一种rna适体结合蛋白的核酸。在还其它实施方案中,试剂盒可包含至少一种合成的两部分指导rna、至少一种rna适体结合蛋白(或编码核酸)和至少一种如上文章节(ii)(b)中描述的crispr/cas蛋白或编码至少一种crispr/cas蛋白的核酸。
试剂盒可进一步包含转染试剂、细胞生长培养基、选择培养基、体外转录试剂、核酸纯化试剂、蛋白纯化试剂、缓冲液等。本文提供的试剂盒通常包括进行下文详述的方法的说明书。试剂盒中包括的说明书可粘贴在包装材料上,或可作为包装插页包括在内。尽管说明书通常是书写或印刷材料,但它们不限于此。本公开内容考虑了能够储存这样的说明书和将它们传达给终端使用者的任何介质。这样的介质包括但不限于,电子存储介质(例如,磁盘、磁带、盒式磁带、芯片)、光学介质(例如,cdrom)等。如本文使用的,术语“说明书”可包括提供了该说明书的网址。
(iv)核酸
本公开内容的进一步的方面提供了编码本文公开的适体-tracrrna、合成的两部分指导rna、rna适体结合蛋白和/或crispr/cas蛋白的核酸。核酸可以是线性或环状的单链或双链的dna或rna。编码crispr/cas蛋白的核酸可经密码子优化以在目标真核细胞中高效翻译成蛋白。密码子优化程序可作为免费软件或从商业来源获得。
在一些实施方案中,编码适体-tracrrna的核酸可以是dna。编码适体-tracrrna的dna可以可操作连接至被噬菌体rna聚合酶识别的启动子序列用于体外rna合成。例如,启动子序列可以是t7、t3或sp6启动子序列或t7、t3或sp6启动子序列的变异。在其它实施方案中,编码适体-tracrrna的dna可以可操作连接至用于在真核细胞中表达的启动子序列。例如,编码适体-tracrrna的dna可以可操作连接至被rna聚合酶iii(poliii)识别的启动子序列。合适的poliii启动子的实例包括但不限于,哺乳动物u6、u3、h1和7slrna启动子。编码适体-tracrrna的dna可以是载体的一部分,如下文详述的。类似地,编码crrna的dna可以可操作连接至噬菌体启动子序列和/或poliii启动子序列。
在进一步的实施方案中,编码至少一种rna适体结合蛋白和/或crispr/cas蛋白的核酸可以是rna。rna可以是体外酶促合成的。为此,编码rna适体结合蛋白或crispr/cas蛋白的dna可以可操作连接至噬菌体启动子序列,如上文所述。在这样的实施方案中,体外转录的rna可被纯化、加帽和/或多腺苷酸化。
在其它实施方案中,编码rna适体结合蛋白和/或crispr/cas蛋白的rna可以是自主复制rna的一部分(yoshioka等人,cellstemcell,2013,13:246-254)。自主复制rna可衍生自非传染性的、自主复制委内瑞拉马脑炎(vee)病毒rna复制子,其是有义单链rna,该rna能够自主复制,持续有限次数的细胞分裂,并且可被修饰以编码目标蛋白(yoshioka等人,cellstemcell,2013,13:246-254)。
在仍其它实施方案中,编码rna适体结合蛋白和/或crispr/cas蛋白的核酸可以是dna。dna编码序列可以可操作连接至用于在目标细胞中表达的至少一种启动子控制序列。在某些实施方案中,dna编码序列可以可操作连接至启动子序列,用于在细菌(例如,大肠杆菌)细胞或真核(例如,酵母、昆虫或哺乳动物)细胞中表达rna适体结合蛋白或crispr/cas蛋白。合适的细菌启动子包括但不限于,t7启动子、lac操纵子启动子、trp启动子、tac启动子(其是trp和lac启动子的杂合体)、任何前述的变异和任何前述的组合。合适的真核启动子的非限制性实例包括组成型、调节型或细胞或组织特异性启动子。合适的真核组成型启动子控制序列包括但不限于,巨细胞病毒立即早期启动子(cmv)、猿猴病毒(sv40)启动子、腺病毒主要晚期启动子、劳斯肉瘤病毒(rsv)启动子、小鼠乳腺瘤病毒(mmtv)启动子、磷酸甘油酸激酶(pgk)启动子、延伸因子(ed1)-α启动子、遍在蛋白启动子、肌动蛋白启动子、微管蛋白启动子、免疫球蛋白启动子、其片段或任何前述的组合。合适的真核调节型启动子控制序列的实例包括但不限于受热激、金属、类固醇、抗生素或醇调节的那些。组织特异性启动子的非限制性实例包括b29启动子、cd14启动子、cd43启动子、cd45启动子、cd68启动子、结蛋白启动子、弹性蛋白酶-1启动子、内皮糖蛋白启动子、纤连蛋白启动子、flt-1启动子、gfap启动子、gpiib启动子、icam-2启动子、inf-β启动子、mb启动子、nphsi启动子、og-2启动子、sp-b启动子、syn1启动子和wasp启动子。启动子序列可以是野生型,或者它可经修饰以更有效或高效表达。在一些实施方案中,dna编码序列还可连接至多腺苷酸化信号(例如,sv40多聚a信号、牛生长激素(bgh)多聚a信号等)和/或至少一种转录终止序列。在一些情况下,rna适体结合蛋白和/或crispr/cas蛋白可从细菌或真核细胞纯化。
在各种实施方案中,编码适体-tracrrna、rna适体结合蛋白和/或crispr/cas蛋白的核酸可存在于载体中。合适的载体包括质粒载体、病毒载体和自主复制rna(yoshioka等人,cellstemcell,2013,13:246-254)。在一些实施方案中,编码核酸可存在于质粒载体中。合适的质粒载体的非限制性实例包括puc、pbr322、pet、pbluescript和其变体。在其它实施方案中,编码核酸可以是病毒载体(例如,慢病毒载体、腺伴随病毒载体、腺病毒载体等)的一部分。质粒或病毒载体可包含另外的表达控制序列(例如,增强子序列、kozak序列、多腺苷酸化序列、转录终止序列等)、选择标记序列(例如,抗生素抗性基因)、复制起点等。关于载体和其用途的另外信息可见于“currentprotocolsinmolecularbiology”ausubel等人,johnwiley&sons,newyork,2003或“molecularcloning:alaboratorymanual”sambrook&russell,coldspringharborpress,coldspringharbor,ny,第3版,2001。
(v)用于靶向转录调节、靶向表观基因组修饰或靶向基因组修饰的方法
本公开内容的另一方面包括用于靶向转录激活、靶向转录阻抑、靶向表观基因组修饰或靶向基因组修饰的方法,其中所述方法包括向细胞中引入任何一种在上文章节(i)中描述的合成的两部分指导rna、至少一种如上文章节(ii)(a)中定义的rna适体结合蛋白或编码所述至少一种rna适体结合蛋白的核酸和如上文章节(ii)(b)中定义的crispr/cas蛋白或编码所述crispr/cas蛋白的核酸。相对于其中tracrrna不含有rna适体序列的crispr/cas系统,在本文公开的方法中,靶向转录激活、靶向转录阻抑、靶向表观基因组修饰或靶向基因组修饰的效率和/或特异性增加。另外,相对于不含有延伸序列的适体-tracrrna,在其中适体-tracrrna进一步包含延伸序列的实施方案中,靶向转录激活、靶向转录阻抑、靶向表观基因组修饰或靶向基因组修饰的效率增加。
grna将crispr/cas蛋白导向染色体dna中的靶序列。为了实现这一点,crrna与靶染色体序列和tracrrna二者杂交,后者还与crispr/cas蛋白相互作用。此外,至少一种rna适体结合蛋白与tracrrna中的至少一种rna适体序列结合/相互作用,从而允许与rna适体结合蛋白缔合的效应结构域与染色体dna、与染色体dna缔合的蛋白和/或crispr/cas蛋白相互作用。作为这些相互作用的结果,crispr/cas蛋白介导的靶向转录激活、靶向转录阻抑、靶向表观基因组修饰或靶向基因组修饰基因组的有效性和/或特异性增加。
在一些实施方案中,所述方法可经修改用于多路复用应用,其中所述方法进一步包括向真核细胞引入另外的crrna。各crrna具有不同的5’序列(即,其靶向不同的染色体序列),但具有通用的3’序列,使得其可与tracrrna碱基配对。
在其中crispr/cas蛋白是与至少一种转录激活结构域、转录阻抑结构域或表观基因组修饰结构域连接的催化无活性的crispr/cas蛋白的实施方案中,靶染色体序列的转录可被修饰,组蛋白/核小体可被修饰(例如,乙酰化、甲基化、磷酸化、腺苷酸化等)或dna可被修饰(例如,甲基化、去氨基化等)。相对于其中tracrrna不含有rna适体序列的crispr/cas系统(或者不含有延伸序列的适体-tracrrna),这样的修饰的频率和/或效率增加(见实施例)。
在其中crispr/cas蛋白包含核酸酶活性的实施方案中,crispr/cas核酸酶可裂解双链染色体序列的两条链(即,产生双链断裂)。染色体序列的双链断裂可通过非同源末端连接(nhej)修复过程修复。因为nhej是易错的,至少一对碱基对的插入/缺失(即,缺失或插入)、至少一对碱基对的置换或其组合可在修复断裂期间发生。因此,靶向染色体序列可被修饰、突变或失活。例如,编码序列的阅读框中的缺失、插入或置换可导致蛋白产物改变或没有蛋白产物(这被称为“敲除”)。在一些重复中,所述方法可进一步包括向细胞中引入供体多核苷酸(见下文),所述多核苷酸包含侧接与位于靶染色体序列的任一侧的序列具有实质序列同一性的序列的至少一个供体序列,使得在通过同源定向修复过程(hdr)修复双链断裂期间,供体多核苷酸的供体序列可与靶染色体序列的染色体序列交换或整合至靶染色体序列的染色体序列中。外源序列的整合被称为“敲入”。相对于其中tracrrna不含有rna适体序列的crispr/cas系统(或者不含有延伸序列的适体-tracrrna),这样的靶向基因组修饰的频率和/或效率增加。
(a)向细胞中引入
如上文所提及的,所述方法包括向细胞中引入至少一种合成的两部分grna、至少一种rna适体结合蛋白或编码核酸和crispr/cas蛋白或编码核酸。各种分子可通过各种方式引入目标细胞。
在一些实施方案中,细胞可用合适的分子(即,蛋白、dna和/或rna)转染。合适的转染方法包括核转染(或电穿孔)、磷酸钙-介导的转染、阳离子聚合物转染(例如,deae-葡聚糖或聚乙烯亚胺)、病毒转导、病毒颗粒转染、病毒体转染、脂质体转染、阳离子脂质体转染、免疫脂质体转染、非脂质体脂质转染、树枝状聚合物转染、热激转染、磁转染、脂转染、基因枪递送、穿刺转染、声致穿孔、光转染和专有试剂增强的核酸摄取。转染方法是本领域众所周知的(参见例如,“currentprotocolsinmolecularbiology”ausubel等人,johnwiley&sons,newyork,2003或“molecularcloning:alaboratorymanual”sambrook&russell,coldspringharborpress,coldspringharbor,ny,第3版,2001)。在其它实施方案中,分子可通过显微注射引入细胞。例如,分子可注入目标细胞的细胞质或细胞核。引入细胞的各分子的量可改变,但本领域技术人员熟悉用于确定合适的量的方法。
各种分子可同时或序贯引入细胞。例如,编码至少一种rna适体结合蛋白和crispr/cas蛋白的核酸可稳定引入细胞中。或者,所有组分可同时引入。
一般而言,细胞在适合细胞生长和/或维持的条件下维持。合适的细胞培养条件是本领域众所周知的,和描述于例如santiago等人,proc.natl.acad.sci.usa,2008,105:5809-5814;moehle等人proc.natl.acad.sci.usa,2007,104:3055-3060;urnov等人,nature,2005,435:646-651;和lombardo等人,nat.biotechnol.,2007,25:1298-1306。本领域技术人员理解,用于培养细胞的方法是本领域已知的,并且可以和将要根据细胞类型而改变。在所有情况下可使用常规优化以确定对于特定细胞类型的最佳技术。
(b)任选的供体多核苷酸
在其中crispr/cas蛋白具有核酸酶活性的实施方案中,所述方法可进一步包括向细胞引入至少一种供体多核苷酸。供体多核苷酸可以是单链或双链的,线性或环状的,和/或rna或dna。在一些实施方案中,供体多核苷酸可以是载体,例如,质粒载体。
供体多核苷酸包含至少一个供体序列。在一些方面,供体多核苷酸的供体序列可以是内源或天然染色体序列的修饰形式。例如,供体序列可与由dna修饰蛋白靶向的序列中或其附近的一部分染色体序列基本相同,但其包含至少一个核苷酸变化。因此,在与天然序列整合或交换时,靶向染色体位置处的序列包含至少一个核苷酸变化。例如,变化可以是一个或多个核苷酸的插入、一个或多个核苷酸的缺失、一个或多个核苷酸的置换或其组合。作为修饰的序列的“基因修正”整合的结果,细胞可从靶向染色体序列产生修饰的基因产物。
在其它方面,供体多核苷酸的供体序列可以是外源序列。如本文使用的,“外源”序列是指对于细胞不是天然的序列或其天然位置在细胞基因组的不同位置中的序列。例如,外源序列可包含蛋白编码序列,其可以可操作连接至外源启动子控制序列,使得在整合至基因组时细胞能够表达由整合的序列编码的蛋白。或者,外源序列可整合至染色体序列,使得其表达受内源启动子控制序列调节。在其它重复中,外源序列可以是转录控制序列、另一种表达控制序列、rna编码序列等。如上所述,整合外源序列至染色体序列中被称为“敲入”。
如本领域技术人员可理解的,供体序列的长度可以和将要改变。例如,供体序列的长度可从数个核苷酸至几百个核苷酸至几十万个核苷酸改变。
通常,供体多核苷酸中的供体序列侧接上游序列和下游序列,它们与分别位于crispr/cas蛋白靶向的序列的上游和下游的序列具有实质序列同一性。因为这些序列相似性,供体多核苷酸的上游和下游序列允许供体多核苷酸和靶向染色体序列之间的同源重组,使得供体序列可整合至染色体序列(或与其交换)。
如本文使用的上游序列是指与crispr/cas蛋白靶向的序列上游的染色体序列共有实质序列同一性的核酸序列。类似地,下游序列是指与crispr/cas蛋白靶向的序列下游的染色体序列共有实质序列同一性的核酸序列。如本文使用的,短语“实质序列同一性”是指具有至少约75%序列同一性的序列。因此,供体多核苷酸的上游和下游序列可与靶序列上游或下游的序列具有约75%、76%、77%、78%、79%、80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性。在示例性的实施方案中,供体多核苷酸的上游和下游序列可与crispr/cas蛋白靶向的序列上游或下游的染色体序列具有约95%或100%序列同一性。
在一些实施方案中,上游序列与位于紧接crispr/cas蛋白靶向的序列上游的染色体序列共有实质序列同一性。在其它实施方案中,上游序列与位于离靶序列上游约一百(100)个核苷酸内的染色体序列共有实质序列同一性。因此,例如上游序列可与位于离靶序列上游约1至约20、约21至约40、约41至约60、约61至约80或约81至约100个核苷酸的染色体序列共有实质序列同一性。在一些实施方案中,下游序列与位于紧接crispr/cas蛋白靶向的序列下游的染色体序列共有实质序列同一性。在其它实施方案中,下游序列与位于离靶序列下游约一百(100)个核苷酸内的染色体序列共有实质序列同一性。因此,例如下游序列可与位于离靶序列下游约1至约20、约21至约40、约41至约60、约61至约80或约81至约100个核苷酸的染色体序列共有实质序列同一性。
每个上游或下游序列的长度范围可以是约20个核苷酸至约5000个核苷酸。在一些实施方案中,上游和下游序列可包含约50、100、200、300、400、500、600、700、800、900、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400、2500、2600、2800、3000、3200、3400、3600、3800、4000、4200、4400、4600、4800或5000个核苷酸。在特定的实施方案中,上游和下游序列的长度范围可以是约50至约1500个核苷酸。
(c)靶向转录调节、表观基因组修饰或基因组修饰
crrna和靶染色体dna之间、crrna和tracrrna之间、crrna/tracrrna和crispr/cas蛋白之间、rna适体结合蛋白和tracrrna中的rna适体序列之间以及与rna适体结合蛋白连接的效应结构域和靶染色体序列、与靶染色体序列缔合的蛋白和/或crispr/cas蛋白之间的相互作用促进和增加靶向转录调节、靶向表观基因组修饰或靶向基因组修饰的效率。
在各种重复中,相对于其中tracrrna不包含rna适体序列的crispr/cas系统(或者不含有延伸序列的适体-tracrrna),靶向转录激活、靶向转录阻抑、靶向表观基因组修饰或靶向基因组修饰基因组的效率可增加至少约0.1倍、至少约0.5倍、至少约1倍、至少约2倍、至少约5倍、至少约10倍、或至少约20倍、至少约50倍、至少约100倍或超过约100倍。
(d)细胞类型
各种细胞合适用于本文公开的方法。一般而言,细胞是真核细胞。例如,细胞可以是人类哺乳动物细胞、非人类哺乳动物细胞、非哺乳动物脊椎动物细胞、无脊椎动物细胞、昆虫细胞、植物细胞、酵母细胞或单细胞真核生物。在一些实施方案中,细胞还可以是单细胞胚胎。例如,非人类哺乳动物胚胎,包括大鼠、仓鼠、啮鼠动物、兔、猫、犬、绵羊、猪、牛、马和灵长类胚胎。在仍其它实施方案中,细胞可以是干细胞,例如胚胎干细胞、es-样干细胞、胎儿干细胞、成体干细胞等。在一个实施方案中,干细胞不是人类胚胎干细胞。此外,干细胞可包括通过wo2003/046141(其以其整体并入本文)或chung等人(cellstemcell,2008,2:113-117)中公开的技术制备的那些。细胞可以是体外的或体内的(即,在生物内)。在特定的实施方案中,细胞是哺乳动物细胞或哺乳动物细胞系。在具体的实施方案中,细胞是人类细胞或人类细胞系。
合适的哺乳动物细胞或细胞系的非限制性实例包括人类胚胎肾细胞(hek293、hek293t);人类宫颈癌细胞(hela);人类肺细胞(w138);人类肝细胞(hepg2);人类u2-os骨肉瘤细胞、人类a549细胞、人类a-431细胞和人类k562细胞;中国仓鼠卵巢(cho)细胞、幼仓鼠肾(bhk)细胞;小鼠骨髓瘤ns0细胞、小鼠胚胎成纤维细胞3t3细胞(nih3t3)、小鼠b淋巴瘤a20细胞;小鼠黑素瘤b16细胞;小鼠成肌细胞c2c12细胞;小鼠骨髓瘤sp2/0细胞;小鼠胚胎间充质c3h-10t1/2细胞;小鼠癌ct26细胞、小鼠前列腺ducup细胞;小鼠乳腺emt6细胞;小鼠肝癌hepa1c1c7细胞;小鼠骨髓瘤j5582细胞;小鼠上皮mtd-1a细胞;小鼠心肌myend细胞;小鼠肾renca细胞;小鼠胰腺rin-5f细胞;小鼠黑素瘤x64细胞;小鼠淋巴瘤yac-1细胞;大鼠成胶质细胞瘤9l细胞;大鼠b淋巴瘤rbl细胞;大鼠成神经细胞瘤b35细胞;大鼠肝癌细胞(htc);buffalo大鼠肝brl3a细胞;犬肾细胞(mdck);犬乳腺(cmt)细胞;大鼠骨肉瘤d17细胞;大鼠单核细胞/巨噬菌体dh82细胞;猴肾sv-40转化成纤维细胞(cos7)细胞;猴肾cvi-76细胞;非洲绿猴肾(vero-76)细胞。哺乳动物细胞系的广泛列表可见于美国典型培养物保藏中心目录(atcc,manassas,va)。
(vi)用于检测特定基因组基因座的方法
在其中crispr/cas蛋白具有非核酸酶活性的实施方案中,上文详述的方法可经修改用于检测或可视化真核细胞的特定基因组基因座。在这样的实施方案中,crispr/cas蛋白进一步包含至少一种可检测标记。可检测标记可以是荧光团(例如,fam、tmr、cy3、cy5、texasred、oregongreen、alexafluors、halo标签或合适的荧光染料)、纯化标签(例如,生物素、地高辛等)、量子点或金颗粒。本文公开的各种组分之间的相互作用促进和增强特定基因组基因座或靶向染色体序列的检测。
所述方法包括向真核细胞中引入至少一种合成的两部分grna、至少一种rna适体结合蛋白或编码核酸和可检测标记的crispr/cas蛋白或编码核酸,和检测与靶染色体序列结合的标记的crispr/cas。检测可通过动态活细胞成像、荧光显微术、共焦显微术、免疫荧光、免疫检测、rna-蛋白结合、蛋白-蛋白结合等进行。检测步骤可在活细胞或固定细胞中进行。
在其中所述方法包括在活细胞中检测染色质结构动力学的实施方案中,可将各组分作为蛋白或核酸引入细胞。在其中所述方法包括在固定细胞中检测靶向染色体序列的实施方案中,可将各组分作为蛋白(或rna-蛋白复合物)引入细胞。用于固定和渗透细胞的方法是本领域众所周知的。在一些实施方案中,固定细胞可经过化学和/或热变性过程,以将双链染色体dna转化为单链dna。在其它实施方案中,固定细胞不经过化学和/或热变性过程。
在实施方案中,指导rna可进一步包含可检测标记用于原位检测(例如,fish或cish)。可检测标记是本领域已知的。
(vii)应用
本文公开的组合物和方法可用于各种治疗、诊断、工业和研究应用。在一些实施方案中,本公开内容可用于在细胞、动物或植物中调节任何目标染色体序列的转录或修饰/编辑任何目标染色体序列,以建造基因功能模型和/或研究基因功能,研究目标遗传或表观遗传条件或研究参与各种疾病或病症的生物化学途径。例如,可产生建造疾病或病症模型的转基因生物,其中与疾病或病症有关的一种或多种核酸序列的表达被改变。疾病模型可用于研究突变对生物的影响,研究疾病的发展和/或进展,研究药学活性化合物对疾病的影响和/或评价潜在基因治疗策略的功效。
在其它实施方案中,所述组合物和方法可用于进行高效和成本有效的功能基因组筛选,其可用于研究参与特定生物学过程的基因的功能和基因表达的任何变化可如何影响该生物学过程,或结合细胞表型进行基因组基因座的饱和或深度扫描诱变。饱和或深度扫描诱变可用于确定对于例如基因表达、耐药性和疾病逆转所需的功能元件的关键最小特征和离散脆弱性。
在进一步的实施方案中,本文公开的组合物和方法可用于诊断测试,以确定疾病或病症的存在,和/或用于确定治疗选择。合适的诊断测试的实例包括检测癌细胞中的特定突变(例如,egfr、her2等中的特定突变)、检测与特定疾病有关的特定突变(例如,三核苷酸重复、与镰状细胞疾病有关的β-珠蛋白的突变、特定snp等)、检测肝炎、检测病毒(例如,zika)等。
在另外的实施方案中,本文公开的组合物和方法可用于纠正与特定疾病或病症有关的遗传突变,例如纠正与镰状细胞疾病或地中海贫血有关的珠蛋白基因突变,纠正与重度联合免疫缺陷(scid)有关的腺苷脱氨酶基因的突变,减少htt(亨廷顿病的致病基因)的表达,或纠正视紫红质基因的突变用于治疗色素性视网膜炎。这样的修饰可离体在细胞中进行。
在仍其它实施方案中,本文公开的组合物和方法可用于产生具有性状改进或对环境应激的抗性增加的农作物。本公开内容还可用于产生具有性状改进的家畜或生产动物。例如,猪具有许多使它们作为生物医学模型而具有吸引力(特别是在再生医学或异种移植方面)的特征。
列举的实施方案
提供以下列举的实施方案以说明本发明的某些方面,并且不意图限制其范围。
1.合成的两部分指导rna(grna),其包含(a)成簇的规律间隔的短回文重复序列(crispr)rna(crrna)和(b)反式作用crrna(tracrrna),其中crrna包含与染色体dna中的靶序列互补的5’序列和能够与tracrrna的一部分碱基配对的3’序列;和tracrrna包含5’四环和至少一个茎-环,其中5’四环和/或至少一个茎-环经修饰以含有至少一个形成发夹的rna适体序列。
2.列举1的合成的两部分grna,其中至少一个形成发夹的rna适体序列是ms2序列、pp7序列、com序列、盒b序列、组蛋白mrna3’序列、富含au的元件(are)序列或其变体。
3.列举1或2的合成的两部分grna,其中至少一个形成发夹的rna适体序列位于tracrrna的5’四环、至少一个茎-环和/或3’末端中。
4.列举3的合成的两部分grna,其中tracrrna包含茎-环1、茎-环2和茎-环3,和至少一个形成发夹的rna适体位于5’四环和/或茎-环2中。
5.列举4的合成的两部分grna,其中5’四环和/或茎-环2进一步包含延伸序列。
6.列举5的合成的两部分grna,其中延伸序列包含约2个核苷酸至约30个核苷酸。
7.列举5或6的合成的两部分grna,其中crrna进一步包含能够与tracrrna的5’四环中的延伸序列或5’四环中的延伸序列的一部分碱基配对的序列。
8.列举1-7中任一项的合成的两部分grna,其中crrna是化学合成的。
9.列举1-7中任一项的合成的两部分grna,其中tracrrna是体外酶促合成的。
10.编码列举1-6中任一项的tracrrna的核酸。
11.列举9的核酸,其可操作连接至被噬菌体rna聚合酶识别的启动子序列用于体外rna合成。
12.列举9或10的核酸,其是载体的一部分。
13.试剂盒,其包含列举1-6中任一项定义的tracrrna或列举10-12中任一项定义的核酸。
14.列举13的试剂盒,其进一步包含至少一种列举1、7或8中任一项定义的crrna。
15.列举13或14的试剂盒,其中至少一种crrna包含crrna的库。
16.列举13-15中任一项的试剂盒,其进一步包含与至少一种功能结构域缔合的至少一种rna适体结合蛋白或编码与至少一种功能结构域缔合的至少一种rna适体结合蛋白的核酸。
17.列举16的试剂盒,其中所述rna适体结合蛋白是mcp、pcp、com、n22、slbp或fxr1,和所述至少一种功能结构域是转录激活结构域、转录阻抑结构域、表观遗传修饰结构域、标记结构域或其组合。
18.列举17的试剂盒,其中所述转录激活结构域是vp16激活结构域、vp64激活结构域、vp160激活结构域、来自nfκb的p65激活结构域、热激因子1(hsf1)激活结构域、myod1激活结构域、gcn4肽、病毒r反式激活因子(rta)、53激活结构域、camp反应元件结合蛋白(creb)激活结构域、e2a激活结构域或活化t细胞核因子(nfat)激活结构域。
19.列举17的试剂盒,其中所述转录阻抑结构域是kruppel-关联盒(krab)阻抑结构域、诱导型camp早期阻抑(icer)结构域、yy1富甘氨酸阻抑结构域、sp1-样阻抑结构域、e(spl)阻抑结构域、iκb阻抑结构域或甲基-cpg结合蛋白2(mecp2)阻抑结构域。
20.列举17的试剂盒,其中所述表观遗传修饰结构域具有乙酰基转移酶活性、去乙酰基酶活性、甲基转移酶活性、去甲基酶活性、激酶活性、磷酸酶活性、氨基化活性、去氨基化活性、遍在蛋白连接酶活性、去遍在蛋白化活性、腺苷酸化活性、去腺苷酸化活性、sumo化活性、去sumo化活性、核糖基化活性、去核糖基化活性、豆蔻酰化活性、去豆蔻酰化活性、瓜氨酸化活性、烷基化活性、去烷基化活性、解旋酶活性、氧化活性或核小体相互作用活性。
21.列举20的试剂盒,其中所述表观遗传修饰结构域是p300组蛋白乙酰基转移酶、激活诱导的胞苷脱氨酶(aid)、apobec胞苷脱氨酶或tet甲基胞嘧啶双加氧酶。
22.列举17的试剂盒,其中所述标记结构域是荧光蛋白、纯化标签或表位标签。
23.列举13-22中任一项的试剂盒,其进一步包含crispr/cas蛋白或编码crispr/cas蛋白的核酸。
24.列举23的试剂盒,其中所述crispr/cas蛋白具有核酸酶活性或所述crispr/cas蛋白具有非核酸酶活性。
25.列举24的试剂盒,其中具有核酸酶活性的crispr/cas蛋白是crispr/cas核酸酶或与非crispr/cas核酸酶结构域连接的催化无活性的crispr/cas蛋白。
26.列举24的试剂盒,其中具有非核酸酶活性的crispr/cas蛋白是与非核酸酶结构域连接的催化无活性的crispr/cas蛋白。
27.列举26的试剂盒,其中所述非核酸酶结构域是转录激活结构域、转录阻抑结构域或表观遗传修饰结构域。
28.列举27的试剂盒,其中所述转录激活结构域是vp16激活结构域、vp64激活结构域、vp160激活结构域、nfκbp65激活结构域、热激因子1(hsf1)激活结构域、myod1激活结构域、gcn4肽、病毒r反式激活因子(rta)、53激活结构域、camp反应元件结合蛋白(creb)激活结构域、e2a激活结构域或活化t细胞核因子(nfat)激活结构域。
29.列举27的试剂盒,其中所述转录阻抑结构域是kruppel-关联盒(krab)阻抑结构域、yy1富甘氨酸阻抑结构域、sp1-样阻抑结构域、e(spl)阻抑结构域、iκb阻抑结构域或甲基-cpg结合蛋白2(mecp2)阻抑结构域。
30.列举27的试剂盒,其中所述表观遗传修饰结构域具有乙酰基转移酶活性、去乙酰基酶活性、甲基转移酶活性、去甲基酶活性、激酶活性、磷酸酶活性、氨基化活性、去氨基化活性、遍在蛋白连接酶活性、去遍在蛋白化活性、腺苷酸化活性、去腺苷酸化活性、sumo化活性、去sumo化活性、核糖基化活性、去核糖基化活性、豆蔻酰化活性、去豆蔻酰化活性、瓜氨酸化活性、烷基化活性、去烷基化活性、解旋酶活性、氧化活性或核小体相互作用活性。
31.列举30的试剂盒,其中所述表观遗传修饰结构域是p300组蛋白乙酰基转移酶、激活诱导的胞苷脱氨酶(aid)、apobec胞苷脱氨酶或tet甲基胞嘧啶双加氧酶。
32.列举23-31中任一项的试剂盒,其中所述crispr/cas蛋白是ii型crispr/cas核酸酶或v型crispr/cas核酸酶。
33.列举23-32中任一项的试剂盒,其中所述crispr/cas蛋白进一步包含至少一种核定位信号、至少一种细胞穿透肽、至少一种标记结构域或其组合。
34.组合物,其包含(a)如列举1-9中任一项定义的合成的两部分grna;(b)至少一种如列举16-22中任一项定义的rna适体结合蛋白;和(c)如列举23-33中任一项定义的crispr/cas蛋白。
35.用于在真核细胞中靶向转录激活、靶向转录阻抑、靶向表观基因组修饰、靶向基因组修饰或靶向基因组基因座可视化的方法,所述方法包括向细胞中引入(a)如列举1-9中任一项定义的合成的两部分grna;(b)至少一种如列举16-22中任一项定义的rna适体结合蛋白;和(c)至少一种如列举23-33中任一项定义的crispr/cas蛋白。
36.列举35的方法,其中相对于其中grna不含有rna适体序列的crispr/cas系统,(a)、(b)和(c)的组合具有增加的效率和/或特异性。
37.列举35或36的方法,其中所述方法进一步包括引入一种或多种另外的crrna,每种另外的crrna包含不同的5’序列但包含通用的3’序列。
38.列举35-37中任一项的方法,其中所述crispr/cas蛋白具有核酸酶活性,和所述方法进一步包括向真核细胞中引入包含至少一个供体序列的供体多核苷酸。
39.列举35-38中任一项的方法,其中所述真核细胞在体外。
40.列举35-38中任一项的方法,其中所述真核细胞在体内。
41.列举35-40中任一项的方法,其中所述真核细胞是哺乳动物细胞。
定义
除非另外定义,本文使用的所有技术和科学术语具有本发明所属领域的技术人员通常理解的含义。以下参考文献向技术人员提供了本发明中使用的许多术语的一般定义:singleton等人,dictionaryofmicrobiologyandmolecularbiology(2nded.1994);thecambridgedictionaryofscienceandtechnology(walkered.,1988);theglossaryofgenetics,5thed.,r.rieger等人(eds.),springerverlag(1991);和hale&marham,theharpercollinsdictionaryofbiology(1991)。如本文使用的,以下术语具有归因于它们的含义,除非另外指明。
当引入本公开内容或其优选实施方案的要素时,冠词“一”、“一个”、“该”和“所述"意图指存在一个或多个要素。术语“包含”、“包括”和“具有”意图是包括性的,并意指可存在所列要素之外的其它要素。
术语“约”当关于数值x使用时,例如意指x±5%。
如本文使用的,术语“互补的”或“互补性”是指双链核酸通过经由特定氢键的碱基配对的缔合。碱基配对可以是标准watson-crick碱基配对(例如,5’-agtc-3’与互补的序列3’-tcag-5’配对)。碱基配对也可以是hoogsteen或反向hoogsteen氢键合。互补性通常关于双链体区域测量,因此不包括例如突出物。双链体区域的两条链之间的互补性可以是部分的,和如果仅一些(例如,70%)碱基是互补的,则表示为百分比(例如,70%)。不互补的碱基是“错配的”。如果双链体区域中的所有碱基是互补的,互补性也可以是完全的(即,100%)。
如本文使用的,术语“crispr/cas系统”是指包含crispr/cas蛋白(即,核酸酶、切口酶或催化死蛋白)和指导rna的复合物。
如本文使用的术语“内源序列”是指对于细胞是天然的染色体序列。
如本文使用的,术语“外源”是指对于细胞不是天然的序列,或其在细胞的基因组中的天然位置在不同的染色体位置中的染色体序列。
如本文使用的“基因”是指编码基因产物的dna区域(包括外显子和内含子),以及调节基因产物的产生的所有dna区域,无论这样的调节序列是否邻近编码和/或转录的序列。因此,基因包括但不一定限于启动子序列、终止子、翻译调节序列例如核糖体结合位点和内部核糖体进入位点、增强子、沉默基因、绝缘子、边界元件、复制起点、基质附着点和基因座控制区。
术语“异源”是指对于目标细胞不是内源或天然的实体。例如,异源的蛋白是指衍生自或初始衍生自外源来源(例如外源引入的核酸序列)的蛋白。在一些情况下,异源的蛋白通常不由目标细胞产生。
术语“切口酶”是指裂解双链核酸序列的一条链(即,使双链序列产生缺口)的酶。例如,具有双链裂解活性的核酸酶可通过突变和/或缺失进行修饰以作为切口酶起作用,和仅裂解双链序列的一条链。
如本文使用的术语“核酸酶”是指裂解双链核酸序列的两条链的酶。
术语“核酸”和“多核苷酸”是指呈线性或环状构象和呈单链或双链形式的脱氧核糖核苷酸或核糖核苷酸聚合物。为本公开内容的目的,这些术语不应解释为在聚合物长度方面进行限制。该术语可包括天然核苷酸的已知类似物以及在碱基、糖和/或磷酸酯部分中进行修饰的核苷酸(例如,硫代磷酸酯主链)。一般而言,特定核苷酸的类似物具有相同的碱基配对特异性;即,a的类似物将与t碱基配对。
术语“核苷酸”是指脱氧核糖核苷酸或核糖核苷酸。核苷酸可以是标准核苷酸(即,腺苷、鸟苷、胞苷、胸苷和尿苷)、核苷酸异构体或核苷酸类似物。核苷酸类似物是指具有修饰的嘌呤或嘧啶碱基或修饰的核糖部分的核苷酸。核苷酸类似物可以是天然存在的核苷酸(例如,肌苷、假尿苷等)或非天然存在的核苷酸。核苷酸的糖或碱基部分上的修饰的非限制性实例包括添加(或去除)乙酰基、氨基、羧基、羧甲基、羟基、甲基、磷酰基和硫醇基以及用其它原子置换碱基的碳和氮原子(例如,7-脱氮杂嘌呤)。核苷酸类似物还包括二脱氧核苷酸、2’-o-甲基核苷酸、锁核酸(lna)、肽核酸(pna)和吗啉代物。
术语“多肽”和“蛋白”可互换地用于指氨基酸残基的聚合物。
术语“靶序列”、“靶染色体序列”和“靶位点”可互换地用于指crispr/cas蛋白所靶向的染色体dna中的特定序列,和其中crispr/cas蛋白介导其活性的位点。
用于确定核酸和氨基酸序列同一性的技术是本领域已知的。通常,这样的技术包括确定基因的mrna的核苷酸序列和/或确定由其编码的氨基酸序列,和将这些序列与第二核苷酸或氨基酸序列比较。也可以此方式确定和比较基因组序列。一般而言,同一性是指两个多核苷酸或多肽序列分别的核苷酸与核苷酸或氨基酸与氨基酸的准确对应性。两个或更多个序列(多核苷酸或氨基酸)可通过确定它们的百分比同一性来比较。两个序列(无论是核酸还是氨基酸序列)的百分比同一性是两个比对序列之间准确匹配的数量除以较短序列的长度并乘以100。smith和waterman,advancesinappliedmathematics2:482-489(1981)的局部同源性算法提供了核酸序列的近似比对。该算法可通过使用由dayhoff,atlasofproteinsequencesandstructure,m.o.dayhoffed.,5suppl.3:353-358,nationalbiomedicalresearchfoundation,washington,d.c.,usa开发和由gribskov,nucl.acidsres.14(6):6745-6763(1986)标准化的评分矩阵应用于氨基酸序列。该算法确定序列的百分比同一性的示例性执行由geneticscomputergroup(madison,wis.)在“bestfit”实用应用程序中提供。用于计算序列之间的百分比同一性或类似性的其它合适的程序是本领域通常已知的,例如,另一种算法程序是以默认参数使用的blast。例如,使用以下默认参数,可使用blastn和blastp:遗传密码=标准;滤器=无;链=2;截止值=60;期望值=10;矩阵=blosum62;描述=50个序列;排序方式=高评分;数据库=非冗余的genbank+embl+ddbj+pdb+genbankcds翻译+swiss蛋白+spupdate+pir。这些程序的细节可见于genbank网站。
因为在不脱离本发明的范围的情况下在上述细胞和方法中可进行各种变化,因此预期在上文的描述和下文提供的实施例中含有的所有内容应被解释为说明性的,而不应以限制意义解释。
实施例
以下实施例说明了本公开内容的某些方面。
实施例1.两部分指导rna的设计和合成
本文公开的两部分grna含有一种crrna,其是靶标特异性的;和一种适体-tracrrna,其包含通用序列。对于spcas9的典型的两部分grna的序列和二级结构(设计#1)显示于图1。ms2茎-环序列(各自34nt)已经插入在四环和茎-环2中。延伸序列(下划线)已经插入在四环中。crrna含有20nt的单独间隔区(靶标特异性的)序列。表1提供了这种和数种其它两部分grna设计的序列(四环延伸序列用下划线表示)。crrna是化学合成的,和适体-tracrrna是体外酶促合成的。
实施例2.用两部分指导rnagrna的靶向基因激活
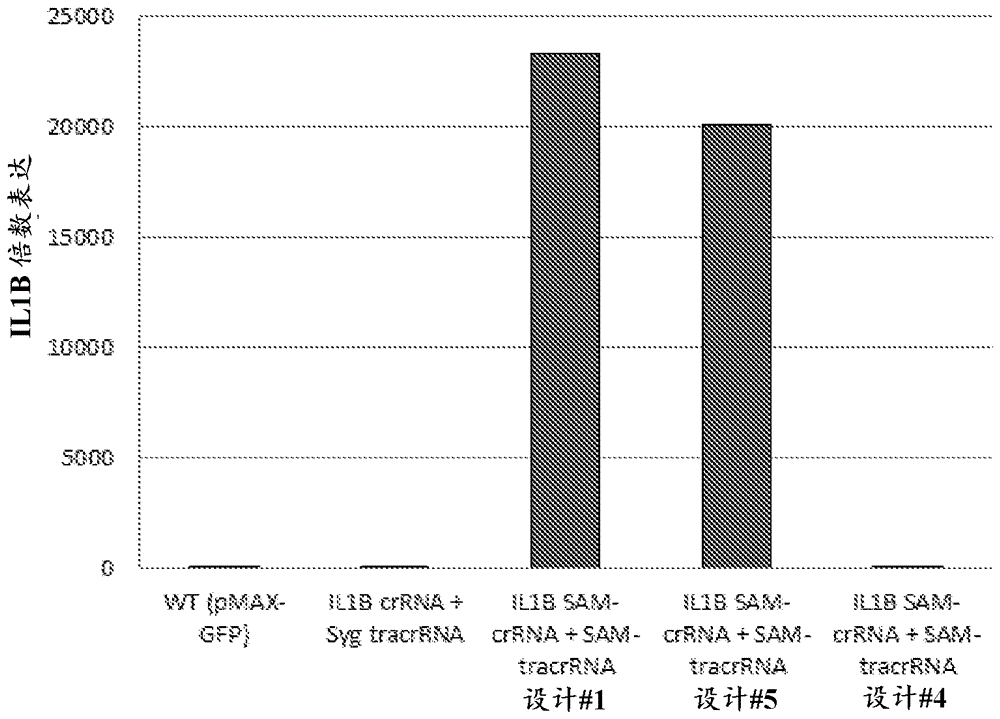
测试上文实施例1中描述的数种两部分grna对人类pou5f1和il1b基因的激活。测试的那些两部分grna为设计#1(含有延伸的四环序列)、设计#5(含有更长的延伸的四环序列)和设计#4(不含有延伸的四环序列)。对照crrna+tracrrna(syg)不含有适体序列。已知pou5f1和il1b两个基因在hek293(人类胚胎肾)细胞中下调或不表达。稳定的hek293细胞系使用慢病毒介导的vp64-dcas9和ms2-hsf1-p65插入产生。在12孔组织培养板中使用3µl的转染试剂,用100pmol两部分grna/150,000个细胞转染细胞。将对于pou5f1的靶序列(ggaaaaccgggagacacaac;seqidno:48)或对于il1b的靶序列(aaaggggaaaagagtattgg;seqidno:49)包括在合成的crrna中,和以1:1摩尔比与合成的tracrrna在10mmtrisph7.5和0.1mmedta中在95℃下复合2分钟,和以0.5℃/秒冷却至12℃。
通过收获总rna和使用taqman探针(hs003005111_m1、hs00174097_m1)进行多路复用定量rt-pcr(qrt-pcr),测定基因表达。将表达标准化至持家基因ppia的表达。通过用pmax-gfpdna转染细胞获得阴性对照。与不含有适体修饰的对照crrna+tracrrna比较靶标的激活。
如图2a和2b所示,相对于阴性对照,两部分指导rna设计#1和设计#5(均含有适体和延伸的四环序列)能够在pou5f1(图2a)和il1b(图2b)二者上均显著促进转录激活。显著地,两部分指导rna设计#4(含有适体序列,但没有延伸的四环序列)导致差的靶标激活或不导致靶标激活。这些数据表明如设计#1或#5中的延伸的四环是关键的。
- 还没有人留言评论。精彩留言会获得点赞!