脂肪酸的糖苷化合物,包含其的组合物,其获得方法以及将其施加于植物或果实上或者同时施加于二者上的方法与流程
本发明涉及脂肪酸的糖苷化合物,包含其的组合物,其获得方法以及用于将其施加于植物或果实或者同时施加于二者的方法,其中所述脂肪酸的糖苷化合物具有通式:galnac-galnac-glc-o-r,其中galnac是α-或β-d-n-乙酰半乳糖胺,
glc-o-r是与单不饱和脂肪酸(r)酯化的α-或β-d-葡萄糖分子,其中r选自:12:1(n),并且其中n是2至11的整数;11:1(n),并且其中n是2至10的整数;10:1(n),并且其中n是2至9的整数;9:1(n),并且其中n是2至8的整数;8:1(n),并且其中n是2至8的整数;7:1(n),并且其中n是2至7的整数;以及6:1(n),并且其中n是2至6的整数。该化合物具有针对植物病原体的活性,并诱导植物防御以及促进植物生长。
背景技术:
由细菌引起的植物病害很难防治,在农业生产中,几乎没有可用于治疗细菌病害的产品。用于处理细菌感染的少数商业替代品之一是铜,其已在农业中用作叶的治疗持续数个世纪,以保护植物免受真菌性和细菌性病害的侵害。然而,当在杀菌水平上系统地使用时,铜是有毒的,因此,它不被认为是在大规模中的有效治疗或可取治疗。
被发现提供对细菌性病害的防治的第二类杀菌剂是抗生素。被标记为用于农业中的两种主要的抗生素是硫酸链霉素和土霉素。自1950年代以来,这些产品已在植物上使用,但它们在人和动物医学中也很重要,因此,这些抗生素的全部国内使用的仅一小部分(百分之一)用于农业(http://www.nass.usda.gov,美国政府问责局(unitedstatesgovernmentaccountabilityoffice)(2011))。链霉素是优选的杀菌剂,因为它通过接触而杀伤细菌(杀菌剂),而土霉素具有抑菌作用并抑制细菌生长。抑菌性杀菌剂需要更长的暴露时间才能充分抑制生长,从而降低细菌效价。
在每一种农业中,植物病原真菌在世界各地的不同的作物中造成数百万美元的毁灭性的损失。因此,合成杀真菌剂的广泛施加已被用于防治植物病原真菌,但是数十年来重复使用这些杀真菌剂已经改变了天然生物系统,并且有时导致了真菌的抗性的发展。此外,许多这些农药产品对不是目标的生物产生了不期望的影响,并引起了对环境和人的健康的忧虑。
因此,考虑到上述情况,寻求对环境和健康更友好的作物保护替代品是发展更加可持续的农业生产的当务之急。最有前途的策略之一是植物免疫的触发剂、激发子(elicitor)、诱导剂或生物防治剂,它们是基于天然来源(微生物或植物)的物质(分子)配制的,这些物质(分子)使得植物提高其自身对危害其的致病生物体的防御水平。
一般而言,已知这些防御诱导剂分子在植物中开始信号传导过程,这导致一系列阻止或延迟病原体微生物进展的生化响应的激活(bonas和lahaye,curr.opin.microbiol.(2002)5:44-50)。在生物产品或诱导剂生物输入的优点中,可被列举出的是:它们是生物可降解的,对真菌和细菌具有广谱的作用,对人而言几乎没有毒性,产生抗性的可能性低,并且除此之外通常生产成本低(nürnberger和brunner,curr.opin.plantbiol.(2002)5:318-24)。
已知某些真菌来源的糖脂具有抗微生物活性,例如在文章microbiologicalresearch168(2013)22-32中。还已知具有抗微生物活性的槐糖脂(sophorolipid)(j.microbiol.biotechnol.(2002),12(2),235-241)以及从真菌中分离的具有抗微生物活性的糖脂(africanjournalofmicrobiologyresearchvol.5(17),pp.2512-2523,9september,2011)。还公开了对植物的水分胁迫(hydricstress)发挥作用的海藻糖的糖脂(cn105831159)和用于控制天然酵母的糖脂,例如酵母的甘露糖赤藓糖醇酯(mel)和甘露糖甘露糖醇脂(mml)(jp2010215593)。还已知赋予植物以对胁迫的耐受性的脂肪酸酯、糖醇的脂肪酸酯和alcalil糖苷(us2011/0100079)。
技术实现要素:
定义:术语fl或fls是根据本发明的化合物。
提供了包含以下通式的脂肪酸的糖苷化合物:
galnac-galnac-glc-o-r,其中galnac是α-或β-d-n-乙酰半乳糖胺,glc-o-r是与单不饱和脂肪酸(r)酯化的α-或β-d-葡萄糖分子,其中r选自:12:1(n),并且其中n是2至11的整数;11:1(n),并且其中n是2至10的整数;10:1(n),并且其中n是2至9的整数;9:1(n),并且其中n是2至8的整数;8:1(n),并且其中n是2至8的整数;7:1(n),并且其中n是2至7的整数;以及6:1(n),并且其中n是2至6的整数。考虑以下通式中每个键的构型:galnac-(a→b)galnac-(c→d)glc-(e)-o-ra可以是1、3、4或6;b可以是1、3、4或6;当b=1时c可以是3、4或6;当b=3时,c可以是1、4或6;当b=4时,c可以是1、3或6;当b=6时,c可以是1、3或4;当e=1时,d可以是2、3、4或6;当e=2时,d可以是1、3、4或6;当e=3时,d可以是1、2、4或6;当e=4时,d可以是1、2、3或6;当e=6时,d可以是1、2、3或4。
提供了用于促进植物生长的组合物,所述组合物包含具有以下通式的脂肪酸糖苷以及辅助剂:
galnac-galnac-glc-o-r,其中galnac是α-或β-d-n-乙酰半乳糖胺,glc-o-r是与单不饱和脂肪酸(r)酯化的α-或β-d-葡萄糖分子,其中r选自:12:1(n),并且其中n是2至11的整数;11:1(n),并且其中n是2至10的整数;10:1(n),并且其中n是2至9的整数;9:1(n),并且其中n是2至8的整数;8:1(n),并且其中n是2至8的整数;7:1(n),并且其中n是2至7的整数;以及6:1(n),并且其中n是2至6的整数。在一个优选的实施方案中,辅助剂是壬基酚乙氧基化物或甲基化植物油或同时它们二者。在一个优选的实施方案中,所述组合物具有浓度为0.16μg/ml至50μg/ml的脂肪酸糖苷,浓度为0.013%至0.07%的壬基酚乙氧基化物化合物或浓度为0.15%至1.16%的甲基化植物油或者同时具有两者的浓度。
提供了上述化合物的提取和获得方法,该方法包括以下步骤:
a.在搅拌下使植物组织接触酸性介质;
b.对前一步骤中获得的提取物进行离心;
c.通过制备色谱法分成级分;
d.将回收的级分浓缩并通过色谱法纯化。
在一个优选的实施方案中,植物属于蔷薇科(rosaceae)。
提供了通过使用上述化合物用于预防植物中的病原体感染的方法,该方法包括施加浓度为0.03μg/ml至400μg/ml的所述化合物,其中施加通过喷淋(spraying)或浸渍(immersion)进行或者通过二者同时进行。在一个优选的实施方案中,病原体可以是带化红球菌(rhodococcusfascians)、密执安棒状杆菌(clavibactermichiganensis)、草莓黄单胞菌(xanthomonasfragariae)、炭疽菌属(colletotrichumspp)、指状青霉菌(penicillumdigitatum)、绿黄假单胞菌(pseudomonasviridiflava)、密执安棒状杆菌(c.michiganensis)、燕麦食酸菌(acidovoraxavenae)、绿黄假单胞菌、柠檬黄单胞菌(xanthomonascitri)、多主棒孢菌(corynesporacassiicola)和灰葡萄孢菌(botrytiscinerea),并且植物可以是大豆、草莓、柠檬树、甘蔗或拟南芥(a.thaliana)。
提供了通过使用上述化合物用于治疗被病原体感染的植物的方法,该方法包括将浓度为20μg/ml至400μg/ml的所述化合物施加于植物,其中所述施加可通过喷淋或浸渍进行。在一个优选的实施方案中,病原体可以是带化红球菌、密执安棒状杆菌、草莓黄单胞菌、炭疽菌属、指状青霉菌、绿黄假单胞菌、密执安棒状杆菌、燕麦食酸菌、绿黄假单胞菌、柠檬黄单胞菌、多主棒孢菌和灰葡萄孢菌,并且植物可以是大豆、草莓、柠檬树、甘蔗或拟南芥。
提供了通过使用上述化合物用于在植物中诱导防御的方法,所述方法包括将浓度为0.03μg/ml至100μg/ml的所述化合物施加至植物。
提供了通过使用上述化合物以促进植物生长的方法,所述方法包括将浓度为0.16μg/ml至50μg/ml的所述化合物施加至植物。在一个优选的实施方案中,植物是大豆、草莓或甘蔗。
附图说明
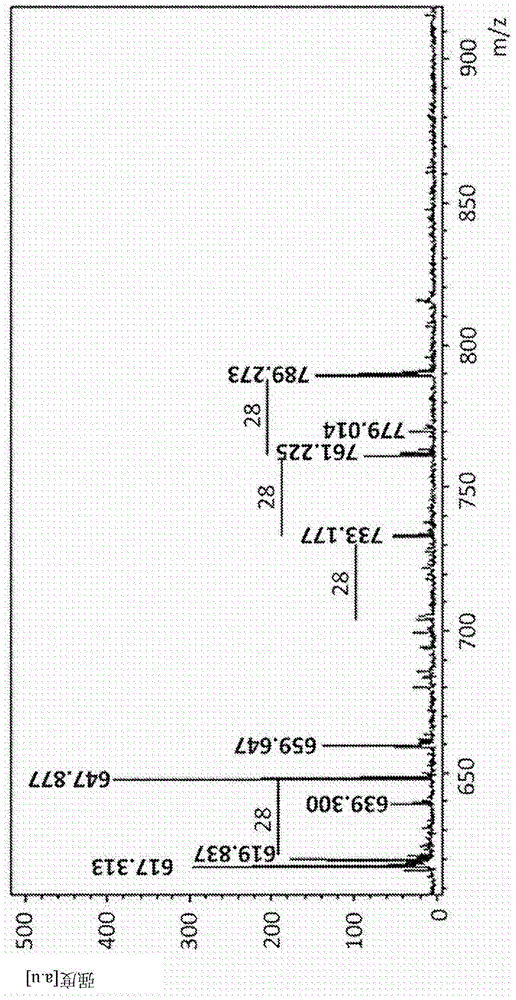
图1示出了基质辅助的解吸/电离-飞行时间(maldi-tof)质谱的分析图。通过使用正离子和反射(reflectron)模式的2.5-二羟基苯甲酸(dhb)基质分析fl。
图2以图的形式示出了fl的组成。通过fl酸性水解作用释放的中性单糖和氨基糖的hpaec-pad对其进行鉴定。d-半乳糖胺(galnh2)和d-葡萄糖(glc)是fl分子中的主要单糖。
图3示出了针对fl提出的化学结构,fl是包含两个n-乙酰半乳糖胺分子的脂肪酸糖苷,所述n-乙酰半乳糖胺分子与单个葡萄糖分子键合,所述单个葡萄糖分子与6至12个碳原子的单不饱和脂肪酸(r)酯化。
图4在图上示出了细菌膜的渗透性。示出了化合物disc3(5)从用60μg/mlfl(正方形)、1.0μm缬氨霉素(圆圈)和无菌水(三角形)处理的细胞中的释放。
图5在图上示出了fl(0至90μg/ml)对密执安棒状杆菌膜通透性的剂量依赖性作用。其示出了化合物disc3(5)从用不同浓度的fl处理的细胞中的释放。
图6以图形方式示出了用fl(0.1mg/ml)的预处理对用灰葡萄孢菌和指状青霉菌接种的草莓植物的果实的作用。病害发病率(具有症状的果实的%)和病害的严重程度等级(severityrate)(1:无症状;2:每个果实1%至25%的受影响面积;3:每个果实26%至50%的受影响面积;4:每个果实多于50%的受影响面积),蒸馏水作为阴性对照,并且4%的次氯酸钠作为阳性对照。
图7以图形方式示出了用fl(0.1mg/ml)的处理对用灰葡萄孢菌和指状青霉菌预先接种的草莓植物的果实的作用。
病害发病率(有症状的果实的%)和病害的严重程度等级(1:无症状;2:每个果实1%至25%的受影响面积;3:每个果实26%至50%的受影响面积;4:每个果实多于50%的受影响面积),蒸馏水作为阴性对照,并且4%的次氯酸钠作为阳性对照。
图8以图形方式示出了用fl(0.1mg/ml或0.2mg/ml)的预处理对用灰葡萄孢菌和指状青霉菌接种的柠檬的果实的作用。病害发病率(具有症状的果实的%)和病害的严重程度等级(0:无症状;1:每个果实1%至25%的受影响面积;2:每个果实26%至50%的受影响面积;3:每个果实51%至75%的受影响面积;4:每个果实76%至100%的受影响面积),蒸馏水作为感染对照,fl(0.1和0.2g/ml)或商用杀真菌剂抑霉唑(imazalil)(500ppm)。
图9在图上示出了对用病原体尖孢炭疽菌(colletotrichumacutatum)接种的草莓植物的诱导抗性试验(ir)的结果。用0.03μg/ml的fl、水(阴性对照)或已知的防御诱导剂(包括水杨酸(sa5mm)和阿拉酸式苯-s-甲基(acibenzolar-s-methyl,bth1mm))喷淋植物。预处理之后5天,用真菌尖孢炭疽菌(c.acutatum)的强毒株接种植物。在每种处理的植物的叶柄上确定病害严重程度指数(值为1至5,对应于不断提高的严重程度的等级)。
图10示出了对具有病原体绿黄假单胞菌alb8的拟南芥(arabidopsisthaliana)植物的ir测试的结果,所述植物先前用水(阴性对照)、het(57μg/ml)或fl(10μg/ml)处理。细菌生长以每克叶重的菌落形成单位的对数(logufc/gpf)表示。未用细菌接种的植物用作细菌计数的阴性对照。
图11示出了对具有致病性真菌灰葡萄孢菌bmm的拟南芥的ir测试的结果。病害严重程度以用fl(10μg/ml)、het(57μg/ml)或水(阴性对照)预处理的受感染拟南芥植物叶上的叶-病斑(lesion)直径的平均值进行确定。
图12示出了对用病原真菌多主棒孢菌接种的大豆植物的ir测试的结果。参照用水(阴性对照)预处理的对照植物,病害严重程度以audpc(病害进展曲线下面积)表示。在病原体接种之前3天,用fl(0.1mg/ml)或商用杀真菌剂opera(5ml/l)处理大豆植物,在病原体接种后第4、7和10天进行评估。(*)表示相对于阴性对照的显著差异。
图13示出了在受控生长条件下对进行处理并随后用灰葡萄孢菌和指状青霉菌接种的草莓果实的ir测试的结果。评估病害发病率(有症状果实的%)和病害严重程度等级(1:无症状;2:每个果实1%至25%的受影响面积;3:每个果实26%至50%的受影响面积;4:每个果实多于50%的受影响面积)。将消毒后的草莓浸入到蒸馏水(阴性对照)或者病原体-生长亚抑制浓度的fl(0.01mg/ml)或het(0.8mg/ml)的溶液中。作为阳性的杀生物剂对照,使用了4%的次氯酸钠溶液。
图14示出了针对采后病害的草莓果实的ir测试的结果。
评估由田间起源的天然病原体造成的病害发病率(有症状果实的%)和病害严重程度等级(1:无症状;2:每个果实1%至25%的受影响面积;3:每个果实26%至50%的受影响面积;4:每个果实多于50%的受影响面积)。评估了用蒸馏水(阴性对照)或fl(0.01mg/ml)或het(0.8mg/thml)或商用生物杀真菌剂gluticid(3mg/ml)预处理的草莓植物的果实。
图15示出了拟南芥植物叶中超氧化物自由基产生的照片。用nbt的染色表明超氧化物自由基的积累,其被视为黑点(紫色)。用蒸馏水(阴性对照)或fl(0.01mg/ml)处理植物。在处理之后0、2、4和6小时(horasaftertreatment,hat)对叶进行染色。
图16示出了用苯胺蓝染色观察到的拟南芥叶中的胼胝质(callose)沉积的照片;当使用带有紫外线的荧光显微镜时,胼胝质沉积被视为亮点。拟南芥植物用水(对照)或fl(0.01mg/ml)预处理,6天后用苯胺蓝染色。此外,将一组用水或fl预处理的植物在处理之后4天用绿黄假单胞菌(p.viridiflava)接种,并在接种之后2天用苯胺染色。
图17示出了通过使用qpcr技术的拟南芥植物中防御基因相对表达的水平。在拟南芥叶中用fl(0.01mg/ml)处理之后1、3、6和24小时测定pri基因(水杨酸依赖性)和pdf1.2(乙烯/茉莉酮酸酯依赖性)的表达水平。表达被确定与用蒸馏水处理的对照植物有关。在所有情况下,efi组成型表达基因均用作qpcr-反应加载对照。
图18示出了fl刺激对拟南芥植物生长的结果:(a)在萌发后14天,在补充有0.16μg/mlfl、0.5ng/ml萘乙酸(naa)的ms培养基中体外生长的拟南芥幼苗根或在ms培养基中生长的对照植物的发育。(b)在萌发之后10天,与对照植物相比,生长素依赖性dr5::gus基因在补充有fl(0.16μg/ml)或naa(0.5ng/ml)的培养基中生长的拟南芥幼苗中的表达(被视为黑点)。(c)通过用fl(1.6μg/ml)或水(对照)的叶喷淋进行处理之后5周,每株植物的角果数量。
图19示出了田间生长并用fl处理的草莓植物的果实产量的结果。通过每两周从田间生长的植物中收集成熟果实,评估通过每月一次的叶喷淋施加fl(50μg/ml)对产量的影响。在与2010年和2012年相对应的季节(6月至11月)中确定了每种植物(灰色条)和商用(白色条)的果实总重量。以蒸馏水处理的植物用作参照对照。另外,所有植物均接受常规的农艺处理。(*)表示相对于对照的显著统计差异。
图20示出了在温室中生长的大豆植物的荚果的发育结果。当植物达到v1、v7、r1和r3阶段时,用作为参照对照的水或者fl(50μg/ml)来喷淋地上的植物的部分。当植物达到最终发育阶段r8时,荚果的数量被确定。用商用生物接种剂biagro10对种子的处理作为阳性对照,biagro10是基于在具有结瘤启动子的大豆植物中形成结节的慢生根瘤菌属(bradyrhizobiumsp.)的菌株,慢生根瘤菌属被用作阳性对照。(*)表示相对于参照对照的显著统计差异。
图21示出了在温室中生长的甘蔗生长促进的结果。将单节甘蔗柄(stalk)浸入到蒸馏水(参照对照)、fl(14mμ,或商用生物接种剂granem(基于固氮螺菌属(azospirillumsp.)菌株)中,然后种植在具有固体基质的盆中。在种植之后两个月,通过分别用蒸馏水或fl(14μg/ml)的叶喷淋对甘蔗进行处理。两个月后,确定新鲜的根重和柄长。遵循制造商的建议进行用gramen的处理。(*)表示相对于参照对照的显著统计差异。
具体实施方式
植物来源的农业生物输入物(例如根据本发明的化合物)的开发,具有优于农业中使用的生物接种剂的有利优势,因为在后者中,必须对涉及将微生物释放到环境中(可能负面影响农业生态系统)的潜在风险进行评估。因此,植物来源的生物活性化合物在开发和注册为农业生物输入物方面的限制较少。
在另一方面,相对于采用有毒溶剂例如甲醇的传统提取方法,在水或醇或两种介质中同时提取这样的生物活性脂肪酸糖苷,构成了一种简便、快速且无害的方法。此外,植物叶还被利用用于获得所述糖苷,并且这些叶是在耕种季节结束时产生的农业废弃物,这与许多其他非植物来源的由非栽培物种(例如野生植物或藻类物种)产生的生物输入物不同。
已经显示通过施加根据本发明的化合物诱导的防御转移到植物的其他部分,降低了整个植物中病害的发展(全身作用),这在其果实表现出严重程度较低的采后病害的草莓植物中可看到。
maldi-tof质谱分析(图1)示出了不同的信号,其m/z值在28个单位中彼此不同,这是化学结构中存在脂肪酸的特征。
通过fl的水解作用释放并通过对fl的hplc鉴定的现有单糖的分析表明不存在酸性单糖,而存在中性单糖和氨基糖。fl分子中存在的两种主要糖是:
d-半乳糖胺和d-葡萄糖(图2)。
fl化学结构中存在的脂肪酸通过碱性水解作用释放,进行衍生化并随后通过气相色谱法分析:结果表明,fl由具有6至12个碳原子的不饱和脂肪酸构成。
考虑到所有来自化学分析的信息,针对fl提出的化学结构是由与单个葡萄糖单元键合的两个n-乙酰半乳糖胺分子构成的脂肪酸糖苷,所述葡萄糖单元与具有6至12个碳原子的单不饱和脂肪酸酯化(图3)。提出的分子量为715.12;727.12;739.12;751.12;763.12;775.12和789.12;分别对应于r为6、7、8、9、10、11和12个碳原子。
根据本发明的新的fl化合物对应于通式。
考虑到以下通式中每个键的构型:
galnac-(a→b)galnac-(c→d)glc-(e)-o-r,其中galnac是α-或β-d-n-乙酰半乳糖胺,并且glc-o-r是与单不饱和脂肪酸(r)酯化的α-或β-d-葡萄糖分子。
r可以是:
12:1(n),并且其中n是2至11的整数;11:1(n),并且其中n是2至10的整数;10:1(n),并且其中n是2至9的整数;9:1(n),并且其中n是2至8的整数;8:1(n),并且其中n是2至8的整数;7:1(n),并且其中n是2至7的整数;以及6:1(n),并且其中n是2至6的整数。
12:1(n),其中n可以是2、3、4、5、6、7、8、9、10或11。
11:1(n),其中n可以是2、3、4、5、6、7、8、9或10。
10:1(n),其中n可以是2、3、4、5、6、7、8或9。
9:1(n),其中n可以是2、3、4、5、6、7或8。
8:1(n),其中n可以是2、3、4、5、6、7或8。
7:1(n),其中n可以是2、3、4、5、6或7。
6:1(n),其中n可以是2、3、4、5或6。
考虑到以下通式中每个键的构型:
galnac-(a→b)galnac-(c→d)glc-(e)-o-r
a可以是1、3、4或6;b可以是1、3、4或6;当b=1时,c可以是3、4或6;当b=3时,c可以是1、4或6;当b=4时,c可以是1、3或6;当b=6时,c可以是1、3或4;当e=1时,d可以是2、3、4或6;当e=2时,d可以是1、3、4或6;当e=3时,d可以是1、2、4或6;当e=4时,d可以是1、2、3或6;当e=6时,d可以是1、2、3或4。
例如,fl可具有通式i
抗微生物活性
测试了不同浓度的fl(0;0.025;0.05;0.075;0.1;0.25;0.5;0.75;1;2.5;5;7.5;10;25;50;75和100μg/ml),并确定了抑制50%的微生物生长的有效浓度(ce50):发现即使在非常低的浓度下,经纯化的化合物也能抑制对植物、动物、人具有致病性的细菌以及植物致病真菌的生长(表1)。在许多情况下,与已知的抗生素相比,fl显示出更有效的抗微生物活性,这可通过针对人病原体(金黄色葡萄球菌(staphylococcusaureus)、表皮葡萄球菌(staphylococcusepidermidis)、屎肠球菌crl35(enterococcusfaeciumcrl35)、枯草芽孢杆菌(bacillussubtilis)、单核细胞增多性李斯特菌(listeriamonocytogenes)、变形杆菌属(proteussp.)、铜绿假单胞菌(pseudomonaaeruginosa))和植物病原体(带化红球菌、密执安棒状杆菌坏腐亚种c5(clavibactermichiganensissubspsepedonicusc5)、草莓黄单胞菌)的更低的ec50值所证明。发现fl抑制细菌生长的效率与所评估的真菌相比高10至100倍。
重要的是要说明所有测试的真菌均对植物具有致病性:例如,炭疽菌属菌株对草莓植物具有致病性;指状青霉菌是柠檬树果实的病原体,并且灰葡萄孢菌是影响不同的植物物种的死体营养型真菌。
由于fl是生物可降解的,因此其可与更少量显示一定毒性的杀真菌剂组合使用。fl化合物可有助于减少或者甚至替代目前在草莓生产以及其他作物和农产品中使用的有毒杀真菌剂。
表1.针对不同的细菌和真菌病原体的fl抗微生物活性,体外评估为c50。在右侧栏中,显示了其他抗微生物化合物针对评估的病原体描述的ce50值。
通过在固体培养基板上测试fl级分的系列稀释物,还以最低抑菌浓度(mic)确定抗微生物活性:与所评估的植物致病性真菌相比,即使在非常低的浓度下,fl对细菌也更有活性(表2)。mic值(mg/ml)高于ce50(μg/ml)值。
表2.fl的抗微生物活性。在体外确定对植物病原性细菌和真菌的最低抑菌浓度(cim,其在西班牙语中的简缩)。
为了研究构成fl抗生物活性的基础的潜在机制,通过使用用碘化-3,3’-二丙基硫杂二羰花青(disc3(5))的花青染色法评估施加fl对密执安棒状杆菌胞质膜的作用(图4)(biochemistry(1999),38(22),7235-7242.)。荧光化合物disc3(5)对膜电位的耗散敏感,因此,荧光的增加是膜受到的损害的良好指示剂:例如,向含disc3(5)的细菌细胞添加60μg/ml浓度的fl引起荧光增强,该荧光在一分钟内达到其最大值。添加1μm缬氨霉素(一种膜耗散化合物)引起荧光增强,这与用fl化合物所观察到的类似。在不存在fl或缬氨霉素的情况下,在disc3(5)密执安棒状杆菌细胞中未观察到荧光发射的变化。
在另一方面,质膜的电位或通透性的变化,或同时发生的这两种变化,均取决于fl的浓度,这指示了剂量依赖性作用(图5)。当施加浓度为7.5μg/ml至90μg/ml的化合物fl时,清楚地注意到这种作用。
fl化合物有效地用作采后病害的防治剂。特别是,fl(0.1mg/ml)对草莓植物的果实具有预防和愈合作用。用fl对草莓果实的预处理(预防作用)将由灰葡萄孢菌(b.cinerea)引起的灰霉病的发病率和严重性分别降低了30%和60%(图6)。
以类似的方式,与用水处理的果实相比,由指状青霉菌(p.digitatum)(蓝色霉菌)产生的病害症状显著减轻,发病率降低了78%,严重程度降低了50%。还评估了化合物fl的其他浓度(0.05至0.4mg/ml),已经获得与优选浓度0.1mg/ml相似的结果。
与用水处理的对照果实相比,将fl化合物(0.1mg/ml)施加于先前接种有灰葡萄孢菌或指状青霉菌的果实上(愈合作用)可将两种病害的发病率降低至70%,而严重程度降低52%(对于灰葡萄孢菌)和55%(对于指状青霉菌)(图7)。
进行了测试,使用的fl浓度范围为0.05至0.4mg/ml,其具有与用优选浓度0.1mg/ml获得的结果相似的结果。
通过在草莓果实上用fl化合物处理来针对病害提供保护的结果优于用在草莓生产中经常使用的次氯酸钠(消毒剂)获得的结果。
fl化合物显示出对经处理的柠檬的预防作用:
用fl化合物对柠檬表面进行的预防性处理针对由指状青霉菌引起的感染提供了保护(图8)。例如以0.1mg/ml的浓度施加fl化合物,因此,其将指状青霉菌感染的症状的发病率和严重性分别降低了25%和26%。然而,与未处理的果实相比,当施加更高浓度的fl(0.2mg/ml)时,观察到该病害的发病率为40%,病害的严重性降低了53%。
使用优选浓度为0.1mg/ml的fl化合物的处理所获得的结果与使用抑霉唑(一种常用于柠檬作物的杀真菌剂)获得的结果相当,但当fl以其最高浓度0.2mg/ml施加时其保护作用更强。
fl化合物诱导了先天免疫的防御系统并针对植物病害提供保护。
草莓:用fl化合物的处理提供了针对炭疽病的保护
与用作病害的对照的植物相比,用fl化合物处理的植物显示出炭疽病症状的严重性降低了30%至40%(图9)。这种对病害的保护作用与施加水杨酸(sa)和阿拉酸式苯-s-甲基(bth)相当。这些结果表明,fl是用于控制草莓作物生产中炭疽病的高效生态替代品。
用fl化合物的预处理在拟南芥植物中诱导针对绿黄假单胞菌alb8的保护。
用fl化合物在拟南芥植物中进行的预处理在被感染的叶中诱导了由细菌病原体绿黄假单胞菌alb8引起的病害症状的明显减轻(图10),这伴随有细菌种群的计数降低100倍。在用灰葡萄孢菌感染的拟南芥植物中观察到了相似的结果(图11),当在感染之前用fl化合物处理这些植物时,显示出病斑的尺寸缩小了33%,而在用het处理的植物中观察到16%的保护:这比用fl化合物观察到的要少得多。在这些情况下,使用浓度为1μg/ml至20mg/ml的fl,降低的百分比为15%至40%。
用fl化合物进行的预处理给予大豆植物以针对由真菌多主棒孢菌引起的周期末期病(end-of-cycledisease)环斑病(ringspotdisease)的保护。在接种致病性菌株多主棒孢菌(c.cassiicola)之前三天用fl化合物进行的叶处理使大豆植株中的病害症状严重程度显著降低(60%)(图12)。相比之下,商用杀真菌剂opera(5ml/l)的施加,作为结果,使病害严重程度降低70%。
草莓:使用fl化合物进行的预处理针对采后病害提供保护。
关于草莓采后病害。fl化合物(对于病原体生长的亚抑制浓度为5μg/ml至100μg/ml)对病害的发展具有预防性作用,无论是在受控的生长条件下进行的实验中(图13)还是在田间天然接种物的压力下(图14)均是如此,这表明草莓中针对病原体的防御系统的激活。
将收获和经消毒的健康草莓在受控的生长条件下接种灰葡萄孢菌(灰色霉菌)和指状青霉菌(蓝色霉菌)。随后将受感染的果实用10μg/ml的fl化合物溶液处理,这分别将灰色霉菌的发病率和严重程度降低了70%和62%。对于蓝色霉菌也得到了类似的结果,观察到其发病率降低了62%,严重程度降低了60%。相比之下,使用het进行的处理可将灰葡萄孢菌的发病率和严重性分别降低40%和45%,而使用次氯酸钠的处理将发病率降低70%并将严重程度降低45%。对于蓝色霉菌,使用het进行的处理可将发病率降低25%并且严重程度降低50%,而次氯酸钠使发病率降低50%,严重程度降低40%。
使用常规农业管理对草莓植物进行的田间试验表明,以病原体亚抑制浓度(5μg/ml至100μg/ml;优选10μg/ml)的fl组合物溶液的叶上施加可将用fl处理的植物的果实中采后病害的发病率和严重程度降低至多50%。相比之下,在针对病原体提供防御的植物中施加杀真菌剂和诱导剂商用生物产品gluticid可将采后病害的发病率降低70%。然而,fl的预防作用持续时间比gluticid更长,因此延长了果实的商品寿命。
在拟南芥叶中产生活性氧类:用fl化合物溶液对拟南芥植物进行的叶处理在叶中诱导了超氧自由基(o2.-)的早期和瞬时积累(图15),其被视为黑点(紫色)。在处理之后4小时,超氧化物的产生达到最大积累,这与作为先天激活针对病原体的防御的典型信号的早期氧化爆发相一致。
用fl化合物处理的叶中胼胝质的积累:胼胝质的积累是一种植物防御机制,其可加固细胞壁并有助于阻止病原体入侵。已经显示,用fl化合物处理的拟南芥叶仅产生弱的胼胝质沉积(图16,右上照片),但是当fl处理的植物随后用病原体绿黄假单胞菌alb8攻击时,积累非常明显(图16,右下照片)。在用水处理且未接种的植物中未检测到胼胝质积累(图16,左上照片)。令人感兴趣的是观察到与受感染并用水预处理的植物相比,用fl处理的植物在接种绿黄假单胞菌时积累了多得多的胼胝质(图16,左下照片)。该结果表明可能的引发(priming)作用,即与fl处理相关的针对病原体的警戒状态的激活。
拟南芥中基因表达的诱导:在拟南芥叶中,与水杨酸防御方式相关的遗传标志物pri基因的相对表达水平在用fl化合物处理之后6至24小时提高。此外,与茉莉酮酸乙烯酯(ethylenejasmonate)信号传导相关的遗传标志物pdf1.2基因的表达被诱导早于pri,并在用fl化合物的处理之后3小时达到最大表达(图17)。
这些结果表明,fl激活了植物中的多于一种防御方式,这表明它们激活了针对病原体的广谱保护作用。在pr1和pdf1.2的时序性表达中注意到的差异可能取决于水杨酸防御方式与茉莉酮酸乙烯酯的方式之间的拮抗作用(plantphysiology,(2008),147(3),1358-1368)。
fl促进植物的生长和发育:fl对拟南芥植物生长和发育的作用
为了评估fl化合物对植物生长和发育的作用,利用拟南芥幼苗在虚拟定向的琼脂板上进行体外生长测试。如图18a所示,与用水处理的植物(对照)相比,浓度为0.16μg/ml的ms培养基中的fl促进了拟南芥幼苗中初生根的伸长并刺激了侧根的发育。关于用5ng/mlnaa生长素处理的植物的根发育,获得了相似的结果,尽管观察到较小的侧根伸长和发育。已知的事实是生长素是植物侧根的出现和发育所必需的(theplantcell,(2001)13(4),843-852;theplantjournal,(2002)29(3),325-332;cell,(2003)115(5),591-602),正因如此,研究了fl化合物在拟南芥dr5::gus转基因系中的作用,其中由于gusa基因的高度生长素敏感性合成启动子dr5调节剂,组织与生长素发生反应而被染成蓝色。如图18b所示,在补充有0.16μg/mlfl或5ng/mlnaa的ms培养基中生长的拟南芥dr5::gus幼苗在叶尖、枝条(shoot)(可能在托叶中)、侧根原基和侧根点、主根尖(可能维管组织和基柱组织)中显示出很强的染色(深蓝色)。如所预期的,观察到未经处理的拟南芥幼苗中这些相同组织的染色,这是因为生长素的内源性作用,但与用fl或naa处理的植物相比却没有那么明显(图18b)。
此外,与用水处理的对照植物相比,在拟南芥成熟植物的叶上施加1.6μg/ml的fl使得每株植物的角果(12%)以及主茎和次生茎的数量显著增多(图18c)。
fl化合物促进植物生长和发育。
草莓:田间条件下的果实产量。
与用水处理的参照植物相比,通过使用常规农业管理在田间种植的草莓植物上叶施加fl化合物显著促进地上营养生长,并在2010年和2012年分别使每株植物的果实总量提高约30%和73%(图19)。除果实的总产量之外,fl还以大约相同的数字,20%(2010年)和73%(2012年),提高了商业果实的数量。施加的fl浓度为5μg/ml至100μg/ml,优选的浓度为5μg/ml。
对大豆植物荚果产生的作用:在温室条件下,与用水处理的植物相比,用fl化合物处理的大豆植物每株植物的荚果数量高18%至36%(图20)。得到的结果与用商业生物接种剂biagro10处理种子相当。fl化合物可用作基于生长促进剂微生物的大豆商业接种剂的补充。
促进温室中种植的甘蔗植物的根生长:对温室中种植的甘蔗植物进行的实验(图21)表明,fl化合物的施加促进了根鲜重生物量约20%的发展。用fl处理还使茎重与其长度之间的比提高8.5%,这表明茎粗显著提高。fl诱导的茎的生长与针对用商业生物接种剂gramen处理的甘蔗植物观察到的作用相当。
本发明具有为抗微生物剂、植物防御的诱导剂、植物生长的促进剂以及产量和植物生物量的增强剂的活性,其用于配制在农学(植物检疫(phitosanitary)管理、生物施肥、产量的提高以及生物量的增大)、食品保存以及人和动物二者的健康中具有潜在利用的生物资产。所述活性先前没有特别针对这些化合物进行描述。
通过减少氧的消耗、使电势耗散以及提高这些微生物的质膜的渗透性,通过改变微生物质膜的功能来实现抗微生物活性。本发明的fl化合物针对植物病原体具有活性,因此其可用于减少植物病害的发生并延迟室温下果实的腐烂,这是在草莓和柠檬中查明的事实,并且本发明的fl化合物也可用于食物保存。它们还针对人类和动物的病原体具有活性,因此其可用于开发用于控制微生物疾病的药物。
植物防御的诱导剂活性:以关于所处理病原体的生长的亚抑制浓度施加根据本发明的化合物,并且如果施加是在病原体的接种或到达之前(取决于是否该实验是在受控条件下或在田间进行的)或者在植物病害的症状发作期间进行,则降低病害的严重程度。
对防御的诱导进行了生物化学和分子表征。激活了防御机制,该防御机制包括活性氧类的积聚、胼胝质的积聚、与植物免疫相关的基因(pr21pdf1.2)的诱导,其响应于植物激素水杨酸和茉莉酮酸乙烯酯。
举例来说,本发明的组合物减轻了分别由拟南芥中的细菌病原体绿黄假单胞菌alb8以及草莓和大豆中的真菌尖孢炭疽菌和多主棒孢菌引起的病害的症状。免疫力从植物转移至其果实,这是通过采后病害发生的减少得到证明的事实,并且减少了由真菌死体营养型病原体灰葡萄孢菌(botrityscinerea)在草莓中产生的病害。
根据本发明的化合物具有促进植物生长或提高产量或同时做这两件事的活性。例如,在草莓植物中,它提高了营养生长以及果实的数量和质量。在大豆中,提高了每株植物的荚果的数量。在甘蔗和拟南芥中,提高了根发育。这种活性直接或间接地引起农业产量的提高,以及可被利用作为产生能源的基质的总植物生物量的提高。
在0μg/ml至400μg/ml的浓度下,fl化合物具有抗微生物活性:
-在草莓中,通过在果实表面上直接施加,它们延迟由病原体引起的新鲜果实腐烂,从而延长了在室温下所述果实的保存。
-在柠檬中,通过在果实表面上直接施加,它们延迟由病原体引起的新鲜果实腐烂,从而延长了在室温下所述果实的保存。
-它们有效针对马铃薯病原体密执安棒状杆菌坏腐亚种c5;草莓病原体草莓黄单胞菌、草莓炭疽菌、尖孢炭疽菌和胶孢炭疽菌;以及针对带化红球菌(多个植物物种的病原体),因此它们有效防治不同植物病原体产生的病害。
-它们有效针对人类的病原体金黄色葡萄球菌、表皮葡萄球菌、屎肠球菌、枯草芽孢杆菌、单核细胞增多性李斯特菌、铜绿假单胞菌和变形杆菌属,因此适当的剂量允许开发用于人和兽医学的药物。它们也可用作食品防腐剂。
在0.03μg/ml至0.1mg/ml的浓度下,fl化合物具有诱导植物防御的活性:
-在拟南芥植物中,它们防止由细菌和真菌病原体引起的病害的发生,这表明针对多种病原体的防御的激活。
-在草莓植物中,它们防止炭疽病的发生并将保护作用转移至果实,这减少了采后病害的发生并延迟了果实腐烂。
-在病原体到来之前或在病害发生过程中对大豆植物的施加减少了由真菌多主棒孢菌引起的环斑。
在0.16μg/ml至50μg/ml的浓度下,fl化合物具有促进植物生长的活性:
-在草莓中,它们提高了营养生长以及每株植物果实的数量和质量。
-在大豆中,它们提高了每株植物荚果的数量,有可能提高每株植物的粒产量。
-在甘蔗和拟南芥中,它们提高了根发育,有利于利用地面养分并有可能成为非生物胁迫管理(尤其是水分胁迫)的替代物。这也可使得农业产量和甘蔗中的糖产量提高。
-能源作物(例如甘蔗)中营养生长的提高意味着可获得更多原材料用于产生能源作为使用化石来源燃料的替代。
-在大豆植物中通过根的施加以直接的方式用作生物肥料,并且以间接的方式用作生物刺激剂,因为本发明中公开的化合物在结构上与结瘤信号类似。
根据以下实施例更好地举例说明本发明,这些实施例不应被认为是对本发明范围强加的限制:相反,必须清楚地理解的是,在不脱离本发明的精神或不脱离所附权利要求书的范围或不同时脱离这二者的情况下,本领域技术人员在阅读本说明书之后可能会被建议可采取本发明的其他实施方案、修改和等同方案。
实施例
实施例1
fl纯化方案
fl化合物获自草莓属(fragaria)、蛇莓属(duchesnea)、委陵菜属(potentilla)以及属于蔷薇科的其他属的作物物种的不同组织。fl的提取在用三氟乙酸(tfa)酸化的水性介质中进行,将植物材料(0.1g鲜重//ml溶剂)匀浆并在20rpm(4℃)下搅拌2小时。离心之后,以10,000xg,15分钟回收澄清的提取物,并通过制备色谱法将其分成数个级分,使用的是包含10gc18-e基质的固相提取柱(solidphaseextractioncartridge,spe)(phenomenex,ee.uu.)。将20ml的澄清提取物上样到柱中,并且然后用在水中以0.1%稀释的80mltfa进行洗涤。由于柱分子不吸收fl分子,因此收集了初始体积负荷和洗涤流作为初步纯化阶段。
将回收的级分(约80ml)在真空浓缩器(speedvac,thermoscientific)中浓缩40倍(2ml)并且使用反相色谱柱(source5rpc,gehealthcarebiosciencesab)通过hplc进行另外的纯化。再次如在spe柱的情况下,fl不与反相基质相互作用,并因此它们与在水中进行0.1%稀释的tfa一起通过柱。在真空条件下浓缩所收集的流动级分(2ml)直至干燥。
将来自反相柱的干浓缩物溶于1ml水中并施加至hplzzorbax-amino(waters,ee.uu.)正相柱。使用含80%乙腈的等度梯度和1ml/min的流量进行合并材料的洗脱。约5分钟之后收集期望的级分,真空下浓缩直至干燥并重悬于1ml水中。在最后的纯化阶段中,使用了具有安培检测器的高效阴离子交换色谱系统(high-performanceanionexchangechromatographysystemwithanamperometricdetector,hpaec-pac),该系统具有carbopacpa-1柱(4x250mm,dionex,ee.uu.),并且通过三方溶剂(200naohmm作为溶剂a,水作为溶剂b,以及acona1m作为溶剂c)的梯度洗脱fl。保持25%a、75%b和0%c的初始溶剂梯度持续10分钟,随后是线性梯度,其改变溶剂b和c的浓度直到达到(30分钟之后)包含25%a、25%b和50%c的最终溶液。流量为每分钟1ml,并且6.49分钟之后回收纯fl。
实施例2:fl化合物的化学结构
通过基质-辅助的解吸/电离-飞行时间质谱(massspectrometrydesorption/ionization-timeofflight,maldi-tof)的分析:将通过hplc色谱获得的纯fl级分用乙酸中和,在真空条件下浓缩直至干燥,并通过质谱(maldi-tof)进行分析,在正离子和反射模式中使用了2,5-二羟基苯甲酸(dhb)酸基质。
单糖中的组成:将纯fl级分在真空浓缩器(speedvac,thermoscientific)中浓缩直至干燥,在蒸馏水中溶解,并在100℃下于三氟乙酸(tfa)中水解4小时。将经水解的样品再次在真空条件下浓缩直至干燥,在蒸馏水中溶解,并通过hplc进行分析以与d-半乳糖胺、d-葡萄糖胺、l-岩藻糖、d-甘露糖、d-半乳糖和d-葡萄糖的标准样品比较来鉴定释放的单糖。通过具有脉冲安培检测的高效阴离子交换色谱法(high-performanceanionexchangechromatographywithpulsedamperometricdetection,hpaec-pac)进行分析,使用的是carbopacp20柱(3x150mm,dionex,ee.uu.)阴离子交换柱,并且流量为每分钟0.5ml。通过6%的溶剂a(naoh200mm)和94%的溶剂b(蒸馏水)的等度程序洗脱中性单糖。通过三方溶剂(naoh200mm作为溶剂a,水作为溶剂b以及acona1m作为溶剂c)洗脱酸性单糖,使用的是24%的a、62%的b、14%的c的等度程序。
脂肪酸中的组成:脂肪酸通过甲酯衍生物气相色谱法测定。在室温下将通过hplc获得的纯fl级分在naoh1.67%中水解并搅拌24小时。之后,将其用hcl酸化并用等体积的二氯甲烷提取三次。回收有机相,聚集在一起并浓缩直至干燥。将所得剩余物溶于0.ml甲苯中并添加等体积的甲醇中的20%三氟化硼。在氮气氛下将溶解的样品在80℃下孵育1小时。在室温下冷却之后,将样品洗涤3次,添加等体积的蒸馏水并回收有机相,将其用甲苯提取3次。脂肪酸的分析是在毛细管柱(超1.25mx0.20mm)中通过气相色谱法进行的。温度程序为80℃下持续2分钟,随后以10℃/分钟的速度上升至290℃,多至30分钟的总时间。
实施例3:液体介质中的抗微生物测试
抗菌测试:在96孔微板上评估了fl化合物针对植物和人病原体的不同细菌物种的抗微生物活性。(environmentalscience&technology,(2009),43(7),2498-2504)。fl在孔中以包含0.005至2μg/ml的浓度分布,直至最终体积为200μl。接下来,每个孔用对应于每ml104个菌落形成单位(cfu)的细菌物种的悬浮液接种,该悬浮液由固定相细菌培养物在液体培养基中持续一夜(o/n)而获得。在26℃下以100rpm在搅拌器中孵育12至24小时之后,通过在微量滴定板的分光光度计中测量490nm处的吸光度确定了不同细菌的细胞生长(密执安棒状杆菌坏腐亚种c5、草莓黄单胞菌、地毯草黄单胞菌柑桔致病变种、丁香假单胞菌菖蒲致病变种、皱纹假单胞菌、胡萝卜软腐欧文氏菌、带化红球菌)或37℃(金黄色葡萄球菌、表皮葡萄球菌、屎肠球菌crl35、微球菌属(micrococcussp.)、枯草芽孢杆菌、单核细胞增多性李斯特菌、铜绿假单胞菌、柠檬酸杆菌属、大肠杆菌、牛波特沙门菌和变形杆菌属)。与在不含fl的培养基中的生长相比,ce50值对应于抑制50%的细菌生长的fl浓度。除以下细菌之外,所有细菌菌株均使用液体培养基luriabertani(lb)(molecularcloning:alaboratorymanual,(1989),2nded.coldspringharborlaboratorypress,coldspringharbor,n.y):屎肠球菌crl35和单核细胞增多性李斯特菌(lpt-葡萄糖培养基,journalofaoacinternational,(2014)97(2),431-441)、草莓黄单胞菌(ps培养基,theplantpathologyjournal,(2001),17(6),336-341)以及地毯草黄单胞菌柑桔致病变种(cadmus培养基,canadianjournalofmicrobiology,(1976)22(7),942-948)。
抗真菌试验:评估了fl化合物对微量滴定96孔板中多种真菌的生长的活性(appliedmicrobiology,(1972)23(5),998-1000)。将fl以0.5至100μg/ml不等的浓度分配到含有无菌营养肉汤的孔中(马铃薯葡萄糖液体培养基,compendiumofmethodsforthemicrobiologicalexaminationoffoods,(1992),3rded.americanpublichealthassociation,washington,d.c.)直至最终体积为200μl。将每个孔用真菌分生孢子的悬浮液接种直至最终浓度为104cfu/ml。如先前所述获得分生孢子悬浮液(europeanjournalofplantpathology,(2007)117,109-122)。在28℃下在搅拌器(100rpm)中孵育24至48小时之后,通过在微量滴定板的分光光度计中测量490nm处的吸光度来评估真菌的生长。与在不含fl的相同培养基中生长的对照样品相比,ce50值对应于抑制50%真菌生长的fl浓度。
琼脂板上的抗微生物测试:
评估了面对多个植物病原体物种的fl化合物的抗微生物活性(appliedmicrobiology,(1972)23(5),998-1000)。制备了不同浓度的fl(5μg至100μg/ml,在无菌蒸馏水中),并且将每种浓度的10μl液滴置于lp琼脂板中直至吸收。将柔软的无菌融化琼脂(0.7%,在水中)冷却至40℃,并以107个细胞/ml接种植物病原细菌(密执安棒状杆菌坏腐亚种c5(c.michiganensissubspeciessepedonicusc5)、燕麦食酸菌、绿黄假单胞菌alb8、柑桔黄单胞菌柑桔亚种)菌株的整夜培养物。将相应的细菌溶液倒在lb板上直至琼脂表面被覆盖。在28℃下24至48小时孵育期之后,见到每个含有fl的液滴周围都有生长抑制区。最小抑制浓度(mic)确定为产生细菌生长抑制的fl的最低浓度。用cadmus培养基替代lb培养基,以评估对柑桔黄单胞菌柑桔亚种生长的抑制。
以与针对细菌所描述的相似的方式评估fl化合物对抗真菌生长的活性。将纯fl级分在无菌蒸馏水中稀释以提供包含2μg/ml至1000μg/ml的浓度。将每种浓度的50μl置于马铃薯-葡萄糖(pda)琼脂板上直至其吸收。将柔软的无菌融化琼脂(0.7%,在水中)冷却至40℃,并以104个分生孢子/ml接种每个所分析植物病原体株(多主棒孢菌、灰葡萄孢菌bmm和指状青霉菌p5)的整夜培养物。然后,将相应的分生孢子溶液倒在pda板上以覆盖琼脂表面。在28℃下48至72小时的孵育期之后,见到每种fl稀释液周围都有生长抑制区,并确定了mic。在每种植物病原体的独立实验中,至少三次确定mic。
实施例4
密执安棒状杆菌中膜的去极化测试
通过改变disc3(5)膜-敏感染色剂的荧光发射强度来控制细菌密执安棒状杆菌中膜的去极化(biochemistry,(1999),38(22),7235-7242.)。密执安棒状杆菌培养在lb液体培养基中,并在26℃下在搅拌器(120rpm)中孵育直至在中值对数期中生长(od600=0.5)。将收获的细胞离心并洗涤一次(葡萄糖5mm和hepes20mmph7.3),并在相同缓冲液中再次悬浮直至最终od600最终=0.05。将100μl等分试样置于石英样品池中,该样品池中包含2ml的葡萄糖5mm、kcl100mm和缓冲液napepes5mm,ph7.2。
添加0.4μmdedisc3(5)之后,将包含细菌细胞的样品池在26℃下孵育直到达到稳定的荧光降低(约5分钟),这表明染色剂已并入到细菌膜中。然后,添加fl、缬氨霉素或水,并用rf-5301pc分光荧光计(shimadzu,kyoto,japan)记录622nm(激发波长)和670nm(发射波长)处的染色荧光增强。抗生素缬氨霉素是k+选择性离子载体,其改变细菌膜的电势。
添加缬氨霉素1μm和kcl100mm用作细菌膜去极化的阳性对照。通过测量不同浓度(0、7、15、30、60和90μg/ml)的fl级分1分钟之后的荧光来对密执安棒状杆菌膜的渗透性进行fl剂量-响应测试。
实施例5:在草莓果实中针对采后病害进行保护的测试
通过用70%的乙醇、10%的次氯酸钠或用无菌水洗涤,将成熟且健康的草莓果实消毒。
为了评估治愈作用,将已消毒的果实用灰葡萄孢菌或指状青霉菌的强毒分离株接种,在每个果实的表面上施加20μl的真菌孢子悬浮液(105个孢子/ml)。将受感染的果实在25℃、90%的湿度和16小时的光周期下孵育。病原体接种之后3天,以真菌生长抑制浓度(优选地,0.1mg/ml/)将每个果实用fl喷淋。7天之后,评估发病率(受感染果实的%)和严重性(受影响果实的表面程度)。使用用4%的次氯酸钠溶液喷淋的果实作为处理的阳性对照,并且使用用水处理的无菌果实作为生长的阴性对照。
预防作用的评估:将已消毒的草莓果实(如先前所述)用fl化合物以优选0.1mg/ml的浓度喷淋,并且在25℃、90%湿度下并且以16小时的光周期在室中孵育。孵育2天之后,将用fl处理的果实的表面用灰葡萄孢菌或指状青霉菌的20μl真菌孢子(105个孢子/ml)的悬浮液接种,并且在相同的培养条件下孵育。病原体接种之后7天,评估了发病率(受感染果实的%)和严重性(受影响果实的表面程度)。使用用4%的次氯酸钠溶液喷淋的果实作为处理的阳性对照,并且使用用水处理的无菌果实作为阴性对照。
实施例6:柠檬树果实中针对采后病害进行保护的测试
通过在病原体接种之前(预防作用)6小时用fl溶液处理柠檬来评估fl针对病原体的保护活性。用柠檬病原体接种是在经喷淋果实的表面上表面地(直径1mm并且深度2mm)进行,通过用钢解剖刀刺入,并随后施加20μl的106个孢子/ml的指状青霉菌强毒株悬浮液的等分试样。
对于预防性处理,评估了两种fl浓度:0.1和0.2mg/ml的fl。作为针对真菌病害进行保护的阳性对照,利用了用于柠檬工业的商用杀真菌剂抑霉唑(500ppm),同时将用蒸馏水处理的柠檬用作阴性对照。将所有经处理果实在25℃和90%的相对湿度下在生长室中孵育。病原体接种之后六天,对果实进行了检查,并评估了发病率(有症状的果实数量)和感染严重性(受菌丝体发育影响的果实表面)。进行了数字视觉评估,数值为0(无菌丝体发育)至4(完全被菌丝体覆盖的果实)。
通过评估每种果实受菌丝体影响的表面,可将严重性指数计算为每个值的果实频率。发病率指数定义为受感染柠檬的数量(阶段1至4)与每种处理的果实的总数量之比。
实施例7:在草莓植物中抗病性的测试
将来自体外组织培养的cv”pájaro”(“鸟”)3月龄草莓(fragariaxananassa)的健康植物用优选的浓度为0.03μg/ml的fl化合物喷淋,并且在5天之后将其暴露于病原体真菌尖孢炭疽菌(炭疽病的病原体)(europeanjournalofplantpathology,(2007)117,109-122)。将受感染的植物在最佳条件下在生长室中孵育以便真菌的繁殖和病害的发生(28℃,80%的相对湿度和16小时的光周期)。孵育之后7天,根据delp和milholland(plantdisease,(1980),64(12),1071-1073)提出的量表评估叶柄病害的严重性症状,该量表将严重性值指定为包含1(健康植物)至5(非常严重或死亡的植物)。作为诱导针对病原体防御的阳性对照,用fl处理被水杨酸5mm或1mm的阿拉酸式苯-s-甲基或bth(在植物中诱导商业防御的水杨酸类似物)替代。值得注意的是,所使用的fl、bth和水杨酸浓度对尖孢炭疽菌生长具有亚抑制作用。作为防御诱导的阴性对照,用无菌蒸馏水喷淋植物。
实施例8:测试拟南芥叶中的抗病性
将4周龄的拟南芥col-0健康植物用fl(10μg/ml)喷淋,并且在4天之后将其用细菌性病原体绿黄假单胞菌alb8(molecularplant-microbeinteractions,(2002),15(12),1195-1203.)或真菌病原体灰葡萄孢菌bmm(plospathogens,(2011),7(7),e1002148.)接种。
随后将用绿黄假单胞菌接种的植物在控制条件下(26℃、80%的相对湿度和16小时的光周期)在培养室中孵育。细菌接种之后三天,注意到叶病害的症状,并且通过将受感染植物组织匀浆,进行活细菌细胞的计数(cfu),并将细胞以连续稀释接种在具有lb培养基的板上。
此外,将用灰葡萄孢菌接种的植物在22℃、80%的rh下在黑暗中在培养室中孵育,并且在孵育之后三天测量叶病斑的直径。作为防御诱导的阳性对照,使用了从草莓分离的57μg/ml先前所述的鞣花鞣质化合物(het)(molecularplant-microbeinteractions,(2012),25(11),1430-1439.)。作为防御诱导的阴性对照,包括用蒸馏水喷淋的未经接种植物和具有感染对照的经接种植物。实验中使用的fl和het浓度对病原体生长具有亚抑制作用,对于fl,例如浓度为1μg/ml至20μg/ml。
实施例9:大豆叶中的抗病性测试
使多种优良a8000rg的健康大豆(glycinemax)种子萌发,并且其在温室中生长直至菌丝生长阶段v3;之后,将植物用0.1mg/ml的fl化合物喷淋,并且三天之后用病原体真菌多主棒孢菌(环斑病的病原体)的强毒株接种。应指出的是,实验中使用的fl浓度对多主棒孢菌的生长具有亚抑制作用。作为防御诱导的阴性对照,使用了用无菌蒸馏水处理的植物。此外,其还包括用常用于环斑的田间管理的商业杀真菌剂opera(5ml/l)进行的处理。在接种之后4、7和10天评估每种预处理植物的v3和v4段的叶中受影响的面积,并且病害严重程度在shaner和finney(phytopathology,(1977),67(8),1051-1056)之后表示为病害进展曲线下的面积(areaunderthediseaseprogresscurve,audpc)。
实施例10:草莓果实中的抗病性测试
在受控的生长条件下接种的果实:通过在70%的乙醇、10%的次氯酸钠和无菌水中洗涤,对在田间收集的健康且成熟的草莓进行消毒。将已消毒的果实浸入fl溶液(10μg/ml)中,并且在25℃、90%的湿度和16小时的光周期下孵育。孵育2天之后,将经处理果实的表面用20μl(105个孢子/ml)的灰葡萄孢菌或指状青霉菌的真菌孢子悬浮液接种,并且在上述相同的生长条件下孵育。病原体接种之后七天,评估了病害的发病率(受感染果实的%)和严重程度(受影响果实表面的程度)。将用4%的次氯酸钠溶液喷淋的果实用作保护阳性对照,并且将用水处理的无菌果实用作阴性对照。此外,还包括用植物防御诱导剂het(0.8mg/ml)进行的处理。fl和het浓度对真菌生长具有亚抑制作用。
在无然接种物压力下的果实:使用亚抑制性fl(10μg/ml)或het(0.8mg/ml)浓度确定真菌生长的植物防御的诱导。在田间生长的草莓植株接受了两次受试产品的施加,第一次是在80%的植物开花时并且第二次是在15天之后。以在25℃、90%的湿度和16小时的光周期下在生长室中孵育收获的果实来测量每种处理所提供的保护程度。收获之后5天评估果实并且对病害的严重程度(受影响果实表面的程度)进行分析,并将其与未经处理果实(阴性对照)和用商业生物杀真菌剂gluticid(3mg/ml)处理的果实(保护的阳性对照)进行比较。实验是使用随机完全区组设计(randomizedcompleteblockdesign)进行的,该设计对于每种处理有5个区组,每个区组30株植物。在2009年8月至9月之间,在tucumán省mercedes地区植物处于常规栽培管理下。
实施例11:拟南芥叶中活性氧类(ros)的产生
根据wohlgemuth等(plantcellenviron.,(2002),25717-726.)并进行了较小的修改,通过nbt组织化学染色进行了拟南芥叶中超氧化物自由基产生的原位检测。通过叶喷淋将植物用fl(10μg/ml)进行处理或用水(阴性对照)进行处理。在处理之后0、2、4和6小时,将叶从经处理植物移出,并且浸入磷酸钾缓冲液50mm(ph7.8)中,该缓冲液具有0.1%的nbt和10mm的叠氮化钠。通过将叶在真空条件下浸润,通过双重真空冲击处理1分钟和100mm的hg对叶进行染色,并且然后将它们在黑暗中(无真空)孵育1小时。在黑暗中孵育之后,首先将叶浸入96%(v/v)的乙醇中以去除剩余的叶绿素,并随后使其澄清并保存在乳酸/甘油/水中(3∶3∶4v/v/v)。超氧化物的产生显现为叶组织内紫色的甲
实施例12:拟南芥叶中胼胝质的积累
使用(protoplasma,(1956),45(4),552-559)中描述的方法使胼胝质沉积物可视化。将预处理的拟南芥植物的叶在96%的乙醇中脱色,并通过将其依次浸入50%的乙醇、25%的乙醇中并且最后是k2hpo467mm(ph12)中使其逐渐再水化。再水化之后,将叶在黑暗中用0.05%的苯胺蓝染色1小时,并且最后将其浸入30%的甘油中,然后在荧光显微镜中在uv光下对其进行分析,荧光显微镜使胼胝质的积聚显现为亮蓝色斑点。拟南芥植物的预处理由以下组成:用10μg/ml的fl或0.0857mg/ml的het(阳性对照)或蒸馏水(阴性对照)喷淋,并且处理之后6天,以先前所述的方式对分离的叶进行染色。此外,用fl或水处理4天之后,用强毒病原体绿黄假单胞菌alb8接种一些植物,并在接种之后2天用苯胺蓝对其进行染色。
实施例13:拟南芥中基因表达的诱导
通过实时pcr(qpcr)对拟南芥植物中的基因表达进行评估。在叶喷淋lf10μg/ml或蒸馏水(阴性对照)之后0、1、3、6和24小时,从拟南芥植物的叶纯化总rna。将经处理叶与其植物分离并置于研钵中,在液氮中冷冻并用杵将其匀浆。按照根据chomczynski和sacchi(anal.biochem.(1987),162,156-159)的trizol方法提取总rna。简单地说:将150mg的叶在1ml的trizol反应物中匀浆,在氯仿:异戊醇的混合物中纯化,并且最后用dna酶i(dnasei)进行处理。分别通过分光光度法和电泳确定提取的rna的纯度和品质。按照制造商的说明书,用反转录酶m-mlv酶(thermoscientific)进行反转录。使用iqsybrgreensupermix(biorad)通过实时pcr对所得cdna进行分析。研究了pri基因(at2g14610;正向引物:gtctccgccgtgaacatgt(seqidn°1);反向引物:cgtgttcgcagcgtagttgt(seqidn°2))和pdf1.2(at5g44420;正向引物:tttgcttccatcatcaccctta(seqidn°3);反向引物:gcgtcgaaagcagcaaaga(seqidn°4))的表达。组成型表达基因ef1(at1g18070,正向引物:agcacgctcttcttgctttc(seqidn°5),反向引物:gggttgtatccgaccttcttc)(seqidn°6)用作所有样品的上样对照。
实施例14:拟南芥中对生长促进的研究。
使用在琼脂板中垂直定向的培养系统培养拟南芥col-0和转基因品系dr5::gus的植物,以评估地上生长和根发育(theplantcell,(2007),19(3),831-846.)。将纯fl级分(0.16μg/ml)添加至融化的ms介质(50℃),随后将其倒入培养皿(petriplate)中。在种子萌发之后7、10和14天观察到表型。通过比较,评估了生长素对在补充有5ng/ml萘乙酸(naa)的ms培养基中培养的植物的生长和发育的作用。转基因植物dr5::gus携带对生长素强烈敏感的合成启动子(dr5),该启动子可指导和调节β-葡糖醛酸糖苷酶报道基因(gusa)的表达,可通过组织化学染色将其用于检测生长素分布和植物组织应答(plantphysiology,(2002),130(1),199-209)。为了使gusa在不同植物组织中的表达可视化,使幼苗如先前所示生长,收集并浸入显色底物5-溴-4-cyloro-3-吲哚葡糖苷酸(x-gluc)中10分钟。之后,将它们在37℃下在黑暗中孵育16小时。在黑暗中孵育之后,首先用磷酸钠缓冲液50mm,ph7清洗幼苗;然后将其用95%(v/v)的乙醇脱色,并且最后将其浸入70%/v/v的乙醇中。使用具有10倍放大率并配备有数码相机的光学显微镜记录用x-gluc染色的拟南芥组织的图像。使用10个植物样品/实验重复实验3次。
在开花的初期(花序的开始),评估了在温室(25℃、16小时的光周期和70%的rh)中栽培的拟南芥col-0植物的生长促进,该植物在3周龄的健康植物的地上部分喷淋了fl(1.6μg/ml),并且在处理之后的第5周中评估了每株植物的总角果数量。用蒸馏水喷淋的植物用作对照处理。实验设计由以下组成:对于每种处理4个随机区组,每个区组6株植物。
实施例15:田间条件下的草莓产量
通过用fl(50μg/ml)或去离子水(阴性对照)以及基于硅酮的辅助剂乙氧基化壬基酚(0.03%)喷淋叶来评估对草莓植物(fragariaxananassacvcamarosa)的生长促进作用。在6月至11月,tucumán省mercedes地区的两个生长季节(2010年和2012年)期间,对于这两种处理在常规管理下,采用随机区组设计进行了田间测试,该设计包含5个区组,每个区组30株植物。从6月到10月,所有植物每月都要接受fl或水的施加并且每两周一次。收获成熟的果实,并且以每月为基础,确定每个区组的果实和商业果实的总重量。随后,进行了统计分析,该分析将表示所评估月份每株植物果实的重量。将重量大于10g,或者甚至高于其;80%成熟,或者甚至更多,没有病害或机械损伤的迹象或症状的果实定义为商业果实。
实施例16:大豆荚果构造中的温室测试
在生长阶段v1、v7、r1和r3中,通过用fl(50μg/ml)或水(阴性对照)以及基于硅酮的辅助剂乙氧基化壬基酚(0.3%)喷淋地上部分对大豆植物(a8000rg,成熟组viii)进行处理,该植物播种在具有低肥力无菌基底的盆中并在温室控制条件下栽培。作为生长促进的阳性对照,用基于大豆慢生根瘤菌(bradyrhizobiumjaponicum)e109细菌菌株的商业生物接种剂biagro10(biagros.a.,lasheras,argentina),按照制造商的说明书(对于190kg种子,77g/l)对大豆种子进行处理。测试以25℃至30℃不等的温度和18小时受控的光周期(12000至18000lux)在在温室中进行。对于每种处理,各自使用4个区组,每个区组4株植物。一旦植物达到r8阶段,就确定每种处理的每株植物荚果的总数量。
实施例17:在温室中栽培的甘蔗植物中的生长促进
甘蔗植物(甘蔗属杂交变种(saccharumspp.hybridvar.)lcp85-384)是从种植在具有无菌基底的盆(4升容积)中的单节棒(uninodalstake)获得的。用fl(14μg/ml)或水(阴性对照)对植物进行处理两次,首先在种植前将每根棒浸入1小时,并且其次,在种植之后2个月进行叶喷淋。所有的处理均与基于硅酮的(0.03%)辅助剂乙氧基化壬基酚一起施加。生长促进的阳性对照处理是使用基于固氮螺菌属的细菌菌株的商业生物接种剂gramen
该实验是以28℃至35℃的温度和18小时的光控光周期在温室中进行的。对于每种处理,各自使用5个区组,每个区组5株植物。4个月以后,计算每种处理的鲜根重量、地上部分鲜重与每株植物茎长度之间的比。
实施例18:用于提取和获得fl化合物的方法
fl化合物获自草莓属、蛇莓属、委陵菜属以及属于蔷薇科的其他属的作物物种的不同组织。fl的提取在用三氟乙酸(tfa)酸化的水性介质中进行,将植物材料(0.1g鲜重//ml溶剂)匀浆并在20rpm(4℃)下搅拌2小时。离心之后,以10,000xg,15分钟回收澄清的提取物并通过制备色谱法将其分成数个级分,使用的是包含10gc18-e基质的固相提取柱(spe)(phenomenex,ee.uu.)。将20ml的澄清提取物上样到柱中,并且然后在水中以0.1%稀释的80mltfa进行洗涤。由于柱分子不吸收fl分子,因此收集了初始体积负荷和洗涤流作为初步纯化阶段。
将回收的级分(约80ml)在真空浓缩器(speedvac,thermoscientific)中浓缩40倍(2ml)并且使用反相色谱柱(source5rpc,gehealthcarebiosciencesab)通过hplc进行另外的纯化。再次如在spe柱的情况下,fl不与反相基质相互作用,并因此它们与在水中进行0.1%稀释的tfa一起通过柱。在真空条件下浓缩所收集的流动级分(2ml)直至干燥。
将来自反相柱的干浓缩物溶于1ml水中并施加至hplzzorbax-amino(waters,ee.uu.)正相柱。使用含80%乙腈的等度梯度和1ml/min的流量进行合并材料的洗脱。约5分钟之后收集所期望的级分,真空下浓缩直至干燥并重悬于1ml水中。在最后的纯化阶段中,使用了具有安培检测器的高效阴离子交换色谱系统(hpaec-pac),该系统具有carbopacpa-1柱(4x250mm,dionex,ee.uu.),并且通过三方溶剂(200naohmm作为溶剂a,水作为溶剂b,以及acona1m作为溶剂c)的梯度洗脱fl。保持25%a、75%b和0%c的初始溶剂梯度持续10分钟,随后是线性梯度,其改变溶剂b和c的浓度直到达到(30分钟之后)包含25%a、25%b和50%c的最终溶液。流量为每分钟1ml,并且6.49分钟之后回收纯fl。
实施例19:根据本发明的组合物的产生。
高至2%浓度的96°乙醇的添加使得fl能够在室温下保存6个月而无改变,并且4℃冷藏可保存2年。
所获得的产品(fl)是完全水溶性的并且与农业辅助剂相容。fl组合物可用0.03%的壬基酚乙氧基化物(nonylphrenolethoxylate)制得或者fl组合物用0.15%的商业甲基化植物油制得。
实施例20:富fl提取物的获得方法。
将商业栽培的草莓的叶干燥以从植物组织去除水,直至达到初始重量的25%:这使得能够在室温下在干燥环境中将叶保存2至5年。干燥是通过在温室中的栅格上蒸发并在7至10天期间促进它们的曝气进行的。
然后,使用允许获得3mm颗粒的刀式粉碎机(knifemill)将干燥的叶磨碎。
然后通过在适当的溶剂中浸软磨碎的干燥叶来进行提取,以提取和溶解fl:例如,使用0.5%的浓缩10x柠檬汁在去离子水中的溶剂,比例为0.25g干燥的地面叶在1ml的溶剂中。使用桨式搅拌器在低转速(5至10转/分钟)下将其孵育24小时。
接下来,通过对每种提取物体积添加2体积的96°乙醇,对剩余植物材料中存在的fl进行再提取,并且将再提取物在室温下孵育2小时。
使用具有可再用布的布袋真空-强压(300mmhg)滤器进行过滤以将提取物与固体植物材料分离。较晚(ulterior)的沉淀阶段使得糖和没有活性的其他化合物不溶解。为此,由提取物在室温下静态过滤24小时进行孵育。用具有可再用布的布袋真空-强压(300mmhg)滤器对提取物进行新的过滤。
然后将提取物浓缩以完全去除乙醇和部分水分。为此,在具有可调节温度和压力的简单蒸馏装置中进行真空蒸馏。由此获得的提取物具有约0.1mg/ml的fl。
高至2%浓度的96°乙醇的添加使得产品能够在室温下保存6个月而无改变,并且低至4℃的冷藏可保存2年。
所获得的产品是完全水溶性的并与农业辅助剂(例如壬基酚乙氧基化物(0.03%)和商业甲基化植物油(0.15%))相容。
序列表
- 还没有人留言评论。精彩留言会获得点赞!