西红花色香味多组分定量结合指纹图谱质量评价方法与流程
本发明涉及中药活性成分分析技术领域,具体地说,是涉及一种西红花色香味多组分定量结合指纹图谱质量评价方法。
背景技术:
西红花(Crocus sativus L.)又称藏红花,以雌蕊上部三根红色柱头入药,具有独特的颜色、香气和苦味,价格昂贵,为名贵中药,也是世界上最名贵香料,目前从西红花中分离得到的化合物已达到50余种,主要可分为二萜类(以西红花苷类化合物为代表,为西红花红色的主要成分)、单萜类(以苦藏花素和藏花醛为代表,分别是西红花的苦味和香气成分)、黄酮类(以山奈酚为苷元),其中西红花苷中的西红花苷-Ⅰ、西红花苷-Ⅱ和苦藏花素含量较高,三者之和可占干重的40%以上,其它化合物的质量比例都较小。作为食品添加剂的国际标准ISO 3632-2(2010版),用分光光度法分别于λmax440nm、λmax 330nm和λmax 257nm测定西红花水提取液中色、香、味的代表成分西红花苷、藏花醛和苦藏花素的色价来进行质量控制与分级。规定西红花苷色价大于190,苦藏花素色价大于70,藏花醛色价介于20-50之间为一级品。但该方法专属性不强,不能精确表示色、香、味三类组分的含量,如西红花苷类,在257nm和330nm处也有吸收,存在干扰。
2015年版《中国药典》用HPLC法测定西红花苷-Ⅰ和西红花苷-Ⅱ的含量,规定两者总含量大于10%为合格品,该标准只对西红花苷中西红花苷-Ⅰ和西红花苷-Ⅱ进行含量控制,对其他西红花苷、苦藏花素、藏花醛等则没有规定。苦藏花素和藏花醛均具有较强的药理活性,为西红花的药效成分,并且苦藏花素在西红花中含量均较高,苦藏花素纳入西红花质量控制指标能更有效地控制和评价西红花药材的质量。
定量指纹图谱技术是以指纹图谱与多成分定量相结合的综合评价方法,能较为全面地反映中药及其制剂中所含化学成分的种类与数量,且能够同时进行多种药效成分的定量分析,进而可以对药品质量进行整体描述和评价,体现出中药的整体观。文献报道,不同产地,不同质量等级的西红花所含化学成分的种类与数量有较大的差异,使用定量指纹图谱技术更能全面反映西红花药材质量,为临床安全、合理用药提供依据。
技术实现要素:
本发明所要解决的技术问题是提供一种测定西红花提取液中色、香、味的代表成分西红花苷、藏花醛和苦藏花素等多组份含量;对其他复杂成分利用指纹图谱进行质量控制的方法。
为解决上述技术问题,本发明提供了一种西红花色香味多组分定量结合指纹图谱质量评价方法,包括步骤:
a.确定高效液相色谱条件;
b.确定质谱条件;
c.制备供试品溶液;
d.制备色味混合对照品和藏花醛对照品溶液;
e.取对照品和西红花样品溶液进样分析,得对照品和西红花样品高效液相色谱图和质谱总离子流色谱图,首先基于液相色谱的在线紫外图谱判断化合物的结构类型,再利用波峰在正负离子模式下离子裂解规律推断化合物的结构;
f.光谱和质谱分析西红花中的色谱峰特征;
g.建立西红花定量指纹图谱方法:
精密度试验:取同一供试品溶液按指纹图谱的色谱条件,连续进样6次,采用国家药典委员会中药色谱指纹图谱相似度评价系统2004A版计算其相似度;
稳定性试验:取同一供试品溶液,在步骤b中的色谱条件下分别在0、2、4、8、12、20、24h测定,记录色谱图,测定样品稳定性;
重复性试验:取西红花样品6份,精密称定,按照步骤c中的方法制备供试品溶液,按照步骤a中的液相色谱条件下进行测定,记录色谱图,考察实验方法的重复性;
h.西红花样品波长切换HPLC指纹图谱的建立和定量:取干品西红花,按步骤供试品溶液制备方法和检测方法进行检测,得到样品的高效液相色谱图,将西红花样品的高效液相色谱图谱信号数据导入国家药典委员会中药指纹图谱相似度评价系统(2004A版)软件进行处理,设定第一个样品为参照图谱,选取时间窗宽度为0.1min,对照图谱的生成方法为中位数,选择稳定性和重复性在0.999以上、吸收较强、特征明显的色谱峰为共有特征峰,进行多点校正,自动匹配,生成对照图谱,11个共有色谱峰为:苦藏花素、槐糖苷、trans-5-tG、西红花苷-Ⅰ、西红花苷-Ⅱ、trans-2-G、藏花醛、西红花苷-Ⅰ的顺式异构体、西红花苷-Ⅱ的顺式异构体以及trans-1-g;然后进行各样品的相似度评价,以供试品溶液指纹图谱中西红花苷-Ⅰ的保留时间及峰面积来计算其他共有峰相对保留时间和相对峰面积,并统计结果。
优选地:所述步骤a中,高效液相色谱条件:Ultimate XB C18色谱柱;柱温:30℃;流动相:0.4%甲酸-甲醇,梯度洗脱,0-60min,甲醇浓度:20%-100%;DAD波长范围200~600nm,检测时间在25min内测定波长为260nm,25-29min之间测定波长为440nm,29-36min之间测定波长为260nm,36-40.5min之间测定波长为440nm,40.5-42.5min之间测定波长为310nm,42.5-60min之间测定波长为440nm;流速:0.8ml·min-1;进样量:10μl。
优选地:所述步骤b中,所述质谱条件进一步为,离子源:大气压电喷雾离子源ESI;检测模式:正负离子;全扫描质核比:50-1200m/z;干燥气温度:350℃,干燥气流量:12.0L·min-1,雾化气压力:35.0psi;毛细管电压:4.5kV;碰撞电压1.0V;进入质谱的流动相流速分流至0.4ml·min-1。
优选地,所述步骤c,进一步为,称取西红花样品粉末10mg,精密称定,置25ml棕色量瓶中,加甲醇20ml,冰浴超声处理30min,放置室温,加甲醇定容至刻度,摇匀,0.22μm微孔滤膜滤过,取续滤液,得到供试品溶液。
优选地,其特征在于,所述步骤d,进一步为,
1)制备色味混合对照品溶液:精密称取西红花苷-Ⅰ对照品、西红花苷-Ⅱ对照品、以及苦藏花素置于棕色量瓶中,用甲醇溶解并定容至刻度。得浓度为59.6μg·mL-1、29.6μg·mL-1和40.8μg·mL-1的西红花苷-Ⅰ、西红花苷-Ⅱ和苦藏花素混合对照品溶液,摇匀,备用;
2)制备藏花醛对照品溶液:精密吸取藏花醛对照品51.5mg,置25mL 棕色量瓶中,用甲醇溶解并定容至刻度,得浓度为2.06mg·mL-1对照品溶液,作为储备液。从中精密吸取0.5mL,置25mL棕色量瓶中,加甲醇稀释至刻度,得浓度为41.2μg·mL-1对照品溶液。
优选地,其特征在于,所述步骤e中,进一步为,采用波长切换方法在440nm、250nm和330nm下测定西红花中的西红花苷、苦藏花素和藏花醛化合物,得对照品和西红花样品高效液相色谱图和质谱总离子流色谱图。
西红花的国际标准ISO 3632-2,用分光光度法测定西红花的色价来进行质量控制与分级,该方法专属性不强,不能精确表示色、香、味三类组分的含量。《中国药典》用HPLC法测定,但该标准只对西红花苷中西红花苷-Ⅰ和西红花苷-Ⅱ进行含量控制,对其他药效成分如苦藏花素、藏花醛等则没有规定。本发明首先采用HPLC-DAD-ESI-MSn技术对西红花中主要化学成分进行分析和鉴别,在基于西红花中“色香味”多药效组分和质谱鉴定的基础上,利用波长切换HPLC-DAD技术通过色-香-味多组分定量结合指纹图谱,构建了西红花的多组分质量评价体系,可对西红花进行较全面的质量分析,可提高西红花临床应用的安全性和有效性。
与现有技术相比,本发明所述的西红花色香味多组分定量结合指纹图谱质量评价方法,达到了如下效果:
国际标准ISO 3632-2,用分光光度法测定西红花水提取液中色、香、味的代表成分西红花苷、藏花醛和苦藏花素的色价来进行质量控制与分级。但该方法专属性不强,不能精确表示色、香、味三类组分的含量。《中国药典》用HPLC法测定,但该标准只对西红花苷中西红花苷-Ⅰ和西红花苷-Ⅱ进行含量控制,对其他药效成分如苦藏花素、藏花醛等则没有规定,因此现行国际标准与中国药典对西红花质量评价尚存在较大的缺陷。
本发明首先采用HPLC-DAD-ESI-MSn技术对西红花中主要化学成分进行分析和鉴别,在基于西红花中“色香味”多药效组分和质谱鉴定的基础上,利用波长切换HPLC-DAD技术通过色-香-味多组分定量结合指纹图谱,构建了西红花的多组分质量评价体系,可对西红花的14种成分进行定性与定量分析,测定结果稳定可靠,比现有方法更全面评价西红花质量,可提高西红花临床应用的安全性和有效性。
本发明采用HPLC-DAD-ESI-MSn技术对西红花中主要化学成分进行分析和鉴别,在基于西红花中“色香味”多药效组分和质谱鉴定的基础上,利用波长切换HPLC-DAD技术通过色-香-味多组分定量结合指纹图谱,构建了西红花的多组分质量评价体系,可对西红花进行较全面的质量分析,可提高西红花临床应用的安全性和有效性。
附图说明
此处所说明的附图用来提供对本发明的进一步理解,构成本发明的一部分,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。在附图中:
图1为实施例1中对照品和样品波长切换液相色谱图;
图2a-图2b为西红花总离子流图,图2a为正离子模式,图2b为负离子模式;
图3为实施例1中的精密度试验色谱图;
图4为实施例1中的稳定性试验色谱图;
图5为不同提取溶剂液相色谱HPLC图;
图6为超声提取不同时间HPLC图;
图7为对照图谱;
图8a-图8c为28批西红花样品的共有模式图,其中s1-s28分别代表样品1-样品28;
图9a-图9c为西红花对照品和样品波长切换HPLC图。
具体实施方式
如在说明书及权利要求当中使用了某些词汇来指称特定组件。本领域技术人员应可理解,硬件制造商可能会用不同名词来称呼同一个组件。本说明书及权利要求并不以名称的差异来作为区分组件的方式,而是以组件在功能上的差异来作为区分的准则。如在通篇说明书及权利要求当中所提及的“包含”为一开放式用语,故应解释成“包含但不限定于”。“大致”是指在可接收的误差范围内,本领域技术人员能够在一定误差范围内解决所述技术问题,基本达到所述技术效果。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明本发明的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
实施例1:
本实施例提供了一种西红花色香味多组分定量结合指纹图谱质量评价方法,具体步骤如下:
A.高效液相色谱条件:Ultimate XB C18色谱柱(250mm×4.6mm,5μm);柱温:30℃;流动相:0.4%甲酸(A)-甲醇(B),梯度洗脱,0-60min(B:20%-100%);DAD波长范围200~600nm,0-25min(260nm),25-29min(440nm),29-36min(260nm),36-40.5min(440nm),40.5-42.5min(310nm),42.5-60min(440nm);流速:0.8ml·min-1;进样量:10μL。
B.质谱条件:离子源:大气压电喷雾离子源(ESI);检测模式:正负离子;全扫描质核比(m/z):50-1200;干燥气温度:350℃,干燥气流量:12.0L·min-1,雾化气压力:35.0psi;毛细管电压:4.5kV;碰撞电压1.0V;进入质谱的流动相流速分流至0.4ml·min-1。
C.供试品溶液制备
称取西红花样品粉末约10mg,精密称定,置25ml棕色量瓶中,加甲醇20mL,冰浴超声处理30min,放置室温,加甲醇定容至刻度,摇匀,0.22μm微孔滤膜滤过,取续滤液,即得。
D.对照品溶液制备
1)色-味混合对照品溶液制备:精密称取西红花苷-Ⅰ对照品2.98mg,西红花苷-Ⅱ对照品1.48mg,苦藏花素2.02mg置50ml棕色量瓶中,用甲醇溶解并定容至刻度。得浓度为59.6μg·ml-1、29.6μg·ml-1和40.8μg·ml-1的西红花苷-Ⅰ、西红花苷-Ⅱ和苦藏花素混合对照品溶液,摇匀,备用。
2)藏花醛对照品溶液制备:精密吸取藏花醛对照品51.5mg,置25ml棕色量瓶中,用甲醇溶解并定容至刻度,得浓度为2.06mg·ml-1对照品溶液,作为储备液。从中精密吸取0.5ml,置25ml棕色量瓶中,加甲醇稀释至刻度,得浓度为41.2μg·ml-1对照品溶液。
E.液相色谱图和总离子流图的建立
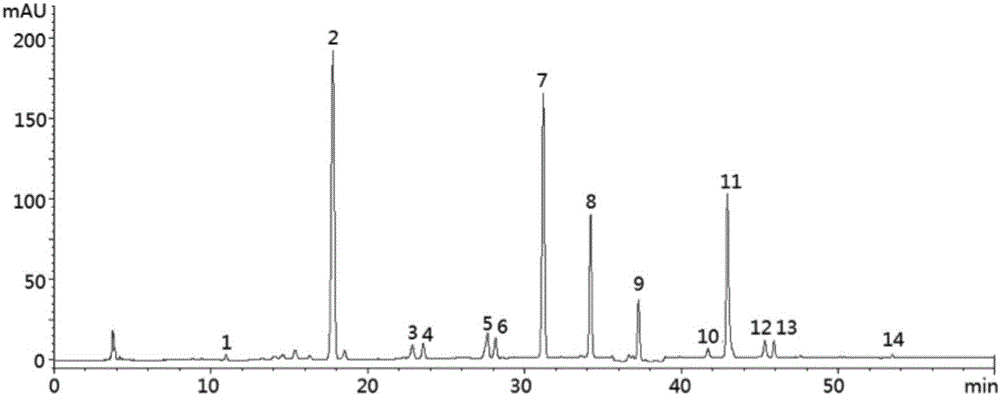
通过对流动相和检测波长考察,建立了较佳的液相色谱分析条件,基本实现了西红花中主要化合物的基线分离。由于西红花中的西红花苷、苦藏花素和藏花醛三类主要化合物在440nm、250nm和330nm下有特征性吸收,但吸收强度相差很大,所以本发明采用了波长切换技术。按上述实验条件,取对照品和西红花样品溶液进样分析,得对照品和西红花样品高效液相色谱图(图1)和质谱总离子流色谱图(图2a和图2b)。
从HPLC图和总离子流图可看出,液相上的色谱峰基本均有质谱响应,正离子模式比负离子模式色谱峰多,并且响应峰的强度大,但有的色谱峰在负离子下有响应的,正离子无响应。所以本发明首先基于HPLC的在线紫外图谱,判断化合物的可能结构类型,再进一步利用各峰在正负离子模式下离子裂解规律推断化合物的结构。
F.西红花中14个色谱峰光谱和质谱特征分析
由于流动相中存在钠离子和甲酸根离子,通过正负离子模式下的总离子流图可发现,西红花中多种西红花苷类成分、苦藏花素和黄酮类成分在正离子模式下主要产生[M+Na]+峰,在负离子模式下主要产生[M-H]-和[M+HCOO]-峰。为了更好地归纳分析西红花化学成分的质谱裂解规律,通过与对照品保留时间、在线紫外图谱和化合物的一级、二级、三级质谱裂解特征,并通过对比同类化合物的质谱裂解规律和质谱碎片特征,参考现有技术相关文献进行推测。结果见表1。
表1 14个峰UV和质谱裂解规律
G.西红花定量指纹图谱方法建立
精密度试验:取同一供试品溶液按指纹图谱的色谱条件,连续进样6次,采用国家药典委员会“中药色谱指纹图谱相似度评价系统2004A版”计算其相似度在0.999以上,表明仪器的精密度良好。见图3。
稳定性试验:取同一供试品溶液,在前述色谱条件下分别在0、2、4、8、12、20、24h测定,记录色谱图,考察样品稳定性。经相似度评价,均在0.999以上,表明供试品溶液24h内稳定性良好。见图4。
重复性试验:取S15样品6份,精密称定,按照“供试品溶液制备”项下的方法制备供试品溶液,在前述色谱条件下分别进行测定,记录色谱图,考察实验方法的重复性。经相似度评价,均在0.999以上,表明方法重复性良好。
H.西红花样品波长切换HPLC指纹图谱的建立和定量
取干品西红花,按以上供试品溶液制备方法和检测方法进行检测,得到样品的高效液相色谱图。将样品HPLC图谱信号数据导入国家药典委员会《中药指纹图谱相似度评价系统(2004A版)》软件进行处理,设定第一个样品为参照图谱,选取“时间窗宽度”为0.1min,对照图谱的生成方法为“中位数”,选择稳定性和重复性好,吸收较强,特征明显的11个色谱峰为共有特征峰,进行多点校正,自动匹配,生成“对照图谱”,11个共有色谱峰为:
1:苦藏花素,2:槐糖苷,3:trans-5-tG,4:未鉴定出,5:西红花苷-Ⅰ,6:西红花苷-Ⅱ,7:trans-2-G,8:藏花醛,9:西红花苷-Ⅰ的顺式异构体(cis-4-GG),10:西红花苷-Ⅱ的顺式异构体(cis-4-Gg),11:trans-1-g;
然后进行各样品的相似度评价,以供试品溶液指纹图谱中西红花苷-Ⅰ的保留时间及峰面积来计算其他共有峰相对保留时间和相对峰面积,并统计结果。
实例2:西红花供试液制备方法的优化
1.仪器、试剂和材料
Agilent 1200高效液相色谱仪(美国Agilent公司);Agilent 6330离子阱质谱仪,配有电喷雾离子源(ESI)(美国Agilent公司);AG135电子天平(瑞士Mettle Toledo公司);Milli-Q超纯水仪(美国Millipore公司);KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司)。
西红花苷-Ⅰ(批号:111588-201202),西红花苷-Ⅱ(批号:111589-201304),供HPLC含量测定用,均购于中国食品药品检定研究院;藏花醛(批号:101198434,Sigma公司,含量>88%);苦藏花素(自制,含量>90%);甲醇和甲酸均为色谱纯(美国Tedia公司),其余化学试剂均为分析纯。
西红花药材由湖州西红花种植基地提供,经浙江中医药大学陈锡林教授鉴定为Crocus sativus L.的干燥花柱。研磨后,过60目筛,避光干燥保存。
2.方法
2.1供试品溶液制备
2.1.1提取溶剂选择
鲜品西红花柱头主要含有多种西红花苷类成分(以西红花苷-Ⅰ和西红花苷-Ⅱ为主,占总西红花苷90%以上)和苦藏花素,两类成分可占干重的40%以上,极性较大,溶于水、甲醇和乙醇。加热干燥过程中苦藏花素会部分水解,生成苷元,进一步脱水生成藏花醛,含量较低。藏花醛为西红花的香气成分,不溶于水,可溶于甲醇、乙醇、乙醚等。本研究以西红花中的色-香-味三类成分为指标,对提取溶剂进行考察。见图5。
结果表明,水对西红花苷-Ⅰ的提取率最低,并且无藏花醛色谱峰。50%乙醇、70%甲醇和甲醇对苦藏花素和西红花苷-Ⅰ、Ⅱ提取率基本相似,但甲醇对藏花醛的提取率较高,并且样品在甲醇中的稳定性最好,故本研究以甲醇为提取溶剂。
2.1.2提取时间
现有技术中的文献报道,西红花中的西红花苷类成分稳定性较差,2015年版《中国药典》西红花项下,西红花苷-Ⅰ和西红花苷-Ⅱ含量测定,用超声法提取,并要求在冰浴上操作,本研究为进一步考察超声法对西红花苷类成分,苦藏花素和藏花醛的提取率的影响,对超声时间进行了优化。见图6。
结果表明,不同超声提取时间,成分种类基本一致,但提取率有差异。随着提取时间延长西红花苷-Ⅰ、西红花苷-Ⅱ和苦藏花素提取率增加,达到30min时提取率最高,之后变化不大。故超声提取30min。
2.1.3供试品溶液制备
在优化了提取溶剂和超声时间的基础上,最终确定了供试品溶液的制备方法,具体如下:
称取西红花样品粉末约10mg,精密称定,置25mL棕色量瓶中,加甲醇20mL,冰浴超声处理30min,放置室温,加甲醇定容至刻度,摇匀,0.22μm微孔滤膜滤过,取续滤液,即得。
实例3:28批国产西红花波长切换HPLC指纹图谱的建立和分析
取不同来源的28批干品西红花,按以上供试品溶液制备方法和检测方法进行检测,得到28批样品的高效液相色谱图。将28批样品HPLC图谱信号数据导入国家药典委员会《中药指纹图谱相似度评价系统(2004A版)》软件进行处理,设定S1为参照图谱,选取“时间窗宽度”为0.1min,对照图谱的生成方法为“中位数”,选择稳定性和重复性好,吸收较强,特征明显的11个色谱峰为共有特征峰,进行多点校正,自动匹配,生成“对照图谱”,见图7。11个共有色谱峰为:
1:苦藏花素,2:槐糖苷,3:trans-5-tG,4:未鉴定出,5:西红花苷-Ⅰ,6:西红花苷-Ⅱ,7:trans-2-G,8:藏花醛,9:西红花苷-Ⅰ的顺式异构体(cis-4-GG),10:西红花苷-Ⅱ的顺式异构体(cis-4-Gg),11:trans-1-g
匹配后的28批样品谱图见图8a-8c。然后进行各样品的相似度评价,见表3。除样品S5、S7和S20三个样品外,其余25批样品相似度均在0.98以上,尤其S7相似度最低。从图8a-8c和表3相似度可知,S5、S7和S20的9号、10号和11号色谱峰响应值较高,从表5相对峰面积可看出,这三批样品的9号色谱峰相对峰面积在1以上,而其他样品的该色谱峰的相对峰面积在1以下,可能是引起3批样品相似度低的主要原因。根据第一章质谱鉴定结果,表明该成分为西红花苷-Ⅰ的顺式异构体(cis-4-GG),后期研究表明,该成分在鲜品中含量较低,其干品中的含量与干燥温度等有关。并且S7的相似度最低(0.934),从表5可看出,该样品1号色谱峰(苦藏花素)相对峰面积为1,其他样品该色谱峰的相对峰面积均大于1,8号色谱峰(藏花醛)和9号色谱峰相对峰面积均较其他样品高,可能是该样品相似度低的主要原因。
通过与对照品对照和结合第一章质谱鉴定结果,确定5号峰为西红花苷-Ⅰ。以5号峰作为参照峰S,以供试品溶液指纹图谱中西红花苷-Ⅰ的保留时间及峰面积来计算其他共有峰相对保留时间和相对峰面积,统计结果分别见表4和表5。
表3 28批国产西红花指纹图谱相似度
表4 28批西红花共有色谱峰相对保留时间
表5 28批西红花共有色谱峰相对峰面积
从相对保留时间和相对峰面积数据可看出,不同来源国产西红花药材指纹图谱中共有峰相对保留时间基本一致(RSD<0.5%);但由于来源不同,可能采后加工方法等不同,各批药材共有峰的相对峰面积有较大差异(即各峰代表成分含量的相对比值则有较大差别),差异最大的是峰8(藏花醛) 和峰10(cis-4-Gg);其次是峰9(cis-4-GG)和峰11(trans-1-g)。由此可知,建立的色谱方法可以使不同来源西红花药材具有基本一致的色谱行为(相对保留时间),但药材之间西红花苷类和苦藏花素等成分的含量受多种因素的影响,具有较大差异(相对峰面积)。提示不同产地西红花存在差异,必须严格控制西红花质量,确保其临床疗效。
实例4:色香味HPLC法同时定量分析国内外西红花样品
1.1仪器、试剂和材料
仪器、试剂、材料同实例2
1.2方法
1.2.1供试品溶液制备
同实例2
1.2.2对照品溶液制备
同实例2
1.2.2.1色-味混合对照品溶液制备
同实例2
1.2.2.2藏花醛对照品溶液制备
同实例2
1.3色谱条件
Ultimate XB C18色谱柱(250mm×4.6mm,5μm);柱温:30℃;流动相:0.4%甲酸(A)-甲醇(B),梯度洗脱,0-60min(B:20%-100%);DAD波长范围200~600nm,0-25min(260nm),25-29min(440nm),29-36min(260nm),36-40.5min(440nm),40.5-42.5min(310nm),42.5-51min(440nm);流速:0.8mL·min-1;进样量:10μL。波长切换代表色谱图见图9a-9c。
1.4方法:方法于现有技术中的定量指纹图谱的方法相同
1.4.1线性关系考察
1.4.1.1色味线性关系考察
分别精密吸取西红花苷-Ⅰ、西红花苷-Ⅱ和苦藏花素混合对照品溶液1、2、4、6、8、10μL,按上述色谱条件进样分析,测定峰面积。以峰面积Y为纵坐标,对照品质量为横坐标(X,μg),绘制标准曲线。得回归方程和线性范围,结果见表8,三个成分在各自浓度范围内线性关系良好。
1.4.1.2香(藏花醛)线性关系考察
分别精密吸取藏花醛对照品溶液1、2、4、6、8、10μL,按上述色谱条件进样分析,测定峰面积。以峰面积Y为纵坐标,对照品质量为横坐标(X,μg),绘制标准曲线。得回归方程和线性范围,结果见表8,藏花醛在一定浓度范围内线性关系良好。
表8西红花中4个成分的线性关系
1.5样品含量测定
按前述供试品溶液制备方法和色谱条件测定28批国产西红花中西红花苷-Ⅰ、西红花苷-Ⅱ、苦藏花素和藏花醛的含量,结果见表10。
2.UV法测定总西红花苷含量方法的建立
西红花中的西红花苷类成分有其特殊性,苷元均为西红花酸,紫外吸收光谱特征基本相同,最大吸收波长均为440nm。《中国药典》方法测定的28批西红花样品的结果表明,西红花苷-Ⅰ含量均比西红花苷-Ⅱ含量高,基本是西红花苷-Ⅱ的2倍以上;并且西红花苷-Ⅱ对照品的价格是西红花苷-Ⅰ的2倍以上,故本文以西红花苷-Ⅰ为对照,有其合理性。
2.1对照品溶液的制备
精密称取西红花苷-Ⅰ对照品6.20mg,置25mL棕色量瓶中,用甲醇溶解并定容至刻度。从中精密移取2.0mL置10mL量瓶中,用甲醇稀释至刻度,摇匀,得浓度为49.6μg·mL-1的对照品溶液。
2.2供试品溶液制备
精密吸取“色-香-味HPLC法同时定量分析方法”供试品溶液5mL,置50mL棕色量瓶中,用甲醇稀释至刻度。
2.3测定波长的选择
对照品溶液及供试品溶液分别于200-700nm进行波长扫描,发现两者均在440nm处有最大吸收,故确定检测波长为440nm。与西红花苷类成分的最大吸收波长相一致。
2.4线性关系考察
分别精密吸取对照品溶液0.1,0.2,0.4,0.6,0.8,1.0mL置于10mL量瓶中,用甲醇稀释至刻度,以甲醇作空白对照,照紫外-可见分光光度法,于440nm波长处测定吸光度,得回归方程为Y=0.1130X+0.0012(r=0.9999)。结果表明,西红花苷-Ⅰ在0.496-4.96μg·mL-1浓度范围内与吸光度呈良好线性关系。
2.5精密度和稳定性考察
精密吸取0.6mL对照品溶液,按2.4项下方法操作,重复测定6次,吸光度的RSD为0.032%,说明仪器精密度良好。
取S1样品液,按2.4项下方法操作,分别在0min、10min、20min、30min、40min、50min、60min测定吸光度,RSD为0.38%,说明样品在1h内稳定性良好。
2.6重复性考察
取S1样品,平行6份,精密称定,分别按2.2和2.4项下方法操作,测定吸光度,按标准曲线分别计算总西红花苷含量,计算平均含量为27.60%,RSD为1.98%。说明该方法重复性良好。
2.7加样回收率考察
取已知总西红花苷含量(27.60%,重复性试验结果)的S1样品,平行6份,每份5.0mg,精密称定,各加入西红花苷-Ⅰ对照品溶液5mL,分别按2.2和2.4项下方法操作,测定吸光度,按标准曲线分别计算总西红花苷含量,计算平均回收率,结果见表9。表明该方法准确可靠。
表9西红花中总西红花苷加样回收率试验结果
2.8UV法样品中总西红花苷含量测定
取28批西红花药材,分别按“2.2”中的方法制备供试品溶液,按“2.4”中的方法操作,测定吸光度,按标准曲线分别计算总西红花苷含量,测定结果见表10。
表10 HPLC法和UV法测定西红花中色-香-味的含量
从表10可看出,国产不同来源的28批西红花色香味三类成分的含量有较大差异。苦藏花素含量最高的(S27)是含量最低的(S7)的近3倍。紫外测定的总西红花苷含量最高的(S27)是含量最低的(S26)的1.5倍。而藏花醛含量最高的(S7)是含量最低的(S19)的25倍。藏花醛在新鲜西红花柱头中基本不存在,是新鲜西红花在加热干燥过程中由苦藏花素水解后生成苷元,在高温作用下进一步脱水生成。即藏花醛实际上不是新鲜西红花的原始积累产物,是一个采后“干燥胁迫”诱导产物。后期研究表明,该成分的含量与干燥温度有关,S7苦藏花素含量最低,可能是干燥时温度高,苦藏花素热降解,转化成藏花醛。
3.基于TOPSIS分析样品的质量优劣
西红花药材质量与色-香-味多组分的含量有关,是一个典型的多指标决策问题。由于各指标成分含量不同,且在数量级上也存在较大差异,简单加和显然不能客观全面反映样品质量,因此需要选择合理的综合评价方法,以兼顾各种成分在质量评价中所占权重均等。TOPSIS分析法是一种有效的多指标较理想的综合评价方法,其中心思想是首先确定各项指标的正理想值A+和负理想值A-,即各指标的最优解和最劣解。然后求出各样品与正、负理想值之间的加权欧式距离D+和D-,从而求出各样品与理想方案的贴近程度Ci,作为评价方法优劣的标准。即靠即近正理想和远离负理想的程度,来对方案进行排序,相对贴近度越大,说明越靠近正理想而远离负理想,方案越优;反之,方案越劣。
采用DPS数据处理系统,以28批样品中的7个指标成分组成28×11矩阵,基于TOPSIS通过Matlab软件编程实现其贴近度大小,利用贴近度(Ci)对28批样品进行综合排序,结果见表11。首先分别找出7个指标的正负理想如下:
正理想(A+):19.84,18.98,8.84,27.60,28.90,4.06,0.999
负理想(A-):6.65,11.59,4.25,16.89,19.05,0.16,0.934
表11 TOPSIS综合评价结果
TOPSIS评价结果显示,前5批由优至劣顺次排序的样品为:S27(浙江杭州),S1(浙江建德三都西红花合作社),S15(浙江余杭),S22(江西南昌),S2(浙江建德三都西红花合作社)。28批样品排序后5批的样品为:S11(浙江湖州安吉),S25(西藏),S26(浙江湖州),S9(浙江金华浦江县),S5(浙江建德杨树桥镇)。本研究基于“色-香-味多指标定量结合指纹图谱相似度,应用TOPSIS法评价”,可全面表征不同来源西红花药材的化学成分的差别,比各项指标简单加和更能客观全面反映西红花药材质量,可以为西红花药材产地选择,临床应用及质量快速评价提供参考。在此基础上,若能将药效、毒性与物质基础结合起来,深入开展谱效学研究,则更有利于阐明中药作用机制,完善西红花的质量评价体系,为用药安全提供进一步保障。
从TOPSIS评价结果可看出,S5的贴近度(Ci)最小,质量最差。从表10数据可看出,该样品的苦藏花素,西红花苷类成分的含量均比S7高,指纹图谱的相似度也比S7高,但藏花醛含量比S7低,如果从色香味结果的表面去分析,S7质量相对最差。
2015年版《中国药典》用HPLC法测定西红花苷-Ⅰ和西红花苷-Ⅱ的含量,规定两者总含量大于10%为合格品,28批样品均为合格品,如按照中国药典评价,质量最差的是S26。因此,仅由西红花苷-Ⅰ和西红花苷-Ⅱ总量评价西红花有一定局限性。
因此,本研究基于“色-香-味多指标定量结合指纹图谱相似度,应用TOPSIS法评价”,所得出的样品质量优劣顺序较简单加和法将更能综合反映各样品的综合质量。
实例5:色-香-味多指标定量结合指纹图谱对进口西红花的质量评价
国产西红花色香味多组分指纹图谱在进口西红花鉴别中的应用,结果已表明,12批进口西红花的相似度均在0.9以下,均比国产西红花的相似度低,为了进一步考察本发明建立的“色-香-味多指标定量结合指纹图谱相似度综合评价进口西红花的质量”,将在前面研究基础上,利用TOPSIS法评价国产与进口西红花的质量差异。色香味含量和相似度结果见表12。
表12 HPLC法和UV法测定进口西红花中色-香-味的含量
比较表10和表11,可看出进口西红花其西红花苷类和苦藏花素的含量均比国产西红花低,但藏花醛的含量进口西红花整体比国产西红花高。进一步利用TOPSIS综合评价,通过比较贴近度(Ci),从排序结果发现,排在后十二位的除国产S5号外,都是进口西红花,说明进口西红花距离正理想远而距离负理想近;而且,负理想中的数据基本来自于进口西红花组,正理想中的数据基本来自国产西红花组。
因此,TOPSIS综合评价结果表明,国产西红花质量整体优于进口西红花。可能与国内外西红花栽培方式和采后加工等因素有关。种球大小与西红花苷和苦藏花素含量有关,种球越大,积累西红花苷和苦藏花素含量越高。进口西红花采用连续栽培方式,种球较小,成分含量较低。而国产西红花采用二段式栽培方式,室内开花,开花后,种球再种于室外,进行营养生长,培育种球,种球较大,成分含量较高。
上述说明示出并描述了本发明的若干优选实施例,但如前所述,应当理解本发明并非局限于本文所披露的形式,不应看作是对其他实施例的排除,而可用于各种其他组合、修改和环境,并能够在本文所述发明构想范围内,通过上述教导或相关领域的技术或知识进行改动。而本领域人员所进行的改动和变化不脱离本发明的精神和范围,则都应在本发明所附权利要求的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!