癌症治疗药物的制作方法
本发明涉及癌症治疗药物和癌症治疗药物的筛选方法。
背景技术:
许多癌症的治疗成效还谈不上高。例如,对于胰腺癌,用常规化学疗法无法实现完全治愈,并且甚至新型分子靶向治疗药物当与常规化学疗法组合使用时也只是提供了几周的生存益处;因此,开发有希望的新型治疗药物是当务之急。本发明人通过使用临床样本的综合基因表达分析鉴定了显著促进胰腺癌的恶性的新基因智人(homosapiens)染色体16开放阅读框74(c16orf74),并且根据蛋白表达和功能分析报道了其作为胰腺癌的治疗靶向分子的有用性(非专利文献1)。然而,靶向c16orf74的新型治疗方法还未确立。
引用列表
非专利文献
非专利文献1:nakamurat等人,oncotarget,2016jul28,[epubaheadofprint]。
发明简述
要解决的问题
需要实现有效的癌症治疗。详细而言,需要找到靶向c16orf74的新型治疗药物。还需要找到容易筛选优异的癌症治疗药物的方法。
问题的解决方案
本发明人发现c16orf74蛋白定位于紧接细胞膜下方,并形成同源二聚体。本发明人勤勉研究二聚体形成抑制剂,想法是c16orf74的功能可通过抑制该二聚体形成得到抑制,以抑制癌细胞生长。结果是本发明人发现,通过将透膜性肽结合至c16orf74蛋白的氨基酸序列的n末端侧而获得的肽抑制c16orf74蛋白的二聚体形成,以有效抑制癌细胞的生长,从而完成了本发明。
特别地,本发明涉及以下内容:
(1)包含c16orf74蛋白的部分氨基酸序列的肽,其中所述肽包含与c16orf74蛋白的7位的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的14位的半胱氨酸对应的半胱氨酸的一者或两者,并抑制c16orf74蛋白的二聚体形成;
(2)(1)所述的肽,该肽包含与c16orf74蛋白的7位的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的14位的半胱氨酸对应的半胱氨酸的两者;
(3)(2)所述的肽,该肽的长度为12~20个氨基酸;
(4)(3)所述的肽,该肽包含seqidno:2所示的氨基酸序列;
(5)(1)~(4)中任一项所述的肽的突变肽,其中所述突变肽包含在seqidno:1所示的氨基酸序列的部分氨基酸序列中通过取代、缺失或添加一个至多个氨基酸而得到的氨基酸序列,并抑制c16orf74蛋白的二聚体形成;
(6)(1)~(5)中任一项所述的肽,其中透膜性肽与该肽结合;
(7)多核苷酸,该多核苷酸编码(1)~(6)中任一项所述的肽;
(8)载体,该载体包含(7)所述的多核苷酸;
(9)癌症治疗用药物组合物,该药物组合物包含抑制c16orf74蛋白的二聚体形成的物质;
(10)癌症治疗用药物组合物,该药物组合物包含(1)~(6)中任一项所述的肽、(7)所述的多核苷酸或(8)所述的载体;
(11)癌症治疗用药物组合物,该药物组合物包含(6)所述的肽;
(12)(11)所述的癌症治疗用药物组合物,其经腹膜内给药;
(13)癌症治疗药物的筛选方法,该方法包括下述步骤:
(a)在候选药剂的存在和不存在下使c16orf74蛋白的单体在细胞内表达以形成二聚体;
(b)测量形成的细胞内二聚体的量;然后,
(c)与候选药剂的不存在下形成的二聚体的量相比,当在候选药剂的存在下形成的二聚体的量减少时,确定候选药剂有可能是治疗癌症的药物。
发明的有利效果
使用本发明的癌症治疗药物可显著提高癌症的治疗结果。如果采用本发明的癌症治疗药物的筛选,可以容易地找到优异的癌症治疗药物。
附图简述
[图1]图1显示免疫印迹,其证实c16oef74蛋白的二聚体形成。c16-a、c16-b和c16-c表示3个并行的实验体系。
[图2]图2显示免疫印迹,其证实本发明的肽抑制c16oef74蛋白的二聚体形成。
[图3]图3显示证实在胰腺癌细胞中本发明的肽抑制c16oef74蛋白的二聚体形成的图。纵轴显示二聚体形成的相对量,其中未添加肽时假定为1。
[图4]图4显示证实本发明的肽抑制胰腺癌细胞的浸润能力的照片(左)和图(右)。图的纵轴显示浸润的相对量,其中未添加肽时假定为1。
[图5]图5显示表明动物中的肿瘤荧光强度随时间(移植后第7天、第14天、第21天、第28天和第35天)的变化的图。纵轴显示荧光强度的变化倍数。
[图6]图6显示表明动物中的肿瘤重量的图。
[图7]图7显示表明动物中的肿瘤体积的图。
[图8]图8显示表明动物中的肿瘤重量的图。
[图9]图9显示动物中肿瘤的荧光图像随时间的变化。
[图10]图10显示表明动物中的肿瘤荧光强度随时间的变化的图。
[图11]图11显示动物腹膜中的肿瘤的荧光图像。
[图12]图12显示表明动物中的散布结节数的图。
实施方案的描述
本发明在一个方面中涉及包含c16orf74蛋白的氨基酸序列(seqidno:1)的部分氨基酸序列的肽,其中所述肽包含与c16orf74蛋白的7位的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的14位的半胱氨酸对应的半胱氨酸的一者或两者(以下,有时将该肽简称为“本发明的肽”)。但是,本发明的肽与c16orf74蛋白的总氨基酸序列(seqidno:1)不同。在该方面的本发明的肽的具体实例包括由c16orf74蛋白的部分氨基酸序列组成的肽,其中该肽包含与c16orf74蛋白的7位的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的14位的半胱氨酸对应的半胱氨酸的一者或两者。本文的c16orf74蛋白中的氨基酸的位置按照n末端的氨基酸甲硫氨酸的位置假定为1位来指定。在本文中,有时将本发明的肽中的氨基酸表示为“与c16orf74蛋白的x位的氨基酸对应的氨基酸”。除非另外指明,本文的c16orf74蛋白是指野生型人c16orf74蛋白的单体。
c16orf74蛋白的部分氨基酸序列是seqidno:1所示的c16orf74蛋白的氨基酸序列的一部分。本发明的肽包含与c16orf74蛋白的n末端起第7位(7位)的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的n末端起第14位(14位)的半胱氨酸对应的半胱氨酸的一者或两者。优选本发明的肽包含与c16orf74蛋白的7位的半胱氨酸对应的半胱氨酸和与c16orf74蛋白的14位的半胱氨酸对应的半胱氨酸的两者。推断这些半胱氨酸残基参与c16orf74蛋白的二聚体形成。本发明的肽抑制c16orf74蛋白的二聚体形成。
本发明的肽的长度没有特别限制,并且优选为5~30个氨基酸,更优选8~25个氨基酸,和甚至更优选12~20个氨基酸。本发明的这样的优选肽的实例包括包含从c16orf74蛋白的1、2、3、4或5位的任一个氨基酸到15、16、17、18、19或20位的任一个氨基酸的氨基酸序列的肽。其实例包括但不限于包含seqidno:2所示的氨基酸序列的肽。
本发明的肽可以是突变肽。本发明的突变肽抑制c16orf74蛋白的二聚体形成。本发明的肽的突变肽包含野生型c16orf74蛋白的突变氨基酸序列,特别是野生型c16orf74蛋白的氨基酸序列(seqidno:1所示的氨基酸序列)的部分氨基酸序列中通过取代、缺失或添加一个至多个氨基酸而得到的氨基酸序列。术语“多个”是指例如2个、3个、4个、5个、6个、7个、8个或9个。但是,本发明的肽的突变肽保留与野生型c16orf74蛋白的7位和/或14位的半胱氨酸残基对应的半胱氨酸残基。本发明的突变肽的具体实例包括由野生型c16orf74蛋白的突变氨基酸序列组成的肽。
在氨基酸取代的情况下,优选保守氨基酸取代。保守氨基酸取代的实例包括以下:在被取代的氨基酸为芳族氨基酸的情况下在phe、trp和tyr之间的取代;在被取代的氨基酸为疏水性氨基酸的情况下在leu、ile和val之间的取代;在被取代的氨基酸为极性氨基酸的情况下在gln和asn之间的取代;在被取代的氨基酸为碱性氨基酸的情况下在lys、arg和his之间的取代;在被取代的氨基酸为酸性氨基酸的情况下在asp和glu之间的取代;以及在被取代的氨基酸为具有羟基的氨基酸的情况下在ser和thr之间的取代。
本发明的肽的突变肽可以是包含非天然氨基酸的突变肽,或者具有被修饰的任何氨基酸残基的突变肽,或者被标记的突变肽。
本领域技术人员可以通过采用化学合成方法、基因工程改造方法等产生本发明的肽及其突变肽。
透膜性肽可与本发明的肽或其突变肽结合。这样的肽被高效率地输送到癌细胞,并可抑制癌细胞中c16orf74蛋白的二聚体形成。
透膜性肽可以是允许本发明的肽输送到癌细胞内的任何肽。透膜性肽是已知的。与本发明的肽结合的透膜性肽可以是已知的透膜性肽。各种透膜性肽是市售可得的。透膜性肽的实例包括但不限于tat肽和由8个~11个精氨酸残基组成的肽。
透膜性肽可与本发明的肽或其突变肽的n末端、c末端和内部氨基酸残基的任一者结合,但优选与n末端氨基酸残基结合。透膜性肽可与本发明的肽或其突变肽的n末端氨基酸残基直接结合,或经由间隔区结合。间隔区可以是已知的间隔区,并且可以是例如由多个甘氨酸残基组成的肽。
本领域技术人员可以通过使用已知方法,例如化学合成方法或基因工程改造方法,产生已结合透膜性肽的本发明的肽或其突变肽。
本发明在另一方面中涉及多核苷酸,该多核苷酸编码本发明的肽、其突变肽、或者通过将透膜性肽与它们任何结合而获得的肽。产生多核苷酸的方法是已知的,并且本领域技术人员可以例如通过使用化学合成方法产生多核苷酸。
本发明在另一方面中涉及包含上述多核苷酸的载体。可将包含上述多核苷酸的表达载体导入癌细胞内,以抑制癌细胞中c16orf74蛋白的二聚体形成。各种载体是已知的,并且甚至是市售可得的,可以适当选择它们中的任何一种以供使用。
如上所述,本发明人获得了以下认知:通过抑制c16orf74蛋白的二聚体形成,能够有效抑制癌细胞的生长。本发明在又一方面中涉及癌症治疗用药物组合物,该药物组合物包含抑制c16orf74蛋白的二聚体形成的物质。
用本发明的癌症治疗用药物组合物治疗的癌症类型不受限制,只要它表达c16orf74。用本发明的癌症治疗用药物组合物治疗的癌症的实例包括胰腺癌、膀胱癌、颈癌和口舌鳞状细胞癌。
包含在本发明的药物组合物中并抑制c16orf74蛋白的二聚体形成的物质没有特别限制,并且优选实例包括本发明的肽、其突变肽、将透膜性肽与它们任何结合而获得的肽、编码这些肽中任一种的多核苷酸和包含所述多核苷酸的载体。短语“抑制c16orf74蛋白的二聚体形成”是指抑制优选30%或更多、更优选50%或更多、甚至更优选60%或更多、进一步优选70%或更多的c16orf74蛋白的二聚体形成。
可以通过使用已知的手段或方法产生各种剂型的本发明的药物组合物。优选本发明的药物组合物为溶液,并且可以是例如注射剂或输注剂。更优选本发明的药物组合物为注射剂。
本发明的药物组合物的给药途径没有特别限制,并且可以通过各种途径给予本发明的药物组合物。优选本发明的药物组合物经腹膜内给药。
本发明的药物组合物的具体实例包括包含已结合透膜性肽的本发明的肽或其突变肽的癌症治疗用药物组合物。所述药物组合物在经腹膜内给药时能够发挥效果。
本发明的药物组合物的剂量可以是抑制癌症生长的量,或者减少或消除癌症的量。医生可以根据患者的癌症状况、患者的体重等来确定这样的剂量。在对成人进行腹膜内给药的实例中,可以给予患者本发明的药物组合物,使得每天给予约1mg至数十mg/kg(体重)的本发明的肽。
可以将本发明的药物组合物与另一抗癌药和/或抗癌治疗组合使用。
本发明在又一方面中提供癌症患者的癌症治疗方法,该方法包括对癌症患者给予抑制c16orf74蛋白的二聚体形成的物质。
本发明在又一方面中提供抑制c16orf74蛋白的二聚体形成的物质在生产癌症治疗用药物组合物中的用途。
本发明在又一方面中提供用于癌症治疗的抑制c16orf74蛋白的二聚体形成的物质。
本发明在又一方面中涉及癌症治疗药物的筛选方法,该方法包括下述步骤:
(a)在候选药剂的存在和不存在下使c16orf74蛋白的单体在细胞内表达以形成二聚体;
(b)测量形成的细胞内二聚体的量;然后,
(c)与候选药剂的不存在下形成的二聚体的量相比,当在候选药剂的存在下形成的二聚体的量减少时,确定候选药剂有可能是治疗癌症的药物。
步骤(a)中使用的细胞可以是表达c16orf74蛋白的单体的任何细胞,并且优选为癌细胞。许多癌细胞是已知的,并且可以使用它们中的任何一种。或者,细胞可以是从癌症的临床样品得到的细胞。如果使用c16orf74蛋白的表达弱或者没有表达的细胞,可以使c16orf74蛋白的单体强制表达。c16orf74蛋白的强制表达可以通过将编码其的基因掺入表达载体中并将该载体导入细胞内来进行。c16orf74蛋白的单体的强制表达提供更清楚的筛选结果。
候选药剂可以是任何类型的物质。如果候选药剂为肽,可以使用已结合透膜性肽的肽。如果透膜性肽与肽结合,该肽由此输送到细胞内,因此可以省略向细胞内注入候选物质的步骤。如果候选药剂为肽,可以使用掺入编码该肽的多核苷酸的表达载体。
通过在候选药剂的存在和不存在下培养细胞,可以在细胞内形成c16orf74蛋白的二聚体。本领域技术人员根据因素,包括细胞类型,可容易地确定细胞培养条件。
在步骤(b)中,测量c16orf74蛋白的形成的细胞内二聚体的量。形成的二聚体的量的测量可以通过检测培养细胞的裂解物中c16orf74蛋白的二聚体来进行。例如,可以通过使用非变性聚丙烯酰胺凝胶电泳检测c16orf74蛋白的二聚体。
在步骤(c)中,比较候选药剂存在下的c16orf74蛋白的形成的二聚体的量和候选药剂不存在下的c16orf74蛋白的形成的二聚体的量,并且与候选药剂的不存在下形成的二聚体的量相比,当在候选药剂的存在下形成的二聚体的量减少时,确定候选药剂有可能是治疗癌症的药物。形成的二聚体的量的减少被解释为二聚体形成的抑制。如果形成的二聚体的量减少例如50%或更多、60%或更多或者70%或更多,可以确定候选药剂可能是癌症治疗药物。
在本发明的筛选方法中,可以使用不抑制c16orf74蛋白的二聚体形成的肽(例如seqidno:6)作为阴性对照。
本说明书中的各术语意图具有医学和生物化学领域通常理解的意义,除非另外说明。在本文中,氨基酸序列的表示根据已知的单字母编码或三字母编码进行。
下文将参考实施例更详细和更具体地描述本发明;然而,实施例不限制本发明。
实施例1
(1)c16orf74蛋白的二聚体形成的验证
对于该验证采用拉下测定(pull-downassay)。用表达flag标记的c16orf74蛋白的蛋白的载体(pcaggs-c16orf74-3×flag)和表达ha标记的c16orf74蛋白的蛋白的载体(pcaggs-c16orf74-ha)共转染hek293t细胞,其后24小时得到细胞裂解物,并使用附有ha抗体的琼脂糖珠粒进行免疫沉淀。对所得的免疫沉淀物进行电泳,并使用flag抗体进行印迹。在3个并行体系中进行实验。结果见图1。在图中mock表示pcaggs的空载体提供有flag标签和ha标签并且用它们共转染hek293t细胞的情况。在预期水平(120kda)处看到了flag标记的c16orf74蛋白的条带。该结果证实flag标记的c16orf74蛋白和ha标记的c16orf74蛋白直接结合。
(2)本发明的肽的产生
从c16orf74蛋白的n末端到第15个氨基酸的氨基酸序列,即mglkmsclkgfqmcv(seqidno:2)和多聚精氨酸信号rrrrrrrrrrr(seqidno:3)经由ggg标签结合在一起,以提供肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)。以同样的方式,结合多聚精氨酸信号rrrrrrrrr(seqidno:5),以提供肽rrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:6)。
另外,还合成了设计成无法与c16orf74蛋白结合的肽。肽rrrrrrrrrrr-ggg-mglkmsalkgfqmav(seqidno:7)是通过将seqidno:2的氨基酸序列的n末端起第7位和第14位的半胱氨酸残基变换成丙氨酸残基而得到的肽。肽rrrrrrrrrrr-ggg-mglkmaaakgfqaaa(seqidno:8)是通过将seqidno:2的氨基酸序列的n末端起第7位和第14位的半胱氨酸残基以及半胱氨酸残基各自的上游氨基酸残基和下游氨基酸残基变换成丙氨酸残基而得到的肽。
(3)通过本发明的肽抑制c16orf74蛋白的二聚体形成
用pcaggs-c16orf74-3×flag和pcaggs-c16orf74-ha转染hek293t细胞,并且在40μm的肽rrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:6)的存在和不存在下培养24小时,之后以与(1)中描述的相同方式检测二聚体的条带。如图2所示,在40μm的肽(图2中表示为dn-肽)存在下条带变淡,这证实了二聚体形成受到抑制。
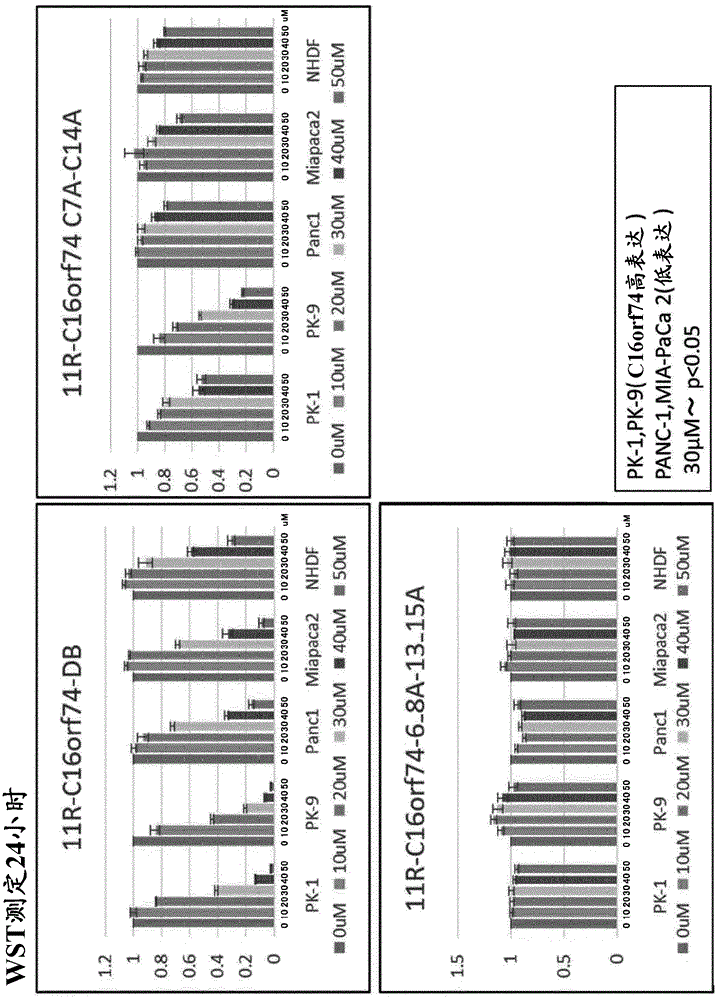
通过使用不同浓度的肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)(图3中表示为11r-c16orf74-db)、肽rrrrrrrrrrr-ggg-mglkmsalkgfqmav(seqidno:7)(图3中表示为11r-c16orf74c7a-c14a)和肽rrrrrrrrrrr-ggg-mglkmaaakgfqaaa(seqidno:8)(图3中表示为11r-c16orf74-6-8a-13-15a),进行与上述(3)同样的实验,以检查c16orf74蛋白的二聚体形成的抑制。对于细胞,使用了4种类型的人胰腺癌细胞(pk-1、pk-9、panc-1、miapaca-2)和正常人皮肤成纤维细胞(nhdf)。结果见图3。
在4种类型的胰腺癌细胞中,11r-c16orf74-db以浓度依赖性方式抑制c16orf74蛋白的二聚体的形成。在pk-1和pk-9中,在30μm的浓度下抑制约60%的二聚体形成。在panc1和miapaca2中,在40μm的浓度下抑制60%或更多的二聚体形成。在nhdf中见到比胰腺癌细胞中弱的二聚体形成抑制。
对于11r-c16orf74c7a-c14a,在pk-1和pk-9中见到二聚体形成的抑制,但该抑制比使用11r-c16orf74-db弱。在panc1、miapaca2和nhdf中几乎未见二聚体形成的抑制。
对于11r-c16orf74-6-8a-13-15a,在任何细胞中均未见二聚体形成的抑制。
(4)通过本发明的肽抑制胰腺癌细胞的浸润能力
使用基质胶(matrigel)就本发明的肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)对人胰腺癌细胞(pk-1、pk-9、panc-1、miapaca-2)的浸润能力的影响进行检查。如图4所示,本发明的肽以浓度依赖性方式抑制任何细胞的浸润。
(5)通过本发明的肽抑制肿瘤生长
(5-1)本发明的肽在背部移植了癌细胞的动物中的肿瘤生长抑制效果
将人胰腺癌细胞(pk-9)移植到各裸鼠(balb/cajclnu/nu小鼠,雌性,销售商:cleajapan,inc.)的背部。从移植后第7天到第35天将本发明的肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)、肽rrrrrrrrrrr-ggg-mglkmaaakgfqaaa(seqidno:8)或pbs按每周5次进行腹膜内给药。在该期间测量动物的体重和肿瘤体积,并获得荧光图像。在移植后第35天摘出肿瘤,并测量重量。关于动物的体重,给予本发明的肽的组比其他给药组显示出更高的增加倾向。肿瘤荧光强度随时间的变化见图5。给予本发明的肽的组(图5中表示为db)未显示荧光强度增加,这表明肿瘤没有生长。给予seqidno:8的肽的组(图5中表示为aaa)和pbs给药组(图5中表示为nc)显示荧光强度增加,这表明肿瘤生长。肿瘤重量见图6。给予本发明的肽的组(图6中表示为db)的平均肿瘤重量为约50mg,相比之下,在其他两组中为约100mg~110mg。这些结果证实本发明的肽在体内具有强的肿瘤生长抑制效果。
(5-2)本发明的肽在皮下注入了癌细胞的动物中的肿瘤生长抑制效果
将pk-9细胞注入各裸鼠(balb/cajclnu/nu小鼠,雌性,销售商:cleajapan,inc.)的背部。注射后2周,按每周5次(10mg/kg/小鼠),在肿瘤附近的皮下组织中注入本发明的肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)、肽rrrrrrrrrrr-ggg-mglkmaaakgfqaaa(seqidno:8)或pbs。给药期为3周。在给药期结束时摘出肿瘤,并测量肿瘤重量。对于给予本发明的肽的组,肿瘤体积减少,然后变得稳定(约100mm3)(图7的11r-db组)。对于给予seqidno:8的肽的组和给予pbs的组,肿瘤体积增加(图7的11r-7_14aaa组和pbs组)。给予本发明的肽(seqidno:4)的组的平均肿瘤重量为约250mg(图8的11r-db组)。对于给予seqidno:8的肽的组和给予pbs的组(图8的11r-7_14aaa组和pbs组),肿瘤重量也显著超过给予本发明的肽的组(约400mg~500mg)。这些结果证实本发明的肽在体内具有强的肿瘤生长抑制效果。
(5-3)本发明的肽在腹膜散布了癌细胞的动物中的肿瘤存活和生节抑制效果
将表达萤光素酶的pk-9细胞(pk-9-tdtomato-luc2)经腹膜内注入各裸鼠(balb/cajclnu/nu小鼠,雌性,销售商:cleajapan,inc.)。从腹膜散布日起到第35天期间,按每周5次(1mg/kg/小鼠)在肿瘤附近的皮下组织中注入本发明的肽rrrrrrrrrrr-ggg-mglkmsclkgfqmcv(seqidno:4)、肽rrrrrrrrrrr-ggg-mglkmaaakgfqaaa(seqidno:8)或pbs。在腹膜散布后第3、7、14、21、28和35天将肿瘤成像。在肽给药期结束时计算结节数。给予本发明的肽抑制肿瘤细胞的存活(图9和图10的11r-db组)。在给予seqidno:8的肽的组和给予pbs的组(图9和图10的11r-7_14aaa组和pbs组)中肿瘤细胞的存活没有受到抑制。给予本发明的肽大幅减少结节数至1个(图11和图12的11r-db组)。对于给予seqidno:8的肽的组和给予pbs的组,结节数没有减少,并且为26~30个(图11和图12的11r-7_14aaa组和pbs组)。这些结果证实本发明的肽在体内具有强的肿瘤生长抑制效果。
工业适用性
本发明的药物组合物和筛选方法在癌症治疗药物、癌症研究等领域有用。
序列表自由文本
seqidno:1显示c16orf74蛋白的全长氨基酸序列。
seqidno:2显示本发明的肽的氨基酸序列的实例。
seqidno:3显示多聚精氨酸信号的氨基酸序列的实例。
seqidno:4显示添加了透膜性肽的本发明的肽的氨基酸序列的实例。
seqidno:5显示多聚精氨酸信号的氨基酸序列的实例。
seqidno:6显示添加了透膜性肽的本发明的肽的氨基酸序列的实例。
seqidno:7显示通过将seqidno:2的氨基酸序列的n末端起第7位和第14位的半胱氨酸残基变换成丙氨酸残基而得到的肽的氨基酸序列。
seqidno:8显示通过将seqidno:2的氨基酸序列的n末端起第7位和第14位的半胱氨酸残基以及半胱氨酸残基各自的上游氨基酸残基和下游氨基酸残基变换成丙氨酸残基而得到的肽的氨基酸序列。
- 还没有人留言评论。精彩留言会获得点赞!